中药马兜铃肾毒性机制的研究进展
马兜铃提取条件的优化以及炮制减毒的研究

次 1 。马兜铃炒制和蜜炙均可降低毒性成分马兜铃 酸 A的含量 , .h 0 蜜炙使马兜铃酸 A的含量 降低 了5.7 , 17% 减毒效果 明显优于炒制 。
关键 词 : 马兜铃; 马兜铃酸 A 炒制马兜铃 ; ; 蜜炙马兜铃
S u y o tmia i n o t a tPr c s fArsoo h c De i s t d n Op i z t fEx r c o e s o it lc i bl o i
摘 要 : 采用单因素试验考察药材粒径、 加水量、 煎煮时间和煎煮的影响。运用
IL - C测定炒制马兜铃与蜜炙马兜铃 中马兜铃酸 A的含量 。结果表 明马兜铃 的最佳提取条件为粒径 1c 2加水 2 I P m , 2倍量 , 煮 2次 , 煎 每
a nd x ct d to y Di e e o e sng To i iy Re uci n b f r ntPr c si
L U Me 一 I i ,L U Jn V Ha I ig ,L o—r n ,Z a HOU h i u
( e at e t f h r ae t a E g er g S h o o hmir n h m cl n ier g ot hn nvr t 1D p r n o P am cui l ni e n , c ol f e sya dC e ia E g e n ,SuhC iaU i s y m c n i C t n i e i
MFHAS1促进诱导M2型巨噬细胞极化减轻马兜铃酸诱导急性肾损伤的研究

MFHAS1促进诱导M2型巨噬细胞极化减轻马兜铃酸诱导急性肾损伤的研究MFHAS1是一种分泌蛋白,已经被证明可以促进M2型巨噬细胞的极化并且减轻马兜铃酸诱导的急性肾损伤。
马兜铃酸是一种可以引起急性肾损伤的有毒植物成分,其毒性效应已经被广泛研究。
在这项研究中,科学家们发现MFHAS1对于减轻马兜铃酸诱导的急性肾损伤具有积极的作用,为患者提供了一种潜在的治疗方法。
本文将详细介绍这一研究的内容和结果。
马兜铃酸是一种可以引起急性肾损伤的有毒植物成分,其主要毒性效应包括肾小管坏死、间质纤维化和肾小管间质炎症反应。
目前尚无特效的治疗方法,因此急性肾损伤的治疗一直是一个值得关注和研究的领域。
最近的研究表明,M2型巨噬细胞的极化可以通过调节肾脏损伤和修复过程起到关键作用。
科学家们开始研究MFHAS1对于M2型巨噬细胞极化的调节作用,以及其对急性肾损伤的治疗效果。
在研究中,科学家们使用小鼠模型进行了实验,首先建立了马兜铃酸诱导的急性肾损伤模型,然后观察了MFHAS1对于M2型巨噬细胞极化和肾损伤修复过程的影响。
实验结果表明,与对照组相比,MFHAS1处理组的小鼠肾功能恢复更快,肾组织病理改变更轻,肾小管坏死和间质纤维化程度更轻。
进一步的实验结果显示,MFHAS1可以促进M2型巨噬细胞的极化,并且减少了炎性因子的释放,从而减轻了马兜铃酸诱导的急性肾损伤。
这一研究的结果表明,MFHAS1可以通过促进M2型巨噬细胞的极化来减轻马兜铃酸诱导的急性肾损伤,为治疗急性肾损伤提供了一个新的思路。
MFHAS1可能成为潜在的治疗靶点,为开发新的治疗手段提供了一个可靠的基础。
这一研究也进一步证实了M2型巨噬细胞在肾脏损伤和修复过程中的重要作用,为相关疾病的治疗提供了新的研究思路。
这一研究具有重要的理论和临床意义,有望为急性肾损伤的治疗提供新的思路和方法。
马兜铃酸肾病研究进展

目前AAN发病机制仍不十分清楚,急性AAN常在短期 大剂量用药后发生,其病理表现为急性肾小管坏死(acute tubular necrosis,ATe);慢性ANN常在长期小剂量用药后发 生。其病理表现为寡细胞性肾间质纤维化,肾间质纤维化是 各种肾脏疾病进展到终末期肾衰竭的共同途径。此病病理 机制有多种观点和假说,近年来较多的研究支持细胞毒学说 及肾缺血假说。 2.1 细胞毒学说 (1)肾小管上皮细胞坏死或凋亡。黎磊
万方数据
为肾小管上皮细胞重度变性、坏死、崩解,部分肾小管仅残留 裸露基膜或断裂,肾间质水肿,偶见少量淋巴及单核细胞散 在浸润,肾小球无明显病变,小动脉内皮细胞肿胀。免疫荧 光阴性。电镜显示肾小管上皮细胞微绒毛脱落。线粒体肿胀 及线粒体嵴消失,部分细胞器崩解,基膜裸露,肾间质水肿, 肾小球基本正常。此病变多发生在短期(甚至1次)大量服 用AA中药后。lI缶床表现主要为少尿或非少尿性急性肾衰 竭(ABF),可伴有肾性糖尿。还有肾外表现,如恶心、呕吐、 血小板减少、肝功能损害及神经系统异常(视听力障碍、震 颤)等。除上述表现外,部分患者有蛋白尿及低蛋白血症,其 病理检查光镜下肾小球系膜增生,电镜见脏层上皮细胞部分 融合,此患者很可能同时伴发肾小球病变。 3.2慢性马兜铃酸肾病”o钆弘刀。 慢性AAN的主要病理 表现为分布不均的寡细胞性肾间质纤维化。光镜:肾间质呈 多灶或大片状纤维化,偶有少量散在或小灶状淋巴及单核细 胞浸润,肾小管呈多灶状或大片状萎缩或消失,肾小球无明 显病变或呈缺血性皱缩、硬化,小动脉管壁增厚,管腔狭窄, 管周毛细血管损害。免疫荧光阴性。电镜:肾间质病变区有 大量的胶原纤维,肾小管基膜增厚、分层,部分肾小球基膜缺 血性皱缩、硬化。此类患者多因持续或间断小剂量服用含 AA药物后出现症状,主要为慢性肾小管一问质。肾病表现。 尿检验呈肾性糖尿及轻度蛋白尿,低比重及低渗透压尿,肾 功能呈进行损害,但进展速度不一,部分患者进展快,0.5一 1年进入终末期肾衰竭。部分患者隐袭进展,lO年以上才进 入慢性。肾衰竭。常伴贫血及轻、中度高血压。B超常发现肾 脏缩小,肾实质厚度变薄较其他非AAN慢性肾小管间质肾 病患者较早出现,且部分患者双肾大小可不对称(长径相差 l cm以上)。当慢性AAN患者若出现明显的均一红细胞血 尿,即应高度怀疑泌尿系癌症,而行相应检查。 3.3 肾小管功能障碍性马兜铃酸肾病[5。6’玩圳 此型AAN 病理改变轻,主要为肾小管变性及萎缩。光镜:肾小管上皮 细胞变性;部分崩解脱落,部分萎缩和管腔扩张,肾间质无明 显病变,有时可见轻度水肿或轻度灶状纤维化,肾小球正常, 小动脉内皮细胞肿胀。免疫荧光阴性。电镜:肾小管刷状缘 部分脱落,上皮细胞线粒体肿胀,部分细胞器崩解及脱落,肾
马兜铃肾病的研究

酸 I和 7O H . 兜 铃 酸 I等 化 学 成 分 。马 兜铃 内 酰 胺 - C 马
制、 临床特征及其诊 断方法进行 综述 , 旨在对马兜铃酸 的毒理 学及马兜铃酸 肾病 的诊 治加深认识 。
关键词 : 马兜铃 肾病 ; 马兜铃酸 ; 肾毒性
中图 分 类 号 : 5 . 9 R 26 5 文 献 标 识 码 : A
马兜铃酸 肾病 ( r tohcai np rpty A N) aio ci c ehoah , A 是指 sl d 服用含有马兜铃酸成分的 中草药而导致 的肾小管 间质疾 病。 随着中草药 及其 制剂在世界范围的广泛应 用 , 中药 毒副反应 的问题受到广泛 的关注 , 特别 是 自 19 93年 比利 时学者 提 出 了“ 中草药 肾病” C iee r ehoah C N) ( hns bN p rpty, H 这一概念 He 后, 历史悠久 的传 统 中药 的安全性 受到 了严 重质疑 。美 国、
马兜铃 。 肾病的病变主要集 中于皮髓交 界区 , 包含近 曲小 管直部 、 髓襻升支粗段 以及外髓集 合管外带 。突出表现慢性
间质性 肾炎 , 广泛、 进行性寡少细胞性 肾间质纤维化 , 小管萎
} 基金项 目: 江西省教育厅资助项 目赣教技字 (07 20号 ; 西省科技厅 资助项 目20 BB 90 20)5 江 09 S 042号
1 1 马 兜 铃 酸 类 马 兜 铃 酸 ( r t ohaeeai. A) . A io c i a cd A 为 sl c
【最新推荐】短期服用马兜铃-实用word文档 (8页)

本文部分内容来自网络整理,本司不为其真实性负责,如有异议或侵权请及时联系,本司将立即删除!== 本文为word格式,下载后可方便编辑和修改! ==短期服用马兜铃篇一:含有马兜铃酸的中药含有马兜铃酸的中药发表者:冯少尊 28469人已访问看了何莲医师的"药物性肾损害"一文中"木通所致肾小管间质肾病"即"马兜铃酸肾病",想补充:什么中草药中含马兜铃酸成分.服用含马兜铃酸(aristolochic acid AA)的中草药引起的肾脏损害称为马兜铃酸肾病(AAN)。
常见的含马兜铃酸的中草药和中成药1. 含AA的中草药很多,应用范围广,包括关木通、广防已、马兜铃、青木香、天仙藤、木防己、细辛、天仙藤、寻骨风、威灵仙等;这些药中的AA含量详见表6-1-1。
表6-1-1 中草药中马兜铃酸含量(%).中草药马兜铃含量中草药马兜铃含量中草药马兜铃含量关木通4.0106寻骨风0.03007广防己0.0068厚朴0.0018马兜铃0.063细辛0.0014耳聋丸0.0437天仙藤0.0026青木香0.00087冠心苏合丸0.0323龙胆泻肝丸0.0219管南香0.25背蛇生0.011分清五淋丸0.0337妇科分清丸0.02192.常用的含AA的中成药:①含关木通中成药:甘露消毒丸(每100克成药中含关木通6克)[4]、灵龙感冒胶囊、耳聋丸、金砂五淋丸、白益镇惊丸、前列回春胶囊、透骨镇风丸(丹)、阿胶生化膏、复肾宁片、跌打丸(片)、连翘败毒丸(膏、片)、清淋冲剂、小儿金丹片、小儿导赤片、壮骨酒、障翳散、消风止痒颗粒、复明片、妇科分清丸、咽炎含片、活血理伤丸、分清五淋丸、五粒回春丸、安阳精制膏、济生橘核丸、通便清火丸、清胃丸、济坤丸、生乳片、大黄清胃丸、太和妙龄丸、清血内消丸、导赤丸、五粒回春丸,等。
②含青木香中成药:双香排石颗粒、冠心苏合丸、冠心苏合滴丸、冠心苏合胶囊、纯阳正气丸、养阴降压胶囊、舒肝理气丸、胃炎康冲剂、胃药胶囊、心无忧片、风痛丸、十香返生丸、康妇软膏、绿雪胶囊、绿雪、三余神曲、关节镇痛膏,等。
不同类型马兜铃酸肾病的发病机制

A N根据 临床表现 、 A 病程 进展和病 变程度 , 临床 上一般 分为急性 肾功能不 全型 、 性肾功能不全 型和肾小管功能 障 慢 碍型三种类 型。不 同类 型 A AN的发病发病机 制可能有所不
尹 广 陈 欣
马兜 铃 酸 肾病 (r to hcai eho a y A N 是 导 aio ci cdnp rpt , A ) sl h
铃属植 物中含量较为 丰富 , 特别是 A A I的含量最为丰富 。 5 ] 2 不同类型 AA L N的发病机 制
致 急性或慢性 肾功能 不全的原 因之 一 , 发病 机制 尚末完全 明
亡 ,一定剂量 的 A A也可诱 导人近端肾小管上皮细胞 ( K ) H C
发生 凋亡 [。
22 慢性 肾功能不全型 . 2 . 肾小 管上皮细胞转分 化 : .1 2 目前认 为肾间质 中的肌成 纤 维细胞 有 3种来源 ,即由肾固有 的成纤维细胞转 变而来 , 肾 小 管上皮 细胞 的转分 化和管周 毛细 血管肌 成纤维 细胞 的迁 移 。其 中肾小管上皮细胞一 肌成纤维细 胞的转分化是 肾间质
・
24 ・ 1
中国药物与临床 20 年 3 09 月第 9 卷第 3 C i s R m d s ln c , r h 2 0 , o , . 期 h ee e ei &Ci is Ma c 0 9 V L9 No3 n e
— —
—
—
不 同 类 型 马 兜 铃 酸 肾 病 的 发 病 机 制
马兜铃属植物 中已得 到并鉴定 的化学成分有 10种பைடு நூலகம்主 4
马兜铃酸
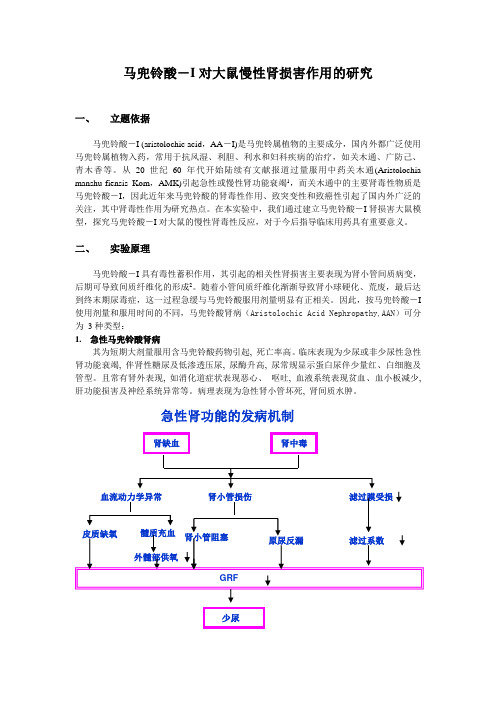
马兜铃酸-I对大鼠慢性肾损害作用的研究一、立题依据马兜铃酸-I (aristolochic acid,AA-I)是马兜铃属植物的主要成分,国内外都广泛使用马兜铃属植物入药,常用于抗风湿、利胆、利水和妇科疾病的治疗,如关木通、广防己、青木香等。
从20世纪60年代开始陆续有文献报道过量服用中药关木通(Aristolochia manshu-fiensis Kom,AMK)引起急性或慢性肾功能衰竭1,而关木通中的主要肾毒性物质是马兜铃酸-I,因此近年来马兜铃酸的肾毒性作用、致突变性和致癌性引起了国内外广泛的关注,其中肾毒性作用为研究热点。
在本实验中,我们通过建立马兜铃酸-I肾损害大鼠模型,探究马兜铃酸-I对大鼠的慢性肾毒性反应,对于今后指导临床用药具有重要意义。
二、实验原理马兜铃酸-I具有毒性蓄积作用,其引起的相关性肾损害主要表现为肾小管间质病变,后期可导致间质纤维化的形成2。
随着小管间质纤维化渐渐导致肾小球硬化、荒废,最后达到终末期尿毒症,这一过程急缓与马兜铃酸服用剂量明显有正相关。
因此,按马兜铃酸-I 使用剂量和服用时间的不同,马兜铃酸肾病(Aristolochic Acid Nephropathy,AAN)可分为3种类型:1.急性马兜铃酸肾病其为短期大剂量服用含马兜铃酸药物引起, 死亡率高。
临床表现为少尿或非少尿性急性肾功能衰竭, 伴肾性糖尿及低渗透压尿, 尿酶升高, 尿常规显示蛋白尿伴少量红、白细胞及管型。
且常有肾外表现, 如消化道症状表现恶心、呕吐, 血液系统表现贫血、血小板减少, 肝功能损害及神经系统异常等。
病理表现为急性肾小管坏死, 肾间质水肿。
急性肾功能的发病机制少尿2.慢性马兜铃酸肾病为持续小剂量服用含马兜铃酸药物引起, 也可由重症急性马兜铃酸肾病不愈发展而来。
表现为首先出现夜尿多, 而后逐渐出现各种肾功能衰竭症状。
尿化验常出现肾性糖尿, 低渗透压尿, 轻微蛋白尿, 少量红、白细胞及管型, 肾功能呈进行性损害。
中药肾毒性的研究进展

肾毒 性就 是 其 中之 一。2 0世 纪 6 0年 代 , 吴 松 寒
首先在 国 内报道 了服 用木 通后 引起 的急 性 肾衰 的病
例, 随后 国外 也 开 始 出现 这 方 面报 道 。 1 9 9 3年 , 比
利 时学者 报道 了患者服 用含 有 防 己和 厚朴 的减肥 药后 出现 了肾脏 的损 害 , 之后 日本 、 美 国也有 使 用 中
[ 摘 要] 目的 研究 中药肾毒性产 生的原因 、 机制 、 肾损伤相关生 物标志 物及安 全评价 等, 为 中药 肾毒性 的相关 研究 通过 检索 万方 、 维普及 P u b m e d等 中外数据 库 中有 关 中药 ’ 肾毒性 的研究 文献 , 对 中药造 成。 肾毒性 的原 近 年来出现 了一些新 的 提供参考信息 。方法
所 致 的 肾小 管 间质损 伤及 肾衰 等 。还 有 一些矿
基金项 目:医科院 重大新 药创 制综 合 大平 台一 药 物安 全评 价研 究 ,
N o . 2 0 1 2 Z X 0 9 3 0 1 0 0 2 4 3 0 1 - 0 0 9 ; 医 科 院 国际 标 准 药 物 安 全 评 价技 术 平 台建 设 , o . 2 0 1 3 z x O 9 3 O 2 3 O 2
例。
一
剂 量过 大 时 , 药物 不 能及 时排 出体 外 , 使 肾组 织暴 露 1 . 5 其 他原 因 如 患者 的特 殊体 质 导 致过 敏 反 应
些 中药本 身 具 有 一 定 肾毒 性 , 长期服用可引
起 药 物蓄 积损 害 肾 脏。 如 长 期 服 用 雷 公 藤 、 木 通 等
因、 机制进行深入分析 , 归纳了一些较 新的。 肾损伤相关生物标志物 以及 中药 肾毒性评价方 法并指 出了其优势及 可行 性。结果 中药 引发肾毒性 的原 因复杂 , 机制也不 十分 明确 , 可能 与氧化损 伤 、 诱 导细 胞凋亡 等有关 。结论 肾损伤检测指标 , 因其特异性和敏感性而得到广泛应用 ; 在安 全评 价方面 , 基 于细胞 的体外 评价方法 日趋成熟 , 代谢组学 方法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中药马兜铃肾毒性机制的研究进展年级:×××级××专业姓名:×××学号:××××××【摘要】中药马兜铃(Aristolochia debilis)主要致肾毒性物质是马兜铃酸(Aristolochic acid, AA)。
服用含有马兜铃酸的药物后引起的肾损害疾病称为马兜铃酸肾病(aristolochic acid nephropathy, AAN)[1]。
马兜铃酸(AA)引起肾损伤的主要特点是肾小管坏死,肾间质进行性纤维化,其具体机制尚不明确,目前存在许多观点。
【关键词】马兜铃马兜铃酸马兜铃酸肾病机制【Abstract】The main toxic component of Aristolochia debilis is Aristolochic acid(AA). The renal injury caused by drugs which contain AA is commonly called aristolochic acid nephropathy, AAN. The main features of AA to cause kidney damage tubular necrosis and renal interstitial fibrosis. However, the mechanism of it is not specified. There is a lot of perspective of the mechanism of it at present research.【Key word】Aristolochia debilis AA AAN mechanism中药马兜铃[2]是马兜铃科植物北马兜铃Aristolochia contorta Bge.或马兜铃Aristolochia debilis Sieb. et Zucc.的干燥成熟果实。
其功能主治为清肺化痰、止咳平喘,用于肺热咳喘、痰中带血、痔疮肿痛、出血等症。
此外,本品还具有缓慢而持久的降压作用。
主要化学成分有马兜铃酸(Aristolochic acid , AA)、马兜铃次酸、木兰碱、青木香酸等。
马兜铃中的马兜铃酸是致肾毒性主要物质,大量服用后可导致急性肾损伤。
自1993年比利时人V anherweghem等[3]报道“中草药肾病”以来,含有马兜铃酸的中草药引起的肾功能损害即马兜铃酸肾病(aristolochic acid nephropathy, AAN)受到了肾脏病学界的广泛关注。
下面就AAN进行综述。
1.AAN的临床分类AAN的病理表现主要为肾小管变性、萎缩及坏死和(或)寡细胞性肾间质纤维化。
临床上有三种基本类型:慢性型AAN、急性型AAN和肾小管功能障碍型AAN。
1.1.急性型AAN急性型AAN常在短期内(甚至只服用1次)大量服用含AA中药后发生,临床表现主要为少尿或非少尿性急性肾功能衰竭(acute renal failure, ARF),可伴有肾性糖尿,还常有肾外表现,如消化道症状恶心、呕吐,血液系统表现贫血、血小板减少,肝功能损害及神经系统异常(视听力障碍、震颤)等。
急性型AAN 的病理表现为肾小管坏死,肾小管上皮细胞重度变性、坏死、崩解,部分肾小管仅残留裸露基膜,肾间质水肿,偶有少量淋巴及单核细胞散在浸润,肾小球无明显病变,小动脉内皮细胞肿胀。
1.2.慢性型AAN患者多在持续或间断小剂量服用含有AA的药物后出现症状,主要表现为慢性小管间质肾病,出现不可逆的进行性肾损害,往往在数月可数年内最终发展为终末期肾病[3]。
慢性型AAN临床表现为头痛、食欲不振、嗜睡、体重减轻、蛋白尿、肾性糖尿、无菌性白细胞尿等。
其病理表现为分布不均一的寡细胞肾间质质纤维化,肾小球无明显病变或呈基底膜缺血皱缩及肾小球硬化,小动脉管管壁壁增厚,管腔狭窄。
1.3.肾小管功能障碍型AAN患者常于间断小剂量服用含有AA的药物数月后出现症状,主要表现为肾小管酸中毒和(或)范可尼氏综合征,同时伴肾小管浓缩功能障碍,而血清肌酐(SCr)及尿素氮基本正常。
此型AAN病理改变轻,主要为肾小管变性及缩,肾间质无明显病变,肾小球基本正常,小动脉内皮肿胀。
2.AAN的发病机制AAN的发病机制目前尚不完全清楚,存在多种观点和假说,主要可经概括为以下几个方面。
2.1.细胞毒作用黎磊石等[4]观察AAN患者肾组织发现,肾小管上皮细胞内可见嗜碱性均匀物质突向管腔,电镜下显示层状结构,并于1999年最先提出AA具有“胞浆毒”的特性,长期滞留于细胞内引起慢性肾损害。
唐功耀等[5]使用大剂量AA能够杀伤体外培养的HK-2(肾小管上皮细胞),证实AA确实有肾寂管上皮细胞毒性作用,并认为急性AAN的发病机制与大剂量AA直接刺激细胞,引起细胞毒性反应相关。
2.2.肾小管上皮细胞持续修复不良肾小管上皮细胞通常具有强大的自身修复能力。
肾毒性损伤发生后,在清除坏死脱落的上皮细胞同时,损伤较轻或未损伤的肾小管上皮细胞可进入增殖活跃状态,使肾小管的完整性得以修复。
然而,在急性AAN患者的肾活检组织以及众多AAN动物模型中发现,肾小管上皮细胞在发生急性损伤坏死的同时并没有出现增殖现象。
这提示AA及其代谢产物抑制了细胞的增殖能力。
李瑛等[6]研究发现,AA可致猪肾小管上皮细胞系LLC-PK1细胞DNA 损伤,使细胞周期阻滞在G2/PM期,认为这可能是AA肾损伤后肾小管上皮细胞再生修复能力差的机制之一。
正是由于AA对肾小管上皮细胞的直接毒性损伤,使其变性凋亡和坏死,而损伤后的小管上皮细胞又出现了自身修复能力低下,从而导致了AAN的发生和发展。
2.3.肾小管上皮细胞转分化目前认为肾间质中的成纤维细胞(Myof)有3种来源,即由肾固有的成纤维细胞转变而来,肾小管上皮细胞的转分化和管周毛细血管肌成纤维细胞的迁移。
其中肾小管上皮细胞肌成纤维细胞的转分化可能是肾间质纤维化的重要机制之一[7]。
郑法雷等[8]在体外人肾小管上皮细胞(HKC)的培养液中加入AA后,AA 可诱导HKC 向肌成纤维细胞转化。
由此推测这一现象可能是患者中肾小管上皮细胞减少,进而出现肾间质纤维化;同时,单核细胞趋化蛋白-1(MCP-1)也诱导HKC细胞转分化,并且MCP-1对细胞的转分化可能具有协同作用,该协同作用可被血管紧张素Ⅱ1型受体拮抗剂抑制。
Myof可以合成纤维结合素和Ⅰ型胶原,使细胞外基质蛋白增加,促进肾间质纤维化的发生和发展。
2.4.肾间质成纤维细胞活化AA能活化肾小管上皮细胞,使其释放细胞转化因子β(TGF-β)等促纤维化因子进入肾间质,以“旁分泌”的形式作用于肾间质纤维细胞,促进肾间质纤维细胞活化并合成细胞外基质,参与肾间质纤维化。
另一方面,AA也能直接刺激及激活间质成纤维细胞,分泌细胞外基质[9]。
体外研究发现40mg/ml浓度AA可显著上调HK-2和人肾间质纤维细胞的TGF-β,纤溶酶原活化抑制剂- 1(PAI- 1)和金属基质蛋白组织抑制因子-1(TIMP-1) mRNA表达,并显著上调hRIFs 的Col mRNA 表达,推测可能与AAN的发病有关[8]。
2.5.肾缺血AA可损伤肾小管壁,引起管壁增生、增厚、管腔狭窄,缺血缺氧,最终导致小管萎缩及间质纤维化[10]。
Sun D等[11]在AAN小鼠模型中观察到,血管内皮细胞生长因子(V ascular endothelial growth factor, VEGF)表达减少,管周毛细血管进行性丢失,缺氧诱导因子-1A( hypoxia inducible factor-1A, HIF-1A)表达上调Wen YJ等[11]也在研究AA 致急性肾小管坏死时发现AA可导致HIF-1A的表达,内皮素-1表达上调,VEGF表达下调。
这些都说明肾脏局部缺血缺氧参与了AAN 的发病机制。
2.6.免疫炎症反应AAN肾间质为寡细胞必纤维化,病变部位无明显炎性细胞浸润,免疫病理检查也多为阴性,故国内外多数学者认为免疫炎症反应不是AAN的主要发病机制。
但左巍等[13]观察到AAN大鼠模型早期存在炎性细胞浸润,随着疾病的发展炎性细胞浸润数目明显增多,到第13周最为明显,而后逐渐减少,持续至第24周时出现寡细胞性肾间质纤维化表现。
Pozdzik A等[14]用大鼠AAN模型研究表明近端肾小管坏死区域有单核/巨噬细胞和T淋巴细胞的浸润。
这些研究提示,免疫炎症反应可能参与了AAN的发生和发展2.7.AA-DNA加合物作用AA进入体内后,代谢形成马兜铃酸内酰胺,进一步与DNA形成加合物[15]。
AA-DNA在AAN动物模型的AAN患者的肾和其他器官中均有发现,其中以肾组织最多。
这种加合物可在动物和人体内蓄积,并在他们的整个生存期中持续存在[16]。
加合物的形成一方面造成细胞相关功能的异常,另一方面可能导致了物损伤的持续存在和进展,而且是AA致泌尿系统肿瘤的重要机制。
有学者推测此加合物除能致癌外,也与该病的肾纤维化进程有关。
AA可在一系列酶如微粒体酶类(CYP1A1、CYP1A2)、胞质酶(硝基还原酶和黄嘌呤氧化酶)、NAD-PH(醌氧化还原酶)等的作用下合成AA-DNA加合物而AA-DNA加合物可使ras基因发生A-T互换突变而活化,还能使抑癌基因p53突变失去正常功能,从而使细胞增殖增强分化异常,最终导致肿瘤的发生。
有研究表明P53通路是马兜铃酸肾病相关膀胱上皮癌的细胞周期标记,并促进急性AAN的肾损伤。
Bakhiya等对有机阴离子转运体(organic anion transporters, OA Ts) 的研究表明,AA 能被hOAT1 、hOAT3 和hOAT4 转运进入近曲小管上皮细胞内OA Ts 抑制药丙磺舒可抑制AA 进入上皮细胞,从而阻断AA-DNA加合物形成有机离子转运与脂肪酸代谢的改变,会进一步导致肾小管损伤以及泌尿代谢特征的变化[17]。
3.结语近年来,AAN 仍是国内外学者关注的焦点对AA毒性研究已经深入展开,阐明了AA毒性的部分作用机制,并且开展了大量的AAN 的预防和治疗工作对于AA的毒性应以预防为主,慎用含有AA的中草药同时应尽快建立中药使用的统一标准,正确合理使用中草药,提高对中草药毒性的认识。
本文对马兜铃中致肾毒性的AA的毒性机制进行了初步整理,为合理利用此类中草药,更好地发挥其治疗优势,减少毒性作用和不良反应提供了一些参考。
参考文献[1].Frederic D Debelle, Jean-Louis V anherweghem, Joelle L Nortier. Aristolochicacid nephropathy: A worldwide problem[J]. Kidney International, 2008, 74(2): 158-169.[2].王志红. 马兜铃属植物与马兜铃酸肾病[J]. 北京中医, 2005, 24(6): 361-363.[3].V anherweghem JL, Depierreux M, Tielemana C, et al. Rapidly progressiveinterstitial renal fibrosis in young women: association with slimming regimen including Chinese herbs[J]. The Lancet, 1993, 341(8842): 387-487.[4].黎磊石. 由木通肾毒性研究带来的思考-提高对中草药肾毒性的认识[J]. 肾脏病与透析肾移植杂志, 1999, 8(1): 1-2.[5].唐功耀, 田雪飞, 谌贻璞. 马兜铃酸对人肾细胞作用的实验研究[J]. 中华肾病杂志, 2001, 18(4): 266-269.[6].李瑛, 刘志红, 郭啸华等. 马兜铃酸Ⅰ致肾小管上皮细胞DNA损伤的实验研究[J]. 肾脏病与透析肾移植杂志, 2004, 13(1): 7-12.[7].Ng Y, Huang TP, Yang WC, et al. Tubular epithelial-myofibroblasttransdifferentiation in progressive tubulointerstitial fibrosis in 5/6 nephrectomized rats[J]. Kidney International, 1998, 54:864-876.[8].郑法雷,文晓彦,李雪梅等. 单个核细胞趋化蛋白-1和马兜铃酸Ⅰ在诱导人类肾小管上皮细胞转分化中的协调作用[J]. 中华内科杂志, 2000, 12: 38-41. [9].李胜, 唐德燊, 刘华锋. 马兜铃酸肾病发病机制的研究进展[J]. 医学综述,2007.8, 13(16): 1239-1241.[10].陈娅娟, 吴俏银, 叶惠兰等. 马兜铃酸毒理研究进展[J]. 广东药学院学报,2003, 1(9): 156-160.[11].Dong Sun, Jiangmin Feng, Chun Dai, et al. Role of Peritubular Capillary Lossand Hypoxia in Progressive Tubulointerstitial Fibrosis in a Rat Model of Aristolochic Acid Nephropathy [ J]. Am JNephrol, 2006, 26( 4): 363- 371. [12].Wen YJ, Qu L, Li XM. Ischemic injury underlies the pathogenesis ofaristolochic acid-induced acute kidney injury[J]. Psychologie und Psychotherapie, 2008, 152(1): 38- 46.[13].左巍, 刘亚革, 王继红等. 大鼠马兜铃酸肾病模型中炎性细胞浸润的特点及意义[ J]. 细胞与分子免疫学杂志, 2005, 21(6): 757-759.[14].PozdzikA, Salmon IJ, Husson CP, et al. Patterns of inter-stitial inflammationduring the evolution of renal injury inexperimental aristolochic acid nephropathy[J]. NephrolD-ialTransplant, 2008, 23( 8): 2480- 2491.[15].郭建, 高福云, 周舒. 马兜铃酸肾病的研究进展[J]. 中华中医药杂志, 2009,24(9): 1187-1190.[16].梁世凯, 许菲菲. 马兜铃酸致癌性研究进展[J]. 国外医学泌尿系统分册,2005, 25(2): 256-259.[17].胡玥, 江振洲, 张陆勇. 中药马兜铃酸肾毒性研究进展[J]. 中南药学, 2011,9(6): 447-450.。
