气体液体和溶液的性质
化学反应中的气体溶解度影响因素

化学反应中的气体溶解度影响因素在化学反应中,气体溶解度是一个重要的影响因素。
气体的溶解度取决于多种因素,包括温度、压力、溶液的性质和气体的性质等。
下面将详细讨论这些影响因素。
1. 温度: 温度是影响气体溶解度的重要因素之一。
一般来说,温度升高会使气体的溶解度降低。
这是因为在较高的温度下,溶剂分子具有更大的动能,更容易冲破气体分子之间的吸引力,从而导致溶解度的降低。
相反,温度降低则会增加气体的溶解度。
2. 压力: 压力也是决定气体溶解度的重要因素之一。
根据亨利气体定律,气体在溶液中的溶解度与气体的分压成正比。
当压力增加时,气体分子在溶液中的溶解度也增加。
这是因为增加压力会增加气体分子与溶剂分子之间的碰撞频率和力度,促进气体分子进入溶液中。
相反,降低压力会减少气体的溶解度。
3. 溶液的性质: 溶液的性质也会对气体的溶解度产生影响。
比如,溶液中存在其他溶质会降低气体的溶解度。
这是因为其他溶质占据了一部分溶剂分子与气体分子之间的作用位点,减少了气体分子进入溶液中的机会。
溶液的酸碱性、离子浓度和溶液的粘度等性质也会对气体的溶解度产生影响。
4. 气体的性质: 不同气体的性质也会导致它们在溶液中的溶解度不同。
一般来说,极性气体更容易在极性溶剂中溶解,而非极性气体更易溶于非极性溶剂中。
这是因为极性溶剂分子与极性气体分子之间的相互作用力更强,有利于气体的溶解。
总结起来,化学反应中气体的溶解度受到温度、压力、溶液的性质和气体的性质等因素的影响。
了解和掌握这些影响因素对于理解和预测化学反应过程中气体溶解度的变化具有重要意义。
在实际应用中,我们可以通过调节这些影响因素来实现对气体溶解度的控制,从而优化化学反应过程和产物的制备。
溶解度与溶液的气体溶解性质

溶解度与溶液的气体溶解性质溶解度是指在一定温度和压力条件下,溶质在溶剂中能够溶解的最大量。
而溶液的气体溶解性质则是指气体在溶液中的溶解行为及相关特性。
本文将就溶解度与溶液的气体溶解性质展开论述,并探讨其背后的科学原理。
一、溶解度溶解度是物质溶解在溶剂中的程度的度量。
它与温度、压力以及溶质和溶剂的性质密切相关。
溶解度通常用单位质量溶剂所能溶解的溶质的数量来表示。
例如,溶解度可以用克溶质/克溶剂或摩尔溶质/升溶液来测量。
在固体溶解于液体的情况下,普遍来说,溶解度随着温度的升高而增加。
这是因为温度升高会使溶剂的分子动能增加,分子间相互作用减弱,使溶质更容易与溶剂相互作用并溶解。
但对于气体溶解于液体的情况,溶解度却是随温度升高而降低。
这是由于气体分子在高温下具有更大的动能,更容易从液体中逸出。
二、气体溶解性质气体溶解性质与溶质和溶剂的物化性质有关。
气体分子在溶液中呈现出三种可能的行为:部分溶解、完全溶解和产生化学反应。
1. 部分溶解一些气体在溶液中仅能部分溶解,只有一部分气体分子与溶剂分子相互作用并保持在溶液中。
这主要与溶质和溶剂之间的相互作用力有关。
例如,氨气溶解于水时,只有一部分氨分子会与水分子形成氢键,而其他氨分子则逃离溶液。
2. 完全溶解一些气体能够完全溶解于溶剂中,所有气体分子都与溶剂分子相互作用并保持在溶液中。
这通常发生在气体分子与溶剂分子之间有较强的相互作用力的情况下。
例如,氧气可完全溶解于水中。
3. 化学反应某些气体在溶液中会产生化学反应,与溶剂发生化学变化。
这类气体在溶液中并没有明确的溶解性,而是产生新的物质。
例如,二氧化碳在水中会发生酸碱反应,生成碳酸。
三、溶解度的影响因素除了温度,压力和物质性质外,溶解度还受其他因素的影响。
1. 压力对于溶解度与压力的关系,通常情况下,固体和液体溶质与液体溶剂的溶解度并不受压力的影响。
而对于气体溶解于液体的情况,溶解度会随压力的增加而增加。
这是由于增加压力会使气体分子更容易与液体分子发生相互作用,从而增加溶解度。
无机化学-气体和溶液

b —— 体积常数。
(2)实际气体分子间有作用力。因此理想压强P为分子碰撞器 壁产生的压强P实际和内层分子作用力产生的压强P内之和。
热力学推导:
令比例系数为a
a —— 引力常数。分子不同时,相互吸引力不同,a不同。
1
范德华方程: ( p+a n2 )(V - nb)=nRT V2
注:范德华方程仍然是近似的
2、道尔顿分压定律:
∑ p总= p1+ p2+ p3 ⋅⋅ ⋅⋅ ⋅ ⋅= pi
§1.2 溶液
§1.2.1 溶液的概念 §1.2.2 非电解质稀溶液的依数性 §1.2.3 胶体溶液
2
§1.2.1 溶液的概念
相: 物理、化学性质均相同的一部分物质,称为一个相。
一个相
纯物质 (同一状态) 以分子、离子、原子形式均匀混合的混合物
在此假想状态下,描述气体性质的物理量 p、V、T、n 之间服从下列关系式:
pV = nRT
理想气体状态方程式
其中: p — 压强(Pa,kPa, atm,mmHg), T — 温度(K) V — 体积(m3、cm3、L,ml), n — 物质的量(mol) R —— 气体常数。
在标准状况下,p =101325Pa, T=273.15K n=1.0 mol时, Vm=22.414L=22.414×10-3m3
∆p = p* - p = p* - p*xB = p*xA
p* — 纯溶剂蒸气压; p — 溶液蒸气压; xA — 溶质的摩尔分数
稀溶液中,nA << nB , ∆p = p*xA≈ p*×MB/1000×bA=KbA
当溶剂一定时,MB、p*一定,故p* ⋅MB/1000为一个常数,用K表示。
第二章 物质的状态 气体、液体、溶液
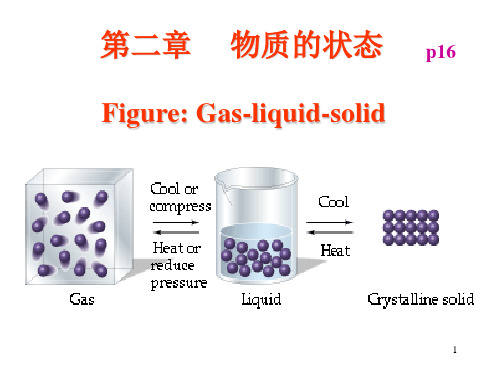
临界现象? 临界现象
课本p26 课本
Tb (沸点) < 室温 沸点) Tc < 室温, 室温, 室温下加压不能 液化
Tb < 室温, 室温, Tc > 室温, 室温, 室温下加压可液 化 Tb > 室温 Tc > 室温, 室温, 在常温常压下为 液体
24
临界常数: 临界常数:
p26
• 每种气体液化时 各有一个特定温度叫临界温度 每种气体液化时, 各有一个特定温度叫临界温度 临界温度Tc. 在Tc 以 无论怎样加大压力, 都不能使气体液化. 上, 无论怎样加大压力 都不能使气体液化 • 临界温度时 使气体液化所需的最低压力叫临界压力 临界温度时, 使气体液化所需的最低压力叫临界压力 临界压力Pc. • 在Tc 和 Pc 条件下 1 mol 气体所占的体积叫临界体积 条件下, 气体所占的体积叫临界体积 临界体积Vc.
17
压力P愈小 温度T愈高 愈高, 压力 愈小, 温度 愈高 愈接近理想气体 愈小
1mol N2气
Z=
18
不同气体的比较 (1mol, 300K )
Z=
19
图总结: 气体 Z-P 图总结:
1. 常压常温下,沸点低的气体,接近理想气体 常压常温下,沸点低的气体, 2. 起初增加压力时,对于分子量较大的分子,分子间作用力增 起初增加压力时,对于分子量较大的分子, 加占主导, 加占主导,使得 Z < 1 3. 增加较大压力时,分子的占有体积占主导,使得 Z > 1 增加较大压力时,分子的占有体积占主导,
第二章
物质的状态
p16
Figure: Gas-liquid-solid Gas-liquid-
1
本章主要内容: 本章主要内容: 一、气体
气体与溶液的物理性质

气体与溶液的物理性质在我们的日常生活和科学研究中,气体和溶液是经常遇到的两种物质状态。
它们各自具有独特的物理性质,这些性质不仅影响着它们在自然界中的存在和变化,也在许多工业和化学过程中起着至关重要的作用。
首先来聊聊气体的物理性质。
气体具有可压缩性,这是其一个非常显著的特点。
由于气体分子之间的距离较大,分子间的作用力相对较弱,所以在施加压力时,气体的体积能够明显减小。
比如说,我们给充满气体的轮胎打气,就是通过压缩气体来增加轮胎内的气压。
气体的扩散性也很强。
气体分子能够迅速地在空间中扩散,从而使不同的气体能够均匀混合。
想象一下,在一个房间里打开一瓶香水,很快整个房间都能闻到香味,这就是气体扩散的表现。
而且,气体的密度通常比固体和液体小得多。
这是因为气体分子间的间距大,单位体积内的分子数量相对较少。
温度对气体的性质影响很大。
当温度升高时,气体分子的热运动加剧,压强会增大,体积也会膨胀。
反之,温度降低时,气体的压强减小,体积收缩。
这就是我们常说的“热胀冷缩”原理在气体中的体现。
接下来看看溶液的物理性质。
溶液具有均一性,也就是说,溶液中各部分的组成和性质完全相同。
比如一杯糖水,无论从哪个部位品尝,甜度都是一样的。
溶液的稳定性也是其重要特性之一。
在一定条件下,溶质能够稳定地分散在溶剂中,不会自行分离出来。
但需要注意的是,这里的稳定是相对的,如果条件发生改变,比如温度、压强等,溶液的稳定性可能会受到影响。
溶液的渗透压是一个比较重要的概念。
当溶液与纯溶剂被半透膜隔开时,溶剂会通过半透膜向溶液一侧渗透,这种压力差就是渗透压。
渗透压在生物体内有着重要的作用,比如细胞内外的物质交换就与渗透压密切相关。
另外,溶液的沸点和凝固点也会因为溶质的存在而发生改变。
一般来说,溶液的沸点会升高,凝固点会降低。
例如,在水中加入盐,盐水的沸点就会高于纯水,而凝固点则低于纯水。
这在冬季道路防滑时经常会用到,向道路上撒盐可以降低水的凝固点,防止道路结冰。
化学反应中的气体与溶液的性质与计算知识点总结

化学反应中的气体与溶液的性质与计算知识点总结化学反应是研究物质之间相互转化的过程,其中气体和溶液是常见的反应状态。
本文将从气体和溶液的性质以及计算知识点方面进行总结。
一、气体的性质1. 压力(P):气体分子对容器壁施加的力所引起的单位面积上的压力,单位为帕斯卡(Pa)或等效单位。
2. 体积(V):气体占据的空间,通常以升(L)为单位。
3. 温度(T):衡量气体分子平均动能的物理量,常用摄氏度(℃)或开尔文(K)表示。
4. 摩尔数(n):单位体积气体所含的物质的量,常用摩尔(mol)表示。
5. 气体状态方程:描述气体体积、压力、摩尔数和温度之间关系的方程式。
a. 理想气体状态方程:PV = nRT,其中R为气体常数。
b. 简化气体状态方程:以特定情况下气体满足的条件为基础,例如低温、高压或温度接近绝对零度。
6. 气体扩散和离子速率:气体的运动以及气体分子间的碰撞导致气体的扩散。
离子速率则与溶液中离子的浓度和电荷密度相关。
二、溶液的性质1. 浓度(C):溶液中溶质的质量或物质的量与溶液总体积的比值。
a. 质量浓度:溶质质量与溶液总体积的比值,单位常为克/升(g/L)。
b. 摩尔浓度:溶质物质的量与溶液总体积的比值,单位为摩尔/升(mol/L)。
2. 溶解度:溶质在溶剂中的最大溶解量,可根据溶解度曲线寻找。
3. 饱和溶液:达到溶解度极限的溶液,无法再溶解更多溶质。
4. 溶液的温度和压力对溶解度的影响:溶解度常随温度的升高而增加,溶解度与压力的关系则与溶质的性质和溶剂有关。
5. 溶液的沉淀和溶解反应:当两种溶液混合时,沉淀反应会导致溶质从溶液中析出,而溶解反应则会使溶质从沉淀中溶解到溶液中。
三、计算知识点1. 摩尔质量计算:将相对原子质量或相对分子质量与摩尔数关联起来,计算物质的质量。
质量(g)= 摩尔质量(g/mol)×物质的摩尔数(mol)2. 摩尔比例:根据化学方程式中的摩尔系数,可以确定反应物和生成物之间的摩尔比例关系。
化学反应中的气体和溶液知识点总结

化学反应中的气体和溶液知识点总结化学反应是物质间发生变化的过程,其中气体和溶液是常见的反应方式。
本文将围绕化学反应中的气体和溶液两个方面进行知识点总结,帮助读者更好地理解这些概念。
一、气体的特性和性质气体是一种无定形的物质形态,具有以下特性和性质:1. 可压缩性:气体的分子间距离较大,分子运动剧烈,因此气体具有可压缩性。
2. 可扩散性:气体分子具有高速运动,可以自由地在容器内扩散和混合。
3. 可溶性:气体可以溶解于液体或固体中,其溶解度受温度和压力的影响。
4. 气压和温度:根据理想气体状态方程P×V = n×R×T,气体压强和温度成正比,压强的单位是帕斯卡(Pa),温度的单位是开尔文(K)。
二、溶液的组成和性质溶液是由溶质和溶剂组成的混合物,其中溶质是被溶解的物质,溶剂是用于溶解溶质的物质。
溶液具有以下组成和性质:1. 溶解度:溶解度是指单位溶剂中能溶解的最大溶质量,常用质量分数或摩尔分数表示。
2. 饱和溶液:当在一定温度下,无法再溶解更多溶质时,称为饱和溶液。
3. 浓度:溶液的浓度可以通过质量浓度、摩尔浓度或体积浓度等方式表示。
4. 溶解过程:溶质分子与溶剂分子之间的相互作用力决定了溶解过程的进行与否。
5. 离子溶液:当溶质是离子时,溶液中的离子数量与电解质的浓度成正比。
三、气体反应常见类型1. 常规气体反应:包括氧化反应、还原反应、酸碱中和反应等。
例如:2H2 + O2 → 2H2O2. 气体的摩尔关系:根据化学计量关系,在气体反应中可以根据反应物的物质的摩尔比例推导出产物的物质摩尔比例。
例如:2H2 + O2 → 2H2O,2摩尔氢气与1摩尔氧气反应生成2摩尔水。
3. 气体溶解平衡:气体溶解于溶液中时,会达到一个平衡状态,溶解度受温度和压力的影响。
四、溶液反应常见类型1. 酸碱反应:酸和碱在溶液中反应生成盐和水的化学反应。
例如:HCl + NaOH → NaCl + H2O2. 沉淀反应:两种溶液混合时,产生的沉淀物是由两种阳离子和阴离子结合形成的固体颗粒。
张祖德《无机化学》修订版辅导用书-章节题库-第1章 气体、液体和溶液的性质【圣才出品】

圣才电子书
十万种考研考证电子书、题库视频学习平
台
同。
7.扩散速率约为甲烷 3 倍的气体是( )。 A.H2 B.He C.N2 D.CO2 【答案】A 【解析】根据气体的扩散定律,气体的扩散速率与相对分子质量的平方根成反比:
8.下列各组气体中,在相同温度下两种气体扩散速率最接近整数倍的是( )。 A.H2 和 He B.He 和 N2 C.He 和 O2 D.H2 和 O2 【答案】D 【解析】气体的扩散速率与相对分子质量的平方根成反比,由此可得:
4 / 19
圣才电子书
十万种考研考证电子书、题库视频学习平 台
9.水在 96.5℃时沸腾,这说明外界大气压( )。 A.等于一个标准大气压 B.略高于一个标准大气压 C.低于一个标准大气压 D.远远高于一个标准大气压 【答案】C 【解析】沸点是指纯液体的饱和蒸气压达到外界大气压时的温度。水的正常沸点为 100℃,此时水的饱和蒸气压等于标准大气压。若水在 96.5℃沸腾,说明此时水的饱和蒸 气压小于标准大气压,即外界大气压小于标准大气压。
圣才电子书
十万种考研考证电子书、题库视频学习平
台
第 1 章 气体、液体和溶液的性质
一、选择题 1.在 100℃时,98.7kPa 压力下,硫蒸气的密度为 0.5977g·L-1,已知 S 的原子量是 32.066,则硫的分子式是( )。 A.S8 B.S6 C.S4 D.S2 【答案】D 【解析】硫蒸气的密度为 0.5977g·L-1,即体积为 1L 时,质量为 0.5977g,且温度及 压力已知,根据理想气体状态方程:
A.100kPa B.200kPa C.300kPa D.400kPa 【答案】B
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章 气体、液体和溶液的性质§1-1 气体的性质本节的重点是三个定律:1.道尔顿分压定律(Dalton’s law of partial pressures ) 2.阿码加分体积定律(Amagat’s law of partial volumes ) 3.格拉罕姆气体扩散定律(Graham’s law of diffusion )一、理想气体(Ideal Gases )――讨论气体性质时非常有用的概念1.什么样的气体称为理想气体?气体分子间的作用力很微弱,一般可以忽略; 气体分子本身所占的体积远小于气体的体积。
即气体分子之间作用力可以忽略,分子本身的大小可以忽略的气体,称为理想气体。
2.理想气体是一个抽象的概念,它实际上不存在,但此概念反映了实际气体在一定条件下的最一般的性质。
3.实际气体在什么情况下看作理想气体呢?只有在温度高和压力无限低时,实际气体才接近于理想气体。
因为在此条件下,分子间距离大大增加,平均来看作用力趋向于零,分子所占的体积也可以忽略。
二、理想气体定律(The Ideal Gas Law )1.由来(1) Boyle’s law (1627-1691)British physicist and chemist - The pressure-volume relationshipn 、T 不变 , V ∝ 1/ p or pV = constant(2) Charles’s law (1746-1823)French scientist 1787年发现-The temperature-volume relationshipn 、p 不变 , V ∝ T or V /T = constant(3) Avogadro’s law (1778-1823)Italian physicistAvogadro’s hypothesis :Equal volumes of gases at the same temperature and pressure contain equal numbers of molecular.Avogadro’s law The volume of a gas maintained at constant temperature andpressure is directly proportional to the number of moles of the gas.T 、p 不变 , V ∝ n2.理想气体方程式(The ideal-gas equation )由上三式得:V ∝ nT / p ,即pV ∝ nT ,引入比例常数R ,得:pV = nRT pV = nRT R---- 摩尔气体常量 在STP 下,p =101.325kPa, T =273.15K n =1.0 mol 时, V m =22.414L=22.414×10-3m 3R =8.314 kPa ⋅L ⋅K -1⋅mol -1nT pV R =K15.2731.0m ol m 1022.414Pa 10132533⨯⨯⨯=-11K m ol J 314.8--⋅⋅=4.理想气体方程式应用 可求摩尔质量(1) 已知p ,V ,T , m 求 M (2) 已知p ,T ,ρ 求 M5.实际气体(Real gas )与理想气体的偏差(Deviations of ideal behavior) (1) 实例:1mol 几种气体 pV / RT ~ p 曲线从两个图中,可以得知:a .分子小的非极性分子偏差小,分子大的极性强的分子偏差大;b .温度越高,压力越低,偏差越小。
6.对理想气体定律的修正— van der Waals equation (1837-1923) Dutch scientist ,荣获1910年 Noble physical prize (1) 形式22n p aV nb nRT V +-()()=(2) 讨论:上式与p id V id = nRT 相比:a .V id = V 实-nb ,n 为mol 数,b 为每mol 分子本身占有的体积 ∴ V 实-nb 就成了气体分子本身占有体积已被扣除了的空间,即为V id b .2id 2n p p aV =+实,为什么要在p 实项上再加上一项22n aV呢?即为什么p 实<p 理呢?降压的因素来自两个方面。
(i) 由于分子内存在相互作用,所以分子对器壁的碰撞次数减少,而碰撞次数与分子的密度(n / V )成正比;(ii) 分子对器壁碰撞的能量减少,它也正比于 n / V ,所以压力降低正比于n 2/ V 2,即p 实 + 22n a V= p id 。
a 、b 称为 van der Waals constant ,由实验确定。
三、道尔顿分压定律(Dalton’s Law of Partial Pressures ) 1801年1.Deduction :假设有一理想气体的混合物,此混合物本身也是理想气体,在温度T 下,占有体积为V ,混合气体各组分为i (=1,2,3,… i ,…) 由理想气体方程式得:11RT p n V= ,22RT p n V= ,……,i iRT p n V=,……∴总p VRTn V RT n p ii ===∑∑,即∑=ip p 总 2.表达式:∑=ipp 总3.文字叙述:在温度和体积恒定时,其总压力等于各组分气体单独存在时的压力之和。
4.另一种表达形式:ii i i RTn p n V x RT p nn V===总─ mole fraction 在温度和体积恒定时,理想气体混合物中,各组分气体的分压(p i )等于总压(p 总)乘以该组分的摩尔分数(x i )。
求转化率:已知某温度、1atm 下,A 4B 2(g)在密闭容中进行如下分解A 4B 2(g)2A 2(g) + B 2(g)达到平衡时,容器的压力为1.4atm ,求A 4B 2的转化率为多少?A 4B 2(g)2A 2(g) + B 2(g) 1 0 01-α 2α α ∴1112 1.4ααα=-++ ∴α = 0.2四、阿玛加分体积定律(Amagat’s Law of Partial Volumes )1.什么叫分体积:混合气体中某组分i 单独存在,并且和混合气体的温度,压强相同时,所具有的体积V i ,称为混合气体中第i 组分的分体积,图示为:总体积 V分体积 V 1分体积 V 2n 1 + n 2n 1n 22.分体积定律:当温度,压力相同时,混合气体的总体积等于各组分分体积之和 3.Deduction :1212()///i i n n n RTnRT V n RT p n RT p n RT p p p++++===++++12///i n RT p n RT p n RT p =++++ 12i i V VV V =++++=∑五、格拉罕姆扩散定律 (Graham’s Law of Effusion and Diffusion )恒压条件下,某一温度下气体的扩散速率与其密度(或摩尔质量)的平方根成反比 表达式:12/u u =(2) 理论推导由分子运动论的推导可知: 223()3u pV m pV Nu N m==⋅∴u =N mV ρ⋅=∴当p = constant , u ∝∴ 12/u u =又 ∵ M ρ∝ ∴ 12/u u =思考:扩散时间与密度(或摩尔质量)之间的关系如何?212121///M M t t ==ρρ§1-2 液体 Liquids液体所表现出来的特性由其结构特点决定的。
它处于完全混乱的气体状态和基本上完全有序的固体状态之间,所以它既不能象气体运动论那样作基本假设,又不能象固体那样,通过一定的对称性作一些定量计算,因而液体的定量理论的发展到目前为止还不甚理想。
但液体本身也有一些特性,如:粘度(viscosity)、表面张力(surface tension)、凝固点(freezing point)、沸点(boiling point)、饱和蒸气压(saturated vapor pressure of liquid ),简称为蒸汽压(vapor pressure of liquid )。
本节我们主要讨论液体的饱和蒸气压和凝固点。
一、液体的蒸气压(Vapor Pressure of Liquid )1.蒸发过程(1) 蒸发是液体气化的一种方式,也可以称为相变过程(phase changes )。
蒸发过程伴随着能量的变化(energy changes)。
很显然,当液体不能从外界环境吸收能量的情况下,随着液体的蒸发,液体本身温度下降,蒸发速率也随之减慢。
(2) 液体的蒸发热(heat of vaporization),也称为蒸发焓(enthalpy of vaporization)。
恒压、恒温下,维持液体蒸发所必须的热量,称为液体的蒸发热。
2.液体的饱和蒸气压(简称蒸气压) (1) 在液体表面,只有超过平均动能的分子,才能克服邻近分子的吸引,进入气相中-─蒸发。
(2) 在密闭容器中,在不断蒸发的同时,部分蒸气又会重新回到液体-─凝聚。
(3) 在一定温度下,在密闭容器中,经过一定时间,蒸发与凝聚达到平衡,这时液面上的蒸气称为饱和蒸气。
(4) 由饱和蒸气产生的压强称为饱和蒸气压,简称蒸气压(vapor pressure of liquid )。
(5) 对于同一种液体的蒸气压不决定于液体的体积,也不决定于蒸气体积,只与温度有关,所以蒸气压仅与液体本质和温度有关。
3.蒸气压与蒸发热的关系(The relationship betweenvapor pressure and enthalpy of vaporization)-The Clausius —Clapeyron equation ((克劳修斯─克拉贝龙方程式)(1) 以饱和蒸气压的自然对数ln p 对绝对温度的倒数(1/T )作图,得到的图象是一条直线,乙醇的ln p 与1 / T 的关系如左图,符合下面的直线方程:vap ln (1/)Hp T C R∆=-+ R :gas constant C :直线的截距Δvap H :enthalpy of vaporization per mole of substance假设在T 1~T 2温度区间内,Δvap H不变,蒸气压分别为p 1和p 2,则vap 11ln (1/)H p T C R∆=-+ (1) vap 22ln (1/)H p T C R∆=-+ (2)(1)-(2)式,得 vap 122111ln(/)()H p p R T T ∆=-或者 vap 122111lg(/)()2.303Hp p R T T ∆=-此式称为克劳修斯-克拉贝龙方程式。
