物理化学第七章 电化学基础
天大物理化学第五版第七章电化学ppt课件

银库仑计中有0.723 mmol Ag沉积,则在电解池中阳极必有相同数量 的Ag被氧化成Ag+而进入溶液,即 n反应 (Ag ) 0.723 mmol
对Ag+ 物料衡算有 : n电解后
n电解前
n反应 n迁移
t(Ag )n反应
17
t(Ag )
n电解前
n电解后
1
1.007
1.390 1
0.470
n反应
电解质溶液的 :
相距为1m, 面积为1m2
1m2
的两个平行板电极之间充
满电介质溶液时的电导。
1m
(2) 摩尔电导率Λm:
1mol电解质溶液导电能力,即单位浓度下的电导率:
m
/c
(单位为S. m2.mol-1)
20
2. 电导的测定
用惠茨通(Wheatstone)电桥测电导
(实为测电阻,用交流电)
当T=0时: VAD = VAC , I1R1 = I2R3 VDB =VCB , I1Rx = I2R4
m,
均可查表计算
26
5. 电导测定的应用
(1) 计算弱电解质的解离度及解离常数
弱电解质部分电离,例如,醋酸:
解离前
CH3COOH = H+ + CH3COO-
c
0
0
解离平衡时 c(1- ) c c
K
( c /c )2 (1 )c /c
2
1 c /c
m m
测电导可求得
由 可求出 m(= /c)
查表、计算可得 Λm
即:通过1 mol 电子电量时,任一电极上发生得失1 mol 电 子的电极反应。电极上析出或溶解的物质的量与之相应。
物理化学答案——第七章-电化学

第七章 电化学(一)基本公式和内容提要1 Faraday (法拉第)定律定义:当电流通过电解质溶液时,通过每个电极的电量与发生在该电极上电极反应的物质的量成正比。
Q = nzF2 离子迁移数定义:每种离子所传输的电量在通过溶液的总电量中所占的分数,以t 表示 Q r t Q r r ++++-==+, Q r t Qr r ---+-==+3 电导G ,电导率κ,摩尔电导率m Λ1I G RU -==1κρ=, A G lκ=m m V cκκΛ== 1c e l ll K R R Aκρ===其中,cell l K A=为电导池常数,c 为电解质的浓度,单位是mol/m 34 离子独立运动定律m ∞Λ = v+()m A λ∞+ + v-()m B λ∞-对于强电解质,在浓度较低的范围内,有下列经验关系(科尔劳乌施经验关系):(1m m β∞Λ=Λ-对于弱电解质: m m α∞Λ=Λ (其中,α为解离度)5 离子平均活度a ±和离子平均活度系数γ±电解质的活度:(/)v v v va a a a m m θγ+-+-±±±===其中,1/()v v v γγγ+-±+-= , 1/()v v vm m m +-±+-=6 德拜-休克尔极限公式ln Az z γ±+-=-式中I 为溶液离子强度212i iI m z =∑;在298 K 的水溶液中,11221.172kg molA -=,上式适用于10.01m ol kg I -≤ 的稀溶液。
7 可逆电池热力学r m G n E Fθθ∆=- (只做电功) r mG nEF ∆=-(只做电功)ln R T E K nFθθ=()()r mr m p pG ES nF T T∂∆∂∆=-=∂∂式中,()p E T∂∂是电池电动势随温度的变化率,称为电池电动势的温度系数。
物理化学-第七章-电化学

通入的总电量:Q I t 0.23060 360库仑
电极上起化学反应物质的量:
n Q 360 0 00373mol zF 196500
析出Ag的质量: m=n×MAg=0.00373×107.88=0.403g
二、电导、电导率和摩尔电导率
体积与浓度的关系如何呢?
c n V
(mol·m-3)
若n为1mol
Vm
1 c
m
Vm
c
S·m2·mol-1
注意:c的单位:mol﹒m-3
3.电导、电导率和摩尔电导率之间的关系
G 1 R
K l A
G K
m
Vm
c
例: 298K时,将0.02mol·dm-3的KCl溶液放入 电导池,测其电阻为82.4Ω,若用同一电导池充 0.0025mol.dm-3的K2SO4溶液,测其电阻为 326Ω,已知298K时,0.02mol·dm-3的KCl溶液 的电导率为0.2768S.m-1 (1)求电导池常数; (2)0.0025mol.dm-3的K2SO4溶液的电率; (3)0.0025mol.dm-3的K2SO4溶液的摩尔电 导率。
★电池 汽车、宇宙飞船、照明、通讯、 生化和医学等方面都要用不同类型的化学 电源。
★ ⒊电分析 ★ ⒋生物电化学
§7-1 电解质溶液的导电性质 一、电解质溶液的导电机理
1.导体: 能够导电的物体叫导体。
第一类: 靠导体内部自由电子的定向运动而导电的物体
如 金属导体
石墨
性质:
A.自由电子作定向移动而导电
F:法拉第常数,即反应1mol电荷物质所需电量 1F=96500库仑/摩尔
物理化学07章电化学

(PHYSICAL CHAMISTRY)
第七章 电化学 (Electrochemistry)
2019/9/7
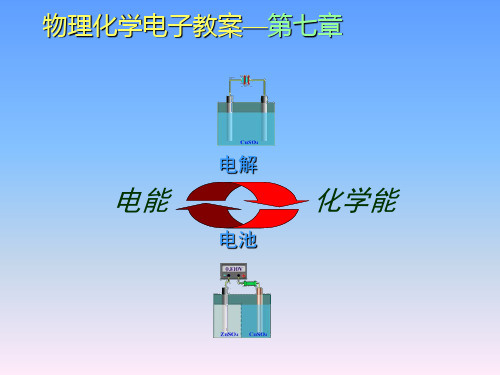
物理化学电子教案—第七章 电化学
电解
电能
电池
化学能
∆rGm
上一内容 下一内容 回主目录
返回
2019/9/7
• 电解质溶液
• 原电池中的电化学过程 电极上的电化学反应
• 电解池中的电化学过程
通电结束,阳极部阳、阴离子各少了3 mol,阴极部 只各少了1 mol,而中部溶液浓度仍保持不变。
上一内容 下一内容 回主目录
返回
2019/9/7
离子的电迁移现象
上一内容 下一内容 回主目录
返回
2019/9/7
思考题:
若阳离子、阴离子均为荷二价的,且阳、 阴两电极反应中的电子得失数均为2,其 余条件相同。试考虑前面两种电迁移情况 有何不同?
电解质溶液的导电性质
上一内容 下一内容 回主目录
返回
2019/9/7
(一)电解质溶液
主要内容
电化学的基本概念和法拉第定律 离子的电迁移和迁移数 电导 强电解质溶液理论简介
上一内容 下一内容 回主目录
返回
2019/9/7
1.1 电化学的基本概念
电化学研究对象
电化学主要是研究电能和化学能之间的 相互转化及转化过程中有关规律的科学。
= 1 7 6 3 C
(2 )t Q I 0 1 .7 0 6 2 3 5 C A 7 .0 5 1 0 4s
(3) n(O2)1 4n(1 3Au) =1 4197.01g .20 m g ol1/34.57103m ol
上一内容 下一内容 回主目录
物理化学第7章 电化学

放置含有1 mol电解质的溶液,这时溶液所具有的
电导称为摩尔电导率 Λ m
Λ m
def
kVm
=
k c
Vm是含有1 mol电解质的溶液
的体积,单位为 m3 mol1,c 是电解
质溶液的浓度,单位为 mol m3 。
摩尔电导率的单位 S m2 mol1
注意:
Λ 在 后面要注明所取的基本单元。 m
b、强电解质: 弱电解质:
强电解质的Λ m
与
c
的关系
随着浓度下降,Λ 升高,通 m
常当浓度降至 0.001mol dm3 以下
时,Λ 与 m
c 之间呈线性关系。德
国科学家Kohlrausch总结的经验
式为:
Λ m
=Λm (1
c)
是与电解质性质有关的常数
将直线外推至 c 0
得到无限稀释摩尔电导率Λm
-
- 电源 +
e-
+
e-
阴
阳
极
极
CuCl2
电解池
阳极上发生氧化作用
2Cl aq Cl2(g) 2e
阴极上发生还原作用
Cu2 aq 2e Cu(s)
三、法拉第定律
Faraday 归纳了多次实验结果,于1833年总结出该定律
1、内容:当电流通过电解质溶液时,通过电极 的电荷量与发生电极反应的物质的量成正比;
作电解池 阴极: Zn2 2e Zn(s)
阳极 2Ag(s) 2Cl 2AgCl(s) 2e
净反应: 2Ag(s) ZnCl2 Zn(s) 2AgCl(s)
2.能量变化可逆。要求通过的电流无限小。
二、可逆电极的种类
1、第一类电极
物理化学07电化学
⑴ 通入电量 Q ;
⑵ 通电时间 t ;
⑶ 阳极上放出氧气的物质的量。
解: 1 Au3+ e = 1 Au
3
3
OH
1 4
O2
1 2
H2O e
(1) Q zF 196500197.01.g20mgol-1 /3 Cmol1
⒉ 通电于若干个电解池串联的线路中,当所 取的基本粒子的荷电数相同时,在各个电极 上发生反应的物质,其物质的量相同,析出 物质的质量与其摩尔质量成正比。
Q =n电F
n电:电板反应得失电子的物质的量 F: 法拉第常数在数值上等于1 mol电子的电量。
知元电荷电量为 1.6022 1019 C
F=L·e =6.022×1023 mol-1×1.6022×10-19 C
务各分担2mol,在假想的AA、BB平面上各有2mol正、 负离子逆向通过。
当通电结束,阴、阳两极区溶液浓度相同,但比 原溶液各少了2mol,而中部溶液浓度不变。
1.离子迁移数的定义
1.离子迁移数的定义 2)设正离子迁移速率是负离子的三倍,v 3v ,则
正离子导3mol电量,负离子导1mol电量。在假想的AA、 BB平面上有3mol正离子和1mol负离子逆向通过。
物理化学电子教案—第七章
电解
电能
电池
化学能
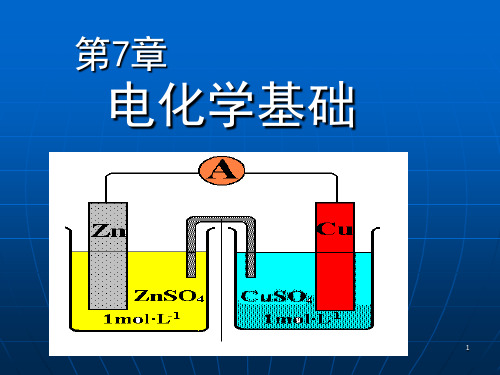
第七章 电化学
§7.1 电解池、原电池和法拉第定律 §7.2 离子的迁移数 §7.3 电导、电导率和摩尔电导率 §7.4 平均离子活度因子及德拜-休克尔极限公式 §7.5 可逆电池及其电动势的测定 §7.6 原电池热力学 §7.7 电极电势和液体接界电势 §7.8 电极的种类 §7.9 原电池设计举例
物理化学课件第七章_电化学

§7.2 电解质溶液的电导
一、电导G、电导率 、摩尔电导率m
二、电导的测定: 电阻R电导G 电导率 三、电导率和摩尔电导率随浓度的变化 四、离子独立运动定律
17
一、电导G、电导率 、摩尔电导率m
电阻:R=U/I(欧姆定律) 电阻率: = R(A / l) 单位: m
对于弱电解质:
m:全部电离,离子间无作用力
m :部分电离,离子间有作用力
若电离度比较小,离子浓度比较低,则相互作用力可
忽略,导电能力全部决定于电离度。
= m / m
31
电离度
= m / m
M + A c c
(1-1价型) MA 平衡时: c(1 - )
(c ) 2 Kc c(1 )
15
解
1.20 g 1 (1) Q nzF 3 96500 C mol 197.0 g mol-1 = 1763 C
(2) t Q 1763 C 7.05104 s I 0.025 A
(3) n(O2 ) 3 n(Au) 4 1.20 g 3 mol = 3 4.57 10 4 197.0 g mol1
⒊ 电化学分析 ⒋ 生物电化学
2
电
化
学
(一)电解质溶液 ☆ (二)可逆电池电动势 ☆ (三)不可逆电极过程
3
§7.1 离子的迁移
1.电解质溶液的导电机理
能够导电的物质称为导体。 第一类导体:金属——靠自由电子的迁移导电。 第二类导体:电解质溶液,熔融电解质,固体电解 质——靠离子的迁移导电。 电解质溶液的连续导电过程必须在电化学装置中 实现,而且总是伴随着电化学反应及化学能和电能 相互转换发生。
第7章-电化学基础
标准电极电势的测定
例5 简述测定Pt | Fe3+(1.0), Fe2+(1.0)的标准电极电势的方法及结果。 解 将Pt | Fe3+(1.0), Fe2+(1.0)与标准氢电极组成电池。从实验电流的方向确定此待测电极为正极,标准氢电极为负极。 测得电动势为0.771V,则 EΘ= E+Θ - E- Θ = EΘFe3+ /Fe2+ - EΘH+/H2
2.电极反应
任何氧化还原反应都可拆分为两个氧化还原电对的半反应(半电池反应,电极反应): Fe3+ + e → Fe2+ Sn2+ → Sn4+ + 2e 氧化-还原反应的实质: 两个共轭电对之间的电子转移反应。
3.电对拆分:
2MnO4-+5H2C2O4 + 6H+ → 2Mn2+ + 10CO2 + 8H2O MnO4- + 8H+ + 5e → Mn2+ + 4H2O ① H2C2O4 → 2CO2 + 2H+ + 2e ② MnO4- / Mn2+; CO2 /H2C2O4
例1 用离子-电子法配平下列氧化还原反应: K2Cr2O7 + KI + H2SO4 →K2SO4 + Cr2(SO4)3+I2+H2O 解:先写成离子反应式: Cr2O72- + I- + H+→ Cr3+ + I2 + H2O 将离子反应式分成两个半反应: I- → I2(电对:I2 /I- ) Cr2O72- + H+ → Cr3+ + H2O(电对:Cr2O72- /Cr3+) 分别配平两个半反应: 2I- = I2 + 2e Cr2O72- + 14 H+ + 6e = 2Cr3+ +7 H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
a
25 C E
0 . 05916 z
lg
a 氧化态 a 还原态
c
a
该式即为电极电势的能斯特方程式。该式在工程 化学中已学过,只是把浓度换为活度而已。
2012-6-28
常见电极的能斯特方程
Cr 2 O 7 14H
E E
4 2
6e 2Cr
lg
3
7H 2 O
0 . 0592 2
lg
a (H ) p ( H 2 ) / p
2012-6-28
2
§7-4 可逆电极的种类
该部分内容在工程化学中已学过,这里再简单复 习一遍。
一、第一类电极 二、第二类电极 三、氧化还原电极
2012-6-28
一、第一类电极
金属-金属离子电极:Zn|Zn2+:Zn2++2e=Zn; Zn-2e=Zn2+ Cu|Cu2+:Cu2++2e=Cu Cu-2e=Cu2+ 气体-离子电极:Cl- |Cl2,Pt:Cl2+2e=2Cl- 2Cl--2e=Cl2 Pt,O2|OH-:O2+2H2O+4e=4OH- 4OH--4e=O2+2H2O
p
解:Pb+2AgCl=PbCl2+2Ag ΔrGm=-zFE=-2×96485×0.490=-94555J/mol
r S m zF ( E T ) p 2 96485 ( 1 . 8 10
4
) 34 . 73 J K
1
mol
1
ΔrHm=ΔrGm+TΔrSm=-94555-298×34.73=104905J/mol Qr=TΔrSm=298×34.73=10350J/mol
例题:已知25℃时,电池 Pt,H2(p )|HCl(a±=0.1)|AgCl,Ag 的 E =0.2223 V。求25℃时电池反应的ΔrGm rGm、K 、Δ 解:电池反应为:H2+2AgCl=2HCl+2Ag ΔrGm =-zFE =-2×96485×0.2223= -42897(J/mol) ΔrGm=-RTlnK
lnK =43418/(8.314×298)=17.52 K =4.08×107
Ksp =1/K =1/(4.08×107)=2.40×10-8
2012-6-28
二、测定电解质溶液中离子的平均活度系数
例:铅酸电池 Pb,PbSO4|H2SO4(1mol/kg)|PbSO4,PbO2,Pb
2012-6-28
§7-5 电池电动势的应用
一、电动势法测定电池反应的热力学函数 二、测定电解质溶液中离子的平均活度系数 三、测定溶液的pH
四、电势滴定法
五、电势—pH图 六、判断反应趋势
2012-6-28
一、电动势法测定电池反应的热力学函数
测定了电动势及电动势温度系数,根据前述公式, 可以计算电池反应的热力学函数。
2012-6-28
二、电极电势和电池电动势
2、电池电动势 电池电动势是构成电池的各个相界面上所产生的电 势差的代数和。接触电势忽略不计,如果有液接电势 可用盐桥消除,所以原电池电动势就是两电极电势的 代数和。即 E = E+ - E-
2012-6-28
§7-2 可逆电池热力学
一、可逆电池构成条件
2012-6-28
二、第二类电极
金属-难溶盐电极:Ag,AgCl(s) |Cl-: AgCl(s)+e=Ag(s)+Cl- Hg,Hg2Cl2(s) |Cl-: Hg2Cl2(s)+2e=2Hg(s)+2Cl- 金属-难溶氧化物电极: H+ |Sb2O3(s) ,Sb: Sb2O3(s)+6H++6e=2Sb+3H2O
14
0 . 0592 6
a ( Cr 2 O 7 ) a a ( Cr
2 3
2
(H )
)
MnO
8H
5e Mn
lg a ( M nO
2
4H 2 O
) a (H )
8 2
E E
0 . 0592 5
4
a (Mn
)
2 H 2e H 2
E
(2) E+= -0.126 +(0.0592/2)ln0.1= -0.156V <E-=-0.136V 逆向自发
2012-6-28
§7-6 浓差电池
电极材料相同,但浓度不同时也可构成电池, 该类电池称为浓差电池,大体可分三类。
一、溶液浓差电池 二、电极浓差电池 三、固体电解质浓差电池
a m / m
0 . 2049 1 . 5875
0 . 1291
2012-6-28
三、测定溶液的pH
以玻璃电极作负极甘汞电极作正极,插入待测溶 液中测其电动势。有专门的pH计用于测pH。
玻璃电极是专门测定氢离子的,称为氢离子选择 电极。其电极电势与待测溶液中氢离子的活度有如 下关系:
例:298K时,E 2+/Sn) = -0.136V,E(Pb2+/Pb) = -0.126V, (Sn 求下列情况下,Sn+Pb2+=Sn2++Pb 的方向。 (1)标准条件下;(2)a(Pb2+)=0.1, a(Sn2+)=1
解:(1) E+ = -0.126 > E- = -0.136,正向自发
2012-6-28
二、电动势与电池反应热力学函数间的关系
根据第二章知, ΔrGm= Wmax =-zFE
( rG m ) T
ΔrGm = -zFE
E T
电池反应的熵变和焓变可通过下式求算:
r S m [ ] p zF ( )p
ΔrHm=ΔrGm+TΔrSm 另外,由于电池作了非体积功,ΔrHm 并非可逆热 效应,而TΔrSm才是可逆热效应,即
二、电动势与电池反应热力学函数间的关系
2012-6-28
一、可逆电池构成条件
1、电池反应互为逆反应 电池反应互为逆反应才能保证系统能够恢复原状。 如铅酸、铜锌等电池皆为可逆电池,而伏达电池、 锌锰干电池等就不能构成可逆电池。
2、电池在充放电时的电流为无穷小 由于电池都有内阻,若有电流通过必然有功转化为 热,而热功转化是不可逆的。
2012-6-28
§7-3 能斯特方程
前已述及,影响电极电势的主要因素为:电极本性、 离子浓度和温度。其中浓度的影响用能斯特方程来描 述。
一、电池电动势的能斯特方程式 二、电极电势的能斯特方程式
2012-6-28
一、电池电动势的能斯特方程式
设电池反应为:aA+bB=cC+dD 因为 ΔrGm=ΔrGm +RTlnJ 将 ΔrGm=-zFE;ΔrGm =-zFE 代入上式得:
2012-6-28
五、电势—pH图
水溶 液 中 ,元 素 的存在形态与溶液 的电势及pH有关, 以pH为横坐标电势 为纵坐标,作出电 势-pH图(与相图类 似),可以分析元 素在不同条件下的 存在形态。如Fe的 电势-pH图。
2012-6-28
六、判断反应方向
根据 ΔrGm=-zFE= - zF(E+-E-),当 E+>E- 时, ΔrGm<0,反应正向自发。
2012-6-28
三、氧化还原电极
Fe3+,Fe2+|Pt: Fe3++e=Fe2+ Pt|Sn4+,Sn2+:Sn4++2e=Sn2+
Pt|Ce4+,Ce3+: Ce4++e=Ce3+
MnO4
-,Mn2+,H+|Pt: MnO
4
8H
5e Mn
2
4H 2 O
常见电极的电极电势已经测出,列于数据表中。
二、电极电势和电池电动势
1、电极电势的产生
M - +- - + +- - + +- - + M
n
M
溶解大于沉积 电极带负电
- ++ - ++ - ++ ++
M
n
沉积大于溶解 电极带正电
影响电极电势的主要因素为:电极本性、离子浓度 和温度。 目前,电极电势的绝对值还无法测量,但可采取相 对标准,即规定标准氢电极的电极电势为零,其它电 极与标准氢电极比较可得出相对值。
2012-6-28
一、电动势法测定电池反应的热力学函数
例题:已知25℃时,E (Pb2+/Pb)=-0.126V,E (PbSO4/Pb) = 0.351 V。求25℃时PbSO4的Ksp 。
解:设计如下电池:Pb,PbSO4|SO42-||Pb2+|Pb 电极反应及电池反应为: -)Pb-2e+SO42- = PbSO4 +)Pb2++2e = Pb Pb2++SO42- = PbSO4 因此,电池反应的平衡常数的倒数就是Ksp。 ΔrGm=-zFE =-2×96485×(-0.126+0.351)= -43418(J/mol) ΔrGm=-RTlnK
E E
c
RT zF
ln J
25 C E
0 . 05916 z
