物理化学第七章 电化学讲解
合集下载
物理化学课件第七章-电化学
解离度为 。
l
S
A
r
r
A
S' E
离子的电迁移
山东理工大学 33
Mx N y
c(1 )
xMz yNz
cx cy
设正离子迁移速率为 r ,单位时间向阴极方向通 过任意截面 ss' 的物质的量为 (cx Ar )mol ,所迁移
的电量为 (cx Ar )zF ,因为是单位时间,所以:
Q t
I
(cx Ar )zF
D. 导电总量全部由电子承担
山东理工大学 6
第二类导体又称离子导体,如电解质溶液、熔 融电解质等 第二类导体的特点是:
A. 正、负离子作反向移动而导电
B. 导电过程中有化学反应发生
C. 温度升高,电阻下降
D. 导电总量分别由正、负离子分担(速率,电荷)
*固体电解质,如 AgBr、PbI2 等,也属于离子 导体,但它导电的机理比较复杂,导电能力不高,
dE u ( dl )
u , u 称为正、负离子的
电迁移率,单位 m2 s1 V1。
离子的电迁移率又称为离子淌度(ionic mobility), 相当于单位电位梯度时离子迁移的速率
电迁移率的数值与离子本性、电位梯度、溶剂性 质、温度等因素有关,可以用界面移动法测量。
山东理工大学 30
离子迁移数的定义
2电解质溶液的导电机理 ①正负离子定向迁移;
②界面上分别发生氧化还原反应,电荷转移;
结果实现了化学能和电能之间的转换。
3 电极命名法: 正极(电势高) 负极(电势低)
原电池 阴极(还原反应) 阳极(氧化反应)
电解池 阳极(氧化反应) 阴极(还原反山东应理工)大学 15
法拉第定律的文字表述
l
S
A
r
r
A
S' E
离子的电迁移
山东理工大学 33
Mx N y
c(1 )
xMz yNz
cx cy
设正离子迁移速率为 r ,单位时间向阴极方向通 过任意截面 ss' 的物质的量为 (cx Ar )mol ,所迁移
的电量为 (cx Ar )zF ,因为是单位时间,所以:
Q t
I
(cx Ar )zF
D. 导电总量全部由电子承担
山东理工大学 6
第二类导体又称离子导体,如电解质溶液、熔 融电解质等 第二类导体的特点是:
A. 正、负离子作反向移动而导电
B. 导电过程中有化学反应发生
C. 温度升高,电阻下降
D. 导电总量分别由正、负离子分担(速率,电荷)
*固体电解质,如 AgBr、PbI2 等,也属于离子 导体,但它导电的机理比较复杂,导电能力不高,
dE u ( dl )
u , u 称为正、负离子的
电迁移率,单位 m2 s1 V1。
离子的电迁移率又称为离子淌度(ionic mobility), 相当于单位电位梯度时离子迁移的速率
电迁移率的数值与离子本性、电位梯度、溶剂性 质、温度等因素有关,可以用界面移动法测量。
山东理工大学 30
离子迁移数的定义
2电解质溶液的导电机理 ①正负离子定向迁移;
②界面上分别发生氧化还原反应,电荷转移;
结果实现了化学能和电能之间的转换。
3 电极命名法: 正极(电势高) 负极(电势低)
原电池 阴极(还原反应) 阳极(氧化反应)
电解池 阳极(氧化反应) 阴极(还原反山东应理工)大学 15
法拉第定律的文字表述
物化 第七章 电化学ppt课件

2. 电极过程
电化学过程必须在电化学池中实现,总是伴随着电化学反应和 化学能和电能相互转换发生。
原电池: 化学能转化为电能的装置;干电池,蓄电池,燃料电池等
系统对外做电功
G T,P 0
上一内容
下一内容
回主目录
返回
2. 电极过程
电解池: 电能转化为化学能的装置;电镀装置,电抛光装置等
Q m n M M z F
M-物质的摩尔质量
上一内容 下一内容 回主目录
返回
3. 法拉第定律
已知元电荷电量为
1 . 6 0 2 21 0C
1 9
F=L· e =6.022×1023 mol-1×1.6022×10-19 C
=96484.6 C· mol-1
≈96500 C· mol-1
上一内容
下一内容
回主目录
返回
2018/11/25
2. 电极过程 原电池 将化学能转化 为电能的装置
阳极(负极):
Zn(s)= Zn2+ (aq)+ 2e(氧化反应)
Zn
Cu
阴极(正极):
Cu2+(aq)+ 2e- = Cu(s) (还原反应)
上一内容
下一内容
回主目录
返回
2018/11/25
回主目录
返回
2018/11/25
3. 法拉第定律
Faraday’s Law
⒈ 在电极界面上发生化学变化物质的质量 与通入的电量成正比。 Q m 或 Q n
Michael Faraday ⒉ 通电于若干个电解池串联的线路中,当 (l791-1867) 所取的基本粒子的荷电数相同时,在各个 英国著名的自 学成才的科学家
天大物理化学第五版第七章电化学ppt课件

银库仑计中有0.723 mmol Ag沉积,则在电解池中阳极必有相同数量 的Ag被氧化成Ag+而进入溶液,即 n反应 (Ag ) 0.723 mmol
对Ag+ 物料衡算有 : n电解后
n电解前
n反应 n迁移
t(Ag )n反应
17
t(Ag )
n电解前
n电解后
1
1.007
1.390 1
0.470
n反应
电解质溶液的 :
相距为1m, 面积为1m2
1m2
的两个平行板电极之间充
满电介质溶液时的电导。
1m
(2) 摩尔电导率Λm:
1mol电解质溶液导电能力,即单位浓度下的电导率:
m
/c
(单位为S. m2.mol-1)
20
2. 电导的测定
用惠茨通(Wheatstone)电桥测电导
(实为测电阻,用交流电)
当T=0时: VAD = VAC , I1R1 = I2R3 VDB =VCB , I1Rx = I2R4
m,
均可查表计算
26
5. 电导测定的应用
(1) 计算弱电解质的解离度及解离常数
弱电解质部分电离,例如,醋酸:
解离前
CH3COOH = H+ + CH3COO-
c
0
0
解离平衡时 c(1- ) c c
K
( c /c )2 (1 )c /c
2
1 c /c
m m
测电导可求得
由 可求出 m(= /c)
查表、计算可得 Λm
即:通过1 mol 电子电量时,任一电极上发生得失1 mol 电 子的电极反应。电极上析出或溶解的物质的量与之相应。
物理化学-第七章-电化学

解: 电极反应: Ag e Ag
通入的总电量:Q I t 0.23060 360库仑
电极上起化学反应物质的量:
n Q 360 0 00373mol zF 196500
析出Ag的质量: m=n×MAg=0.00373×107.88=0.403g
二、电导、电导率和摩尔电导率
体积与浓度的关系如何呢?
c n V
(mol·m-3)
若n为1mol
Vm
1 c
m
Vm
c
S·m2·mol-1
注意:c的单位:mol﹒m-3
3.电导、电导率和摩尔电导率之间的关系
G 1 R
K l A
G K
m
Vm
c
例: 298K时,将0.02mol·dm-3的KCl溶液放入 电导池,测其电阻为82.4Ω,若用同一电导池充 0.0025mol.dm-3的K2SO4溶液,测其电阻为 326Ω,已知298K时,0.02mol·dm-3的KCl溶液 的电导率为0.2768S.m-1 (1)求电导池常数; (2)0.0025mol.dm-3的K2SO4溶液的电率; (3)0.0025mol.dm-3的K2SO4溶液的摩尔电 导率。
★电池 汽车、宇宙飞船、照明、通讯、 生化和医学等方面都要用不同类型的化学 电源。
★ ⒊电分析 ★ ⒋生物电化学
§7-1 电解质溶液的导电性质 一、电解质溶液的导电机理
1.导体: 能够导电的物体叫导体。
第一类: 靠导体内部自由电子的定向运动而导电的物体
如 金属导体
石墨
性质:
A.自由电子作定向移动而导电
F:法拉第常数,即反应1mol电荷物质所需电量 1F=96500库仑/摩尔
通入的总电量:Q I t 0.23060 360库仑
电极上起化学反应物质的量:
n Q 360 0 00373mol zF 196500
析出Ag的质量: m=n×MAg=0.00373×107.88=0.403g
二、电导、电导率和摩尔电导率
体积与浓度的关系如何呢?
c n V
(mol·m-3)
若n为1mol
Vm
1 c
m
Vm
c
S·m2·mol-1
注意:c的单位:mol﹒m-3
3.电导、电导率和摩尔电导率之间的关系
G 1 R
K l A
G K
m
Vm
c
例: 298K时,将0.02mol·dm-3的KCl溶液放入 电导池,测其电阻为82.4Ω,若用同一电导池充 0.0025mol.dm-3的K2SO4溶液,测其电阻为 326Ω,已知298K时,0.02mol·dm-3的KCl溶液 的电导率为0.2768S.m-1 (1)求电导池常数; (2)0.0025mol.dm-3的K2SO4溶液的电率; (3)0.0025mol.dm-3的K2SO4溶液的摩尔电 导率。
★电池 汽车、宇宙飞船、照明、通讯、 生化和医学等方面都要用不同类型的化学 电源。
★ ⒊电分析 ★ ⒋生物电化学
§7-1 电解质溶液的导电性质 一、电解质溶液的导电机理
1.导体: 能够导电的物体叫导体。
第一类: 靠导体内部自由电子的定向运动而导电的物体
如 金属导体
石墨
性质:
A.自由电子作定向移动而导电
F:法拉第常数,即反应1mol电荷物质所需电量 1F=96500库仑/摩尔
物理化学第7章 电化学

放置含有1 mol电解质的溶液,这时溶液所具有的
电导称为摩尔电导率 Λ m
Λ m
def
kVm
=
k c
Vm是含有1 mol电解质的溶液
的体积,单位为 m3 mol1,c 是电解
质溶液的浓度,单位为 mol m3 。
摩尔电导率的单位 S m2 mol1
注意:
Λ 在 后面要注明所取的基本单元。 m
b、强电解质: 弱电解质:
强电解质的Λ m
与
c
的关系
随着浓度下降,Λ 升高,通 m
常当浓度降至 0.001mol dm3 以下
时,Λ 与 m
c 之间呈线性关系。德
国科学家Kohlrausch总结的经验
式为:
Λ m
=Λm (1
c)
是与电解质性质有关的常数
将直线外推至 c 0
得到无限稀释摩尔电导率Λm
-
- 电源 +
e-
+
e-
阴
阳
极
极
CuCl2
电解池
阳极上发生氧化作用
2Cl aq Cl2(g) 2e
阴极上发生还原作用
Cu2 aq 2e Cu(s)
三、法拉第定律
Faraday 归纳了多次实验结果,于1833年总结出该定律
1、内容:当电流通过电解质溶液时,通过电极 的电荷量与发生电极反应的物质的量成正比;
作电解池 阴极: Zn2 2e Zn(s)
阳极 2Ag(s) 2Cl 2AgCl(s) 2e
净反应: 2Ag(s) ZnCl2 Zn(s) 2AgCl(s)
2.能量变化可逆。要求通过的电流无限小。
二、可逆电极的种类
1、第一类电极
物理化学07电化学
析出 Au(s)=1.20 g 。已知 M(Au)=197.0 g mol-1。 求:
⑴ 通入电量 Q ;
⑵ 通电时间 t ;
⑶ 阳极上放出氧气的物质的量。
解: 1 Au3+ e = 1 Au
3
3
OH
1 4
O2
1 2
H2O e
(1) Q zF 196500197.01.g20mgol-1 /3 Cmol1
⒉ 通电于若干个电解池串联的线路中,当所 取的基本粒子的荷电数相同时,在各个电极 上发生反应的物质,其物质的量相同,析出 物质的质量与其摩尔质量成正比。
Q =n电F
n电:电板反应得失电子的物质的量 F: 法拉第常数在数值上等于1 mol电子的电量。
知元电荷电量为 1.6022 1019 C
F=L·e =6.022×1023 mol-1×1.6022×10-19 C
务各分担2mol,在假想的AA、BB平面上各有2mol正、 负离子逆向通过。
当通电结束,阴、阳两极区溶液浓度相同,但比 原溶液各少了2mol,而中部溶液浓度不变。
1.离子迁移数的定义
1.离子迁移数的定义 2)设正离子迁移速率是负离子的三倍,v 3v ,则
正离子导3mol电量,负离子导1mol电量。在假想的AA、 BB平面上有3mol正离子和1mol负离子逆向通过。
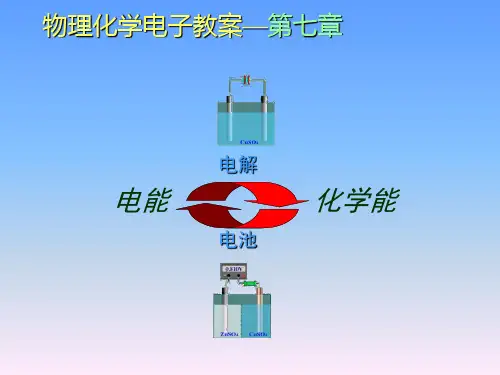
物理化学电子教案—第七章
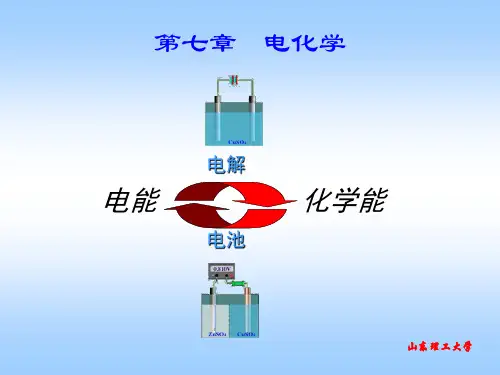
电解
电能
电池
化学能
第七章 电化学
§7.1 电解池、原电池和法拉第定律 §7.2 离子的迁移数 §7.3 电导、电导率和摩尔电导率 §7.4 平均离子活度因子及德拜-休克尔极限公式 §7.5 可逆电池及其电动势的测定 §7.6 原电池热力学 §7.7 电极电势和液体接界电势 §7.8 电极的种类 §7.9 原电池设计举例
⑴ 通入电量 Q ;
⑵ 通电时间 t ;
⑶ 阳极上放出氧气的物质的量。
解: 1 Au3+ e = 1 Au
3
3
OH
1 4
O2
1 2
H2O e
(1) Q zF 196500197.01.g20mgol-1 /3 Cmol1
⒉ 通电于若干个电解池串联的线路中,当所 取的基本粒子的荷电数相同时,在各个电极 上发生反应的物质,其物质的量相同,析出 物质的质量与其摩尔质量成正比。
Q =n电F
n电:电板反应得失电子的物质的量 F: 法拉第常数在数值上等于1 mol电子的电量。
知元电荷电量为 1.6022 1019 C
F=L·e =6.022×1023 mol-1×1.6022×10-19 C
务各分担2mol,在假想的AA、BB平面上各有2mol正、 负离子逆向通过。
当通电结束,阴、阳两极区溶液浓度相同,但比 原溶液各少了2mol,而中部溶液浓度不变。
1.离子迁移数的定义
1.离子迁移数的定义 2)设正离子迁移速率是负离子的三倍,v 3v ,则
正离子导3mol电量,负离子导1mol电量。在假想的AA、 BB平面上有3mol正离子和1mol负离子逆向通过。
物理化学电子教案—第七章
电解
电能
电池
化学能
第七章 电化学
§7.1 电解池、原电池和法拉第定律 §7.2 离子的迁移数 §7.3 电导、电导率和摩尔电导率 §7.4 平均离子活度因子及德拜-休克尔极限公式 §7.5 可逆电池及其电动势的测定 §7.6 原电池热力学 §7.7 电极电势和液体接界电势 §7.8 电极的种类 §7.9 原电池设计举例
物理化学电子课件第七章电化学基础
第一节 电化学的基本概念
三、离子的电迁移和迁移数
3. 离子迁移数 t有多种测定方法,这里主要介绍希托夫(Hittorf) 法。其原理是:分别测定离子迁出或迁入相应电极区的物质的量及发 生电极反应的物质的量,然后通过物料衡算得到离子迁移数。实验装 置如图7-3所示。
第一节 电化学的基本概念
三、离子的电迁移和迁移数 实验测定中的物料衡算思路为:电解后某离子剩余的物质的量
在电解池和原电池中,一般规定:在电极上发生氧化反应(失电 子)的电极为阳极,发生还原反应(得电子)的电极为阴极;电势较 高的电极为正极,电势较低的电极为负极。下面分别对电解池和原电 池进行讨论。
上述反应发生在电极与溶液的界面处,称为电极反应。电解池中
发生的总的化学反应称为电解反应,此处为
2HCl(l)
第二节 电解质溶液
表7-2 25 ℃时几种浓度KCl水溶液的电导率
第二节 电解质溶液
四、摩尔电导率与浓度的关系
科尔劳施 (Kolrausch)对电解质溶液的摩尔电导率进行了深入的 研究,根据实验结果得出结论:在很稀的溶液中,强电解质的摩尔电 导率Λm与其浓度c的平方根呈直线关系,即科尔劳施经验式:
2. 在稀溶液中,电解质的浓度和价型是影响γ±的主要因素。离子 强度I正是为反映这两个因素的综合影响而提出的,其定义为:
即溶液中每种离子的质量摩尔浓度乘以该离子电荷数的平方,所 得诸项之和的一半称为离子强度。
第二节 电解质溶液
3.德拜-休克尔极限公式 子活度因子 γi及离子的平均活度因子γ±的计算公式:
n电解后=该离子电解前的物质的量n电解前±该离子参与电极反应的物质的 量n反应±该离子迁移的物质的量n迁移,即
式(7-7)中的正负号根据电极反应是增加还是减少该离子在溶 液中的量以及该离子是迁入还是迁出来确定。
物理化学第七章电化学
§7-2 离子的迁移数
通电前后各区域物质的量的变化情况:
上述结果表明: 电解后:三个区域的溶液都是电中性的 电解后,两电极附近的阴极区和阳极区中,浓度变化不相同。
Q u 1 = n阴 Q_ u 3 式中 n阴 、 n阳 分别表示阴极区和阳极区内电解质克当量数(物质 的量)的减少。 2、离子的迁移数 某种离子的迁移数ti是指该离子迁移的电量Q+与通过溶液的总电 n阳
§7-1 电化学的基本概念和法拉第定律
如图所示:
§7-1 电化学的基本概念和法拉第定律
直流电源与两电极相连接,电流方向是电源外电路中由正极流 向负极,而电子流动的方向正好与之相反,是由电源外电路中由 负极流向正极。 电极反应 :电子流到电极上,那么在电极上就会进行有电子得失 的化学反应 规定 :发生氧化反应(也就是失去电子的反应)的电极就称为阳 极 发生还原反应(也就是得到电子的反应)的电极称为阴极。
m
§7—3 溶液的电导率和摩尔电导率
2、电导的测定,电导率和摩尔电导率的计算: 电导是电阻的倒数,因而可 电阻箱电阻 通过测定电解质溶液在某一 电导池中的电阻来确定其电 电可 导变 导,测定电阻可通过惠茨通 池电 电容 (wheatstone)电桥: 容( 如图示: )抵
消
A
D
阻待 测 电
B C
检零器
,这种离子的浓度反而降低了。
电解质实例: 1、两个惰性电极组成的电解池,假想可分为三个部分: 阴极区、中间区、阳极区 2、电解池中的溶液含有16克当量/mol的1—1型电解质。 3、通过电解池的总电量为4F(4mol F) 4、负离子的迁移速度U-是正离子迁移速度U+的3倍。
§7-2 离子的迁移数 如图所示:
物理化学第七章-电化学基础
解:Pb+2AgCl=PbCl2+2Ag
ΔrGm=-zFE=-2×96485×0.490=-94555J/mol
rSm
zF
(
E T
)p
296485 (1.8104 )
34.73J K1
mol1
ΔrHm=ΔrGm+TΔrSm=-94555-298×34.73=104905J/mol
7-11 金属的电化学保护 7-12 化学电源
2020/1/6
§7-1 电极电势和电池电动势
一、原电池符号 二、电极电势和电池电动势
2020/1/6
一、原电池符号
2020/1/6
一、原电池符号
与工程化学中学过的一样,负极写作边,正极写右 边,固体或液体与溶液接界用“│”隔开,液体和液 体接界用盐桥符号“‖”隔开。电解质要注明活度,气 体要注明分压,正负即可不注明。如
2020/1/6
一、可逆电池构成条件
1、电池反应互为逆反应 电池反应互为逆反应才能保证系统能够恢复原状。 如铅酸、铜锌等电池皆为可逆电池,而伏达电池、 锌锰干电池等就不能构成可逆电池。
2、电池在充放电时的电流为无穷小 由于电池都有内阻,若有电流通过必然有功转化为 热,而热功转化是不可逆的。
2020/1/6
Qr
zFT
(
E T
)
p
2020/1/6
二、电动势与电池反应热力学函数间的关系
例题:已知25℃时,电池 Pb,PbCl2|KCl|AgCl,Ag 的E=0.490 V, = -1(.8TE0)×p 10-4 V/K。 (1)写出电池反应;
(2)求电池反应的ΔrGm、ΔrSm、ΔrHm、Qr
物理化学下册第七章电化学讲义
m n M z Q F M 2 2 9 0 6 A 5 0 0 2 C 0 m m in o l 1 6 3 .5 g .m o l 1
=7.898gLeabharlann (2) 阳极反应:2Cl- − 2e-→Cl2
n(Cl2)n(Cu)
V n R T 0 .1 2 4 4 m o l 8 .3 1 5 Jm o l 1K 1 2 9 8 K
即:Q=Q++Q-
或: I=I++I-
而: 正离子的运动速度v+ 负离子的运动速度v - QQ , I I
通电 t 时间后,两极附近溶液浓度不同
23 23
§7.2 离子迁移数
离子B的迁移数(transference number):离子B所
运载的电流与总电流之比,用符号tB表示。
def
tB
IB I
如果溶液中只有一种电解质,则:
t t 1
25
电迁移过程示意图
通电前(a): 各区均含有6mol阴离子(-)和阳离子(+) 通电4F电量 : 电极反应(b):阴, 阳极分别发生4mol电子还原及氧化反应。
溶 液 中(c):若υ+=3υ- 中间区电解质物质的量维持不变 阴极区电解质物质的量减少1mol 阳极区电解质物质的量减少3mol
物理化学
Electrochemistry
Copyright © 2007 WUST. All rights reserved.
1
本章基本要求
1 了解电化学研究的主要内容,掌握电解质溶液的导电机理、 法拉第定律、电化学基本概念与术语(电解池、原电池、 阴极、阳极)。
2 掌握电解质溶液的电导、电导率和摩尔电导率、极限摩尔 电导率的概念,掌握电导的测定和电导率、摩尔电导率的 计算,掌握离子独立运动定律及与离子摩尔电导率的关系, 了解无限稀释时离子迁移数、离子的摩尔电导率和离子电 迁移率的关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、电解池 阳极(Anode)
e Zn
Zn2+ SO42-
Cu
阴极(Cathode)
ZnSO4溶液
CuSO4溶液
组成:电解槽、电极和导线(第一类导体),电解质溶液(第二类 ),外加电源。 通电后在电极上的反应:
与电源的正极相连的电极Zn电极:Zn→Zn2++2e (氧化反应 阳极) 与电源的负极相连的电极Cu电极:Cu2++2e→Cu (还原反应 阴极) 电解反应:Zn+Cu2+→Cu+Zn2+
② Faraday定律可以在任何T 和P下使用。
③ 实际电解时,由于存在副反应,如镀锌工艺中,在阴极 除了有Zn析出外,还有H2的生成。所以实际消耗的电量要 比理论电量大,可计算电流效率:
电流效率=理论电量÷实际电量×100%
§7-2离子的迁移数
电解质溶液之所以能导电,是由于溶液中 含有能导电的正、负离子,为了描述电解质溶 液的导电行为,引入了离子电迁移率、离子迁 移数。
1 3
Au(s) 和
1 4
O2 (g)
1 Au( s ) M( )=1/3197.08=65.67 所以 的摩尔质量为: 3 Au(s)
1 3
同样: M( 1 O2 (g) )=1/432=8 4 (a) 由Faraday定律:
Q m M Z F
mZ F 1.20 1 96500 Q 1763C M 65.67
I I I
二、法拉第定律(Faraday Law) Faraday(英国物理、化学家)通过大量电解实验的结果, 于1833年总结出了一条基本规律。
对各种不同的电解质溶液,电解时,每通过1mol电子电 量时,在任一电极上发生得失1mol电子电极反应 1mol电子的电量——Faraday常数
导电机理 电子导体:电子定向运动 离子导体:离子在溶液中定向迁移 电流流经导体 不发生化学变化 发生电解反应 温度升高 导电性下降 导电性上升
原电池和电解池的共同特点: 当外电路接通时在电极与溶液的界面上有电子得失的 反应发生,溶液内部有离子做定向迁移运动。
电极反应:把电极上进行的有电子得失的化学反应. 两个电极反应的总和对原电池叫电池反应,对电解池叫电解 反应。 注意:阴离子在阳极失去电子,失去电子通过外线路流向电源 正极.阳离子在阴极得到电子. 发生氧化反应的电极叫阳极,发生还原反应的电极叫阴极. 正负极依电势高低来定.
1 3
1 2
Au e 1 3 Au(s)
H2O e 1 O (g) H 2 4
3
阳极 :
1 电解反应: 3
1 1 Au3 (aq.) 1 H O ( l ) Au( s ) 2 2 3 4 O2 ( g )
电极反应中得失电子数Z=1,对应电解产物的基本单元:
注意:M和Z的值随所取的基本单元而定。 例:用强度为0.025A的电流通过Au(NO3)3的溶液(Pt作为电 极),当阴极上有1.20g Au(S)析出时,试计算: (a)通过了多少电量? (b)需通电多长时间? (c)阳极上将放出多少氧气(气体在标准状况STP下的体积) 解:若电极反应: 阴极 :
CuSO4溶液 (还原反应) 正极或阴极 (氧化反应) 负极或阳极
在电解池或原电池中,有电流通过时,第一类导体(包 括电极和导线)中的电子和第二类导体中的离子在电场作用 下都作定向移动: 电子: 与电流方向相反 离子: 阳离子(anion)总是向阴极移动 阴离子(cation)总是向阳极移动
在第二类导体中,电流的传导是由阴、阳离子的移动而 共同承担,即:
在STP时,O2(g)的体积为:
V(O2)=4.57×10-3mol×22.4dm3/mol=0.102 dm3
注意:
①Faraday定律中,由基本单元决定的摩尔质量M和得失电子 数Z。本书规定,当电极反应中Z=1时,电解质作为基本单 元,如H2SO4,AgNO3 ,CuSO4: 电极反应分别为: 基本单元
H e 1 2 H2 (g)
Ag e Ag(s)
1 2 2
1 2
H2
Cu
Ag
1 2
Cu
e 1 2 Cu(s)
当通1F电量,在相应的阴极上将析出物质的量分别为: 1mol(½H2)、1mol(Ag) 、 1mol( ½Cu), 它们的质量比为: 1.008:107.9:31.8
F L e 6.0221023 1.6021019 96500C mol1
若电极反应为: MZ++Z+e-→M 通过电解,欲得1mol的M物质,则需通过 Z+F 的电量。 若通过的电量为Q时,可得M的摩尔数n:
n Q Z F
Байду номын сангаас
质量
Q m M Z F
—Faraday定律
一、离子的电迁移现象 在电化学中,常将离子在电场作用下而引起的定向 运动称为电迁移,当电流通过电解质溶液时,发生: ①两个电极上的反应 ②正离子向阴极迁移,负离子向阳极迁移,由正 、 负 离子共同完成导电任务。 由于离子性质不同,它们的迁移速率是不相等的,用图 来讨论离子的电迁移现象:
(b)由电流的定义: I
得:
Q
Q 1763 7.05 10 4 S 19.58hr I 0.025
(c)在阳极上析出的氧气的摩尔数应等于在阴极上析出Au(S) 的摩尔数(前提是所取的基本单元相同)
即:
1 n1 Au n 3 4 O2
1 1 1 1.20 nO 2 n 4 O 2 4.57 10 3 mol 4 4 65.67
3、原电池(primary cell) 与电解池相反,利用两个电极上的反应将化学能转变为电 能的装置,如图: 丹尼尔电池: + Cu - Zn 阳极(Anode) 阴极(Cathode)
Zn2+ SO42-
ZnSO4溶液 原电池的电极反应 Cu极:Cu2++2e→Cu Zn极: Zn→Zn2++2e
第七章 电化学
电化学 —是研究电能和化学能之间相互转化及转化过程中有 关规律的科学。 物理化学中的电化学研究量方面的内容:
1)电能转化为化学能的过程叫电解池 2)化学能转化为电能的过程叫原电池
§7.1 电解质的导电机理和法拉第定律
一、基本概念 1、电导体分为两类:电子导体(第一类导体)和离子导体(第 二类导体) 区别 :
