有机化学性质小结
高中化学(有机官能团化学性质小结表)

高中化学(有机官能团化学性质小结表)
官能团 | 化学性质
---|---
烷基 | 烷基具有亲电性和碱性,能发生置换反应、氧化反应等卤代烷基 | 可发生亲核取代反应和消去反应等
羟基 | 具有醇的性质,可发生酯化反应、醚化反应、酸催化裂解等反应
氨基 | 具有胺的性质,可发生酰化反应、还原反应、烧碱螯合反应等
羧基 | 具有酸的性质,可发生酯化反应、缩合反应、酸催化裂解等
酰基 | 具有酰化的性质,能发生酰化反应、烯醇化反应等
酰胺基 | 具有酰胺的性质,可发生烷化反应、加成反应等
酮基 | 具有酮的性质,可发生加成反应、酯化反应等
醛基 | 具有醛的性质,可发生加成反应、酯化反应等
环氧基 | 具有环氧的性质,可发生开环反应、环氧化反应等苯环 | 具有芳香性,可发生亲电取代反应、电子取代反应等醚基 | 具有醚的性质,可发生加成反应、酯化反应等
烯酮基 | 具有烯酮的性质,可发生加成反应等
烷基硫基 | 具有硫化学的性质,可发生醇化、氧化反应等。
有机化合物化学性质总结(精华版).

有机化合物化学性质总结(精华版).
一、烃类:
1、烷烃:
由单一的碳链和氢原子组成的构成,是饱和的有机化合物,只有单键,没有明显双键,极易析出极性,易溶于有机溶剂,在常温下可析出单质,不溶于水,碱下析出,常
ch2cl2 中溶解,能形成极性分子间相互作用,由于碳链构型的不同,烷烃的化学性质有
一定差异,如丁烷小容易溶于水,而较大碳链烷烃如环氧戊烷,极不易溶于水。
2、烯烃:
具有环状碳链的有机物,由于对电子需要有一定的要求,所以在常温下大部分烯烃是
含有稳定非极性的碳-碳双键,但易析出极性。
它们大部分是不溶于水,形成极少量的分
子间相互作用,但可与有机溶剂混合溶解或共溶。
二、醛类:
由醛基与醇基所组成的有机物,具有特殊的δ+醛δ-醇化合物结构,多用于有机化
学的合成。
醇以存在着一个极性空间的形式存在于有机溶剂中,它们极易与水反应,形成盐,破坏极性空间,有其特殊的分子间作用和无色的现象,所以可以极易溶于水中,但不
溶于有机的溶剂。
三、酯类:
具有羟基组成碳官能团的有机物,主要由酯基和其它某种有机物组成,具有极性碳-
羰基极性空间,可与有机溶剂混合溶解或共溶,但极不溶于水,因为在水中形成羰基,使
得酯类极难溶于水中,但与碱质有相当大的溶解度,具有一定的把水离子弱化的作用,因此,它们主要用于各种特殊目的。
有机物性质总结

有机物化学性质总结官能团与Na或K反应放出H2:醇羟基、酚羟基、羧基与NaOH溶液反应酚羟基、羧基、酯基、C-X键与 Na2CO3 溶液反应酚羟基(不产生CO2)、羧基(产生CO2)与NaHCO3溶液反应羧基与H2发生加成反应(即能被还原)碳碳双键、碳碳叁键、醛基、酮羰基、苯环不易与 H2 发生加成反应羧基、酯基能与H2O、HX、X2 发生加成反应碳碳双键、碳碳叁键能发生银镜反应或能与新制Cu(OH)2反应生成砖红色沉淀醛基使酸性KMnO4溶液褪色或使溴水因反应而褪色碳碳双键、碳碳叁键、醛基能被氧化(发生还原反应)醛基、醇羟基、酚羟基、碳碳双键碳碳叁键发生水解反应酯基、C-X键、酰胺键发生加聚反应碳碳双键与新制Cu(OH)2 悬浊液混合产生降蓝色生成物多羟基能使指示剂变色羧基使溴水褪色且有白色沉淀酚羟基遇FeCI3溶液显紫色酚羟基使酸性KMnO4溶液褪色但不能使溴水褪色苯的同系物使I2变蓝淀粉使浓硝酸变黄蛋白质12.有机物溶解性规律根据相似相溶规则,有机物常见官能团中,醇羟基、羧基、磺酸基、酮羰基等为亲水基团,硝基、酯基、C—X键等为憎水基团.当有机物中碳原子数较少且亲水基团占主导地位时,物质一般易溶于水;当有机物中憎水基团占主导地位时,物质一般难溶于水。
常见不溶于水的有机物:烃、卤代烃、酯、淀粉、纤维素不溶于水密度比水大:CCI4、溴乙烷、溴苯、硝基苯不溶于水密度比水小:苯、酯类、烃【复习】甲烷的化学性质:1.稳定性:通常情况下,甲烷的化学性质比较稳定,跟强酸、强碱不反应。
2.不能使酸性高锰酸钾溶液褪色—-不与强氧化剂反应,3.不能使溴水褪色(既不发生取代反应,也不发生加成反应)。
4.取代反应——卤代反应:CH4 + Cl2CH3Cl + HClCH3Cl + Cl2CH2Cl2 + HClCH2Cl2 + Cl2CHCl3 + HClCHCl3 + Cl2CCl4 + HCl【现象】1.黄绿色逐渐褪去2.试管内液面逐渐上升3.试管壁上有油状液滴生成5.氧化反应:①纯净的甲烷可在空气中安静的燃烧,火焰为明亮的蓝色,无黑烟CH4 + 2O2点燃CO2 + 2H2O②不纯的甲烷点燃会发生爆炸,所以点燃前必须检验纯度。
有机化学基础知识点有机化合物的热稳定性与燃烧性质

有机化学基础知识点有机化合物的热稳定性与燃烧性质有机化合物是由碳元素与氢、氧、氮等其他非金属元素通过共价键相互连接而构成的化合物。
在有机化学中,热稳定性和燃烧性质是衡量有机化合物性质的重要指标。
下面将介绍有机化合物的热稳定性和燃烧性质的基本知识点。
一、有机化合物的热稳定性热稳定性是指有机化合物在高温条件下是否能够稳定存在而不发生分解或者其他的化学反应。
有机化合物的热稳定性与分子内的键能、分子结构的稳定性以及分子之间的相互作用有关。
1. 键能:有机化合物中的化学键能量大小直接影响其热稳定性。
一般来说,碳-碳键和碳-氢键的键能较小,而碳-氧键和碳-氮键的键能较大。
因此,含有碳-碳键和碳-氢键的有机化合物通常比含有碳-氧键和碳-氮键的有机化合物更加热稳定。
2. 分子结构:有机化合物的分子结构也会对其热稳定性产生影响。
分子结构的稳定性通常表现为环化合物比链状化合物更加稳定。
这是因为环状结构可以通过共轭体系来分散单倍键上的π电子密度,使得化合物的能量降低,从而提高热稳定性。
3. 分子间相互作用:在有机化合物中,分子间的相互作用对于热稳定性也有一定的影响。
分子间的范德华力、氢键和离子相互作用等相互作用可以增强分子的稳定性,从而提高热稳定性。
二、有机化合物的燃烧性质有机化合物的燃烧性质是指有机化合物与氧气发生反应产生二氧化碳和水的过程。
燃烧是一种氧化反应,有机化合物与氧气在适当的温度和条件下发生燃烧反应,会产生大量的热能。
1. 热能释放:有机化合物燃烧过程中会释放出大量的热能。
这是因为有机化合物中的碳氢键和碳氧键在燃烧过程中被氧气氧化,形成碳酸气体和水,同时释放出大量的能量。
这种热能释放是有机化合物可以作为燃料的原因之一。
2. 燃烧产物:有机化合物的燃烧主要生成二氧化碳和水,这是一种完全燃烧的产物。
但在不完全燃烧的情况下,有机化合物还会产生一些有害物质,如一氧化碳和氮氧化物,对环境和人体健康有一定的危害。
3. 阻燃剂:对于一些易燃的有机化合物,为了提高其燃烧安全性,人们通常会添加一些阻燃剂。
高中化学有机官能团化学性质小结表

官能团化学性质(1)加成反应:(与H2、X2、HX 、H2O等)-C=C-CH2=CH 2 +Br2 →(乙烯使溴水褪色)CH2=CH 2+ H2 ; CH2=CH2 + H2O催化剂催化剂△△(2)氧化反应:能燃烧、使酸性KMnO4褪色(3)加聚反应: a bn C=C催化剂△c d-C≡C-(1)加成反应:(与H2、X2、HX、H2O等)如:乙炔使溴水褪色: CH≡CH+Br 2→;CHBr=CHBr+Br 2→CH≡CH+HCl 催化剂n CH 2=CHCl催化剂(2)氧化反应:能燃烧、使酸性KMnO 4褪色△△醇-OH (1)与活泼金属(Al 之前)的反应:2R-OH +2Na→△ (2)取代反应:①与HX :ROH +HX浓H2SO4②分子间脱水:2R-OH1400C(3)氧化反应:①燃烧:C2H5OH+3O 2→(火焰)催化剂②催化氧化:2C2H5OH+ O 2 △浓H2SO4浓H2SO4(4)消去反应:C2H5OH1700C0C(5)酯化反应:C2H5OH+CH3COOH △注意:醇氧化规律〔O〕①R-CH2OH →R -CHO ②-OH所连碳上连两个烃基,氧化得酮③-OH所连碳上连三个烃基,不能被氧化(不完全氧化)但可燃烧。
酚-OH (1)弱酸性:①与活泼金属反应放H2②与NaOH:+NaOH →(酸性:H2CO3 酚-OH)(2)取代反应:+ 3Br 2 →(3)与FeCl3的显色反应:苯酚溶液遇FeCl3显紫色。
-X (1)取代反应:C2H5X +NaOH→醇(2)消去反应:C2H5X +NaOH△-CHO (1)加成反应:R-CHO +H2 (制得醇)催化剂(2)氧化反应:①能燃烧△催化剂△②催化氧化:2R-CHO+O2 (制得羧酸)③被新制Cu(OH) 2氧化:CH3CHO + 2Cu(OH) 2△④银氨溶液氧化:CH3CHO +2Ag(NH 3)2△--COOH (1)弱酸性:(酸性:R-COO>H H2CO3>酚-OH>HCO3)RCOOH 具有酸的通性。
官能团的性质及有机化学知识总结(打印)
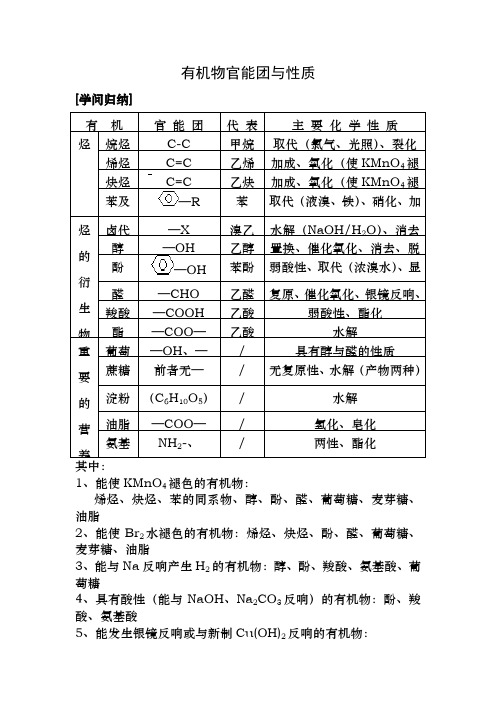
有机物官能团与性质[学问归纳]有机官能团代表主要化学性质烃烷烃C-C甲烷取代(氯气、光照)、裂化烯烃C=C乙烯加成、氧化(使KMnO4褪炔烃C=C乙炔加成、氧化(使KMnO4褪苯及—R苯取代(液溴、铁)、硝化、加烃的衍生物卤代—X溴乙水解(NaOH/H2O)、消去醇—OH乙醇置换、催化氧化、消去、脱酚—OH苯酚弱酸性、取代(浓溴水)、显醛—CHO乙醛复原、催化氧化、银镜反响、羧酸—COOH乙酸弱酸性、酯化酯—COO—乙酸水解重要的营养葡萄—OH、—/具有醇与醛的性质蔗糖前者无—/无复原性、水解(产物两种)淀粉(C6H10O5)/水解油脂—COO—/氢化、皂化氨基NH2-、/两性、酯化1、能使KMnO4褪色的有机物:烯烃、炔烃、苯的同系物、醇、酚、醛、葡萄糖、麦芽糖、油脂2、能使Br2水褪色的有机物:烯烃、炔烃、酚、醛、葡萄糖、麦芽糖、油脂3、能与Na反响产生H2的有机物:醇、酚、羧酸、氨基酸、葡萄糖4、具有酸性(能与NaOH、Na2CO3反响)的有机物:酚、羧酸、氨基酸5、能发生银镜反响或与新制Cu(OH)2反响的有机物:醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖6、既有氧化性,又有复原性的有机物:醛、烯烃、炔烃7、能发生颜色(显色)反响的有机物:苯酚遇FeCl3显紫色、淀粉遇I2变蓝、蛋白质遇浓硝酸变黄、葡萄糖遇Cu(OH)2显绛蓝[有机物间的互相转化关系]图1:图2:[有机合成的常规方法]1.引入官能团:①引入-X的方法:烯、炔的加成,烷、苯及其同系物的取代②引入-OH的方法:烯加水,醛、酮加氢,醛的氧化、酯的水解、卤代烃的水解、糖分解为乙醇与CO2③引入C=C的方法:醇、卤代烃的消去,炔的不完全加成,*醇氧化引入C=O2.消退官能团①消退双键方法:加成反响②消退羟基方法:消去、氧化、酯化③消退醛基方法:复原与氧化3.有机反响类型常见的有机反响类型有取代(包括酯化、水解)、加成、加聚、消去、氧化、复原等。
高中化学有机物的性质实验总结

高中化学有机物的性质实验总结1.甲烷(1)甲烷通入KMnO4酸性溶液中实验:把甲烷通入盛有KMnO4酸性溶液的试管里,观察紫色溶液是否有变化?现象与解释:溶液颜色没有变化。
说明甲烷与KMnO4酸性溶液不反应,进一步说明甲烷的性质比较稳定。
(2)甲烷的取代反应实验:取一个100mL的大量筒,用排饱和食盐水的方法先后收集20mLCH4和80mLCl2,放在光亮的地方(注意:不要放在阳光直射的地方,以免引起爆炸),等待片刻,观察发生的现象。
现象与解释:大约3min后,可观察到量筒壁上出现油状液滴,量筒内饱和食盐水液面上升。
说明量筒内的混合气体在光照下发生了化学反应;量筒上出现油状液滴,说明生成了新的油状物质;量筒内液面上升,说明随着反应的进行,量筒内的气压在减小,即气体总体积在减小。
2.乙烯(1)乙烯的燃烧实验:点燃纯净的乙烯。
观察乙烯燃烧时的现象。
现象与解释:乙烯在空气中燃烧,火焰明亮,并伴有黑烟。
乙烯中碳的质量分数较高,燃烧时有黑烟产生。
(2)乙烯使KMnO4酸性溶液褪色实验:把乙烯通入盛有KMnO4酸性溶液的试管里,观察试管里溶液颜色的变化。
现象与解释:KMnO4酸性溶液的紫色褪去,说明乙烯能被氧化剂KMnO4氧化,它的化学性质比烷烃活泼。
(3)乙烯使溴的四氯化碳溶液褪色实验:把乙烯通入盛有溴的四氯化碳溶液的试管里,观察试管里溶液颜色的变化。
现象与解释:溴的红棕色褪去,说明乙烯与溴发生了反应。
3.乙炔(1)点燃纯净的乙炔实验:点燃纯净的乙炔。
观察乙炔燃烧时的现象。
现象与解释:乙炔燃烧时,火焰明亮,并伴有浓烈的黑烟。
这是乙炔中碳的质量分数比乙烯还高,碳没有完全燃烧的缘故。
(2)乙炔使KMnO4酸性溶液褪色实验:把纯净的乙炔通入盛有KMnO4酸性溶液的试管里,观察试管里溶液颜色的变化。
现象与解释:KMnO4酸性溶液的紫色褪去,说明乙炔能与KMnO4酸性溶液反应。
(3)乙炔使溴的四氯化碳溶液褪色实验:把纯净的乙炔通入盛有盛有溴的四氯化碳溶液的试管里,观察试管里溶液颜色的变化。
高中化学有机物的性质及鉴别总结完整版
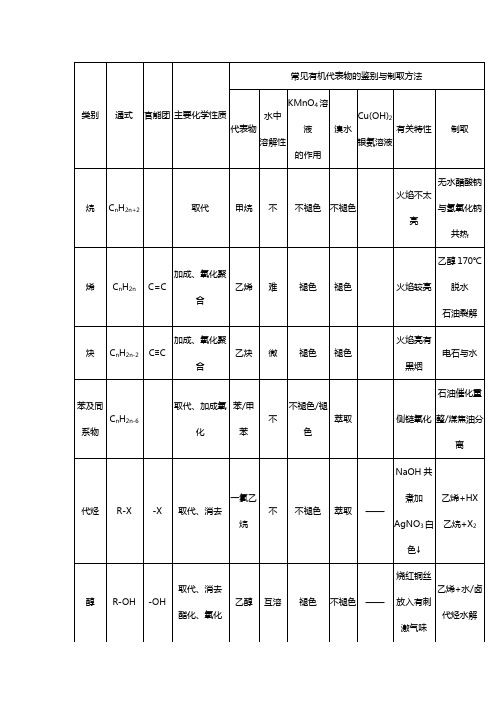
高中化学有机物知识点总结一、重要的物理性质 1.有机物的溶解性(1)难溶于水的有:各类烃、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、醛、羧酸及盐、氨基酸及盐、单糖、二糖。
(3)具有特殊溶解性的:① 乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物。
② 乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
③有的淀粉、蛋白质可溶于水形成胶体..。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
④线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑤ 氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度小于水的密度,且与水(溶液)分层的有:各类烃、酯(包括油脂) 3.有机物的状态[常温常压(1个大气压、20℃左右)] (1)气态:① 烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH 3)4]亦为气态② 衍生物类:一氯甲烷(.....CH ..3.Cl ..,沸点为....-.24.2....℃)..甲醛(...HCHO ....,沸点为....-.21..℃)..(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
如,己烷CH3(CH2)4CH3甲醇CH3OH甲酸HCOOH 乙醛CH3CHO★特殊:不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。
如,石蜡C12以上的烃饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下为固态4.有机物的颜色☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色☆多羟基有机物如甘油、葡萄糖等能使新制的氢氧化铜悬浊液溶解生成绛蓝色溶液;☆淀粉溶液(胶)遇碘(I2)变蓝色溶液;☆含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
醇
酚 醛 羧酸 酯
—OH
---------------
C6H5—OH R—CHO CnH2nO R—COOH CnH2nO2 RCOOR` CnH2nO2 CH3CHO CH3COOH CH3COOC2H5
—CHO —COOH —COO—
水解
酯化
卤代烃 水解 R-X
取代
醇
RCH2OH
氧化 还原
-2H
卤代烃
代表物
CH3CH2Br
化性:①强碱溶液中发生水解生成醇(取代反 应) ②在强碱的醇溶液里发生消去反应生成 乙烯 制法:①乙烯加HBr ② CH3—CH3取代 ③C2H5OH、NaBr、H2SO4混合加热
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:R—OH,饱和一元醇CnH2n+1OH
烃
• 烃:仅由碳氢两种元素组成的化合物
饱和烃 烷烃 环烷烃
CnH2n+2(n≥1) CnH2n(n≥3) CnH2n(n≥2) 碳原子数相同 为同分异构
烃
不饱和烃
烯烃
芳香烃
碳原子数 二烯烃 CnH2n-2(n≥4) 相同为同 炔烃 CnH2n-2(n≥2) 分异构 苯及其同系物 CnH2n-6(n≥6)
醛
R-CHO
氧化
羧酸
RCOOH
酯化
酯
RCOOR’
+16 R+ 29 R+ 45
水解
各类有机物的衍变关系
烃 消去 R—H
卤代
卤代烃 R—X
水解 取代
醇类 R—OH
氧化 加氢
醛类 R—CHO
氧化
羧酸 R—COOH
酯化 水解
酯类 RCOOR`
CH3CH3 CH2=CH2
CH3CH2Br CH3CH2OH CH2Br
特性
苯、甲苯、苯酚的结构与性质的比较
类别 苯
不被高锰酸钾 溶液氧化 液溴 催化剂 C6H5Br
甲苯
—CH3 可被高锰酸钾溶 液氧化 液溴 催化剂 邻、间、对三种 一溴甲苯
苯酚
—OH
常温下在空气中被氧 化呈红色 溴水 无催化剂 三溴苯酚
结构简式 氧化反应情况
溴 代 反 应 溴状态
条件 产物
结论 原因
能发生银镜反应的物质包括:
醛类、 甲酸及其盐、 甲酸酯、 还原性糖如葡萄糖.
H2SO4在有机化学反应中的作用:
(浓) 乙醇→乙烯(脱水、催化) (浓) 硝化反应(催化) (浓) 酯化 (吸水、催化) (稀) 酯水解(催化)
物质与水反应
反应物 烯水化 RX水解 酯水解 CaC2与水反应 生成物 醇 ROH+HX 酸 +醇 Ca(OH)2+C2H2
酚
代表物
OH
(1)易被氧化变质(氧化反应) 化性 (2)与Br2发生取代(取代反应) (3)与FeCl3显紫色(显色反应) (4)弱酸性(比碳酸的酸性弱)
Cl OH
制法:
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:RCHO,一元饱和醛CnH2n+1CHO,分子式CnH2nO 醛类 (1)氧化反应:银镜反应、与新制Cu(OH)2反应 能使溴水、高锰酸钾溶液褪色 化性 催化氧化成羧酸。 (2)还原(加成)反应:加氢被还原成醇
卤代烃的水解
酯化反应
酯的水解
醇变卤代烃
2.加成反应:
烯、
炔烃(加H2、HX、H2O), 苯(加H2)、 醛(加H2)、酮 油脂氢化(加H2)。
3.消去反应:
乙醇(分子内脱H2O)
卤代烃(脱HX)
4.加聚反应: 烯烃等。 5、裂化和裂解
烯、炔、 苯的同系物、
6、氧化、还原反应如:醇(去氢)
7、显色反应
2.加成反应:
H C C H + 易 H-C=C-H Br-Br Br Br 1,2-二溴乙烯
BrBr 稍难 H-C=C-H + Br-Br H-C-C-H BrBr Br Br
1,1,2,2-四溴乙烷
HCCH + 2 H2 HCCH + H--Cl nCH2=CHCl
催化剂
△
CH3-CH3
醇羟基 CH3CH2OH 反应生成醇 钠C2H5ONa 不反应
NaOH
Na2CO3 反应生成硝 反应生成 反应生成酚 酸钠、水和 CH3COONa、 钠C6H5ONa CO2 H2O和CO2 和NaHCO3
NaHCO3 反应生成硝
不反应
反应生成 酸钠、水和 CH3COONa、 CO2 H2O和CO2
还可以表示为
2.苯的物理性质
。
通常情况下,苯是 无 色,带有 特殊气 味的 液体 ,有毒,不 溶于 水, 密度比水 小 。熔点5.5℃,沸点80.1℃。若用冰水冷却,苯可以凝结成无色的 晶体。
苯的同系物中,苯环侧链上的烃基不管多长、 多复杂,只要与苯环相连的第一个C原子上有H原 子,与酸性高锰酸钾作用时,侧链上的烃基都被氧 化成—COOH(羧基)。
三、乙炔
乙炔的结构
电子式
● × ●● ●● ●●
结构式
C H
● ×
结构简式 分子式
CHCH
C2 H2
H C
HCCH
乙炔的物理性质:纯乙炔无色、无味的气
体,微溶于水,密度小于空气。
化学性质、用途
1.氧化反应:
2C2H2+5O2→4CO2+2H2O(l)+2600KJ 燃烧时火焰明亮,并伴有浓烈的黑烟。氧炔焰温度高达 3000℃, 可用作焊接、切割钢铁。
醛(加氧)
酚
醇和酚的比较
类别 实例 官能团 脂肪醇 CH3CH2OH —OH 芳香醇 C6H5CH2OH —OH 酚 C6H5OH —OH
结构 特点
主要 化学性质
—OH与链烃基相连 —OH与芳香烃基侧 —OH与苯环直接相 链相连 连
(1)与钠反应 (2)氧化反应 (3)脱水反应 (4)酯化反应 红热铜丝插入醇中有刺激性气味 (1)弱酸性 (2)取代反应 (3)显色反应 (4)氧化反应 与FeCl3显紫色
性质
烃的衍生物概述
类别 官能团
—OH
通式
R—OH CnH2n+2O
代表物
CH3CH2OH
主要化学性质
(1)与钠反应 (2)取代反应 (3)消去反应 (4)分子间脱水 (5)氧化反应 (6)酯化反应
(1)有弱酸性 (2)取代反应 (3)显色反应 (4)氧化反应 (1)氧化反应 (2)还原反应 (1)具有酸性 (2)酯化反应 水解反应
二.烯烃
分子中含有碳碳双键的一类不饱和链烃。 1、定义: 2、分子通式: 单烯烃:CnH2n (n≥2) 3、官能团:碳碳双键 注意:与 C=C 4、物理性质: ①均不溶于水, 易溶于有机溶剂。 相连的四个原子在同一个平面上
②状态: 气态(2-4)
液态
固态
③沸点、密度随 C 原子数递增而递增 (密度<1)
各种物质的初步判断:
与Na反应 : 水、 醇 、酚、酸
与NaOH反应 :酚、酸、酯 、卤代烃
与Na2CO3反应: 酸(产生气体)
酚醇
氧化
醛
氧化
酸
例1、①如何用化学方法区别乙醇、乙醛、乙 酸?
(Cu(OH)2溶液) ②如何分离乙酸、乙醇、苯酚的混合物? (加入NaOH蒸馏,加入少量水并通入CO2 后分液,再加入浓硫酸后蒸馏)
例2.已知乙炔(C2H2)、苯 (C6H6)、乙醛(C2H4O)的混 合气体中含氧元素的质量分数为 8%,则混合气体中碳元素的质 量分数为( ) A.84% B.60% C.91% D.42%
不反应
不反应
几种物质与高锰酸钾和溴水的作用:
高锰酸钾 溴水
烯烃 炔烃 苯 甲苯 苯酚 乙醇 醛
氧化褪色 氧化褪色 不褪色 氧化褪色 氧化褪色 氧化褪色 乙酸
氧化褪色 乙醛
CH3CHO → CH3COOH
加成褪色 加成褪色 萃取 萃取 褪色 混溶不反应 氧化褪色 CH3CHO+Br2+H2O→ CH3COOH+2HBr
HgCl2 150-160℃ CH2=CHCl 氯乙烯
催化剂 △
[CH2
CH]n 聚氯乙烯, Cl
重要合成树脂,用于制备塑料、合成纤维。
催化剂 △ CH=CH HCCH + H-OH
H
OH
不稳定 分子重组
O CH3-C-H
=
1.苯的组成和结构 (1)苯的分子式是 C6H6 ,结构简式是 。苯分子是平面结构,其中 六个C原子构成 平面正六边形 ;因此,苯是一种 非极性 分子。 (2)苯分子里不存在一般的碳碳 单、双键 ,苯分子里6个碳原子之间的键 完全相同 ,这是一种介于 单键和双键 之间的独特的键。因此,苯的结构简式
Ni △P
CH3-CH2-CH3
CH3-CH-CH2 Br H
加热、加压
马氏规则(马尔科夫尼科夫):凡是不对称结构 的烯烃和卤化氢(HX)加成时,氢原子主要加在 含氢较多的碳原子上。
乙烯的用途
1.石油化学工业最重要的基础原料 乙烯的产量是衡量一个国家石油化工发展水平的重要标 志。 2.植物生长调节剂 乙烯常用作果实催熟剂。
代表物 CH3CHO 制法: HCHO 乙醇氧化法
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:R—COOH,一元饱和酸CnH2n+1COOH,分子式CnH2nO2 羧酸
(1)具有酸的通性(羧酸盐几乎全溶于水) 化性 (2)与醇酯化成酯 (3)甲酸有醛基能发生银镜反应
