(2.5.P.)临床试验信息汇总表
临床试验所需表格目录(初稿)

临床试验所需表格目录(初稿)1、启动会
1.1 启动会签到表
1.2 研究者职责分工表
1.3 研究者签名样张(PI及参与研究者)
2、试剂相关
2.1 试剂运输记录表
2.2 试剂交接记录表
2.3 试剂快递单,出库单
2.4 试剂使用记录表
2.5 试剂回收记录表
2.6 试剂保存、温度记录表
3、仪器(运送仪器需要)
3.1 仪器运输记录表
3.2 仪器交接表
3.3 仪器操作、维护保养SOP
3.4 仪器使用记录表
3.5 仪器回收记录表
4、样本相关
4.1 样本保存记录、温度记录
4.2 样本使用记录
4.3 样本回收处理记录
5、试验相关记录
5.1 受试者鉴认代码表
5.2 筛选与入选表
5.3 随机表
5.4 试验布孔表
5.5 试验记录表
5.6 试验结果原始记录表
6、试验结束
6.1 病例报告表
备注说明:
1、本表目录表格根据自己经验总结仅做参考
2、具体需求请根据中心各医院药理中心文件归档目录为准
3、欢迎大家提出补充完善。
化学药品仿制药口服固体制剂质量和疗效一致评价申报资料要求

变化)及相关的支持性验证研究,包括生产工艺变更的基本思路、
试验设计、考察指标和方法、试验结果等,以及与原研药或参比
制剂的比较研究情况,批量放大过程中的调整等。
汇总研发过程中代表性批次(应包括但不限于临床研究批、
中试放大批、工艺验证批等)的样品情况,包括:批号、生产时
间及地点、批规模、用途(如用于稳定性试验或生物等效性试验
说明再评价品种具体的已上市信息。包括剂型、规格、批 准时间(批准文号)、执行标准、标准号、有效期等内容,并提 供相关的证明性文件。
简要说明本再评价品种自批准上市以来的生产销售、相关 变更及质量稳定性情况,相关变更提供最新有效证明性文件。
3.自评估报告 申请人应对此次一致性评价具体内容的相关研究进行全面 论述。结合每项研究内容,对处方工艺研究、关键步骤和中间体 的控制、原辅料、包装材料进行分析,重点针对与参比制剂一致 性相关的质量研究情况、体内评价研究结果等的分析,提出对本 品种与参比制剂质量和疗效一致性的综合评价结果。 申请人应保证该品种研发过程及结果和申报资料的科学性、 完整性和真实性。 4.临床信息及不良反应 本品种的临床使用情况,主要不良反应,收集历年来生产企 业统计的不良反应反馈情况,对于治疗窗狭窄的药物说明临床治 疗安全窗口指数。 5.最终确定的处方组成及生产工艺情况
8.3.2.(3.2.P.3.2)批处方
以表格的方式列出典型生产规模产品的批处方组成,列明各
成分执行的标准。如有过量加入的情况需给予说明并论证合理性。
对于处方中用到但最终需去除的溶剂也应列出。
表 XX:典型生产批的处方
成分
用量
过量加入 作用
执行标准
工艺中使用并最终 去除的溶剂
8.3.3.(3.2.P.3.3)生产工艺和工艺控制 (1)工艺流程图:以单元操作为依据,提供完整、直观、 简洁的工艺流程图,其中应涵盖工艺步骤,各物料的加入顺序,
15.(2.5.P.)临床试验信息汇总情况表

附件415.(2.5.P.)临床试验信息汇总表本套格式申报资料主要适用于以药动学参数为终点评价指标的生物等效性试验资料的申报。
对于需要进行临床试验的特殊制剂等,信息汇总表应参照注册分类3的格式撰写。
基于目前的认识制定本套格式申报资料,可根据化合物的性质和试验特点做适当优化和补充。
须按时间顺序提交所进行的每项生物等效性试验的相关信息。
应以下级目录形式逐个研究项目填写“生物等效性试验信息汇总表”(“如2.5.P.1空腹生物等效性试验;2.5.P.2餐后生物等效性试验”),共用内容集中填写于首个试验项目中,其余项目参见首个试验,并注明标题编号。
2.5.P.1 XX药的空腹生物等效性试验表1(注:依次编号,下同):基本信息表xx:试验药物信息表xx: 处方信息(举例)应提交所有规格的处方信息表xx:体外溶出试验概要文案大全应提交受试制剂和参比制剂所有规格的溶出试验结果。
文案大全表xx: 试验设计表xx: 试验报告及生物样品储存信息表xx: 完成生物等效性试验的受试者信息(举例)表xx:不良事件发生率统计(举例)表xx: 受试者退出试验情况人原因)等。
表xx: 方案偏离情况表xx: 试验结果表xx:调整评价标准的生物等效性试验数据汇总表(若适用)表xx:生物样品分析方法学验证结果(举例)表xx:生物样品分析的标准曲线和质控数据概要*(举例)表xx :试验样品重复测定情况表xx:餐后生物等效性试验中试验餐的组成表xx:浓度数据汇总表(适用于采用体内药代法进行的生物等效性试验)(代码的定义详见后续表格)a)受试制剂组的药物浓度文案大全文案大全b)参比制剂组的药物浓度文案大全文案大全表xx:药动学参数汇总表(表格中代码的定义详见后续表格)(举例)a)受试制剂药动学参数文案大全max 文案大全b)参比制剂药动学参数文案大全max 文案大全注:生物样品浓度数据表中的代码定义如:N_FIRST=10 指“第10个”采样时间点而不是10小时N_FIRST=24 指“第24个”采样时间点而不是24小时个体药动学参数数据表中的代码定义表xx:试验备案及临床试验登记平台登记情况小结表**药物临床试验登记与信息公示平台网址:/表xx:预试验汇总表(若适用)表xx:参考资料列表。
20160504-2016年第80号通告附件原料药部分-4,5.2类

附件化学药品新注册分类申报资料要求(试行)第二部分注册分类4、5.2类申报资料要求(试行)一、申报资料项目(一)概要1.药品名称。
2.证明性文件。
2.1注册分类4类证明性文件2.2注册分类5.2类证明性文件3.立题目的与依据。
4.自评估报告。
5.上市许可人信息。
6.原研药品信息。
7.药品说明书、起草说明及相关参考文献。
8.包装、标签设计样稿。
(二)原料药19.(2.3.S,注:括号内为CTD格式的编号,以下同)原料药药学研究信息汇总表。
10.(3.2.S)原料药药学申报资料。
10.1.(3.2.S.1)基本信息10.2.(3.2.S.2)生产信息10.3.(3.2.S.3)特性鉴定10.4.(3.2.S.4)原料药的质量控制10.5.(3.2.S.5)对照品10.6.(3.2.S.6)包装材料和容器10.7.(3.2.S.7)稳定性(三)制剂11. (2.3.P)制剂药学研究信息汇总表。
12.(3.2.P)制剂药学申报资料。
12.1.(3.2.P.1)剂型及产品组成12.2.(3.2.P.2)产品开发12.3.(3.2.P.3)生产信息12.4.(3.2.P.4)原辅料的控制12.5.(3.2.P.5)制剂的质量控制12.6.(3.2.P.6)对照品12.7.(3.2.P.7)稳定性13.(2.4.P)制剂非临床研究信息汇总表。
14. 制剂非临床研究申报资料。
214.1.(4.2.2)药代动力学14.2.(4.2.3)毒理学15. (2.5.P.)制剂临床试验信息汇总表。
16.制剂临床试验申报资料。
16.1.(5.2)临床试验项目汇总表16.2.(5.3)生物等效性试验报告16.2.1.(5.3.1.2.1)空腹生物等效性试验报告16.2.2.(5.3.1.2.2)餐后生物等效性试验报告16.2.3.(5.3.1.4) 方法学验证及生物样品分析报告16.3.(5.3.5.4)其他临床试验报告16.4.(5.4)参考文献二、申报资料项目说明(一)概要部分1.药品名称:包括通用名、化学名、英文名、汉语拼音,并注明其化学结构式、分子量、分子式等。
临床试验信息登记表(药物)

:姓名联系电话邮箱
:姓名联系电话邮箱
:姓名联系电话邮箱
:姓名联系电话邮箱
(若启动前监查员与启动时监查员不是同一人,请分别提供联系方式及简历。)
监查计划
次月;天次
申办方或受委托的代表签字日期
主要研究者签字日期
机构办公室
审核人审核日期
审核结论:
□可存放于药房
□需存放于科室,原因
□是□否
是否为注册项目?
□是
□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期(再注册)
□生物等效性
□其他
□否
□Ⅳ期(上市后研究)□一致性评价
□其他
药品
注册分类
□中药类
□化药类
□治疗用生物制品类
□预防用生物制品类
研究中心
数量
组长单位
组长单位
主要研究者
计划入组例数
全球例;中国区例;本中心例。
试验方法
□随机□非随机□其他
□开放□单盲□双盲□其他
其他由申办方提供的试验用药物(□无□有,请完成下表)
药物类型
药物名称
剂型
规格及包装规格
用法用量
储存条件
备注:药物类型填写基础用药急救用药等。
发放周期及发放数量:
(举例:天或周或月次;片或瓶或盒次;共发放次。)
是否涉及周六日或节假日发药:□是□否
是否涉及夜间发药:□是□否
联络信息及监查计划联Fra bibliotek信息申办方项目经理:姓名联系电话邮箱
□阳性对照□安慰剂对照□单臂□其他
□单剂量□多剂量□其他
试验周期
期中分析
□无□有,节点为
项目开展地点
□门诊□急诊
□第一住院部
药物临床试验总结表-复旦大学附属中山医院

药物临床试验总结表
填表日期:年月日编号:(由机构填写)
试验名称:
CFDA批件号:
方案编号:
中文药名:
英文药名:
商品名:
申办者:
CRO:
试验分期:□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期□生物等效性□其他
药物批号:
有效期:
生产日期:
伦理委员会名称:
伦理委员会批准日期:
本机构协议签订时间:
首例签署ICF日期:年月日
最后1例签署ICF日期:年月日
首例入组日期:年月日
最后1例出组日期:年月日
试验开始时间:年月日
试验完成时间:年月日
筛选例数:
入选例数:
脱落例数:
剔除例数:
完成例数:
本机构SAE发生情况(例数、相关性、转归)
本机构AE发生情况(例数、相关性、转归)
始时间为伦理批准时间或接受伦理备案时间,完成时间为分中心小结盖章时间。
化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求

化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)一、申报资料项目(一)概要1.历史沿革2.批准及上市情况3.自评估报告4.临床信息及不良反应5.最终确定的处方组成及生产工艺情况6.生物药剂学分类(二)药学研究资料7.(2.3.P,注:括号内为CTD格式的编号,以下同)制剂药学研究信息汇总表8.(3.2.P)制剂药学申报资料8.1.(3.2.P.1)剂型与产品组成8.2.(3.2.P.2)产品再评价研究8.2.1.(3.2.P.2.1)处方组成8.2.2.(3.2.P.2.2)制剂再研发(适用于处方、工艺有改变的品种)8.2.2.1.(3.2.P.2.2.1)处方再研发8.2.2.2.(3.2.P.2.2.2)工艺再研发8.3.(3.2.P.3)生产信息8.3.1.(3.2.P.3.1)生产商8.3.2.(3.2.P.3.2)批处方8.3.3.(3.2.P.3.3)生产工艺和工艺控制8.3.4.(3.2.P.3.4)关键工艺步骤和中间体的控制8.3.5.(3.2.P.3.5)工艺验证和评价(适用于工艺有改变的品种)8.3.6.(3.2.P.3.6)临床试验/生物等效性(BE)样品的生产情况8.4.(3.2.P.4)原辅料的控制8.5.(3.2.P.5)制剂的质量控制8.5.1.(3.2.P.5.1)质量标准8.5.2.(3.2.P.5.2)分析方法8.5.3.(3.2.P.5.3)分析方法的验证8.5.4.(3.2.P.5.4)批检验报告8.5.5.(3.2.P.5.5)杂质谱分析8.5.6.(3.2.P.5.6)质量标准制定依据8.6.(3.2.P.6)对照品8.7.(3.2.P.7)包装材料8.8.(3.2.P.8)稳定性8.8.1.(3.2.P.8.1)稳定性总结8.8.2.(3.2.P.8.2)后续稳定性承诺和稳定性方案(适用于处方、工艺有改变的品种)8.8.3.(3.2.P.8.3)稳定性数据(三)体外评价9.参比制剂9.1.参比制剂的选择9.2.基本信息9.3.质量考察9.4.溶出曲线考察9.5.溶出曲线稳定性考察(适用于理化性质不稳定品种)10.质量一致性评价10.1.国内外质量标准收载情况比较10.2.关键质量属性研究10.3.参比制剂与被评价制剂的检验结果11.溶出曲线相似性评价11.1.建立体外溶出试验方法11.2.批内与批间差异考察11.3.溶出曲线相似性比较结果(四)体内评价12.(2.5. P)制剂临床试验信息汇总表13.制剂临床试验申报资料13.1.(5.2)临床试验项目汇总表13.2.(5.3)生物等效性试验报告13.2.1.(5.3.1.2.1)空腹生物等效性试验报告13.2.2.(5.3.1.2.2)餐后生物等效性试验报告13.2.3.(5.3.1.4)方法学验证及生物样品分析报告13.3.(5.3.5.4)其他临床试验报告14.参考文献及相关实验数据研究资料二、申报资料项目说明(一)概要1.历史沿革说明同品种原研产品上市背景信息,包括品种治疗领域、国内外上市情况。
临床试验项目基本信息表
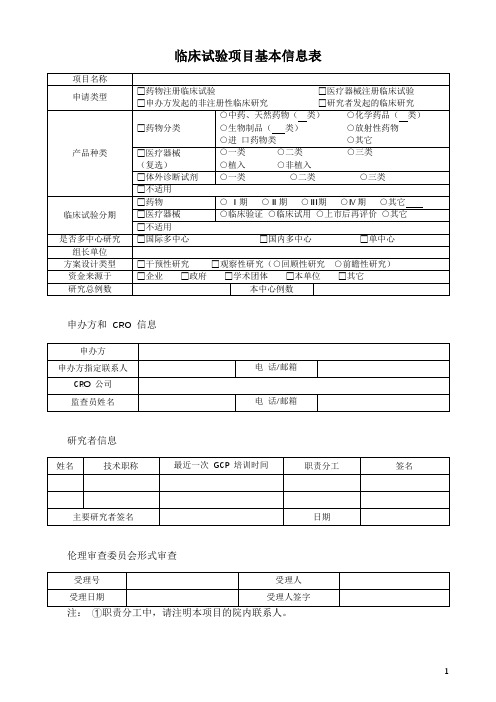
临床试验分期
□药物
○ Ⅰ期○Ⅱ期○Ⅲ期○Ⅳ期○其它
□医疗器械
○临床验证○临床试用○上市后再评价○其它
□不适用
是否
方案设计类型
□干预性研究□观察性研究(○回顾性研究○前瞻性研究)
资金来源于
□企业□政府□学术团体□本单位□其它
研究总例数
本中心例数
临床试验项目基本信息表
项目名称
申请类型
□药物注册临床试验
□申办方发起的非注册性临床研究
□医疗器械注册临床试验
□研究者发起的临床研究
产品种类
□药物分类
○中药、天然药物(类)
○生物制品(类)
○进口药物类
○化学药品(类)
○放射性药物
○其它
□医疗器械
(复选)
○一类
○植入
○二类○三类
○非植入
□体外诊断试剂
○一类○二类○三类
申办方和CRO信息
申办方
申办方指定联系人
电话/邮箱
CRO公司
监查员姓名
电话/邮箱
研究者信息
姓名
技术职称
最近一次GCP培训时间
职责分工
签名
主要研究者签名
日期
伦理审查委员会形式审查
受理号
受理人
受理日期
受理人签字
注:①职责分工中,请注明本项目的院内联系人。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件4
15.(2.5.P.)临床试验信息汇总表
本套格式申报资料主要适用于以药动学参数为终点评价指标的生物等效性试验资料的申报。
对于需要进行临床试验的特殊制剂等,信息汇总表应参照注册分类3的格式撰写。
基于目前的认识制定本套格式申报资料,可根据化合物的性质和试验特点做适当优化和补充。
须按时间顺序提交所进行的每项生物等效性试验的相关信息。
应以下级目录形式逐个研究项目填写“生物等效性试验信息汇总表”(“如2.5.P.1空腹生物等效性试验;2.5.P.2餐后生物等效性试验”),共用内容集中填写于首个试验项目中,其余项目参见首个试验,并注明标题编号。
2.5.P.1 XX药的空腹生物等效性试验
表1(注:依次编号,下同):基本信息
表xx:试验药物信息
表xx: 处方信息(举例)
应提交所有规格的处方信息
表xx:体外溶出试验概要
6 / 27
应提交受试制剂和参比制剂所有规格的溶出试验结果。
7 / 27
表xx: 试验设计
表xx: 试验报告及生物样品储存信息
表xx: 完成生物等效性试验的受试者信息(举例)
表xx:不良事件发生率统计(举例)
表xx: 受试者退出试验情况
人原因)等。
表xx: 方案偏离情况
表xx: 试验结果
表xx:调整评价标准的生物等效性试验数据汇总表(若适用)
表xx:生物样品分析方法学验证结果(举例)
表xx:生物样品分析的标准曲线和质控数据概要*(举例)
表xx :试验样品重复测定情况
表xx:餐后生物等效性试验中试验餐的组成
表xx:浓度数据汇总表(适用于采用体内药代法进行的生物等效性试验)(代码的定义详见后续表格)a)受试制剂组的药物浓度
17 / 27
18 / 27
b)参比制剂组的药物浓度
19 / 27
20 / 27
表xx:药动学参数汇总表(表格中代码的定义详见后续表格)(举例)a)受试制剂药动学参数
21 / 27
max
22 / 27
b)参比制剂药动学参数
23 / 27
max
24 / 27
注:生物样品浓度数据表中的代码定义
如:N_FIRST=10 指“第10个”采样时间点而不是10小时N_FIRST=24 指“第24个”采样时间点而不是24小时
个体药动学参数数据表中的代码定义
表xx:试验备案及临床试验登记平台登记情况小结表*
*药物临床试验登记与信息公示平台网址:
表xx:预试验汇总表(若适用)
表xx:参考资料列表。
