离域_键对化学键稳定性的影响
芳香性、离域π键和休克尔规则

(b) 可以解释键角的变化 对于NH3与NF3,∠HNH>∠FNF,
而对于PH3与PF3,∠HPH<∠FPF。
两者是反序的,这是因为后者是由于F原子上
的孤对电子对占有P原子上的3d空轨道,增强了P原
子上的电子云密度,使成键电子对之间的排斥力增 大,所以键角变大。
超 共 轭 效 应
超 共 轭 效 应
C+
26 26
3个
6 6
18 19
休克尔规则 规则表明,对完全共轭的、单环的、平面多烯 来说,具有(4n+2)个 π电子(这里n是大于或等 于零的整数)的分子,可能具有特殊芳香稳定性。
每个C原子以SP2杂化,分别与两个 C及一个H原子成3个 键,剩余 一个p轨道,与杂化轨道垂直,N 原子SP2杂化,成三个单键,剩余 一个P轨道,一对孤对电子,最后 6 形成 。 4
(1)环丁二烯
环丁二烯不稳定
环丁二烯的取代衍生物有较 大的稳定性。1,2,3-三叔丁基 环丁二烯可以在-70℃的溶液 中存在一段时间
2,3,4-三叔丁基环丁二烯甲酸甲酯在室 温下可以分离出来。
它们环中的键长是不相等的,明显有单 键、双键的区别。前者为0.1506nm,后者 为0.1376nm。
(2) d-p π键的应用
(a) 可以解释共价分子几何构型 (SiH3)3N与(CH3)3N有不同的几何构型,前者为平
面三角形,后者为三角锥型。这是由于在(SiH3)3N中N 原子可以采取sp2杂化,未杂化的2p轨道(有一对孤对
电子对)可以“肩并肩”地与Si原子的3d空轨道重叠
而形成d-pπ键,使平面三角形结构得以稳定。 (CH3)3N中的C原子不存在d价轨道,所以N原子必须采 取sp3杂化,留给孤对电子对以合适的空间。
物质结构与化学稳定性综述

物质结构与化学稳定性综述摘要:物质的化学稳定性是一个关乎其制备、使用、存放等问题的重要性质,在化学实验室中,我们经常需要了解物质的化学稳定性。
从物质结构角度来说明物质的化学稳定性,才是对该物质性质的最本质解释。
本文汇总简述了从不同层次分析的物质结构与化学稳定性的关系的理论。
关键词:物质结构,化学稳定性1 前言:物质稳定性的概念化学稳定性的定义是物质在物理、化学因素作用下保持原有化学性质的能力。
从分析这些问题时所用到的化学理论来看,物质的化学稳定性有热力学稳定性与动力学稳定性之分。
热力学稳定性是指在某体系中,该物质没有任何可想象的化学反应能自发地进行。
化学动力学稳定性是指在某体系中,该物质至少有一个可想象的化学反应能自发地发生,只是这个反应在以无法观测到的、极慢的速度在进行着,从而可以被宏观地认为这个化学反应并没有发生。
因为一个反应可以按许多历程进行,过渡态的寿命又很短,所以化学动力学研究的广度及深度与热力学稳定性相比大有不足,关于动力学稳定性的理论还很不完善。
因此通常的化学物质稳定性研究,都仅限于物质的热力学稳定性。
因为其作用因素的多变性,物质的化学稳定性有针对性,必须明确、统一作用条件这个概念才有意义。
同时物质的化学稳定性难以定量计量,是一个相对的概念,但可间接地通过热力学指标指示其强弱。
要从本质解释物质的稳定性,则需要研究物质的结构。
一方面物质结构导致的物质能量高低体可以较好地反映物质的稳定性:能量高的结构不稳定,能量低的结构稳定;另一方面特殊的物质结构也可以解释热力学难以解释的物质对特定物质的异常的稳定或不稳定性。
下文将简述从不同微观层次分析的物质结构与化学稳定性的关系的理论。
2 原子层面的结构与稳定性2.1 核外电子排布情况核外电子排布大多遵循如下规律:1、泡利不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对;2、能量最低原理:电子尽可能占据能量最低的轨道;3、Hund规则:简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子;4.等价轨道在全充满、半充满或全空的状态是比较稳定的。
关于离域派键的论述

2009届分类号:O61单位代码:10452本科毕业论文浅谈简单化合物中的离域 键姓名袁梦性别女学号************年级2005专业化学系(院)化学化工学院指导教师郭士成2009年3月10日摘要在无机或有机共价化合物的分子或离子中,往往含有一种或几种不同类型的化学键,如πσ和键等。
有些化合物分子或离子中的π键电子不仅仅局限于两个原子的之间,而是在参加成键的多个原子形成的分子或离子骨架中运动,这种化学键称为离域π键。
本文以杂化轨道理论和原子的价电子数为基础,以1,3丁二烯为例阐述了离域π键的概念,以CO2分子为例说明了离域π键的形成条件,论述了N(SiH3)3分子的d-p共轭离域π键,足球烯分子离域π键的特殊性以及丙烯分子的σ-π共扼离域π键,对二氧化氮、氧等几种化合物分子离域π键的形成,-2SO离子中的d-p配键,缺电子分子BF3的离域π键分4别进行了阐述。
以期对简单化合物分子或离子的离域π键有进一步认识。
关键词:离域π键;共轭离域π键;σ-π共扼;d-p配键Delocalized π bond containing compounds the stability ofABSTRACTAt covalent inorganic or organic compounds or molecular ions,often contain one or several different types of chemical bonds,such as π keys, etc. Some molecular compounds or ionic bond in the π electron is not limited to between two atoms. But take part in a number of bonding atoms to form molecules or ions skeleton in sports, t his chemical bond is called π bond delocalization.In this paper, hybrid orbital theory and valence electron number of atom-based, 1,3 but adiene as an example to elaborate the π key concepts from the domain, CO2 molecules as an example to illustrate the formation of delocalized bond conditions, Discusses the N (SiH3) 3 molecules d-p conjugated delocalized π bond, f ootball Triazene π bond delocalization molecular specificity, as well as propylene molecules σ-π conjugated delocalized π bond,of nitrogen, oxygen and other elements of several compounds delocalizati on π bond formation, ion in the dp with key,lack of electron delocalization molecular BF3 keys separately described. With a view to a simple molecular compounds or ions from the keys have a better understanding of the domain.Keywords:πDelocalization Kin; Thermal decomposition of; Molecular Structure目录1引言 (1)2离域π键的概念 (1)3 离域π键的形成条件与类型 (2)3.1离域π键的形成条件 (2)3.2离域π键的类型 (3)3.2.1d-p共轭离域π键 (3)3.2.2足球烯分子的离域π键 (4)3.2.3 σ-π共轭离域π键 (5)4含离域π键分子的结构分析 (5)4.1 NO2分子的结构分析 (5)4.2 O3分子的结构分析 (6)4.3 ClO2分子的结构分析 (6)RO含氧酸根的d-pπ离域配键 (6)4.4 -n44.5 缺电子分子的离域π键 (7)5结语 (8)参考文献 (9)致谢 (10)1234C C C C H H HH 1引言在一些无机或有机共价化合物的分子或离子中,常常含有两种共价键即σ键和π键。
化学键的强度和稳定性

合成高分子材料的合成方法主要有加聚反应和缩聚反应等,可以通过改变反应条件和原料比例来调节化学键的排列和数量,从而获得具有不同性能的合成高分子材料。
药物合成与设计
材料科学:利用化学键理论,研究材料的结构和性能关系,开发具有优异性能的新型材料。
药物合成与设计:利用化学键理论,设计药物的合成路径和分子结构,提高药物的稳定性和疗效。
金属键的强度与金属原子的电子排布有关,电子排布越紧密,金属键的强度越强。
金属键的强度与金属原子的价电子数有关,价电子数越多,金属键的强度越强。
金属键的强度与金属原子的配位数有关,配位数越大,金属键的强度越强。
分子间作用力对化学键强度的影响
分子间作用力包括范德华力和氢键
范德华力影响化学键的强度,范德华力越大,化学键越稳定
氢键影响化学键的强度,氢键越多,化学键越稳定
分子间作用力对化学键强度的影响与分子间的距离和排列方式有关
化学键的稳定性
03
键能与稳定性
键能:化学键的稳定性与键能的大小有关,键能越大,化学键越稳定。
影响因素:化学键的稳定性受到多种因素的影响,如原子间的电负性差异、共价键的类型等。
实例分析:以共价单键、共价双键和共价三键为例,解释不同类型共价键的稳定性差异。
原子半径:原子半径越小,共价键的强度越大。
电子云的密度:电子云密度越大,共价键的强度越大。
离子键的强度
电子密度:电子密度越高,键的强度越强
离子键的形成:由正负离子之间的库仑力形成,其强度与离子的电荷和半径有关
离子半径:离子半径越大,键的强度越弱
离子电荷:离子电荷越高,键的强度越强
金属键的强度
金属键的强度与金属原子的半径有关,半径越大,金属键的强度越弱。
二氧化碳的离域键

二氧化碳的离域键1.引言1.1 概述二氧化碳(CO2)是一种由一个碳原子和两个氧原子组成的分子,被广泛认为是地球上最重要的温室气体之一。
随着人类活动的增加,包括工业生产、交通运输和能源消耗,二氧化碳的排放量不断增加,导致大气中的二氧化碳浓度不断上升。
二氧化碳分子是通过共价键连接碳原子和氧原子而形成的。
然而,在某些情况下,二氧化碳分子中的碳和氧原子可以形成离域键。
离域键的形成使得二氧化碳分子在化学性质和反应性上与普通的共价键有所不同。
离域键的形成机制是由于二氧化碳分子中的氧原子具有一对孤立电子,这对电子可以与其他原子或分子进行电子转移或共享,从而形成新的化学键。
这种形式的离域键可以使二氧化碳分子参与更多的化学反应,并可能产生与普通二氧化碳分子不同的性质和行为。
本文旨在探讨二氧化碳离域键的形成机制、其对环境和人类的影响,以及相关领域的研究进展和未来展望。
通过对离域键的深入了解,我们可以更好地了解二氧化碳分子的性质和行为,为应对气候变化和环境保护提供科学依据和技术支持。
文章结构部分的内容可以如下编写:1.2 文章结构本文共分为引言、正文和结论三部分,下面对每个部分的内容进行简要介绍。
引言部分首先概述了本文的主题——二氧化碳的离域键,并阐明了写作本文的目的。
接下来通过引言部分的概述,读者可以对文章的整体内容有一个初步的了解。
正文部分是本文的核心部分,包括了两个小节。
第一个小节是关于二氧化碳的结构和性质的介绍,将会通过详细论述二氧化碳的分子结构和相关物理化学性质,使读者对二氧化碳有一个全面的认识。
第二个小节将聚焦于二氧化碳的离域键形成机制。
通过对二氧化碳离域键形成的原理和机制的深入解析,以及相关研究的最新进展,帮助读者理解离域键的重要性和意义。
结论部分将对二氧化碳的离域键对环境和人类的影响进行分析,探讨离域键的研究进展和未来展望。
此部分将总结全文的主要观点和研究成果,并给出我们对未来发展方向的展望。
通过以上的结构布局,本文将全方位地介绍二氧化碳的离域键的相关知识,从而帮助读者深入了解离域键的重要性和意义,并为进一步研究和应用提供了基础。
化学键的形成与类型

化学键的形成与类型化学键是指原子之间形成的一种电子云的共享或转移关系。
化学键的形成与类型对于理解化学反应、化学物质的性质以及化学反应的速度等方面非常重要。
本文将重点讨论化学键的形成过程以及常见的化学键类型。
一、化学键的形成过程化学键的形成主要有三种方式:共价键、离子键和金属键。
1. 共价键共价键是通过原子间的电子云共享而形成的。
当原子间的电子云重叠时会形成共价键。
共价键的形成是通过原子间电子的相互吸引力来实现的。
共价键可以进一步分为两种类型:极性共价键和非极性共价键。
极性共价键一般是由两个非金属原子组成的。
其中,一个原子的电负性较高,另一个原子的电负性较低。
这种情况下,电子云偏向电负性较高的原子,形成一个带负电的极性离子。
常见的极性共价键包括氢氧键和氮氧键。
非极性共价键是指共享电子对均匀分布的情况。
在非极性共价键中,两个原子的电负性相似,因此电子云对两个原子的吸引力是相等的。
例如,氧气中的氧气键就是非极性共价键。
2. 离子键离子键是由正负离子之间的静电吸引力而形成的。
它通常出现在金属和非金属元素之间,其中金属元素失去电子成为正离子,非金属元素获得电子成为负离子。
由于负离子与正离子之间存在静电吸引力,因此形成了离子键。
常见的例子是氯化钠中的钠离子和氯离子之间的离子键。
3. 金属键金属键是在金属元素中形成的。
金属中的原子以球状结构形式存在,由一个个正离子组成,而电子则自由移动在这些正离子之间形成电子海。
由于其中的电子可以在正离子之间自由流动,因此形成了金属键。
金属键使得金属在常温下保持固态,并且具有高导电性和高热导性。
二、常见的化学键类型除了以上提到的共价键、离子键和金属键之外,化学中还存在其他一些特殊类型的化学键。
1. 氢键氢键是一种特殊的共价键,它是由一个氢原子与一个电负性较高的原子(如氧、氮、氟等)之间的吸引力形成的。
氢键在生物分子中起着重要作用,例如在DNA的双螺旋结构中就有氢键的存在。
2. 范德华力范德华力是由分子间的瞬时或感应偶极引起的吸引力。
多原子分子中的化学键 (3)
对称 反对称
是不合理的。
* 2 5p
因为I的电负性比H大,电子从电负性较大的I往电负性较小的H 转移,从化学上看 虽然对称性匹配,但电子转移的方向不对,电子转移虽削弱了H2键,但却加强了 I2的键,对反应不利。
由此可见,H2和I2的反应不可能按双分子基元反应的机理进行。 按分步反应的机理: I2 2I I 价层电子组态 (5S)2(4d)10(5P)5
一、前线轨道理论
前线轨道:已填电子的能量最高轨道称为最高占据
轨道(HOMO),能量最低的未被占满的轨道称为最 低空轨道(LUMO),这些轨道统称前线轨道(FMO)。 前线轨道理论的主要内容: 1)分子在反应过程中,分子轨道发生相互作用,优先起作用的是前线轨道。分子 轨道的对称性特别是前线轨道的对称性在反应历程中起决定性作用。只有 HOMO和LUMO的对称性匹配的过渡态才是活化能较低的状态,称为对称允 许的状态。
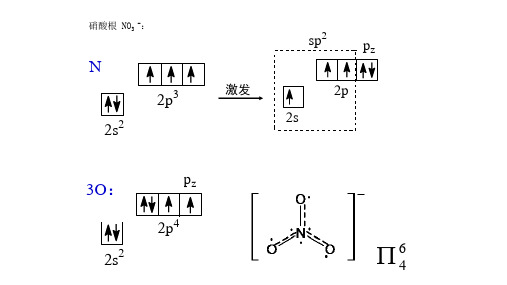
硝酸根 NO3 -:
sp2
激发
pz 2p
N
2p 2s
2 3
2s
3O:
2p4
pz离域π键与分子性质:
由于分子中形成离域π键。对物质的许多性质均有一定的影响。 1、酸碱性 一方面 羟基氧原子上的孤对p电子参与生成大 π 键使羟基氧上的电子往C上迁移。 O 因而使H的电正性增加容易电离成 H+。 和 R C O H
—CH3
* z
-
+
+ + - + +
+ + -
-
+ + -
+ + -
C=C
C=C
*
—CH3 z
+
第3章离域化学键

第三章 离域化学键
(四)共振规则
• 一切正则式必须是真正的Lewis结构; 一切正则式必须是真正的Lewis结构 结构; • 在所有结构中,核的位置必须一样; 在所有结构中,核的位置必须一样; • 一切参与共振的原子,即由离域电子涉及的原子,必须在平 一切参与共振的原子,即由离域电子涉及的原子, 面上,或几乎是在一个平面上; 面上,或几乎是在一个平面上; • 一切正则式中,未共享电子的数目必须要一样; 一切正则式中,未共享电子的数目必须要一样; • 实际分子的能量低于任何正则式的能量,因此,离域导致稳 实际分子的能量低于任何正则式的能量,因此, 定现象; 定现象; • 各个正则式对真实分子的贡献不等。 各个正则式对真实分子的贡献不等。
第三章 离域化学键
一般而言,结构的相对稳定性可从下列情况中作出判断: 一般而言,结构的相对稳定性可从下列情况中作出判断: • 共价键多的结构通常比共价键少的结构更稳定; 共价键多的结构通常比共价键少的结构更稳定; • 随着电荷分离的增大,稳定性减小。带式苻电荷的结构的稳 随着电荷分离的增大,稳定性减小。 定性不及不带电荷的结构, 定性不及不带电荷的结构,超过两个式苻电荷的结构通常贡 献很少, 献很少,尤其不利的结构类型是在相邻的碳上带两个同样的 电荷;当化合物溶于不同溶剂中时,在极性大的溶剂中, 电荷;当化合物溶于不同溶剂中时,在极性大的溶剂中,离 子结构贡献较大; 子结构贡献较大; • 阴电荷在电负性较大的原子上的结构比在电负性较小的原子 上的结构稳定;同样的, 上的结构稳定;同样的,阳电荷最好是在电负性较低的原子 上; • 键长或键角有改变得结构不稳定。 键长或键角有改变得结构不稳定。
第三章 离域化学键
超共轭作用
第三章 离域化学键
互变异构 (一)酮-烯醇互变异构
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
地由共轭大 ! 键的大小或多少得出结论, 但可以根据量子化学计算结果进行定量判断. wiberg 键序: C4H5Cl
( 1.048 3) <C2HCl( 1.137 1) ; C- Cl 键键鞍点处的电荷密度 ρ( r) : C4H5Cl( 0.207 2) <C2HCl( 0.245 9) ; 键长: C4H5Cl
4
1.739 6→1.647 1) 逐渐缩短. 氯乙烷( C2H5Cl) 和氯乙烯( C2H3Cl) 比较, 由于氯乙烯( C2H3Cl) 分子中存在 !3大 ! 键 , 而 氯 乙 烷 ( C2H5Cl) 中 没 有 离 域 ! 键 , 所 以 R ( C- Cl) C2H5Cl >R ( C- Cl) C2H3Cl ( 1.803 1>1.739 6) , 即 氯 乙 烯 ( C2H3Cl) 中的 C- Cl 键比氯乙烷( C2H5Cl) 的 C- Cl 键稳定. 这与结构化学教材中“氯乙烯的氯原子不如氯乙烷 的 氯 原 子 活 泼 ”的 结 论 [4]是 一 致 的 , 说 明 量 子 化 学 定 量 计 算 结 果 是 可 靠 的 . 氯 乙 烯 ( C2H3Cl) 和 氯 乙 炔
3 结论
( 1) 存在离域键的体系比没有离域键的体系中的化学键的化学性质要稳定. 例如, 稳定性: ( C- Cl) C2H3Cl >
( C- Cl) C2H5Cl . ( 2) 当离域范围相同时, 离域键个数越多, 该体系越稳定. 例如, 稳定性: ( C- Cl) C2HCl >( C- Cl) . C2H3Cl ( 3) 离域键个数相同时, 离域键的范围越大, 该体系越稳定. 例如, 稳定性: ( C- Cl) C8H7Cl >( C- Cl) . C6H5Cl ( 4) 以上 3 条结论给我们提供了一个根据离域大 ! 键的大小或多少判断化学键稳定性的方法, 说明量
1 计算方法
采用量子化学从头算( HF) 方法, 在 6- 311+G** 基组水平上对氯代乙烷( C2H5Cl) , 氯代乙烯( C2H3Cl), 氯 代乙炔( C2HCl) , 氯代 1, 3- 丁二烯( C4H5Cl) , 氯苯( C6H5Cl) , C8H7Cl 进行 了几何构型 全优化, 并且 进行了振 动 频率分析, 得到了各个分子的稳定构型( 无虚频) . 上述计算均采用 Gaussian98[1]程序完成. 电子密度拓扑分 析采用 AIM2000[2]程序完成.
10
!9
大
!
键,
ρ( r)
C6H5Cl <ρ( r)
C8H7Cl
即( 0.204
6<0.208
1)
,
R >R (C- Cl) C6H5Cl
(C- Cl) C8H7Cl
( 1.745
7>1.730
0) .
所以 C8H7Cl 中的
C- Cl 键比氯苯( C6H5Cl) 分子中的 C- Cl 键稳定, 即 C- Cl 键的稳定性随着共轭体系的增大而增加.
关键词: 离域; 从头算; 电子密度拓扑分析 中图分类号: O641 文献标识码: A 文章编号: 1673- 1972( 2006) 03- 0032- 03
有机化合物分子可分为共轭分子和非共轭分子 2 大类. 共轭分子中多个原子间有相互平行的 p 轨道, 彼此连贯重叠形成的 π键称为多原子 π键或离域大 π键. 在这类分子中, 参与共轭体系的所有 π电子的游 动不局限在 2 个碳原子之间, 而是扩展到组成共轭体系的所有原子之间. 离域 π键的形成引起分子的物理 性质和化学性质的改变, 常称为离域效应或共轭效应. 离域效应表现在很多方面, 如分子的能量降低, 稳 定性增加, 电子云的分布改变, 酸碱性改变等等. 结构化学和有机化学中只是根据大 π键的大小定性判断 有机化合物分子中的 C- Cl 键强弱和反应活性, 本文针对离域 π键对分子稳定性的影响这一特点, 通过量子 化学计算定量地讨论了在一系列有机化合物分子中的 C- Cl 键的相对稳定性, 从而验证了根据大 π键的大 小定性判断的正确性.
6
C4H5Cl !5
第3期
孙翠红, 张星辰, 常永芳等: 离域π键对化学键稳定性的影响
33
π8
CC6H6H5C5Cll
8
!7
7
(b)
π9
C8H7Cl
89
C8H7Cl !8
图 1 各分子的几何构型
2.2 各分子中的离域键分析
将以上有机分子分为 2 组: ( a) 链状分子; ( b) 环状分子
( a) 组中, 氯乙烷( C2H5Cl) 分子不存在共轭键; 氯乙烯( C2H3Cl) 分子中, 每个 C 原子采取 sp2 杂化, 形成 3 个 ! 键, 剩余 1 个垂直于分子平面的 p 轨道彼此平行, 各提供 1 个单电子, 与 Cl 原子的 p 轨道( 提供 2 个电
键增强. 这可以作为共轭体系中化学键稳定性的一个定性判断依据. 当不能用定性的结论判断时, 可以根
据量子化学计算结果( wiberg 键序、键鞍点处的电荷密度 ρ( r) 、键长等) 定量判断.
参考文献:
[1] M J Frisch, G W Trucks, H B Schlegel, et al., Gaussian 98 ( Revision A.9) Gaussian, Inc[J] . Pittsburgh, PA, 1998 .
摘 要: 采用量子化学从头算方法, 在 6- 311+G** 基组水平上全优化了氯代乙烷(C2H5Cl), 氯 代乙烯( C2H3Cl) , 氯代乙炔( C2HCl) , 氯代 1, 3- 丁二 烯( C4H5Cl) , 氯苯( C6H5Cl) , C8H7Cl 的几 何构型, 对每个分子中的 C- Cl 键的键长、wiberg 键序以及 C- Cl 键的键鞍点处的电荷密度进行了电子密度 拓扑分析对比, 得到了离域体系的大小与 C- Cl 键的键长、wiberg 键序以及 C- Cl 键的键鞍点处的 电荷密度的关系.
34
石家庄学院学报
2006 年 5 月
4
4
( C2HCl) 比 较 , 氯 乙 烯 ( C2H3Cl) 分 子 中 存 在 1 个 !3大 ! 键 , 而 氯 乙 炔 ( C2HCl) 中 存 在 2 个 !3大 ! 键 , 所 以
R ( C- Cl) C2H3Cl >R( C- Cl) C2HCl ( 1.739 6>1.647 1) , 即 氯 乙 炔 ( C2HCl) 的 C- Cl 键 比 氯 乙 烯 ( C2H3Cl) 的 C- Cl 键 稳
4
6
定; 氯乙烯( C2H3Cl) 和氯代 1, 3- 丁二烯( C4H5Cl) 比较, 分子中分别存在 !3和 !5大 ! 键, R( C- Cl) C2H3Cl >R( C-
Cl) C4H5Cl ( 1.739 6>1.736 9) , 即氯乙烯( C2H3Cl) 的 C- Cl 键比氯代 1, 3- 丁二烯( C4H5Cl) 的 C- Cl 键活泼. 由此可
表 1 列出了各分子 C- Cl 键的 wiberg 键序、键鞍点处的电荷密度 ρ( r) 和键长. wiberg 键序和键的强度是 一致的, wiberg 键序越大, 表明该键越强, wiberg 键序越小, 则该键越弱. 根据 Bader 等提出的电子密度拓扑 分析理论[3], 键鞍点处的电荷密度 ρ( r) 是化学键强弱的量度, 电荷密度 ρ( r) 越大, 表明该键越强, 反之, 该键 越弱. 键长越长, 化学键的强度越弱, 反之, 键长越短, 该键越强.
1.137 1
1.055 0
1.055 2
ρ( r)
0.179 3
0.206 5
0.207 2
0.245 9
0.204 6
0.208 1
R( C- Cl) 1.803 1
1.739 6
1.736 9
1.647 1
1.745 7
1.730 0
wiberg- wiberg 键序; ρ( r) —键鞍点处的电荷密度; R( C- Cl) —C- Cl 键的键长
10
!9 大 ! 键.
2.3 各分子中 C- Cl 键的 wiberg 键序、键长和键鞍点处的电荷密度比较
表 1 各分子中 C- Cl 的 wiberg 键序、ρ( r) 、键长
C2H5Cl
C2H3Cl
C4H5Cl
C2HCl
C6H5Cl
C8பைடு நூலகம்7Cl
wiberg
0.991 8
1.043 1
1.048 3
子化学计算结果是可靠的.当要判断的体系的离域键范围没有以上明显的大小之分时, 如氯乙炔( C2HCl) 和
4
6
氯代 1, 3- 丁二烯( C4H5Cl) 比较, 分子中分别存在 2 个 !3和 1 个 !5大 ! 键, 我们可以根据量子化学计算结果
做出判断, 稳定性: ( C- Cl) C2HCl >( C- Cl) . C4H5Cl 综上所述, 随着共轭大 ! 键从无到有, 从少到多, 从小到大的顺序, 体系的稳定性增加, 各分子中 C- Cl
见, 随着共轭大 ! 键从无到有, 从少到多, 从小到大的顺序, 各分子中 C- Cl 键的 wiberg 键序和键鞍点处的电
荷密度 ρ( r) 逐渐增大, 键长逐渐缩短, 稳定性增加. 这可作为我们定性判断化学键稳定性的一个依据.
4
6
氯乙炔( C2HCl) 和氯代 1, 3- 丁二烯( C4H5Cl) 比较, 分子中分别存在 2 个 !3和 1 个 !5大 ! 键, 不能简单
[2] Bader R F W. Atoms in Molecules: A Quantum Theory[M] . Oxford: Clarendon Press, 1990 .
4
子) 形成 p- ! 共轭的大 !3键; 氯乙炔( C2HCl) 分子中, 每个 C 原子采取 sp 杂化, 各形成 2 个 ! 键, 剩余 2 组 p
