【精编】中小学精品课件晶体结构(2)课件.ppt
合集下载
第二章 晶体结构ppt课件

1-5 晶体结构与空间点阵的区别 晶体结构——其类型取决于原子结合,阵点的位置上可以是一 个或多个实际质点或者原子团,其种类可以是无限的。
空间点阵——每个阵点处原子都具有相同的环境,其种类有限 (仅有14种)。
亦即是说,每种空间点阵都可以形成无限多的晶体结构。
空间点阵概括地表明了原子、离子、原子集团、分 子等粒子在晶体结构空间中作周期分别的最基本规律。 空间点阵是把晶体中的质点抽象为阵点,用来描述和分 析晶体结构的周期性与对称性,要求各个阵点的周围环 境相同,它只能有14种类型。 晶体结构则是晶体中实际质点(原子、离子或分子) 的具体排列情况,它们能组成各种类型的排列,因此, 实际存在的晶体结构是无限的。 无论多么复杂的晶体结构都只有一个空间点阵。
二、结合力与结合能(续)
1-3 双原子结合力、结合能模型
双原子互作用力模型
双原子互作用能模型
三、原子半径(Ra)
1.计算公式 当R=R0时,两个正离子间的 中心距,称为原子直径(2Ra),亦 即R0=2Ra;
2.影响因素 ① 致密度越高,则Ra越小;
②键合力越高,则Ra越小;
③不同方向上Ra也可能不同;
四、晶体性
1.固体的分类 晶体——原子呈周期性排列; 非晶体——原子呈不规则排列; 2. 晶体的分类 单晶体——整个物质由一个晶粒组成,其中原子排列位向相同, 具有各向异性。 多晶体——有许多位向不同的小单晶体组成,具有各向同性(单 个经历的各向异性被“平均化”)。 3.晶体和非晶体相互关系 晶体和非晶体在一定的条件下可以相互转化。例如,在极大的冷 速下,可以得到非晶态金属。其原因是液态金属在冷却时来不及 转变成晶体就凝固了,非晶体实质上是一种过冷的液体结构(短 程有序)。
Material Material
空间点阵——每个阵点处原子都具有相同的环境,其种类有限 (仅有14种)。
亦即是说,每种空间点阵都可以形成无限多的晶体结构。
空间点阵概括地表明了原子、离子、原子集团、分 子等粒子在晶体结构空间中作周期分别的最基本规律。 空间点阵是把晶体中的质点抽象为阵点,用来描述和分 析晶体结构的周期性与对称性,要求各个阵点的周围环 境相同,它只能有14种类型。 晶体结构则是晶体中实际质点(原子、离子或分子) 的具体排列情况,它们能组成各种类型的排列,因此, 实际存在的晶体结构是无限的。 无论多么复杂的晶体结构都只有一个空间点阵。
二、结合力与结合能(续)
1-3 双原子结合力、结合能模型
双原子互作用力模型
双原子互作用能模型
三、原子半径(Ra)
1.计算公式 当R=R0时,两个正离子间的 中心距,称为原子直径(2Ra),亦 即R0=2Ra;
2.影响因素 ① 致密度越高,则Ra越小;
②键合力越高,则Ra越小;
③不同方向上Ra也可能不同;
四、晶体性
1.固体的分类 晶体——原子呈周期性排列; 非晶体——原子呈不规则排列; 2. 晶体的分类 单晶体——整个物质由一个晶粒组成,其中原子排列位向相同, 具有各向异性。 多晶体——有许多位向不同的小单晶体组成,具有各向同性(单 个经历的各向异性被“平均化”)。 3.晶体和非晶体相互关系 晶体和非晶体在一定的条件下可以相互转化。例如,在极大的冷 速下,可以得到非晶态金属。其原因是液态金属在冷却时来不及 转变成晶体就凝固了,非晶体实质上是一种过冷的液体结构(短 程有序)。
Material Material
晶体结构PPT教学课件

1
2
3Байду номын сангаас
4
5
想一想,谈一谈:
1、哪些支出是合理的?哪些支出 是不合理的?
2、养成有计划消费的习惯有什么 好处?
读一读,谈一谈。 1、劳动光荣,懒惰可耻。---中华传统美德
2、劳动创造了人本身。 ---马克思 3、劳动是一切有劳动能力的公民的光 荣职责……国家提倡公民从事义务劳动
---《中华人民共和国宪法》
诺贝尔奖获得者认为终生所学到的最主要的东 西,是幼儿园老师给他们培养的良好习惯。那 么,现在的我们,都已经养成了哪些习惯呢?
昨日的习惯,已经造 就了今日的我们;今日的 习惯,决定明天的我们。
好习惯,益终生!
中学生应该拥有以下几方面的良 好习惯:
• 有计保划消持费的自习惯己的、
• 勤于劳动的习惯
• 节约时学间的习习惯别人的 好习惯 • 卫生习惯
晶体结构
第一课时
一:晶体的定义:
而经过结晶过程形成 的具有规则的具有规 则几何外形的固体。 特征:1规则几何外形
2 固定的熔沸点
二 晶体分类:
(1)离子晶体
(2)分子晶体 (3)原子晶体 (4)金属晶体
Cl-
Na+
氯化钠的晶 胞中Na+位 于正方体的 顶点和面心, 氯离子位于 正方体的棱 上和体心
4 在NaCl晶体中与每个Na+距离等 同且最近的几个Cl-所围成的空 间几何构型为 ( ) A.正四面体 B.正六面体 C.正八面体 D.正十二面体
答案 C
常见的NaCl型离子晶体有碱金 属元素(铯除外)的卤化物、 银的卤化物(碘化银除外)、 碱土金属元素(铍除外)的氧 化物、硫化物和硒化
-----威廉·詹姆士
晶体结构PPT演示课件

同素异形体、同位素与同分异构体的比较
同位素
同素异形体
同分异构体
定义 研究对象
质子数相同、质 同一种元素
量数(或中子数)形成的不同
不同的原子
单质
原子
单质
分子式相同而结 构不同的化合物
化合物
性质
化学性质几乎 完全相同
物理性质差别 大,化学性质 稍有差别
物理性质和化 学性质均有较 大差别
常见实例
1H、2H、3H 35Cl、37Cl
态和熔融状态时都不导电。有些在水溶液中能电离 而导电。
3)溶解性 相似相溶:非极性溶质一般能溶于非极性溶剂;极
性溶质一般能溶于极性溶剂
20
一般来说,对于组成和结构相似的物质:
相对分子 质量越大
分子间作 用力越大
物质熔点 沸点越高
讨论:1)比较下列各组物质的熔、沸点高低
① CS2、CO2 ②CCl4 、O2、NaCl、NaF、MgO 离子晶体的熔沸点比分子晶体高 2)为什么氮气的熔沸点很低,而化学性质 很稳定?
◆概念分析:
(1)构成分子晶体的基本微粒是什么?哪些物质可形成 分子晶体?
(2)这些微粒是通过什么作用力形成晶体的?
思考:①稀有气体单质的结构微粒是什么?
②分子晶体表示的化学式的意义? (3)在干冰晶如体S、中S能8、否C找60到、一P、个CPO4 2分子?
18
干冰晶体结构的特点
①在干冰晶胞中存在哪些作用力?
15
在NaCl晶体中,以Na+为中心与之最近且距离
相等的Na+共有多少个?
12个
16
◆物理性质分析: 离子晶体
1)离子晶体的物理性质一般有何特征?为什么?
同位素
同素异形体
同分异构体
定义 研究对象
质子数相同、质 同一种元素
量数(或中子数)形成的不同
不同的原子
单质
原子
单质
分子式相同而结 构不同的化合物
化合物
性质
化学性质几乎 完全相同
物理性质差别 大,化学性质 稍有差别
物理性质和化 学性质均有较 大差别
常见实例
1H、2H、3H 35Cl、37Cl
态和熔融状态时都不导电。有些在水溶液中能电离 而导电。
3)溶解性 相似相溶:非极性溶质一般能溶于非极性溶剂;极
性溶质一般能溶于极性溶剂
20
一般来说,对于组成和结构相似的物质:
相对分子 质量越大
分子间作 用力越大
物质熔点 沸点越高
讨论:1)比较下列各组物质的熔、沸点高低
① CS2、CO2 ②CCl4 、O2、NaCl、NaF、MgO 离子晶体的熔沸点比分子晶体高 2)为什么氮气的熔沸点很低,而化学性质 很稳定?
◆概念分析:
(1)构成分子晶体的基本微粒是什么?哪些物质可形成 分子晶体?
(2)这些微粒是通过什么作用力形成晶体的?
思考:①稀有气体单质的结构微粒是什么?
②分子晶体表示的化学式的意义? (3)在干冰晶如体S、中S能8、否C找60到、一P、个CPO4 2分子?
18
干冰晶体结构的特点
①在干冰晶胞中存在哪些作用力?
15
在NaCl晶体中,以Na+为中心与之最近且距离
相等的Na+共有多少个?
12个
16
◆物理性质分析: 离子晶体
1)离子晶体的物理性质一般有何特征?为什么?
晶体结构与常见晶体结构类型PPT课件
Z 底对角 线
底对角 线 面对角 线
1,`1 2,m,2/m 222,mm2,mmm
4,`4,4/m,422, 4mm, `42m, 4/mmm
3,`3, 32,3m, `3m
6,`6, 6/m,622, 6mm, `62m, 6/mmm
23,m3,432, `43m, m`3m
晶体的分类
晶族和晶系
过该点的任意直线的两端可以找到与其等距离的点。
对应的对称操作:对此点的反伸(倒反)。
C
一个晶体中可以有对称中心,也可以没有对称中心;如果有对称中心,那么只能有一个, 且位于晶体的几何中心。
第37页/共63页
2 、对称面m(mirror plane):一个假想的平面,它能将晶体分成互成镜 像反 映的两个相同部分。
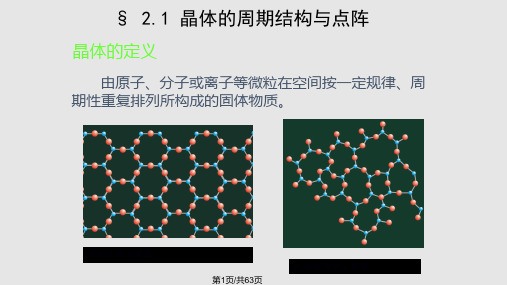
§ 2.1 晶体的周期结构与点阵
晶体的定义
由原子、分子或离子等微粒在空间按一定规律、周 期性重复排列所构成的固体物质。
晶态结构示意图
第1页/共63页
非晶态结构示意图
周期结构与点阵
(1)结构周期:晶体内部质点在三维空间周期性重复排列构成周期结构。
以NaCl晶体为例
Cl Na
0.563nm
2
第2页/共63页
第8页/共63页
第9页/共63页
(4)复式点阵(格子)
若晶体的基元中包括两种或两种以上的原子,则基元中每种原子可分别构成彼此完 全相同的点阵,但它们之间存在相对位移,形成复式点阵。
复式格子的特点 复式格子是由若干相同的布拉菲格子相互位移套构而成。
第10页/共63页
基元
结点
复式格子的特点
第11页/共63页
对称要素:在进行对称操作时所应用的辅助几何要素(点、线、
《晶体的结构和结晶》PPT课件

VC
常稳定。
的
结
▪ 部分碳化物和所有氮化 构
物属于间隙相。
精选ppt
40
▪ b. 具有复杂结构的间隙化合
物
▪ 当r非/r金>0.59时形成复杂结 构间隙化合物。
▪ 如Fe3C、Cr23C6等。Fe3C 称渗碳体,是钢中重要组成 相,具有复杂斜方晶格。
▪ 间隙相与间隙固溶体的区别?
Fe3C的晶格
高温合金中的Cr23C6
电子浓度:价电精子选pp数t 目与原子数目之比值。 38
3、间隙化合物(原子尺寸因素起主要作用)
与间隙固溶体相似,由过渡族金属同原子半径很小 的非金属元素形成的化合物。
无论溶质原子是以间隙方式还是以置换方式进入晶 格,总会对溶剂晶格造成一定程度的畸变。溶质与 溶剂原子的尺寸差别越大,晶格畸变越大,畸变能 越大,增大到一定容限时,原来的结构便不稳定, 会重新组合形成新的相。
为描述晶体内部原子的排列,将原子视为刚性球体。 刚性球体—原子浓缩成一个点(空间点阵)—用假 想的直线连接起来,形成空间格子(晶格)—取出 一个有代表性的最小几何单元—单位晶体(晶胞)。
1. 晶格:用假想的直线将原子中心连接起来所形成 的三维空间格架。直线的交点(原子中心)称结点。 由结点形成的空间点的阵列称空间点阵。
Cu-Ni置换固溶体
(2)置换固溶体
Fe-C间隙固溶体
精选ppt
32
按溶质原子在溶剂晶格中的溶解度分 (1)有限固溶体
间隙固溶体一定是有限固溶体。
(2)无限固溶体 在置换固溶体中,当溶质与溶剂原子半径差
别较小,在化学元素周期表上的位置靠近,且 晶格形式也相同时,可能形成无限固溶体。否 则,是有限固溶体。所以无限固溶体一定是置 换固溶体,反过来不成立。间隙固溶体一定是 有限固溶体,反过来不成立。
常稳定。
的
结
▪ 部分碳化物和所有氮化 构
物属于间隙相。
精选ppt
40
▪ b. 具有复杂结构的间隙化合
物
▪ 当r非/r金>0.59时形成复杂结 构间隙化合物。
▪ 如Fe3C、Cr23C6等。Fe3C 称渗碳体,是钢中重要组成 相,具有复杂斜方晶格。
▪ 间隙相与间隙固溶体的区别?
Fe3C的晶格
高温合金中的Cr23C6
电子浓度:价电精子选pp数t 目与原子数目之比值。 38
3、间隙化合物(原子尺寸因素起主要作用)
与间隙固溶体相似,由过渡族金属同原子半径很小 的非金属元素形成的化合物。
无论溶质原子是以间隙方式还是以置换方式进入晶 格,总会对溶剂晶格造成一定程度的畸变。溶质与 溶剂原子的尺寸差别越大,晶格畸变越大,畸变能 越大,增大到一定容限时,原来的结构便不稳定, 会重新组合形成新的相。
为描述晶体内部原子的排列,将原子视为刚性球体。 刚性球体—原子浓缩成一个点(空间点阵)—用假 想的直线连接起来,形成空间格子(晶格)—取出 一个有代表性的最小几何单元—单位晶体(晶胞)。
1. 晶格:用假想的直线将原子中心连接起来所形成 的三维空间格架。直线的交点(原子中心)称结点。 由结点形成的空间点的阵列称空间点阵。
Cu-Ni置换固溶体
(2)置换固溶体
Fe-C间隙固溶体
精选ppt
32
按溶质原子在溶剂晶格中的溶解度分 (1)有限固溶体
间隙固溶体一定是有限固溶体。
(2)无限固溶体 在置换固溶体中,当溶质与溶剂原子半径差
别较小,在化学元素周期表上的位置靠近,且 晶格形式也相同时,可能形成无限固溶体。否 则,是有限固溶体。所以无限固溶体一定是置 换固溶体,反过来不成立。间隙固溶体一定是 有限固溶体,反过来不成立。
晶体结构 PPT课件

结构可以看成是由C-C四面体共顶连接 而成。
金刚石的类型
晶格中N和B常替代C。N含量一般为 0.001% ~0.25%。按照N的含量将经金 刚石划分为不同类型/
Ⅰ型 (含N) Ⅰa型:N为N2、N3 、N n, 98%的天然无色--黄色钻石属于此类。 Ⅰb 型:N为孤N, 多数合成钻石属于此类。 Ⅰ型金刚石的主要用途:刀具、拉丝 模、砂轮、钻头等。
O2-位于立方晶胞晶棱的中点, Ca2+位于 立方晶胞的中心,配位数为12;Ti4+位于 晶胞的角顶,配位数为6;O 周围有4 个 Ca, 2个Ti。[TiO6]八面体共角顶连接。
CaTiO3的立方原始晶胞
Ti4+与八面体角顶的6个O2-配位
Ca2+
Ti4+ O2-
理想钙钛矿的晶胞
一般将等轴晶系钙钛矿结构称为理想 钙钛矿,典型代表是SrTiO3。这种结 构的钙钛矿很少见。只有当离子半径 满足(rA+rX) =1.414(rB+rX)。才能形成 理想的钙钛矿型结构。
方解石(CaCO3)的结构模型
每一个Ca2+与属于不同的CO32-离子团 中的六个氧离子配位,碳的氧离子配 位数为3 。
Ca2+与不同的CO32-离子团中的六个O2-配位,
(2)钙钛矿(CaTiO3)型晶体结构 高温下为等轴晶系,空间群Pm3m,
ao=0.385nm,Z=1。
钙钛矿结构可看成是较大的Ca2+和O2作立方最紧密堆积,Ti4+充填在由六个 氧形成的八面体空隙中。
10.1 元素单质的晶体结构
1.金属单质的晶体结构
典型的金属单质晶体,原子之间以金属键 结合,结构看成是由等大球紧密堆积而 成,原子配位数高。
晶体结构PPT教学课件
(b)
a2 a1
a4 a3
a6
a5
固体物理学原胞
a8 a7
维格纳--塞茨单胞
(3)三维
立方晶系 ab bc ca a b c
取 i , j ,k为坐标轴的单位矢量,
设晶格常量(布拉维原胞棱边的长度)为a,
即立方体边长为a, a ai ,b a j,c ak
布拉维原胞的体积: V a3
布拉维晶格(简单格)
第二节 晶体结构
本节主要内容: 1.2.1 晶体结构的周期性 1.2.2 原胞 1.2.3 密堆积、配位数和致密度
§1.2 晶体结构
(a)
(b)
(c)
(a)、(b)、(c)为二维晶体结构示意图,它们有何异同?
(a)
(b)
(c)
1.2.1 晶体结构的周期性
一个理想的晶体是由完全相同的结构单元在空间周期性重
垂面(或中垂线),由这些中垂面(或中垂线)所围成的最小体积 (或面积)即为W--S原胞。
特点:它是晶体体积的最小重复单元,每个原胞只包含1 个格点。其体积与固体物理学原胞体积相同。
2.几种晶格的实例 (1)一维原子链 一维单原子链
a
x na x 0 x a
一维双原子链
b a
(2)二维
(a)
(a)简立方
c b a
a1 ai a2 a j a3 ak
每个布拉维原胞包含1个格点。
固体物理学原胞的体积 Ω a3
(b)面心立方
ak
a1
a2 a j a3
ai
a
a1 j k 2
a 2 a i k 2 a a3 i j
2
平均每个布拉维原胞包含4个格点。
固体物理学原胞的体积 Ω a1 a2 a3 1 a3 4
晶体结构PPT课件
第一章 晶体的结构
2021/3/7
CHENLI
1
固体材料是由大量的原子(或离子)组成
约 1 mol / cm3
原子的排列形式(结构)是研究固体材料宏观性能的基础
质地软 良导体 用作润滑剂、笔芯
自然界中硬度最高 不导电
制造刀具、压头、磨料
中空结构
碳纳米管
储氢、月球“天梯”
2021/3/7抗拉强度和韧性在目前所有CH的EN材LI 料中最高
在对晶体结构的研究中,布拉维(Bravais)于十九世 纪中叶提出了空间点阵学说.
认为晶体可看成相同的格点在三维空间 作周期性无限分布所构成的系统.这些格点 的总和称为点阵.
1912 年劳厄(Laue) 对晶体进行了X射线衍射实 验, 首次证实了空间点阵学说的正确性.
2021/3/7描述空间点阵的几C个HE概NLI 念
每三个相切的球的中心构成一个等边三角形.
AB
A
第二层:占据第一层空隙的中心.
第三层:在第一层球的正上方形成ABAB ··· 的排列.
2021/3/7
Be、Cd、Mg和NCHi等ENL金I 属
10
(2) 立方密堆积(Face-Centered Cubic, FCC)
第一层:每个球与6个球相切,有6个
但相应两晶面之间的夹角总是恒定的. mm 两面间夹角总是60º00´ ; mR 两面间夹角总是60º13´ ; mr 两面间夹角总是38º13´ .
2021/3/7
CHENLI
7
(5)各向异性(anisotropy)
晶体的物理性质在不同方向上存在差异.
例如:电导率、热学性质、折射率等 石墨沿不同晶向电导率不同 方解石沿不同晶向折射率不同
2021/3/7
CHENLI
1
固体材料是由大量的原子(或离子)组成
约 1 mol / cm3
原子的排列形式(结构)是研究固体材料宏观性能的基础
质地软 良导体 用作润滑剂、笔芯
自然界中硬度最高 不导电
制造刀具、压头、磨料
中空结构
碳纳米管
储氢、月球“天梯”
2021/3/7抗拉强度和韧性在目前所有CH的EN材LI 料中最高
在对晶体结构的研究中,布拉维(Bravais)于十九世 纪中叶提出了空间点阵学说.
认为晶体可看成相同的格点在三维空间 作周期性无限分布所构成的系统.这些格点 的总和称为点阵.
1912 年劳厄(Laue) 对晶体进行了X射线衍射实 验, 首次证实了空间点阵学说的正确性.
2021/3/7描述空间点阵的几C个HE概NLI 念
每三个相切的球的中心构成一个等边三角形.
AB
A
第二层:占据第一层空隙的中心.
第三层:在第一层球的正上方形成ABAB ··· 的排列.
2021/3/7
Be、Cd、Mg和NCHi等ENL金I 属
10
(2) 立方密堆积(Face-Centered Cubic, FCC)
第一层:每个球与6个球相切,有6个
但相应两晶面之间的夹角总是恒定的. mm 两面间夹角总是60º00´ ; mR 两面间夹角总是60º13´ ; mr 两面间夹角总是38º13´ .
2021/3/7
CHENLI
7
(5)各向异性(anisotropy)
晶体的物理性质在不同方向上存在差异.
例如:电导率、热学性质、折射率等 石墨沿不同晶向电导率不同 方解石沿不同晶向折射率不同
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物的ห้องสมุดไป่ตู้体等。
本节小节: 1 构成离子晶体的微粒是: 2微粒间的化学键为: 3离子晶体化学式的含义为:
4离子晶体中是否存在分子:
晶体网站
www.crystalastar. org
作业:第八页一(1) (2)
A
B
顶点晶胞的共用情况
顶点
面心
棱上
体心
位于棱上的原子
被4个晶胞所共用
位于面心的原子 被2个晶胞所共用
位于体心的原子
为该晶胞所独有
1:在氯化钠的晶胞中,
平均属于每个晶胞的 Na+个数为_____,CI个数为_____
2:氯化钠晶胞中一
个CI-周围等距的 Na+ 有多少个?
3:氯化钠晶胞中一 个Na+周围等距 周围等距的Cl-有 多少个?
晶体结构
第一课时
一:晶体的定义:
而经过结晶过程形成 的具有规则的具有规 则几何外形的固体。 特征:1规则几何外形
2 固定的熔沸点
二 晶体分类:
(1)离子晶体
(2)分子晶体 (3)原子晶体 (4)金属晶体
Cl-
Na+
氯化钠的晶 胞中Na+位 于正方体的 顶点和面心, 氯离子位于 正方体的棱 上和体心
4 在NaCl晶体中与每个Na+距离等 同 且 最 近 的 几 个 Cl- 所 围 成 的 空 间几何构型为 ( )
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
答案 C
常见的NaCl型离子晶体有碱金 属元素(铯除外)的卤化物、 银的卤化物(碘化银除外)、 碱土金属元素(铍除外)的氧 化物、硫化物和硒化
本节小节: 1 构成离子晶体的微粒是: 2微粒间的化学键为: 3离子晶体化学式的含义为:
4离子晶体中是否存在分子:
晶体网站
www.crystalastar. org
作业:第八页一(1) (2)
A
B
顶点晶胞的共用情况
顶点
面心
棱上
体心
位于棱上的原子
被4个晶胞所共用
位于面心的原子 被2个晶胞所共用
位于体心的原子
为该晶胞所独有
1:在氯化钠的晶胞中,
平均属于每个晶胞的 Na+个数为_____,CI个数为_____
2:氯化钠晶胞中一
个CI-周围等距的 Na+ 有多少个?
3:氯化钠晶胞中一 个Na+周围等距 周围等距的Cl-有 多少个?
晶体结构
第一课时
一:晶体的定义:
而经过结晶过程形成 的具有规则的具有规 则几何外形的固体。 特征:1规则几何外形
2 固定的熔沸点
二 晶体分类:
(1)离子晶体
(2)分子晶体 (3)原子晶体 (4)金属晶体
Cl-
Na+
氯化钠的晶 胞中Na+位 于正方体的 顶点和面心, 氯离子位于 正方体的棱 上和体心
4 在NaCl晶体中与每个Na+距离等 同 且 最 近 的 几 个 Cl- 所 围 成 的 空 间几何构型为 ( )
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
答案 C
常见的NaCl型离子晶体有碱金 属元素(铯除外)的卤化物、 银的卤化物(碘化银除外)、 碱土金属元素(铍除外)的氧 化物、硫化物和硒化
