大学无机化学第十六章试题及答案
智慧树知到《无机化学》章节测试答案

智慧树知到《无机化学》章节测试答案第一章1、在恒温恒压条件下,反应热只取决于反应的始态和终态,而与过程的途径无关。
A:对B:错答案: 对2、环境对系统做功,系统的热力学能增加。
A:对B:错答案: 对3、反应的热效应就是该反应的焓变。
A:对B:错答案: 错4、△f Hmθ(Br2,g)=0kJ·mol-1。
A:对B:错答案: 错5、298K、标准态时,NH3(g)与O2(g)反应生成NO(g)和H2O(g),每氧化1molNH3(g)放出226.2kJ 热量,则其热化学方程式为NH3(g)+1/2O2(g)→NO(g)+1/2H2O(g),△rHmθ=-226.2kJA:对B:错答案: 错6、下列各物理量中,为状态函数的是()。
A:△HB:QC:HD:△U答案: H7、已知:2H2O2(l)→2H2O(l)+O2(g),△rHmθ=-196.0kJ·mol-1,1.0gH2O2分解放出的热量为()。
A:196kJB:98kJC:2.9kJD:5.8kJ答案: 2.9kJ8、已知2Cr(s)+3/2O2(g)→Cr2O3(s)的△rHmθ=-1135.0kJ·mol-1,C(石墨)+1/2O2(g)→CO(g)的△rHmθ=-110.5kJ·mol-1,则反应3C(石墨)+Cr2O3(s)→2Cr(s)+3CO(g)的△rHmθ为()。
A:803.5kJ·mol-1B:-1466.5kJ·mol-1C:-803.5kJ·mol-1D:1466.5kJ·mol-1答案: 803.5kJ·mol-19、298K时,二氧化碳和甲酸的标准摩尔生成焓分别为-393.5kJ·mol-1和-409.2kJ·mol-1,则反应:H2(g)+CO2(g)→HCOOH(l)的标准摩尔反应热△rHmθ=()。
A:-802.7kJ·mol-1B:802.7kJ·mol-1C:15.7kJ·mol-1D:-15.7kJ·mol-1答案: -15.7kJ·mol-110、下列各种物质中,298K标准摩尔生成焓为零的是()。
大学无机化学试题及答案

大学无机化学试题及答案试卷一一、选择题( 共15题30分1. 对于H2O2和N2H4,下列叙述正确的是…………………………………………( C )(A) 都是二元弱酸(B) 都是二元弱碱(C) 都具有氧化性和还原性(D) 都可与氧气作用2. 下列含氧酸中属于三元酸的是…………………………………………………(D )(A) H3BO3(B) H3PO2(C) H3PO3(D) H3AsO43. 下列各对含氧酸盐热稳定性的大小顺序,正确的是……………………………( D )(A) BaCO3 > K2CO3(B) CaCO3 < CdCO3(C) BeCO3 > MgCO3(D) Na2SO3 > NaHSO34. 铝在空气中燃烧时,生成…………………………………………………………( D )(A) 单一化合物Al2O3(B) Al2O3和Al2N3(C) 单一化合物Al2N3(D) Al2O3和AlN5. 下列含氧酸根中,属于环状结构的是…………………………………………(C )(A) (B) (C) (D)6. 下列化合物与水反应放出HCl 的是……………………………………………( C )(A) CCl4(B) NCl3(C) POCl3(D) Cl2O77. InCl2为逆磁性化合物,其中In的化合价为……………………………………( D )(A) +1 (B) +2 (C) +3 (D) +1和+38. 鉴别Sn4+和Sn2+离子,应加的试剂为……………………………………………(D )(A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量)9. 下列各组化合物中,都有颜色的一组化合物是………………………………( D )(A) SiCl4,SnCl4,PbO (B) CCl4,NO2,HgI2(C) SiC,B2H6,N2O4 (D) PbO2,PbI2,SnS10. 将过量SiF4通入NaOH溶液中,主要产物是……………………………………( C )(A) H4SiO4,NaF (B) Na2SiO3,NaF(C) Na2SiO3,Na2SiF6(D) SiO2,HF11. 将NCl3通入碱性溶液,其水解产物是…………………………………………(A )(A) NH3和ClO-(B) NH3和Cl-(C)和Cl-(D)和Cl-12. PCl3和水反应的产物是…………………………………………………………(B )(A) POCl3和HCl (B) H3PO3和HCl(C) H3PO4和HCl (D) PH3和HClO13. 下列各对物质,水解能力对比,正确的是………………………………………(D )(A)>(B)>(C) SnCl2 > SnCl4(D) PCl3 > BiCl314. 二氧化氮溶解在NaOH溶液中可得到:D(A) NaNO2和H2O (B) NaNO2,O2和H2O(C) NaNO3,N2O5和H2O (D) NaNO3,NaNO2和H2O15. 下列硫化物,能溶于Na2S溶液生成硫代酸盐的是…………………………( B )(A) SnS (B) SnS2(C) PbS (D) Bi2S3二、填空题( 共12题30分)16. N2O3很容易分解为NO 和NO2。
16-1无机化学复习题

16-1无机化学复习题一、名词解释(1-3题。
每题3分,满分9分)1、同位素:2、氧化还原反应:3、升华:4、催化剂:5、元素周期律:6、离子键:7、电解质:二、填空题:(4~19题。
将正确答案填入题内的括号中。
每题1分,满分16分)1、氯气的水溶液叫( )。
2、氯气在光照或点燃的情况下和氢气反应产生( )。
3、氯气和水反应之后能产生( )和氯化氢。
4、无水氯化钙的吸水性很强,常在实验室中用做( )。
5、碱土金属元素包括铍(Be)、( )、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra)。
6、氯气是一种( )色的、具有强烈刺激性气味的气体。
7、一氧化氮是( )的难溶于水气体,易氧化为二氧化氮。
8、二氧化氮是( )气体,氧化性较强。
9、浓度高于86 %的硝酸,因其易挥发,在空气中形成酸雾,故称为( )。
10、次氯酸钠具有强氧化性,有漂白和( )的作用。
11、纯净的盐酸是( )色,有氯化氢气味的液体。
12、盐酸是( )酸,它具有酸的通性。
13、漂白粉的有效成分是()。
14、氯气和消石灰反应的产物叫( )。
15、高氯酸的分子式是( )。
16、核外电子排布的过程中,离核越近能量越()。
17、写出O元素的核外电子排布式()。
18、H2O的相对分子质量是18,其摩尔质量是( )。
19、写出Na元素的核外电子排布式()。
20、影响化学反应速率的因素有温度、( )、浓度、催化剂。
21、少量的金属钠一般保存在()中。
22、钠和钾在燃烧的过程当中分别呈现黄色和紫色火焰,此现象称为( )。
23、钠在空气当中会被氧气氧化,生成( )。
24、在水溶液或溶融状态下可以导电的物质叫()。
25、( )可以作为一种氧气发生器,常用于高空飞行,潜水等。
26、镁在氧气中燃烧会发出耀眼的( )。
27、钙在空气中极易氧化,所以钙应该( )。
28、氢氧化钠显( )性。
29、石灰石的主要成分是()。
30、磷有多种同素异型体,最常见的是白磷和( )。
无机化学大连理工第十六章 d区元素(一) 习题解

第十六章 d区元素(一) 习题解1.完成并配平下列反应方程式。
(1)2TiO2+ + Zn + 4H+→2Ti3+ + Zn2+ + 2H2O(2)2Ti3+ + 3CO32- + 3H2O →2Ti(OH)3(s) + 3CO2(g)(3)TiO2 + H2SO4(浓) →TiOSO4 + H2O(4)TiCl4 + 3H2O →H2TiO3(s) + 4HCl(5)TiCl4 + 2Mg →2MgCl2 + Ti(s)2.完成并配平下列反应方程式。
(1)V2O5 + 2Cl- + 6H+→2VO2+ + Cl2(g) + 3H2O(2)2NH4VO3→V2O5 + 2NH3(g) + H2O (加热)(3)2VO2+ + SO32- + 2H+→ 2VO2+ + SO42- + H2O(4)5VO2+ + MnO4- + H2O →5VO2+ + Mn2+ + 2H+3.已知下列电对的标准电极电势:VO2+ + 2H++ e-→VO2+ + H2O φθ = 0.9994VVO2+ + 2H++ e-→V3+ + H2O φθ = 0.337VV3+ + e-→V2+φθ = -0.255VV2+ + 2e-→V φθ = -1.2V在酸性溶液中分别用1mol·L-1Fe2+,1mol·L-1Sn2+和Zn还原1mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?解:查附表六可知:Fe3+ + e-→Fe2+φθ(Fe3+/ Fe2+) = 0.769VSn4+ + 2e-→Sn2+φθ(Sn4+/ Sn2+) = 0.1539VZn2+ + 2e-→Zn φθ(Zn2+/ Zn) = -0.7621V当用1mol·L-1 Fe2+还原1mol·L-1的VO2+时,只能得到VO2+离子;当用1mol·L-1 Sn2+Z 在酸性溶液中还原1mol·L-1的VO2+时,首先被还原为VO2+离子,可继续被被还原为V3+离子。
北师大无机化学四版习题答案16章S区金属

第16章 S 区金属(碱金属以碱土金属)16.1 简要说明工业上生产金属钠、烧碱和纯碱的基本原理。
答:①工业制金属钠:由于金属钠非常活泼,通常采用电解其熔融盐(如NaCl )的方法来制取。
以NaCl 和CaCl 2的混合盐为原料,对混合盐进行电解。
加入CaCl 2的目的,既降低电解质的熔点,防止了钠挥发,又可减小金属钠的分散性,因熔融混合物密度比钠大,钠浮在液面上。
电解时电极反式:阳极:2Cl - Cl 2+2e -阴极:2Na ++2e - 2Na 总反应: 2NaCl 2Na+Cl 2↑ 此方法得到的钠约含1%的钙 ②工业制烧碱工业上常用电解NaCl 饱和溶液来制备NaOH ,电解槽以石墨或金属钛做阳极,铁网作阴极,并用石棉网膜把阳极区和阴极区隔开,电解时,阳极反应:2Cl - Cl 2↑+2e -阴极反应:2H 2O+2e - H 2↑+2OH -总的反应:2Cl -+2H 2O 2OH -+H 2↑+Cl 2↑Na +通过石棉网隔膜渗透到阴极区,得到35%的NaOH 溶液。
③工业制纯碱先把氨气通入饱和食盐水,再通入足量二氧化碳,反应生成碳酸氢铵 CO 2+NH 3+H 2O NH 4HCO 3然后使碳酸氢铵同食盐溶液发生复分解反应,析出难溶于氯化铵溶液的碳酸氢钠晶体。
NH 4HCO 3+NaCl NaHCO 3↓+NH 4Cl 最后处理析出的NaHCO 3并煅烧得Na 2CO 3,2NaHCO 3(固) Na 2CO 3+CO 2↑+H 2O16.2 以重晶石为原料,如何制备BaCl 2、BaCO 3、BaO 和BaO 2 ?写出有关的化学反应方程式。
答: 以BaSO 4为原料,用高温还原法,先制成中间产物BaS:BaSO 4+4C BaS+4CO ↑BaS 可溶,可用于制BaCl 2和BaCO 3BaS + 2HCl BaCl 2+H 2S ↑ BaS+CO 2+H 2O BaCO 3↓+H 2S ↑BaCO 3 BaO+CO 2↑ 2BaO+O 2 2BaO 2733~793K16.3 写出下列反应的方程式:(1)金属钠与H 2O 、Na 2O 2、NH 3、C 2H 5OH 、TiCl 4、KCl 、MgO 、NaNO 2的反应;(2)Na 2O 2与H 2O 、NaCrO 2、CO 2、Cr 2O 3、H 2SO 4(稀)的反应。
张祖德《无机化学习题》及答案第十六章
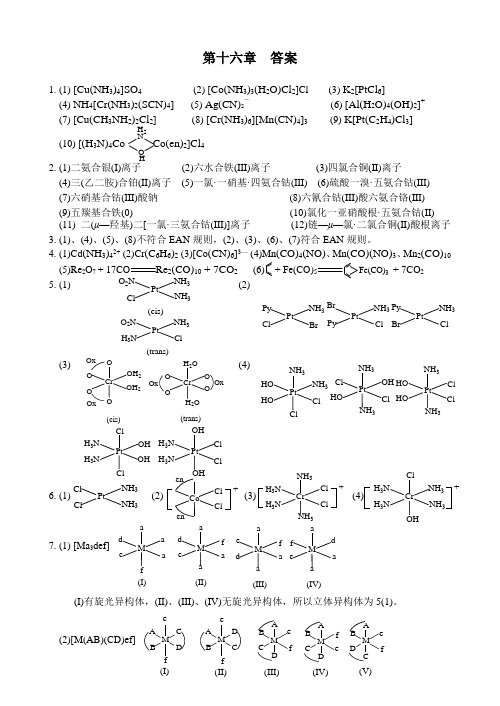
第十六章 答案1. (1) [Cu(NH 3)4]SO 4 (2) [Co(NH 3)3(H 2O)Cl 2]Cl (3) K 2[PtCl 6](4) NH 4[Cr(NH 3)2(SCN)4] (5) Ag(CN)2- (6) [Al(H 2O)4(OH)2]+(7) [Cu(CH 3NH 2)2Cl 2] (8) [Cr(NH 3)6][Mn(CN)4]3 (9) K[Pt(C 2H 4)Cl 3] (10) [(H 3N)4Co Co(en)2]Cl 42. (1)二氨合银(I)离子 (2)六水合铁(III)离子 (3)四氯合铜(II)离子 (4)三(乙二胺)合铂(II)离子 (5)一氯·一硝基·四氨合钴(III) (6)硫酸一溴·五氨合钴(III) (7)六硝基合钴(III)酸钠 (8)六氰合钴(III)酸六氨合铬(III) (9)五羰基合铁(0) (10)氯化一亚硝酸根·五氨合钴(II) (11) 二(μ—羟基)二[一氯·三氨合钴(III)]离子 (12)链—μ—氯·二氯合铜(II)酸根离子3. (1)、(4)、(5)、(8)不符合EAN 规则,(2)、(3)、(6)、(7)符合EAN 规则。
4. (1)Cd (NH 3)42+ (2)Cr (C 6H 6)2 (3)[Co (CN)6]3— (4)Mn (CO)4(NO)、Mn (CO)(NO)3、Mn 2(CO)10 (5)Re 2O 7 + 17CO 2(CO)10 + 7CO 2 (6) + Fe(CO)5 + 7CO 25. (1)Pt3NH 3O 2N Cl (cis)Pt NH 3H 3NO 2N Cl(trans)(2) PtNH 3ClPy BrPtNH 3Cl PyBr PtNH 3Cl Py Br(3)Cr 2OH 2O O O Ox Ox(cis)Cr OH 2OO O (trans)H 2O O OxOx(4)Pt NH 3NH 3HO ClHOClPt NH 3NH 3Cl HOCl Pt NH 3NH 3ClHOCl HOPt H 3N OH ClH 3NOHPt H 3N OH Cl ClH 3NOH6. (1) (2) (3) (4)7. (1) [Ma 3def](I)有旋光异构体,(II)、(III)、(IV)无旋光异构体,所以立体异构体为5(1)。
高等无机化学试题及答案
高等无机化学试题及答案一、选择题(每题2分,共20分)1. 下列元素中,属于过渡元素的是:A. 碳B. 氧C. 铁D. 氦答案:C2. 金属键的强度主要取决于:A. 原子半径B. 电荷数C. 电子云的重叠程度D. 电子云的密度答案:C3. 根据鲍林规则,配位数为6的八面体配合物中,键角为:A. 90°B. 120°C. 180°D. 109.5°答案:B4. 下列化合物中,属于共价化合物的是:A. NaClB. HClC. MgOD. FeS答案:B5. 根据路易斯酸碱理论,下列物质中属于酸的是:A. H2OB. NH3C. NaOHD. HCl答案:D6. 金属晶体中,原子排列方式为:A. 立方体心B. 六方密排C. 面心立方D. 体心立方答案:C7. 晶体场理论中,八面体配合物的分裂能Δo与配体的场强有关,下列配体中场强最大的是:A. I-B. OH-C. H2OD. Cl-答案:A8. 氧族元素中,最活泼的元素是:A. OB. SC. SeD. Te答案:A9. 根据周期表,下列元素中属于第ⅢA族的是:A. AlB. ScC. GaD. In答案:C10. 下列化合物中,属于离子化合物的是:A. CO2B. NaClC. C2H6D. SO2答案:B二、填空题(每题2分,共20分)1. 元素周期表中,第VIII族元素包括______、______、______。
答案:铁、钴、镍2. 根据鲍林规则,四面体配合物的键角为______。
答案:109.5°3. 金属离子的配位数通常为______、______、______。
答案:4、6、84. 金属键形成的条件是______和______。
答案:自由电子、正电荷中心5. 氧族元素中,最不活泼的元素是______。
答案:碲(Te)6. 晶体场理论中,八面体配合物的分裂能Δo与配体的场强成正比,场强越大,Δo______。
高中《无机化学》第十六至十八章测试题及答案
高中《无机化学》第十六至十八章测试题及答案(d区元素、f区元素)(总9页)-本页仅作为预览文档封面,使用时请删除本页-高中《无机化学》第十六至十八章测试题及答案(d区元素、f区元素)第十六章 d区元素(一)一、填空题1、在所有过渡元素中,熔点最高的金属是 W ,熔点最低的是 Hg ,硬度最大的是 Cr ,密度最大的是 Os ,导电性最好的是 Ag ,耐海水腐蚀的是Ti 。
2、分别写出下列离子的颜色:[Fe(H2O)6]2+淡绿色,FeO42-紫色,[FeCl4]-黄色,[Fe(H2O)6]3+淡紫色,[Ti(H2O)6]3+紫色,VO43-淡黄色,[Co(H2O)6]2+粉红色,[Mn(H2O)6]2+粉红色,[Ni(H2O)6]2+绿色。
3、CrCl3溶液与氨水反应生成灰绿色的 Cr(OH)3沉淀该产物与NaOH溶液反应生成亮绿色的 Cr(OH)4-。
4、锰在自然界主要以软锰矿的形式存在,在强氧化剂(如KClO3)作用下碱熔时只能得到 +6 价锰的化合物,而得不到高锰酸盐,这是因为后者在碱中和受热均分解。
5、K2Cr2O7(s)与浓H2SO4反应生成的氧化物为 CrO3,它为橙红色,遇酒精立即着火,生成铬的一种绿色氧化物,其化学式为 Cr2O3。
KMnO4(s)与浓H2SO4作用生成的氧化物为 Mn2O7;MnO2与浓H2SO4反应生成的气体是O2。
6、高锰酸钾是强氧化剂,它在酸性溶液中与H2O2反应的主要产物是 O2和 Mn2+,它在中性或弱碱性溶液中与Na2SO3反应的主要产物为 SO42-和MnO2。
7、在强碱性条件下,KMnO4溶液与MnO2反应生成绿色的 K2MnO4;在该产物中加入硫酸后生成紫色的 KMnO4和褐色的 MnO2。
8、三氯化铁蒸气中含有的聚合分子化学式为 Fe2Cl6,其结构与金属 Al 的氯化物相似。
FeCl3能溶于有机溶剂。
9、既可用于鉴定Fe3+,又可用于鉴定Co2+的试剂是 KCNS ,当Fe3+存在时,能干扰Co2+的鉴定,可加入 NaF 因生成 FeF63-而将Fe3+掩蔽起来,消除对Co2+鉴定的干扰。
大学无机化学试题集及答案
大学无机化学试题集及答案第一章气体、液体和溶液的性质1. 敞口烧瓶在7℃所盛的气体,必须加热到什么温度,才能使1/3气体逸出烧瓶?2. 已知一气筒在27℃,30.0atm时,含480g的氧气。
若此筒被加热到100℃,然后启开阀门(温度保持在100℃),一直到气体压力降到1.00atm时,共放出多少克氧气?3. 在30℃时,把8.0gCO2、6.0gO2和未知量的N2放入10dm3的容器中,总压力达800 mmHg。
试求:(1) 容器中气体的总摩尔数为多少?(2) 每种气体的摩尔分数为多少?(3) 每种气体的分压为多少?(4) 容器中氮气为多少克?4. CO和CO2的混合密度为1.82g⋅dm-3(在STP下)。
问CO的重量百分数为多少?5. 已知某混合气体组成为:20份氦气,20份氮气,50份一氧化氮,50份二氧化氮。
问:在0℃,760mmHg下200dm3此混合气体中,氮气为多少克?6. S2F10的沸点为29℃,问:在此温度和1atm下,该气体的密度为多少?7. 体积为8.2dm3的长颈瓶中,含有4.0g氢气,0.50mol氧气和分压为2atm 的氩气。
这时的温度为127℃。
问:(1) 此长颈瓶中混合气体的混合密度为多少?(2) 此长颈瓶内的总压多大?(3) 氢的摩尔分数为多少?(4) 假设在长颈瓶中点火花,使之发生如下反应,直到反应完全:2H2(g) + O2(g) =2H2O(g)当温度仍然保持在127℃时,此长颈瓶中的总压又为多大?8. 在通常的条件下,二氧化氮实际上是二氧化氮和四氧化二氮的两种混合气体。
在45℃,总压为1atm时,混合气体的密度为2.56g⋅dm-3。
计算:(1) 这两种气体的分压。
(2) 这两种气体的重量百分比。
9. 在1.00atm和100℃时,混合300cm3H2和100 cm3O2,并使之反应。
反应后温度和压力回到原来的状态。
问此时混合气体的体积为多少毫升?若反应完成后把温度降低到27℃,压力仍为1.00atm,则混合气体的体积为多少毫升?(已知27℃时水的饱和蒸汽压为26.7mmHg)10. 当0.75mol的“A4”固体与2mol的气态O2在一密闭的容器中加热,若反应物完全消耗仅能生成一种化合物,已知当温度降回到初温时,容器内所施的压力等于原来的一半,从这些数据,你对反应生成物如何下结论?11. 有两个容器A和B,各装有氧气和氮气。
无机化学(下)参考答案(重要).docx
《无机化学》下册(第三版)习题参考答案武汉大学、吉林大学等校编曹锡章、宋天佑、王杏乔修订高等教育出版社屮国石油大学(华东)化学化工学院第十二章卤族元素1. 单质的活泼性次序为:F 2»Cl 2>Br 2>I 2从F 2到Cl 2活泼性突变,其原因归结为F 原了和厂离了的半径特别小。
F Cl Br I 厂 cr Br _ 厂r/pm 64 99114 133 136 181 195 216 (1)由于F 的原了半径非常小,F —F 原了间的斥力和非键电了对的斥力较大,使 F2的解离能(155KJ/mol)远小于CH 的解离能(240KJ/mol)。
(2)山于F 离了半径特别小,因此在形成化合物时,氟化物的离了键更强,键能或 晶格能更大。
(3) 由于F 离子半径特别小,F"的水合放热比其他卤素离子多。
2. 氧化性顺序为:F2>C12>Bf2>l2 ;还原性顺序为:I->BF>C 「>F. 尽管在同族中氯的电子亲合能最高,但最强的氧化剂却是氛卤索单质绘很强的氧化剂,随着原子半径的增大,卤素的氧化能力依次减弱。
尽管在同 族屮氯的电子亲合能最高,但最强的氧化剂却是氟。
一种氧化剂在常温下,在水溶液屮 氧化能力的强弱,可用具标准电极电势值來表示,0&值的大小和下列过程有关(见课本 P524)3. (1)2C12+Ti =TiCl 4 加热, 干燥 (2)3C12+2A1 =2A1C13 加热, 干燥 (3)C12+H 2=2HC1 点燃 (4)3Cb+2P (过量)=2PCb 干燥 5Cb(过量)+2P=2PC15干燥 (5) C12+H 2O=HC1O +HC1(6) C12+2K2C03+H2OKC1+KC10+2KHC034. (1) CC14为非极性溶剂,【2溶在CC14中后仍为分子状态,显示出12单质在蒸气时的紫颜 色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十七章卤素总体目标:1.掌握卤素单质、氢化物、含氧酸及其盐的结构、性质、制备和用途2.掌握卤素及其化合无各氧化态间的关系各节目标:第一节卤素单质1.了解卤素单质的物理性质,如:颜色、状态、熔点、沸点、溶解性等等2.掌握卤素单质的化学性质,包括与水作用、与金属的反应、与非金属反应、与氢气的反应及其递变规律;了解卤素单质的用途3.运用元素电势图来判断卤素及其化合物的氧化—还原性第二节卤化氢和氢卤酸掌握卤化氢的酸性、还原性、热稳定性及其变化规律;卤化氢的制备方法第三节卤化物、卤素互化物和拟卤素了解卤化物的分类;金属卤化物、卤素互化物和拟卤素的主要性质和制备第四节卤素的含氧化合物了解卤素含氧酸及其盐酸性、氧化性强度及变化规律Ⅱ习题一选择题1.某元素的电势图为:E A?M4+-0.15M2+-0.14M,下列说法中正确的是()A. M2+不能发生歧化反应B. M2+是强氧化剂C. M是强还原剂D. M4+与M 反应生成M2+2.碘的电子结构式是[Kr]5S25P5 ,指出下列哪种化学式的化合物不能存在()A.IF5B.IF7C.Na3H2IO6D.HIF3.下列关于(CN)2 的反应中,不象卤素单质反应的是()A.(CN)2 +H2O==HCN+HCNOB.可在空气中燃烧C.与银、汞、铅反应得难溶盐D.与卤素反应生成CNCl、CNBr等4.下列叙述正确的是()A.无论在酸性还是在碱性介质中,卤素电对X2|Xˉ不变B.由于卤素阴离子(Xˉ)具有还原性,所以能用电解卤化物水溶液的方法制备卤素单质C. 卤素阴离子可以作为路易斯碱而构成配合物的内界D.氟的电负性最大,所以F2分子中的共价键是所有共价键中最强的5.在含Iˉ的溶液中通入Cl2,产物可能是()A.I2和ClˉB.ClO3和ClˉC.ICl2ˉD.以上产物均有可能6.将氟气通入水中,生成的产物可能有()A.O2、O3和HFB.OF2和HFC.H2O2和HFD.以上诸种7.冷的氯水中微粒的种类有()A.5种B.6种C.7种D.8种8.卤素互化物一般由较重卤素和较轻卤素构成,在卤素互化物分子中,较轻卤素原子个数一般为()A.1B.2C.1、3、5、7(奇数)D.2、4、6(偶数)9.下列物质受热产生Cl2 的是()A.Cl3O5B.ClO2C.Cl2O2D.Cl2O 10.关于SnCl2和SnCl4的熔沸点高低,正确的是()A.SnCl2高于SnCl4B. SnCl2低于SnCl4C.两者差不多一样高D.外界条件不同,熔、沸点高低不同11.制备F2实际所采用的方法是()A.电解HFB.电解CaF2C.电解KHF2D.电解NH4F 12.实验室制备Cl2最常用的方法是()A.KMnO4与浓盐酸共热B.MnO2与稀盐酸反应C.MnO2与浓盐酸共热D. KMnO4与稀盐酸反应13.实验室制得的氯气含有HCl和水蒸气,欲通过二个洗气瓶净化,下列洗气瓶中试剂选择及顺序正确的是()A.NaOH,浓H2SO4B.CaCl2,浓H2SO4C.H2O,浓H2SO4D. 浓H2SO4,H2O 14.下列各对试剂混合后能产生氯气的是()A.NaCl与浓H2SO4B.NaCl与MnO2C.NaCl与浓HNO3D.KMnO4与浓HCl 15.实验室中制取少量HBr所采用的方法是()A.红磷与Br2混合后滴加H2OB.KBr固体与与浓H2SO4作用C. 红磷与H2O混合后滴加Br2D. Br2在水中歧化反应16.欲与KBr固体制备HBr气体,应选择的酸是()A. H2SO4B.HAcC. HNO3D. H3PO417.氢氟酸最好贮存在()(吉林大学《无机化学例题与习题》) A.塑料瓶中 B.无色玻璃瓶中 C.金属容器中 D.棕色玻璃瓶中18.卤素单质中,与水不发生水解反应的是()A.F2B.Cl2C.Br2D.I219.在热碱溶液中,Cl2的歧化产物为()(吉林大学《无机化学例题与习题》) A.Cl-和ClO- B. Cl-和ClO2- C. Cl-和ClO3- D. Cl-和ClO4-20.卤素的氧化物中,热稳定性最高的是()(吉林大学《无机化学例题与习题》)A. ClO2B.OF2C.I2O5D.I2O721.下列各对物质在酸性溶液中能共存的是()(吉林大学《无机化学例题与习题》) A.FeCl3与KI B.FeCl2与Br2C.FeCl3与KBrD.KI与KIO322.下列有关卤素的论述不正确的是 ( ) (吉林大学《无机化学例题与习题》) A.溴可由氯作氧化剂制得B.卤素单质都可由电解熔融卤化物得到C.I2是最强的还原剂D.F2是最强的氧化剂二填空题1.碘易溶于溶剂中,也易溶于盐溶液中,形成。
2.将氯水加入溴化钾和碘化钾的混合溶液,首先析出色的,然后析出色的。
3.氢卤酸在一定压力下能组成,将氢卤酸蒸馏会达到不变。
4.歧化反应是指,卤素歧化反应类型有,判断歧化反应的热力学依据是。
5.金属卤化物与生成化合物,称为,在IF3、IF5中的I 的成键轨道和分子的几何构型分别是。
6.F,Cl,Br三元素中电子亲合能最大的是,单质的解离能最小的是。
7.键能F2 Cl2,活泼性F2 Cl2。
8.卤素单质的颜色为:F2,Cl2,Br2,I2。
(吉林大学《无机化学例题与习题》)9. I2溶于KI溶液中的颜色可能为,或,原因是。
10.导致氢氟酸的酸性与其他氢卤酸明显不同的因素主要是小,而特别大。
(吉林大学《无机化学例题与习题》) 三简答题1.已知砹的元素电势图E A AtO3 ˉ1.5 HAtO1.0 1/2At20.3 At-判断在酸性介质中,用Cr2O72-离子氧化Atˉ最可能产物。
2.Mn的电势图在极性溶液中为:MnO4ˉ0.564MnO42-2.26MnO20.95Mn2O3ˉ1.51Mn2+-1.18Mn ①写出可能发生歧化反应的方程式,并配平。
②写出MnO4ˉ作为氧化剂与Na2SO4在不同PH值下的反应。
3.为什么不能用盐酸与铅反应制取AlCl3?4.熔融的AlBr3不导电,而AlBr3的水溶液是电的良导体。
5. SnCl4在潮湿的空气中发烟(写出反应式)。
6. F的电子亲合能比Cl小,但F2却比Cl2活泼,请解释原因。
7.四支试管分别盛有HCl,HBr,HI,H2SO4溶液。
如何鉴别?吉大8.漂白粉长期暴露于空气中为什么会失效?吉大9.为什么NH4F一般盛在塑料瓶中?10.说明I2易溶于CCl4,KI溶液的原因。
四计算题1.把氯水滴加到Br-,I-混合液中的现象是先生成I2,I2被氧化成HIO3,最后生成Br2。
(1)写出有关的反应方程式。
(2)有人说:“电动势大的反应一定先发生”。
你认为如何?2.将0.100molI2溶解在1.00L0.100mol/LKI溶液中而得到I3-溶液。
I3-生成反应的Kc值为0.752,求I3-溶液中I2的浓度。
3. 根据电势图计算在298K时,Br2在碱性水溶液中歧化为Brˉ和BrO3ˉ的反应平衡常数。
4.(1)向含Brˉ、Clˉ的混合溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中[Brˉ]/[Clˉ]的比值是多少?(2)向含Iˉ、Clˉ的混合溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中[Iˉ]/[Clˉ] 的比值是多少?5.分离Clˉ,Brˉ离子的方法是:加足量的AgNO3溶液使它们沉淀,经过过滤、洗涤后,往沉淀上加足量的2mol/dm3NH3?H2O,AgCl溶解而AgBr微溶。
如果开始的Clˉ浓度为Brˉ的500倍,问能否用这个方法分离Clˉ和Brˉ?参考答案一选择题1. B2. D3. B4. C5. D6. D7. C8. C9. D 10.A 11.C 12.C 13.C 14.D 15.C 16.D 17.A 18.A 19.C20.C 21.C 22.C 二填空题1.有机,Iˉ,配位离子I3ˉ2.红棕,Br2,紫黑,I23.恒沸溶液,溶液的组成和沸点4.自身氧化还原反应,两种,E右﹥E左5.卤素单质,多卤化物,平面三角形、三角双锥6. Cl,F27.<,>8.浅黄,黄绿,棕红,紫黑 9.黄,红,棕,I2的浓度不同10. F原子半径,H—F键的解离能三简答题1.提示:最可能的产物为AtO3ˉ,因为E Cr2O72-|Cr3+ =1.33,而E?AtO3 ˉ|=1.19﹥E?HAtO |Atˉ=0.65﹥E?At2 |Atˉ=0.3,而1.19﹤1.33。
Atˉ2.①发生歧化反应必须满足E氧化型﹥E还原型,2H+ + Mn2O3ˉ== Mn2+ +MnO2↓+H2O 4H+ +3MnO42 - ==MnO2↓+2MnO4 - +2H2O②MnO4 -在酸性介质中还原为Mn2+ ,在中性中为MnO2 ,在强碱中为MnO42 - 。
3.由AlCl3的水解及其Al(OH)3 的不稳定性,∴最终得到Al2O3 。
4.提示:a.从Al3+极性能力及Brˉ的特点进行考虑; b.从AlBr3在水溶液中电离。
5. 提示:SnCl4水解。
6.答:F的半径特殊的小,因而其F-电子密度较大,生成氟离子时,放出的能量较少。
F2却比Cl2活泼,原因是F的半径小,氟原子非键电子对之间斥力较大而使F2的解离能比Cl2小,氟化物的晶格能比氯大,能量更低。
其次,在水溶液中,F-的水合热比Cl-大得多。
7.向四支试管中分别加入少许CCl4和KMnO4,CCl4层变黄或橙色的是HBr,CCl4层变紫的是HI,CCl4层不变色,但KMnO4褪色或颜色变浅的是HCl,无明显变化的是H2SO4。
本题也可由生成沉淀的实验加以鉴别。
8.漂白粉中的有效成分是Ca(ClO)2,在空气中易吸收CO2生成HClO,Ca(ClO)2+ CO2+H2O==CaCO3+2HClO, HClO不稳定,易分解放出O2:2HClO==HCl+O2,此外,生成的HCl与Ca(ClO)2作用产生Cl2放出也消耗漂白粉的有效成分。
HCl+HClO===H2O+Cl2↑漂白粉中往往含有CaCl2杂质,吸收CO2的Ca(ClO)2也与CaCl2作用:Ca(ClO)2+2CO2+CaCl2===2 CaCO3+2Cl2。
9. NH4F水解生成NH3和HF:NH4F+ H2O===NH3 ?H2O+HF,HF和SiO2反应,使玻璃容器被腐蚀:SiO2 +4HF===SiF4↑+ 2H2O 因而NH4F只能储存在塑料瓶中。
10.答:I2是非极性分子,易溶于非极性溶剂CCl4(相似相溶)。
I2和KI作用生成多卤离子I3-。
四计算题1.解:(1)Cl2+2I-===2Cl-+I2 E0(电池)= E0(Cl2/Cl-)-E0(I2/I-)=1.36-0.54=0.82V 5Cl2+I2+6H2O=2HIO3+10HClE0(电池)= E0(Cl2/Cl-)-E0(HIO3/I2)=1.36-1.2=0.16V Cl2+2Br-=2Cl-+Br2E0(电池)= E0(Cl2/Cl-)-E0(Br2/Br-)=1.36-1.08=0.28V(2)反应发生的先后与反应速率有关。
