5-甲基-4-氧代-3,4-二氢噻吩并[2,3-d ]嘧啶-6-甲酸乙酯衍生物的合成
杂环化合物命名

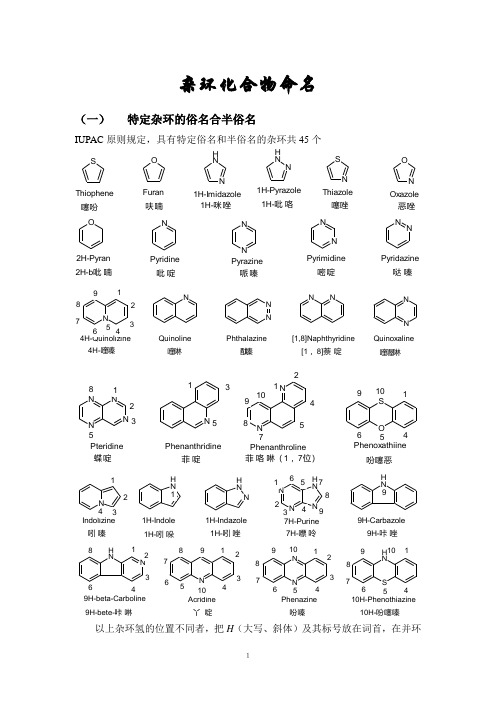
杂环化合物命名(一)特定杂环的俗名合半俗名IUPAC原则规定,具有特定俗名和半俗名的杂环共45个S O NHN NHNSNONNNNNNNNONNNN NNNNNNNNHN以上杂环氢的位置不同者,把H(大写、斜体)及其标号放在词首,在并环上者,注明边号(用a 、b 、c 表示)。
ONN当杂原子在环上的位置不同时,可视为异构体。
NHS NONN几点说明(1) 杂环的写法可以不同,但是位号不变。
(2) 单杂环的编号从杂原子开始,并使其他杂原子或指示氢位号尽可能小;杂原子不同时,要使优先的杂原子号小,常见的位O ,S ,-NH-,-N=顺序;只含一个杂原子的单杂环,也可对杂原子旁的碳用αβγ进行编号。
(3) 稠杂环有其固定的编号顺序,通常从一端开始,依次编号一周(公用碳不编号,如需编号时,用前一位加a,b,c 表示),并尽可能使杂原子,特别使优先的杂原子号小;也有的杂环按相应的环烃编号,此时杂原子编号最大(见咔唑,丫啶),嘌呤使个特例,不仅公用碳编号,且编号顺序也很特别。
(4) 含两个以上杂原子的五元单杂环,其中至少含一个氮原子的通称“某唑”;含两个以上杂原子(至少一个位氮)的六元单杂环多称为“某嗪”;含氧的称“恶”;含硫的称“噻”。
例如:ON NSNNNNNi a z o l ei a z o l ea zi n e(5) 杂环已经含有最大数目的非聚集双键之外,还含有的饱和氢原子(两个二价元素中间的饱和氢不算)称做“指示氢”或“额外氢”或“标氢”。
指示氢不同的异构体,以其位号加“H ”(斜体大写)作词首来表示。
(6) 若杂环尚未含有最大数目的非聚集双键,这样的饱和氢原子为外加氢。
命名时要指明加氢的位置和数目,全部饱和可以省略位置。
(7) 含活泼氢的杂环及其衍生物,可能存在互变异构体,结构不同,名称也异;命名时尚需标明两种可能的位号 。
(8) 杂环母环的名称确定之后。
就可参照芳香化合物的命名方法,将环上取代基位置,数目及名称,以词首或词尾的形式加在环名的前后,有时杂环也可以作为取代基命名。
新型配体双(4-羟基-7-甲基-6,7-二氢噻吩[2,3-d]嘧啶-2-甲基)甲基胺的合成
![新型配体双(4-羟基-7-甲基-6,7-二氢噻吩[2,3-d]嘧啶-2-甲基)甲基胺的合成](https://img.taocdn.com/s3/m/0488ce074a7302768e99398c.png)
回流
OH OH OH
1 实验 部 分
1 1 2一 甲基一 羟 基一7一 . 氯 4一 甲基一67一 氢 噻 吩 [ , , 二 23一d 嘧 啶 的 合成 ] 参 照 文 献 [O 合 成 . 1]
1 2 双 ( 羟 基一 甲基一6 7一 氢 噻吩 [ , . 4一 7一 , 二 2 3一d 嘧 啶一 甲基 ) ] 2一 甲基 胺 的 合成
( DC3 : . 6 . 8 d 6 , . 6 S3 , . 0 C l 1 3 ~1 3 ( ,H) 2 3 ( ,H) 2 9 ~2 9 ( 2 , . 3 ) . 9 m,H) 3 4 ~3 5 ( 4 , . 6 m, H) 3 6 ( ,H) 2 6 ( , H) .9 s4 ,1 . 7 s 2 ;¨C NMR( DC3 : 7 3 7 3 2 5 3 6 6 . ,1 4 1 - C 1 1 . ,3 . ,4 . ,4 . , 0 1 2 . , )
取 10g2一 甲基一4一 基 一7一 . 氯 羟 甲基 一6 7一 氢 噻 吩 [ , , 二 2 3一d 嘧 啶 置 于 烧 瓶 中 , 入 ] 加
DMF3 加热回流 2 . 0mL, Oh 冷却后倒入水 中用 乙酸 乙酯萃取 , 用无水硫 酸钠干燥 , 滤 , 过 减
压蒸 去 乙酸 乙酯 , 黄 色 固体 , 率 7 % . 点 为 2 6 3 得 产 O 熔 3 ~2 8℃ . [ I +1 :9 ,H— MS 1 T ]3 0 NMR
比较 图 l中 的两 张谱 图可 以看 出 , 产 物 NMR谱 图 中最 明 显 的 变 化 为 原 料 中 4 5 在 H— . 处 C 21 H C 的特 征 峰 消 失 , 在 2 4处 增 加 了 N— C 而 . H3特 征 峰 . 物 其 他 氢 的归 属 见 图 1 另 产 . 外 结 合产 物 的¨ — C NMR 和 MS 见 实 验 部 分 )最 终 确 定 产 物 为 双 ( 羟基 一7 甲基 一67一 ( , 4一 一 , 二 氢 噻 吩 [ , d 嘧 啶一 甲基 ) 2 3一 ] 2一 甲基 胺 . 成 双 ( 羟 基 一7一 生 4一 甲基 一6 7一 氢 噻 吩 [ , , 二 2 3一d ] 嘧 啶一2 甲基 ) 一 甲基 胺 的反 应 机 理 可 能如 下 :
吡啶并[3′,2′:4,5]噻吩并[3,2-d]嘧啶类衍生物的研究进展
![吡啶并[3′,2′:4,5]噻吩并[3,2-d]嘧啶类衍生物的研究进展](https://img.taocdn.com/s3/m/ac5c3bb8a1116c175f0e7cd184254b35eefd1aea.png)
物 11 具有潜在的研究价值。
3 嘧啶环上 3 位取代吡啶并[3′,2′:4,5] 噻吩
并[3,2 -d] 嘧啶衍生物
2001 年 Ho 等 [10] 探索了 3 位取代的合成路线, 保留吡啶环
第 49 卷第 13 期
并嘧啶衍生物的合成, 并对吉姆沙氏液染小白鼠的肥大细胞的
组氨释放抑制剂和诱导剂进行综合评估分析。 化合物 13a 在所
有被测量条件下的半致死浓度为 9 ~ 25 μmol 范围。 对比 13b 在
免疫和化学激发条件下具更较强的组胺释放剂诱导作用; 化合
物 13c 作为细胞毒素作用于体外肿瘤细胞测试, 具有较好的非
性( IC50 = 3 nM) , 然而作用促代谢型谷氨酸受体 mGluR5 抑制
活性( IC50 >100000 nM) , 在各种较活泼的生物疼痛模型体内具
有全面的功效, 目前该化合物已在临床中进行试验。
2005 年 El-Essawy 等 [13] 将脂肪醇类烃引入到嘧啶环 3 位,
吡啶环上保留两个甲基取代, 与酰氯反应后得到一系列目标化
(1 Guiyang Grain and Oil Quality Testing Center, Guizhou Guiyang 550002;
2 Center for Research and Development of Fine Chemicals, Guizhou University, Guizhou Guiyang 550025, China)
activities and lower biological toxicity, and have attracted the attention of scientific researchers. The derivatives were
四氢苯并[4’,5’]噻吩并[3’,2’:5,6]吡啶并[4,3-d]嘧啶-4(3H)-酮的合成、晶体结构及杀菌活性
![四氢苯并[4’,5’]噻吩并[3’,2’:5,6]吡啶并[4,3-d]嘧啶-4(3H)-酮的合成、晶体结构及杀菌活性](https://img.taocdn.com/s3/m/360abea4dd3383c4bb4cd276.png)
E—mail:hel208@ public.wh.hb.ca Received February 20,2006;revised July 27,2006;accepted September 21,2006.
国家 重点 基础 研究 发展 规划 973计划 (No.2003CB1144OO)及 国家 自然科 学基 金(No.20372023)资助项 目
398
有 机 化 学
维普资讯
、,0l_27.2007
未见诸 文献报 道、具有新颖 结构 的 2.取代苯氧基.3.苯 基 .5.甲基.僻 8,9,10,11.四氢苯 并 [4’,5’】噻酚 并[3’,2’:5,6】 吡 啶并[4,3. 嘧啶.4(3/-/).酮(6a ̄6h)的合成,并对 其杀 菌活性进行了初步筛选.合成路线如 Scheme 1所示.
(Key Laboratory ofPesticide& Chemical Biology,Ministry ofEducation,Institute ofOrganic Synthesis, Central ChinaNormal University,Wuhan 430079)
Abstract A series of new tetrahydrobenzo[4’,5’]thieno[3’,2’:5,6]pyrido[4,3-d]pyrimidin-4(3H)-one deriva-
较苛刻 、反应 时间长 、步骤 多且收率较低. 近年来,文 献报道 由膦亚胺 的氮杂 Wittig反应合成
含氮 杂环 的方 法得到 了广 泛 的关注和应用 【l 】.最近 , 我们 课题 组基于 此方法 合成 了一 系列新 型含氮 杂环分 子,如吡 唑并嘧啶,噻酚 并嘧啶 以及吡 啶并嘧啶,并对 这些化合物 的生物 活性进行 了相关研 究工 作【l 一 ,发现 这类 化合物尤其是吡 啶并嘧 啶具有 很好的生物 活性.基 于寻 找具有 新颖 结构和 较好 活性 的农药 小分子方 面 的 兴趣 ,我 们继续开展 了这一方面 的研 究.这 里报 道一类
配伍选择题

配伍选择题(1-3题共用备选答案)A.成酰胺修饰 B.成环修饰 C.开环修饰 D.成酯修饰 E.成酯或酰胺1.对药物氨基的修饰通常用2.对药物羧基的修饰通常用3.对药物羟基的修饰通常用正确答案:1.A,2.E,3.D(4-6题共用备选答案)A.易与受体蛋白质的羧基结合 B.可与生物大分子形成氢键,增强与受体的结合力 C.明显增加药物的亲脂性,并降低解离度 D.影响药物电荷分布及作用时间E.取代在脂肪链上,常使毒性下降4.药物分子中引入羟基5.药物分子中引入酰胺基6.药物分子中引入卤素正确答案:4.E,5.B,6.D(7-10题共用备选答案)A.结构特异性药物 B.结构非特异性药物 C.lgP D.药效构象 E.pH 7.评价药物亲脂性8.药效主要受药物理化学性质影响9.化学结构改变直接影响其药效10.药物与受体相互作用时,与受体互补的药物构象正确答案:7.C,8.B,9.A,10.D(11-14题共用备选答案)A.O一脱甲基化 B.¦Ψ-1的氧化 C.N-脱异丙基化D.苯环的羟基化 E.生成酰氯然后与蛋白质发生酰化11.普萘洛尔的代谢为12.氯霉素的代谢为13.苯妥英钠的代谢为14.可待因的代谢为正确答案:11.C,12.E,13.D,14.A 解题思路:考查药物的代谢方式。
(15-18题共用备选答案)A.结构特异性药物 B.结构非特异性药物 C.药效构象 D.lgP E.pK 15.评价药物亲脂性的是16.药效主要受物理化学性质影响的是17.药物与受体相互作用时,与受体互补的药效构象是18.化学结构改变直接影响其药效的是正确答案:15.D,16.B,17.C,18.A 解题思路:考查药物的化学结构与药效的关系。
(19-20题共用备选答案)A.药效构象 B.氢键 C.偶极一偶极相互作用 D.手性药物 E.范德华引力19.含有手性中心的药物20.药物与受体相互作用时的构象正确答案:19.D,20.A(21-23题共用备选答案)A.前药 B.抗代谢药 C.软药 D.生物前药 E.硬药21.本身无药理活性,经体内代谢而转化为活性药物的是22.具有生物活性,经代谢后失活的药物是23.不发生代谢或化学转化的药物是正确答案:21.A,22.C,23.E 解题思路:考查前药、软药和硬药的基本概念。
杂环化合物命名
杂环化合物命名(一)特定杂环的俗名合半俗名IUPAC原则规定,具有特定俗名和半俗名的杂环共45个S O NHN NHNSNONNNNNNNNONNNN NNNNNNNNHN以上杂环氢的位置不同者,把H(大写、斜体)及其标号放在词首,在并环上者,注明边号(用a 、b 、c 表示)。
ONN当杂原子在环上的位置不同时,可视为异构体。
NHS NONN几点说明(1) 杂环的写法可以不同,但是位号不变。
(2) 单杂环的编号从杂原子开始,并使其他杂原子或指示氢位号尽可能小;杂原子不同时,要使优先的杂原子号小,常见的位O ,S ,-NH-,-N=顺序;只含一个杂原子的单杂环,也可对杂原子旁的碳用αβγ进行编号。
(3) 稠杂环有其固定的编号顺序,通常从一端开始,依次编号一周(公用碳不编号,如需编号时,用前一位加a,b,c 表示),并尽可能使杂原子,特别使优先的杂原子号小;也有的杂环按相应的环烃编号,此时杂原子编号最大(见咔唑,丫啶),嘌呤使个特例,不仅公用碳编号,且编号顺序也很特别。
(4) 含两个以上杂原子的五元单杂环,其中至少含一个氮原子的通称“某唑”;含两个以上杂原子(至少一个位氮)的六元单杂环多称为“某嗪”;含氧的称“恶”;含硫的称“噻”。
例如:ON N SNNN NN(5) 杂环已经含有最大数目的非聚集双键之外,还含有的饱和氢原子(两个二价元素中间的饱和氢不算)称做“指示氢”或“额外氢”或“标氢”。
指示氢不同的异构体,以其位号加“H ”(斜体大写)作词首来表示。
(6) 若杂环尚未含有最大数目的非聚集双键,这样的饱和氢原子为外加氢。
命名时要指明加氢的位置和数目,全部饱和可以省略位置。
(7) 含活泼氢的杂环及其衍生物,可能存在互变异构体,结构不同,名称也异;命名时尚需标明两种可能的位号 。
(8) 杂环母环的名称确定之后。
就可参照芳香化合物的命名方法,将环上取代基位置,数目及名称,以词首或词尾的形式加在环名的前后,有时杂环也可以作为取代基命名。
生物素中间体(5Z)-5-[(3aS,6aR)-1,3-二苄基-2-酮基-六氢-4H-噻吩[3,4-d]咪唑-4-烯基]-戊酸的合成改进
![生物素中间体(5Z)-5-[(3aS,6aR)-1,3-二苄基-2-酮基-六氢-4H-噻吩[3,4-d]咪唑-4-烯基]-戊酸的合成改进](https://img.taocdn.com/s3/m/4cad5a5fc850ad02de804124.png)
生物素中间体(5Z)-5-[(3aS,6aR)-1,3-二苄基-2-酮基-六氢-4H-噻吩[3,4-d]咪唑-4-烯基]-戊酸的合成改进摘要:本文在Chavan小组2005年报道的工艺和2006年陈克喜工艺基础上做了改进,使该工艺更加简单,更易于工业化,并且收率有了极大的提高,合成中间体的收率比陈克喜的工艺提高了17%。
关键词:d-生物素;中间体;氧化;过氧乙酸Improved method for the synthesis of biotin intermediate (5Z)-5-[(3aS,6aR)-1,3-dipenzyl -2-oxo-Hexahydro -4H-thieno [3,4-d] imidazole -4- alkenyl]-pentanoic acidXu jianyue,Chen weiyong.Pan pingping.Liang hao.Chen hongguang(ZHEJIANG NHU CO.LTD,xinchang 312500)ABSTRACT: this is a paper about a new and highly efficient synthesis of (+)-biotin intermediate which is based on the technology of Chavan group published in 2005 and Chen kexi group published in 2006,is more easy and more conductive to the industrialization,the total yield is 17%more than Chen’s technology.Key words: d-biotin;intermediate;Oxidation;peracetic acid自1949年瑞士Roche 公司首次合成生物素后,现已有几十种化学合成法到目前为止,所有(+)-生物素的全合成策略可基本分为两种,,一种采用富马酸为原料的对映选择性合成1-2,另一种,采用L-半胱氨酸等的立体专一性合成1-5,由于L-半胱氨酸和L-胱氨酸分子廉价易得,符合d-生物素分子中碳原子构型的要求,并且具有巯基和羧基反应活性基团6,在后续合成中不用再有上硫的反应,是一个较为环保的路线。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5-甲基-4-氧代-3,4-二氢噻吩并[2,3-d ]嘧啶-6-甲酸乙酯衍生物的合成廖矛川;张夷;陈玉【摘要】5-amino-3-methylthiophene-2,4-dicarboxylate (2) was synthesized by ethyl acetoacetate, ethyl cyanoacetate and sulfur through Gewald reaction under the catalysis of morpholine.Then 5-( ethoxymethyleneamino)-3-methylthiophene-2,4-dicarboxylate (3) was synthesized by reacting 2 with triethyl orthoformate.Finally four derivatives (4a~4d) of 5-methyl-4-oxo-3, 4-dihydrothieno [ 2, 3-d ] pyrimidine-6-carboxylate were obtained from the reaction of 3 with the corresponding amines.The structures were confirmed by 1 H NMR, IR and MS.The results showed that the raw materials were easily available and the target compounds could be obtained with mild reaction conditions and high yield.%在吗啡啉催化下,利用Gewald反应使乙酰乙酸乙酯、氰基乙酸乙酯与硫反应得到中间体5-氨基-3-甲基噻吩-2,4-二甲酸乙酯(2),再与原甲酸三乙酯反应生成5-乙氧基亚甲胺-3-甲基噻吩-2,4-二甲酸乙酯(3),最后再与相应的伯胺反应生成了4个目标产物5-甲基-4-氧代-3,4-二氢噻吩并[2,3-d]嘧啶-6-甲酸乙酯衍生物(4a~4d),所得产物结构经由1 H NMR,IR,MS进行了确证。
结果表明:该研究方法原料易得,反应条件适宜,所得化合物产量较高。
【期刊名称】《中南民族大学学报(自然科学版)》【年(卷),期】2015(000)002【总页数】4页(P57-60)【关键词】噻吩并嘧啶;Gewald反应;合成【作者】廖矛川;张夷;陈玉【作者单位】中南民族大学药学院,武汉430074;中南民族大学药学院,武汉430074;中南民族大学化学与材料科学学院,武汉430074【正文语种】中文【中图分类】TQ253.225-甲基-4-氧代-3,4-二氢噻吩并[2,3-d]嘧啶-6-甲酸乙酯衍生物的合成廖矛川1,张夷1,陈玉2,*( 1中南民族大学药学院,武汉430074; 2中南民族大学化学与材料科学学院,武汉430074)摘要在吗啡啉催化下,利用Gewald反应使乙酰乙酸乙酯、氰基乙酸乙酯与硫反应得到中间体5-氨基-3-甲基噻吩-2,4-二甲酸乙酯( 2),再与原甲酸三乙酯反应生成5-乙氧基亚甲胺-3-甲基噻吩-2,4-二甲酸乙酯( 3),最后再与相应的伯胺反应生成了4个目标产物5-甲基-4-氧代-3,4-二氢噻吩并[2,3-d]嘧啶-6-甲酸乙酯衍生物( 4a~4d),所得产物结构经由1H NMR,IR,MS进行了确证.结果表明:该研究方法原料易得,反应条件适宜,所得化合物产量较高.关键词噻吩并嘧啶; Gewald反应;合成中图分类号TQ253.22文献标识码 A文章编号1672-4321( 2015) 02-0057-04收稿日期2014-12-28 *通讯作者陈玉( 1970-),女,副教授,博士,研究方向:药物合成,E-mail: chenyuwh888@ 126.com作者简介廖矛川( 1962-),男,教授,博士,研究方向:天然药物化学,E-mail: sipper1976@163.com基金项目中央高校基本科研业务费专项资金资助项目( CZY13004) Synthesis of 5-Methyl-4-oxo-3,4-dihydrothieno [2,3-d]pyrimidine-6-carboxylate DerivativesLiao Maochuan1,Zhang Yi1,Chen Yu2,*( 1 College of Pharmacy,South-Central University for Nationalities,Wuhan 430074,2 College of Chemistry and Materials Sciences,South-Central University for Nationalities,Wuhan 430074)Abstract 5-amino-3-methylthiophene-2,4-dicarboxylate ( 2) was synthesized by ethyl acetoacetate,ethyl cyanoacetate and sulfur throughGewald reaction under the catalysis of morpholine.Then 5-( ethoxymethyleneamino) -3-methylthiophene-2,4-dicarboxylate ( 3) was synthesized by reacting 2 with triethyl orthoformate.Finally four derivatives ( 4a~4d) of 5-methyl-4-oxo-3,4-dihydrothieno[2,3-d]pyrimidine-6-carboxylate were obtained from the reaction of 3 with the corresponding amines.The structures were confirmed by1H NMR,IR and MS.The results showed that the raw materials were easily available and the target compounds could be obtained with mild reaction conditions and high yield.Keywords thiophene and pyrimidine; Gewald reaction; synthesis噻吩并[2,3-d]嘧啶是一类具有良好生物活性的药效团[1,2],其衍生物在农药、新药开发等人类健康和农业生产中具有重要作用[3,4].当前针对这一类化合物的设计和结构优化是现阶段有机化学和药物化学领域的研究热点.2003年Chambhare等[5]以噻吩并[2,3-d]嘧啶为骨架设计合成5位呋喃取代的噻吩并[2,3-d]嘧啶酰胺和亚胺类化合物(见图1化合物1,2),初步分析探讨了它们的生物活性,其MHC和LD50的表达显示了酰胺类化合物活性较好,在新药设计研发中具有十分重要的意义.2008年 Bogolubsky等[6]合成了大量2、5、6取代噻吩并[2,3-d]嘧啶-4-酮化合物(见图1 化合物3),为进一步研究其磷酸二酯酶( PDE9)抑制剂奠定了基础.MariaModica等[7]合成的一系列噻吩并[2,3-d]嘧啶类化合物(见图1 化合物4)对5-HT3和5-HT4受体有极其明显的药效表达.以噻吩并[2,3-d]嘧啶为基本骨架的一类先导化合物现阶段已受到了人们的广泛关注,同时针对此类化合物在杀菌、抗肿瘤、抗过敏等方面的研究也取得了突破性进展[8].图1 具有生物活性的噻吩并[2,3-d]嘧啶衍生物( 1~4)Fig.1 Thiophene[2,3-d]pyrimidine derivatives( 1~4) with biological activities故本文拟以噻吩并[2,3-d]嘧啶为基本骨架,在嘧啶环的3位上引入不同的取代基,设计合成5-甲基-4-氧代-3,4-二氢噻吩并[2,3-d]嘧啶-6-甲酸乙酯衍生物4a~4d.噻吩并嘧啶酮类衍生物的合成方法[7,9-12]众多,如Maria Modica等采用的方法,但该法步骤复杂,原料来源困难,本文拟利用Gewald反应[13,14]合成中间体2-氨基噻吩类化合物,快速获得最终产物,反应条件温和,原料均为常规试剂,制备方法简单易行,无需苛刻的无水无氧条件,反应温度不高,有些甚至在室温下搅拌即可,反应时间较短.本文以Gewald反应为基础,设计合成了4个噻吩并[2,3-d]嘧啶酮类衍生物,并针对此类化合物的结构进行了表征.应用乙酰乙酸乙酯,氰乙酸乙酯与硫在吗啡啉催化下利用Gewald反应[15,16],顺利制得了2-氨基噻吩中间体2,中间体2再与原甲酸三乙酯回流反应生成中间体3,中间体3最后与相应的伯胺反应生成目标产物4a~4d,合成路线见图2 .图2 5-甲基-4-氧代-3,4-二氢噻吩并[2,3-d]嘧啶-6-甲酸乙酯衍生物( 4a~4d)的合成Fig.2 Synthesis of 5-methyl-4-oxo-3,4-dihydrothieno[2,3-d]pyrimidine-6-carboxylate derivatives( 4a~4d)1 实验部分1.1试剂与仪器乙酰乙酸乙酯、硫、吗啡啉、原甲酸三乙酯、氰乙酸乙酯、无水乙醇、胺、乙酸乙酯、石油醚等为进口或国产化学纯或分析纯.核磁共振仪[瑞士布鲁克( Bruker) AM-400Hz型,TMS内标,氘代氯仿为溶剂],红外光谱仪( NE ×US 470型,KBr压片),申光WRS-2微机熔点仪,循环真空泵( SHZ-III型,巩义予华仪器公司),恒温加热磁力搅拌器( DF-101s),天孚牌电子天平( DT200A,常熟市金羊砝码仪器公司),旋转蒸发器( SHZ-III型,上海亚荣生化仪器公司),TLC薄层硅胶板( GF254,青岛海洋化工厂),三用紫外分析仪( ZF-6,上海嘉鹏科技有限公司),柱层析硅胶200~300目(青岛海洋化工厂).1.2化合物的合成1.2.1中间体2( 5-氨基-3-甲基噻吩-2,4-二甲酸乙酯)的合成室温搅拌下,将乙酰乙酸乙酯( 1.30 g,10 mmol)、氰乙酸乙酯( 1.14 g,10 mmol)与硫粉( 0.32 g,10 mmol)加入到无水乙醇( 50 mL)中,滴加2 mL吗啡啉,将反应混合物在60℃搅拌反应12 h.反应液浓缩后,倒入100 mL冰水中,有淡黄色沉淀析出,抽滤,滤饼用大量水洗涤得粗产物,再用乙醇重结晶,得1.9g棕浅黄色晶体中间体2,产率73.4%.1.2.2中间体3 ( 5-乙氧基亚甲胺-3-甲基噻吩-2,4-二甲酸乙酯)的合成取上步所得产物5-氨基-3-甲基噻吩-2,4-二甲酸乙酯( 5 mmol,1.29 g)加至100 mL反应瓶中,再缓慢滴加30 mL原甲酸三乙酯后,升温回流反应,反应过程TLC监控.待反应完全后减压蒸馏,蒸出未反应的过量原甲酸三乙酯,得中间体3的粗产物,此时中间体3可不经纯化后处理直接用做下步产物的原料.1.2.3 5-甲基-4-氧代-3,4-二氢噻吩并[2,3-d]嘧啶-6-甲酸乙酯衍生物4a~4e的合成取上步所得产物5-乙氧基亚甲胺-3-甲基噻吩-2,4-二甲酸乙酯( 1 mmol,0.31 g)加至100 mL反应瓶中,缓慢滴加30 mL无水乙醇并充分搅拌2min,使原料完全溶解,缓慢搅拌下滴加伯胺3 mL,升温至60℃下搅拌反应,通过TLC薄层跟踪监控反应,当原料点消失,再继续反应1h使原料充分反应,则停止结束.将所得反应液减压浓缩后,得化合物4的粗产物,后处理用乙醇重结晶或利用硅胶柱层析纯化得到最终产物4.[V(石油醚)︰V(乙酸乙酯) = 9︰1].1.2.4目标化合物的结构表征3-正丁基-5-甲基-4-氧代-3,4-二氢噻吩并[2,3-d]嘧啶-6-甲酸乙酯4a:产率75%,白色粉末,m.p.137~138℃,1H NMR ( 400 MHz,CDCl3)δ: 8.01 ( s,1H),4.37 ( q,J = 7.2 Hz,2H),3.97 ( t,J =7.2 Hz,2H),2.95 ( s,3H),1.81~1.72 ( m,2H),1.43~1.37 ( m,5H),0.97 ( t,J =7.2 Hz,3H) ;13C HMR ( 100 MHz,CDCl3)δ: 165.3,162.5,158.2,148.4,148.4,144.1,123.7,61.3,46.7,31.5,19.9,15.2,14.3,13.6; IR( KBr,cm -1) 1718 ( vC = O),1675 ( vC = O),1581 ( vC = C) ; ESIMS: 295.3( M + H)+.3-异丙基-5-甲基-4-氧代-3,4-二氢噻吩并[2,3-d]嘧啶-6-甲酸乙酯4b:产率73%,白色粉末,m.p.164.9~166.3℃,1H NMR ( 400 MHz,CDCl3)δ: 8.09( s,1H),5.28~5.11 ( m,1H),4.37 ( q,J = 7.1 Hz,2H),2.96 ( d,J = 1.5 Hz,3H),1.48 ( d,J = 6.9 Hz,6H),1.40 ( t,J = 7.1 Hz,3H) ; IR( KBr,cm-1) 1714 ( vC = O),1669 ( vC = O),1567 ( vC = C) ; ESI-MS: 281.1( M + H)+.3-仲丁基-5-甲基-4-氧代-3,4-二氢噻吩并[2,3-d]嘧啶-6-甲酸乙酯4c:产率78%,白色粉末,m.p.142.9~144.4℃,1H NMR ( 400 MHz,CDCl3)δ: 8.02 ( s,1H),5.05~4.90 ( m,1H),4.37 ( q,J = 7.2 Hz,2H),2.96 ( s,3H),1.88~1.76 ( m,2H),1.46 ( d,J = 7.2 Hz,3H),1.40 ( t,J = 7.1 Hz,3H),0.94 ( t,J = 7.4 Hz,3H) ; IR( KBr,cm-1) 1712 ( vC = O),1671( vC = O),1567 ( vC = C) ; ESIMS: 295.2( M + H)+.3-异丁基-5-甲基-4-氧代-3,4-二氢噻吩并[2,3-d]嘧啶-6-甲酸乙酯4d:产率69%,白色絮状,m.p.115.5~116.6℃,1H NMR ( 400 MHz,CDCl3)δ: 8.00( s,1H),4.39 ( q,J = 7.2 Hz,2H),3.80 ( d,J = 7.2 Hz,2H),2.96 ( s,3H),2.28~2.14 ( m,1H),1.42 ( t,J = 7.1 Hz,3H),1.01 ( d,J = 6.8 Hz,3H),0.98 ( d,J = 6.8 Hz,3H) ; IR ( KBr,cm-1) 1707 ( vC = O),1677 ( vC = O),1575 ( vC = C) ; ESI-MS: 295.2( M + H)+.2 结果与讨论2.1合成条件2-氨基噻吩中间体制得乙氧基亚甲胺中间体的相关方法中,除反应原料外,还加入了醋酸酐进行催化,同时该步反应对醋酸酐量的要求比较严苛.但在本文所采用的方法中,由中间体2与原甲酸三乙酯生成中间体3过程中,不使用醋酸酐同样能使反应顺利进行,而且没有醋酸酐的加入,反应副产物生成较少,后处理简单,经浓缩后的粗产物,可直接用于下步反应,减少了后处理步骤的同时也将其所可能引起的产物的损失降到了最低.该反应以无水乙醇为溶剂,中间体3无需催化,能直接与相应的伯胺关环得到最终目标产物.反应所需温度适宜,产率较高,由于没有其他催化剂的使用,此步反应对环境污染较小.整个反应只需要三步即可完成,所需原料均简单易得,故反应副产物较少,利用简单的乙醇重结晶或柱层析即可分离纯化目的产物.2.2目标化合物的波谱分析本研究设计合成的化合物4a~4d均经过IR,1H NMR,MS分析确证,其中化合物4a还经过13C-NMR分析确证.在红外光谱中,在1669~1678 cm-1区域内有一个强烈的伸缩振动吸收峰为嘧啶环上的羰基信号,在1707~1719 cm-1区域内吸收峰为与噻吩环相连的酯基中的羰基信号;在1567~1582 cm-1区域内吸收峰为C = C的信号.1H NMR中化学位移(δ) 8.00~8.09处为嘧啶环上的N = CH的单峰质子信号,化学位移(δ) 4.37~4.38上有一个四重峰为酯基中的亚甲基信号,化学位移(δ) 2.93~2.99上有一个单峰为与噻吩环相连的甲基信号.在化合物4a的13C NMR图谱中,δ在148处为嘧啶环上的CH特征信号,162.5和158.2处为羰基碳的特征信号,δ在约15.2,14.3,13.6处为甲基碳的信号,δ在约61.3,46.7,31.5,19.9处为四个亚甲基的信号.3 结语本文采用经典Gewald反应经过3步合成了4 个5-甲基-4-氧代-3,4-二氢噻吩并[2,3-d]嘧啶-6-甲酸乙酯衍生物,通过1H NMR、MS、IR确证了其结构.此合成方法所需原料均简单易得,实验过程操作简单,反应所需的条件温和,所得产物产率较高,为设计合成以噻吩并嘧啶酮为基本骨架的各类衍生物的深入研究奠定了良好的基础.参考文献[1]Al-Taisan K M,Al-Hazimi H M A,Al-Shihry S S.Synthesis,characterization and biological studies of some novel thieno[2,3-d]pyrimidines[J].Molecules,2010,15( 6) : 3932-3957.[2]廖全斌,刘明国,陈百玲,等.3-苯基-噻吩并嘧啶-4-酮衍生物的合成及其抑菌活性[J].应用化学,2010,27 ( 5) : 533-538.[3]Alagarsamy V,Solomon V R,Meena R,et al.Design and synthesis of 2-methylthio-3-substituted-5,6-dimethylthieno [2,3-d]pyrimidin-4(3H) -ones as analgesic,anti-inflammatory and antibacterial agents[J].Med Chem,2007,3(1) : 67-73.[4]刘建超,贺红武,陈荷莲.2-氨基(芳氧基) -3-对甲基苯基噻吩并[3',2':5,6]吡啶并[4,3-d]嘧啶-4 ( 3H) -酮的合成和生物活性[J].有机化学,2011,31( 8) : 1208-1212.[5]Chambhare R V,Khadse B G,Bobde A S,et al.Synthesis and preliminary evaluation of some N-[5-( 2-furan-yl) -2-methyl-4-oxo-4H-thieno[2,3-d]pyrimidin-3-yl]-carboxamide and 3-substituted-5-( 2-furanyl) -2-methyl -3H-thieno [2,3-d]pyrimidin-4-ones as antimicrobial agents[J].Eur J Med Chem,2003,38(1) : 89-100.[6]Bogolubsky A V,Ryabukhin S V,Plaskon A S,et al.Dry HCl in parallel synthesis of fused pyrimidin-4-ones[J].J Comb Chem,2008,10( 6) : 858-862.[7]Modica M,Santagati M,Guccione S,et al.Synthesis and binding properties of novel and selective 5-HT3and 5-HT4receptor ligands[J].Eur J Med Chem,2000,35( 12) : 1065-1079.[8]张广龙,欧阳贵平,李文举,等.具有抗肿瘤活性的噻吩并嘧啶衍生物的研究进展[J].精细化工中间体,2010,40( 3) : 12-17.[9]Neumann O,Zhang D,Tam F,et al.Direct optical detection of aptamer conformational changes induced by target molecules[J].Anal Chem,2009,81( 24) : 10002-10006.[10]Wood E R,Shewchuk L M,Ellis B,et al.6-Ethynylthieno[3,2-d]- and 6-ethynylthieno[2,3-d]pyrimidin-4-anilines as tunable covalent modifiers of ErbB kinases [J].Proc Natl Acad Sci,2008,105( 8) : 2773-2778.[11]Gillespie R J,Adams D R,Bebbington D,et al.Antagonists of the human adenosine A2Areceptor.Part 1: Discovery and synthesis of thieno[3,2-d]pyrimidine-4-methanone derivatives[J].Bioorg Med Chem Lett,2008,18( 9) : 2916-2919.[12]Rheault T R,Caferro T R,Dickerson S H,et al.Thienopyrimidine-based dual EGFR/ErbB-2 inhibitors[J].BioorgMed Chem Lett,2009,19( 3) : 817-820.[13]Puterová Z,Krutoíková A,Végh D.Gewald reaction: synthesis,properties and applications of substituted 2-aminothiophenes [J].Special issue reviews and accounts arkivoc,2010( i) : 209-246.[14]张豹子,刘洋,王凌.Gewald反应及其在药物合成中的应用[J].中国抗生素杂志,2012,37 ( 8) : 579-586.[15]Sabnis R W,Rangnekar D W,Sonawane N D.2-Aminothiophenes by the Gewald reaction[J].J Heterocycl Chem,1999,36(2) : 333-345.[16]陈玉,柏舜.3-烷基-7-甲基-5,6,7,8-四氢-3H-吡啶并[4',3':4,5]噻吩并[2,3-d]嘧啶-4-酮衍生物的合成[J].中南民族大学学报:自然科学版,2013,32 ( 1) : 24-27.。
