Hofmann烷基化
有机人名反应(pdf版)

迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:
反应实例
14
参考文献
[1] [2] [3] [4] E. Beckmann, Ber., 1886, 19,988; 1887, 20, 1507. W. Z. Heldt, Org. Reactions, 1960, 11, 1~156. J. Kenyonn, A. Campbell, J. Chem. Soc., 1946, 25. J. Kenyonn, D. P. Young, J. Chem. Soc., 1941, 263.
Bucherer 反应
反应机理
20
反应实例
参考文献
[1] [2] [3] [4] [5] [6] [7] H. T. Bucherer, J. Prakt. Chem ., 1904, 69(2), 49. H. T. Bucherer, J. Prakt. Chem ., 1904, 70(2), 345. H. T. Bucherer, J. Prakt. Chem ., 1907, 75(2), 249. H. T. Bucherer, J. Prakt. Chem ., 1905, 75(2), 433. N. L. Drake, Org. Reactions, 1942, 1, 105. A. Rieche, H. Seeboth, Ann., 1960, 638, 66, 43, 76. H. Seeboth, Angew. Chem. Int. Ed., Engl., 1967, 6, 307-317.
X
Y Yurev 反应
Z
Zeisel 甲氧基测定法
Arbuzov 反应
亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:
有机人名反应(pdf版)

9
反应实例
参考文献
[1] [2] [3] [4] A. E. Arbuzov, J. Russ. Phys. Chem. Soc., 1906, 38, 687. A. Michaelis, Ber., 1898, 31, 1048. Organic Reactions, 1951, 6, 276. D. Redmore, Chem. Rev., 1971, 71, 317.
18
1574. [7] J. Gal. et al., J. Org. Chem ., 1974, 39, 418.
参见 : Pictet-Spengler 合成法
Bouveault-Blanc 还原
反应机理
反应实例
19
参考文献
[1] L. Bouveault, G. Blanc, Compt. Rend., 1903, 136, 1676; 1903, 137, 60328; Chem. Zentr., 1903, II, 418; Bull. Soc. Chim. France, 1903, 29, 787; 1904, 31, 666, 1203; 1906, 35, 629. [2] L. Bouveault, R. Locquin, Compt. Rend., 1905, 140, 1593, 1669. [3] Org.Syn., II, 1943, 154, 372; [4] N. S. Isaacs, Reactive Intermediate in Organic Chemistry, John Wiley & Sons, 1974, p370,.
Birch 还原
反应机理
15
反应实例
16
参考文献
第17章 胺

强。
(1)(2)芳胺的亲电取代反应1. 卤化NH2(CH3CO)2O CH3 NHCOCH3 Br2, CH3CO2H NHCOCH3 BrCH3Br2, H2O NH2 Br BrCH3 1) HCl, H2O Δ 2) NaOH NH2 BrCH3CH32. 硝化:NH2 (CH3CO)2ONHCOCH3 HNO3NHCOCH3 NO2CH(CH3)2CH(CH3)2CH(CH3)2 KOH, EtOHΔNH2 NO23. 弗瑞德-克莱福特反应 (Friedel-Crafts)NH2 C2H5 CH3COCl, AlCl3CH(CH3)2NH2 C2H5 (CH3CO)2ONHCOCH3 C2H5 CH3COCl, AlCl3NHCOCH3 C2H5COCH3胺的制备一氨或胺的烷基化(Hofmann烷基化)SN2RNH2 + RNH2X CH2R'RNHRNH2 + R'CH2XRNH+ + RNH3X-CH2R'+ CH R' RN + RNH3X2 CH2R'+ R'CH2X+ - RNH2 RNHX (CH2R')2CH2R'RN CH2R' + R'CH2X CH2R'+ RN(CH2R)3X-RI > RBr > RCl > RF1º RX 或 2º RX, 3º RX易发生消除反应9混合产物,合成伯胺时, NH3需要过量. 9合成季铵盐, RX 需要过量.氨或胺的烷基化的具体应用1 工业制备(结合高效率的分馏塔) 2 利用电子效应和原料配比的调节,可以制备1°胺PhCH2NH2 + CH3I C2H5OH PhCH2NHCH3 + PhCH2N(CH3)2 + PhCH2N(CH3)3I 15% 45% 10%+PhCH2Cl + NH3C2H5OHPhCH2NH2 + NH4Cl 50%40倍CH3CHCOOH + NH3 BrCH3CHCOONH3 + 65 % -70%CH3OH+ HBr1mol70molCH2NH2 + 3CH3ICH2N(CH3)3I 相转移催化剂+****卤代芳烃的氨解BrNaNH2 NH3 ( l )反应历程为:NH2Br H苯炔的结构NH2-*NH3NH2 * +*NH2·sp2杂化轨道·CF3 ClNaNH2 NH3 ( l )反应历程为:CF3 NH2CF3 Cl NaNH2NH3 ( l )CF3NH2-CF3· ·-CF3 NH2 +稳定· ·-NH2CF3· ·-CF3NH3NH2+ NH- 2 NH2二 盖布瑞尔(S.Gabriel)合成法利用邻苯二甲酰亚胺的烷基化来制备一级胺,称为盖 布瑞尔合成法。
hofmann重排反应的应用进展

hofmann重排反应的应用进展Hofmann重排反应(Hofmann rearrangement)是一种有机化学反应,它可以将亚胺基乙酸酯(aminoethyl esters)或者亚胺基丙酸酯(aminopropyl esters)转化为亚胺(aminonitriles)。
这一反应是由德国化学家Hofmann在1881年发现的,因此得名。
Hofmann重排反应的基本机理是,亚胺基乙酸酯或者亚胺基丙酸酯在碱性条件下经过脱氧和消旋反应,得到亚胺基苯甲酰胺(aminophenylformamide)。
然后,亚胺基苯甲酰胺在热条件下经过环氧化反应和脱氧反应,得到亚胺基氰(aminonitrile)。
Hofmann重排反应在药物合成、材料合成和有机合成等领域有着广泛的应用。
例如,它可以用来合成药物中的亚胺类化合物,如氯普鲁兰(chlorpromazine)和替莫唑胺(trazodone)。
此外,Hofmann重排反应还可以用来合成含亚胺基的聚合物,如聚烯烃(polyolefins)和聚氨酯(polyurethanes)。
在近年来,随着有机合成方法的不断改进和发展,Hofmann重排反应也发生了很大的变化。
例如,现在可以使用新型催化剂来提高反应的效率;也可以使用新型的反应体系,如超临界流体(supercritical fluids)或者微波辅助反应(microwave-assisted reactions)来改进反应条件,从而使反应更加安全、高效、环保。
此外,Hofmann重排反应在有机合成中还可以用来进行多种复合反应,如酰胺与醛的加成反应、亚胺与苯并芘的加成反应、亚胺与苯并噻唑的加成反应等。
这些反应可以用来合成含有多种不同功能基团的化合物,如酰胺基膦酸酯(phosphonate esters)、苯并芘衍生物(phenanthrene derivatives)和苯并噻唑衍生物(dibenzothiophene derivatives)等。
有机人名反应(pdf版)

Bischler-Napieralski 合成法
反应机理
17
反应实例
参考文献
[1] [2] [3] [4] [5] A. Bis, 26, 1903. R. H. Manske, Chem. Rev ., 1942, 30, 146. F. W. Bergstrom, Chem. Rev ., 1944, 35, 218. W. M. Whaley, Org. Reactions, 1951, 6, 75-150. B. S. Thyagarajan, Chem. Rev . 1954, 54, 1033. [6] C. Reby, J. Gardent, Bull. Soc. Chim. France, 1972,
Baeyer-Villiger 氧化
11
反应机理
12
反应实例
参考文献
[1]S. L. Friess, Rex Pinson Jr., J. Amer. Chem. Soc., 1952, 74, 1302. [2] S. L. Friess, J. Amer. Chem. Soc., 1949, 71, 2571. [3] C. H. Hassall, Org. Reactions, 1957, 9, 73-106. [4] S. L. Friess, P. E. Frankenburg, J. Amer. Chem. Soc.,1952, 74, 2679. [5] J. Meinwald, J. J. Tufariello, J. J. Hurst, J. Org. Chem., 1964, 29, 2914.
G Gabriel 合成法 Gattermann 反应 Gattermann-Koch 反应 Gomberg-Bachmann 反应
第17章胺-精品文档
C H (C H 3 ) 2
C H (C H 3 ) 2
(2)化学还原
CH3 CH3 NO2 Fe E tO H , H C l h e at NH2 NH2
Sn、Fe/HCl
NO2
选择性还原试剂
硫化铵
硫氢化钠
硫化钠
还原剂计量: 二硝基化合物选择还原
p775
4. 腈及其它含氮化合物的还原
R C l + aC N N N i / H 2 R C H N H R C N 2 2 or L i A l H 4
O N N O
+ R N H + H O 2 2
O
氨基酸合成 p773
3. 硝基化合物还原
(1)催化氢化:污染少,逐步替代化学方法。中性条件下进行,
适于对含有对酸、碱敏感的官能团化合物进行还原
CH3 CH3 NO2 H 2, N i h e at , p re s s u re NH2
制备伯胺
Ni, Pd, Pt
5. 还原氨化——醛(酮)在氨存在下催化氢化生成 胺的反应(reductive amination)
RC O H (R') + NH 3 Ni/H 2 RC H NH 2 H (R')
NH RC H (R')
中间体
R
R ' C N R '' R '''
醛(酮)与伯胺的反应通过半缩胺 (亚胺)中间体发生,与仲胺的反应 则通过半缩胺(亚胺离子)
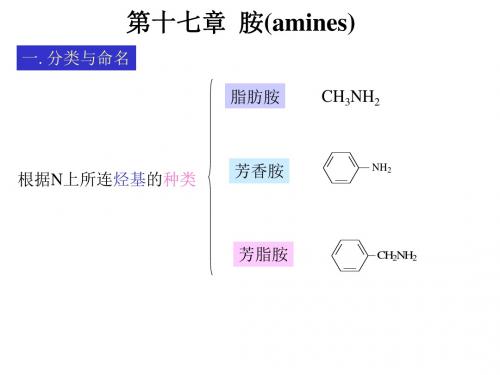
第十七章 胺(amines)
一. 分类与命名
脂肪胺 CH3NH2
根据N上所连烃基的种类
芳香胺
NH2
有机化学反应机理

二十六、Favorskii重排
二十八、Friedel-Crafts酰基化反应
三十、Fischer,O-Hepp,E重排
三十二、Gattermann反应
三十四、Gomberg-Bachmann反应
三十六、Haworth反应
三十八、Hinsberg反应
四十、Hofmann消除反应
四十二、Houben-Hoesch反应
四十四、Kiliani氯化增碳法
四十六、Koble反应
四十八、Kolbe,H.Syntbexis ofNitroparsffini合成
五十、Lossen反应
五十二、Meerwein-Ponndorf反应
五十四、Martius,C.A.重排
五十六、Oppenauer氧化
有机化学反应机理
一、Arbuzov反应
三、Baeyer-villiger反应
五、Birch还原
七、Bucherer反应
九、Berthsen,A.Y吖啶合成法
十一、Chichibabin反应
十三、Claisen-Schmidt反应
十五、Clemmensen还原
十七、Cope消除反应
十九、Curtius反应
五十八、Paal-Knorr反应
六十、Prileschajew,N反应
六十二、Pinacol重排
六十四、Pictet-Spengler异喹啉合成法
六十六、Reimer-Tiemann反应
六十八、Robinson缩环反应
七十、Ruff递降反应
七十二、Sandmeyer反应
七十四、Schmidt反应
七十六、Sommelet-Hauser反应
参考资料
西南大学(有机化学)

西南大学(有机化学)第一篇:西南大学(有机化学)西南大学(有机化学)单项选择题1、2、蛋白质的基本组成单位是()。
氨基酸脱氧核糖核酸核糖核酸葡萄糖3、E.、5、6、下列方法中,()可以使糖的碳链增长。
佛尔递降法芦福递降法克利安尼氰化增碳法碳二亚胺法7、请对下列分子进行合理的切断,并写出其合成子()8、9、写出对氨基苯乙酮的结构()10、胡萝卜素类化合物广泛地存在于植物和动物的脂肪内,属于___萜化合物。
二单三四11、下列氨基酸中,()不属于必需氨基酸。
蛋氨酸异亮氨酸精氨酸赖氨酸12、下列基团中____不能用来保护羟基THP(四氢吡喃基)对甲氧基苄氧基甲基p-MeOC6H4CH2OCH2―简写为PMBM硅保护基,例如三乙基硅基(TES)苄基13、下列反应中,(Aldol缩合反应)不属于周环反应。
14、判断题15、芳香胺的碱性比氨强。
A.√B.×16、乳糖用酸水解,得一分子D一半乳糖和一分子D一葡萄糖酸。
A.√B.×17、氨基酸的熔点很高,多数氨基酸受热分解而不熔融。
A.√B.×18、胺很容易氧化,特別是芳香胺,大多数氧化剂使胺氧化成焦油状的复杂物质,但是过氧化氢、过酸能使三级胺氧化为氧化胺。
A.√B.×19、羧酸比酰卤、混合酸酐或活泼酯都活泼,因为一X,一OR(R 中有吸电子基),一OCOOR,都是比一OH较好的离去基团。
A.√B.×20、Hinsberg反应可用于分离鉴别一级胺、二级胺和三级胺。
A.√B.×21、喹啉、异喹啉是三级胺,具有碱性。
A.√B.×22、Fehling试剂或Benedict试剂常与醛糖及酮糖反应产生氧化亚铜红色沉淀,这类糖称为还原糖。
A.√B.×23、氨具有棱锥形的结构,氮用sp3杂化轨道与三个氢的s轨道重叠,形成三个sp3-s σ键,成棱锥体。
A.√B.×24、A.√ B.×25、吡咯的α-C、β-C和N上均能发生质子化反应。
