高三化学平衡图象
化学平衡图像_2-课件

•
10、阅读一切好书如同和过去最杰出 的人谈 话。2021/2/282021/2/282021/2/282/28/2021 9:01:03 AM
•
11、越是没有本领的就越加自命不凡 。2021/2/282021/2/282021/2/28Feb-2128-Feb-21
化学平衡图像
化学平衡图象题型
化学平衡图象分析的一般方法: 一看面:看清图象中横坐标和纵坐标的含义。 二看线:弄清图象中线的斜率或线走势的意义 三看点:明确曲线的起点、终点、交点及拐点等 四看是否需要辅助线。
化学平衡常见图象题型: 一、速率---时间图象(V—t图象)
例1、判断下列图象中时间t2时可能发生了哪一种变化? 分析平衡移动情况。
14、意志坚强的人能把世界放在手中 像泥块 一样任 意揉捏 。2021年2月28日星期 日2021/2/282021/2/282021/2/28
•
15、最具挑战性的挑战莫过于提升自 我。。2021年2月2021/2/282021/2/282021/2/282/28/2021
•
16、业余生活要有意义,不要越轨。2021/2/282021/2/28Februar y 28, 2021
(A)
(B)
(C)
化学平衡常见图象题型: 同类变式
1、对于可逆反应:N2(g)+3H2(g) 2NH3(g) ;△H<0kJ/mol ,达平衡后外界条件改变有下 图所示的图象,试分析t1、t2、t3时外界条件 如何改变?
二、转化率(或产率、百分含量等)----时间图象
例3、可逆反应mA(s)+nB(g) pC(g)+qD(g)。反应 中,当其它条件不变时,C的质量分数与温度(T) 和压强(P)的关系如上图,根据图中曲线分析,判
化学平衡图像

pC(g) +qD(g)
A B t1 t2
T1 T2 t
T1
T2 t
1、T1 < T2 ( > = < ) 正反应是 放热 反应 (放热、吸热)
2、T1 > T2 ( > = < ) 正反应是 放热 反应 (放热、吸热)
可逆反应 mA(g) + nB(g)
A 转 化 率 B%
pC(g)+qD(g)
A.增大A的浓度
B.缩小容器的容积
A的转化率
C.加入催化剂
D.升高温度
a
b
t
随堂测试:
3 、右图表示外界条件 ( 温度、压强 ) 的变 化对下列反应的影响: L(固)+G(气) 2R(气),(正反应为吸热反应),在图中,Y轴是 指( B ) A.衡混合气中R的体积分数 Y B.平衡混合气中G的体积分数 C.G的转化率 100kpa D.L的转化率 10kpa
X或Y t1 t2 t3 t
题组一
1
题组二
2
题组三
3
题组四
4
5
题组五
6
7
题组一 浓度—时间图像 1. 已知 NO2 和 N2O4 可以相互转化:
2NO2(g) N2O4(g)(正反应为放热反应 )。现将
一定量 NO2 和 N2O4 的混合气体通入一体积为 1 L 的恒温密闭容器中, 反应物浓度随时间变化 关系如图所示,回答下列问题: (1) 图中共有两条曲线 X 和 Y,其中曲线
题组一
1
题组二
2
题组三
3
题组四
4
5
题组五
6
7
题组三 恒温线(或恒压线)图像
高中化学精品课件:化学平衡图像

v正= v逆
v(正) v'正=v'逆
v(逆)
v正=v逆 v(逆) v'正=v'逆
v(正)
升高温度 ② 若正反应是放热反应
v(逆)v'正=v'逆 v(正)
降低温度
v(正) v'正=v'逆 v(逆)
二、化学平衡的有关图像 1、速率——时间图像
解题方法: ①改变条件使平衡移动的瞬间曲线是连续的,则是物质浓度发生改变 ②改变条件使平衡移动的瞬间曲线出现断点,则是温度改变或是压强改变 ③改变条件反应速率变化但是平衡不移动,则是使用催化剂或是反应前后气 体系数不变的反应中压强改变
【课堂练习】 D
B
B
B
A
C%
的
转
化 率
1.01×105Pa 1.01×106Pa
1.01×107Pa
T 正反应放热
m+n<p+q
500℃ 200℃
正反应吸热
P
m+n>p+q
二、化学平衡的有关图像
小结:百分含量(或转化率)—压强或温度图像
解题策略: 涉及两个外界因素(P/T)对化学平衡的影响,因此需要“定一议二” 即控制变量法。 ①分析任意一条坐标系中任意一条曲线横坐标变量对纵坐标的影响。 ②做一个“等温线”或者“恒压线”辅助线,再用勒夏特列原理进行分 析。
课堂小结
影响化
学平衡 的因素
浓度 压强 温度
理论理解 勒夏特列原理 图像分析 平衡图像
【课堂练习】 1.对于可逆反应mA(g)+nB(g) ⇌qC(g) ΔH=Q kJ·mol-1
(1)根据图①回答问题:①m+n_<__q(填“>”“<”或“=”,下同); ②若Q>0,则T1__>___T2; ③若T1<T2,则Q_<___0。
高中化学--化学平衡图像

[练习3]在密闭容器中进行下列反应: M(气)+N(气) R(气)+2L 此反应符合下面图像,下列叙述是正确的是 (C ) (A) 正反应吸热,L是气体 (B) 正反应吸热,L是固体 (C) 正反应放热,L是气体 (D) 正反应放热,L是固体 或液体
[练习4] 对于2A(g)+B(g) 2C(g)(正反 应为放热反应),符合该反应的下列图象:
√
时间 时间
√
时间
[练习5] 可逆反应:
a A (S)+ b B(g) c C(g)+ d D(g),反应 过程中,当其他条件不变时,某物质在混合物中的含量 与温度(T)、压强(P)的关系如下图:
B%
P1
NO 转 化 率
B C 0
A E D
C点
T
率
104Pa
T (温度)
•固定压强,讨论T与 A的转化率的关系 •固定温度,讨论P与 A的转化率的关系
A 转 化 率
106Pa
T (温度)
[练习1] 密闭容器中进行下述反应:2A+B(气) C(气)+D(气),此反应符合下面图,则下列叙述正 确的是: (C ) A.正反应是吸热反应,A是气体。 B.正反应是吸热反应,A是固体。 C.正反应是放热反应,A是固体。 D.正反应是放热反应,A是气体。
P2 时间
据图分析,以下正确的是 A. T1>T2, 正反应吸热 C. P1>P2,a+b=c+d
化学平衡图像
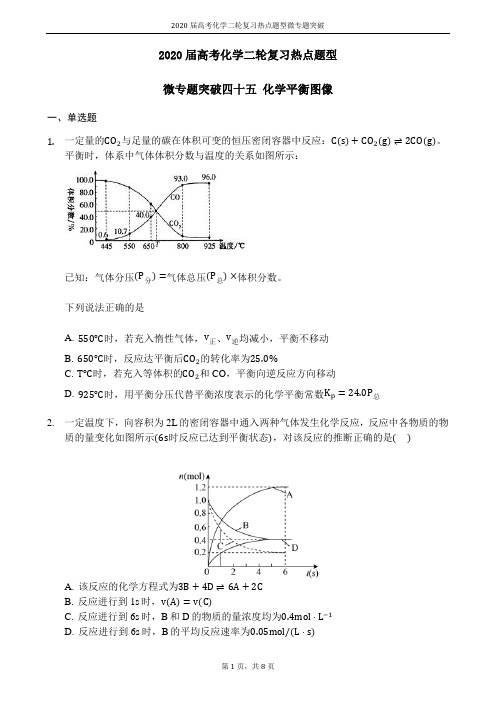
2020届高考化学二轮复习热点题型微专题突破2020届高考化学二轮复习热点题型微专题突破四十五化学平衡图像一、单选题1.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)⇌2CO(g)。
平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。
下列说法正确的是A. 550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动B. 650℃时,反应达平衡后CO2的转化率为25.0%C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数K p=24.0P总2.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是()A. 该反应的化学方程式为3B+4D⇌6A+2CB. 反应进行到1s时,v(A)=v(C)C. 反应进行到6s时,B和D的物质的量浓度均为0.4mol⋅L−1D. 反应进行到6s时,B的平均反应速率为0.05mol/(L⋅s)3.在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),则下图中正确的是(M表示混合气体的平均相对分子质量)()A. B.C. D.4.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)()A. B.C. D.5.下列叙述与图象对应符合的是()A. 对于达到平衡状态的N2(g)+3H2(g)⇌2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动B. 对于反应2A(g)+B(g)⇌C(g)+D(g)△H<0,p2>p1,T1>T2C. 该图象表示的化学方程式为:2A=B+3CD. 对于反应2X(g)+3Y(g)⇌2Z(g)△H<0,y可以表示Y的百分含量6.在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是()A. 可能是减小了反应物的浓度,反应物X2转化率一定减小B. 可能是加入了催化剂,反应物X2百分含量(X2%)将增大2020届高考化学二轮复习热点题型微专题突破C. 可能是缩小了容器的体积,但该反应的平衡常数保持不变D. 可能是升高了温度,该反应的平衡常数一定减小7.反应:2X (g)+Y(g)⇌2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如下图所示,下列判断正确的是()A. P1>P2T1>T2△H<0B. P1>P2T1<T2△H<0C. P1<P2T1>T2△H>0D. P1<P2T1<T2△H>08.在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)⇌xC(g)△H=?,符合图(a)所示的关系,其中w(C)为C的质量分数,由此推断关于图(b)的说法正确的是()A. P3>P4,y轴表示A的转化率B. P3<P4,y轴表示B的体积分数C. P3<P4,y轴表示混合气体的平均相对分子质量D. P3>P4,y轴表示混合气体的密度9.图中表示2NO(g)+O2(g)⇌2NO2(g)△H<0,能正确反映该可逆反应变化的图象是()A. B.C. D.10.某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g)⇌pC(g)的速率和平衡的影响图像如下,下列判断正确的是()A. 由图1可知,T1<T2,该反应正反应为吸热反应B. 由图2可知,该反应m+n<pC. 图3中,表示反应速率v(正)>v(逆)的是点3D. 图4中,若m+n=p,则a曲线一定使用了催化剂11.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH<0下列分析中正确的是()A. 图Ⅱ研究的只是t0时使用催化剂对反应速率的影响B. 图Ⅰ研究的是t0时缩小容器体积对反应速率的影响C. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高D. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂12.某密闭容器中发生如下反应:2X(g)+Y(g)⇌Z(g);△H<0如图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是()A. t3时降低了压强B. t5时提高了温度C. t1−t2时该反应的平衡常数小于t6时反应的平衡常数D. t6时刻后反应物的转化率最低二、填空题13.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)⇌2NO(g)△H>0,已知该反应在240℃,平衡常数K=64×10−4.请回答:(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字2020届高考化学二轮复习热点题型微专题突破母序号).14.元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(2)CrO42−和Cr2O72−在溶液中可相互转化。
化学平衡图像ppt3 人教课标版

A
T
B
P
C
P
D
T
6、其他图象 例题8、一定条件下,将 X和 Y两种物质按不同比例放 入密闭容器中,反应达到平衡后,测得X、Y转化率与 起始时两种物质的量之比 [n(X)/n(Y)] 的关系如下图, 则X和Y反应的方程式可表示为( B ) A.X+3Y C.3X+2Y 2Z Z B.3X+Y D.2X+3Y 2Z 2Z
2、关于转化率或反%或产%—t的图象
问题(1)图象中水平线的意 义?斜率的意义?
(2)温度、压强、催化剂对 图象有什么影响?
解题一般方法:先斜后平
例题4、在密闭容器中进行下列反应: M(g)+N(g) R(g)+2L 此反应符合下面图象, 下列叙述正确的是( C ) A、正反应吸热,L是气体 B、正反应吸热,L是固体
[问题]下图表示的是某可逆反应达到平衡过程中某反应 物的v—t图象,我们知道v=Δc/ Δt;反之, Δc= v×Δt。请问下列v—t图象中的阴影面积表示的是什么?
A、从反应开始到平衡该反应物的消耗浓度 B、从反应开始到平衡该反应物的生成浓度 C、从反应开始到平衡该反应物实际减小的浓度 V正
V逆
例题3、在容积固定的2L密闭容器中,充入X、Y各2mol,发 生可逆反应X(g)+2Y(g) Z(g),并达平衡,以Y 的浓度改变表示的反应速率v正,v逆与时间t的关系如图,则 Y的平衡浓度表达式正确的是(式中S指对应区域的面积) ( A. S a o b B. 1- S a o b C. S a b d o D. S b o d )
例题6、mA(s)+nB(g) qC(g);ΔH<0的可逆反应,在 一定温度下的密闭容器中进行,V(B)%与压强(P)关系如 下图所示,下列叙述正确的是( B、C )
化学平衡图像分析

a+b>c 正反应为放热反应
a+b>c 正反应为吸热反应
a+b<c 正反应为吸热反应
a+b=c 正反应为放热反应
5.速率—温度(压强)图
化学平衡的图像分析
对于反应 2SO2 + O2
SO3 △H<0 ,升温或增压时,
v(正)、v(逆)的变化如下图所示:
v
v
v(逆)
v(正)
v(正)
v(逆)
T
T升高,v(逆)加快程度大于v(正)
p
p升高,v(正)加快程度大于v(逆)
下列各图是温度或压强对反应2A(s)+2B(g) 应
化学平衡的图像分析 2C(g)+D(g)(正反
为吸热反应)的正逆反应速率的影响,其中正确的图象是( )
V V正
V
V逆
V正
V逆
A
T
v
V正
V逆
C
P
T
B
V
V逆 V正
P
D
6.平衡线 与 非平衡点
化学平衡的图像分析
α a
3.作出判断: 依题意仔细分析作出正确判断。
这样的图像!
添加标题
情况1:加入催化剂
添加标题
情况2:当a+b=c时, 采用改变压强的方法
添加标题
B%
可逆反应m A(s)+n B(g) e C(g)+f D(g),反应过程中,当 其它条件不变时,C的百分含量(C%) 与温度(T)和压强(P)的关系如下图, 下列叙述正确的是( )
达平衡后,加入催化剂则C%增大
如图所示,反应:X (g) + 3Y (g) 2Z (g)(正反应为放热反应),在不
人教版高中化学复习课件:平衡图像(共34张PPT)

可用于:
1) (已知反应)判断引起平衡移动的因素。
2)已知引起平衡移动的因素,判断反应是吸热或放热,
反应前后气体体积的变化。
v
v正
•引起平衡移动的因素
v逆
t1
t2
是 增大反应物浓度
,
平衡将向 正 方向移动。
t
v
v正
•引起平衡移动的因素
是 减小生成物浓度
,
v逆
平衡将向 正 方向移动。
t1
t2
t
•已知对某一平衡改变温度时有如下图变化, 则温度的变化是 升高(升高或降低),平衡 向 正 反应方向移动,正反应是 吸 热反应。
1.01×106Pa
1.01×106Pa
c 1.01×105Pa
T
T
T1
正反应 放 热
m+n > p+q
•对于反应mA(g)+nB(g)
pC(g)+qD(g)
C%
1.01×106Pa 1.01×105Pa
A%
1.01×104Pa
200℃
300℃
T
P
•正反应吸热 m+n>p+q
•正反应吸热 m+n=p+q
练:在密闭容器中进行下列反应:M(g)+ N(g) R(g)+2L此反应符合右图,下列叙述正确的是( D )
A.正反应吸热 ,L是气体
R%
B.正反应吸热, L是固体
C.正反应放热 ,L是气体
T2、P2
T1、P2 T1、P1
D.正反应放热 ,L是固体或液
体
t
四、某物质的转化率(或百分含量)-温度(或
化学平衡图像
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
写给外婆,愿她在天堂一切都好。
小九2019年2月6日
外婆家场畔的草丛里,向西斜倾着一棵老杏树。它有着黑色粗桶般的腰身,粗糙的黑黢黢的纹理里长着绿绒绒的苔藓。几只体型硕大身节分明的黑蚂蚁,沿着这些纹路上上下下来来回回地奔忙。
外婆说这杏树比母亲的年龄还大。也许是因为衰老的缘故,也许是由于干硷畔缺少水份,树冠中间夹杂着好多的枯枝,钢戟一样地刺向幽远的天空。杏树叶子并不鲜绿而阔大,但很繁密。风一吹, 叶子哗哗哗地响,叶脉翻动,露出红褐色的叶梗和满枝桠青绿色的果实。
正如我此时,我不经意看到经文,看到佛像,甚至路过一个僧人,一阵清风,都会不自觉想起外婆,想起那一段有点灰沉沉却也每天异常被幸福鼓舞着,温暖包围着喜悦的贫寒季节。。 蛋白 https:///
冥冥之中,外婆去了,却也留下了和我们相逢的最平凡的方式。或许世间最好的相遇,不仅仅长久的陪伴,更是来自灵魂深处的不自觉培植,当一代代人离去,留给了下一代不自觉的敬畏和追思, 也就留下了世间有关虔诚的印记,这些点滴的影子即使化不了高山流水,也会揉进我们的心里眼里,将遇见的山山水水当作生命认知解读的仪式,开启认知和新生。
