第十六章 硼族元素剖析
第16章 硼族元素
Hmө = - 2547kJ·mol-1 C-O 358
室温:2B (s) + 3 F2 (g) = 2BF3 高温:与N2、S、Cl2、Br2、I2 等反应。 2B + N2 = 2BN (氮化硼) 2B + 3Cl2 = 2BCl3 2B + 3S = 2B2S3
B在空气中燃烧的 产物是什么?
H3BO3
乙醚 乙醚
H H
均裂 异裂
空气中允许的最高浓度
2B2H6 + 3LiF + 3AlF3 2B2H6 + 3NaBF4
均裂
B2H6
2L 异裂
2BH3L [BH2L2]+ + [BH4]34 35
36
3、硼氢配合物
硼氢配合物是含有 BH4- 的化合物。 2LiH + B2H6 = 2LiBH4 4NaH + BF3 = NaBH4 + 3NaF 4NaH + B(OCH3)3 = NaBH4 + 3NaOCH3 硼氢配合物是由于含有 H- ,所以是极强的还原剂。 BH4- + 8OH- = H2BO3- + 5H2O +8e ϕӨ = -1.24 V
2B + 2NaOH + 2H2O △ 2NaBO2 + 3H2↑
3、制 备
工业上用碱法分解硼镁矿制取单质硼:
Mg2B2O5 · H2O + 2NaOH = 2NaBO2 + 2Mg(OH)2 4NaBO2 + 10H2O + CO2 = Na2B4O7 ·10H2O + Na2CO3
有氧化剂存在与强碱共熔: 2B + 2NaOH + 3KNO3 △ 3KNO2 + 2NaBO2+ H2O
第十六章硼族元素

2B 2NaOH 3KNO 3 2NaBO 2 3KNO 2 H2O 硼的用途? 铝、镓、铟、铊?铝热还原法?用途?
硼的化合物?
16.3 硼的化合物
1.硼的氢化物
硼烷分类:BnHn+4和 BnHn+6
例: B2H6
B4H10
乙硼烷 丁硼烷
有CH4,但无BH3 最简单的硼烷:B2H6 其结构并非如右图所示:
16.1 硼族元素概述
硼族(ⅢA):B,Al,Ga,In,Tl 价电子构型:ns2np1 缺电子元素:价电子数<价层轨道数 缺电子化合物:成键电子对数<价层轨道数 例如:BF3,H3BO3。 注意: HBF4不是缺电子化合物。
缺电子化合物特点:
a. 易形成配位化合物HBF4 b. 易形成双聚物Al2Cl6
HH HBBH
HH
• 硼烷的结构
B 2s22p1
B:利用sp3杂化轨道,与氢形成
4个B-H( 2c-2e )—— σ 键
2个三中心两电子键(3c-2e)——氢桥键
H BB
记作: H H
H
BB
H
H
H
要点:B的杂化方式, 三中心两电子键、氢桥键。
B4H10分子结构
119pm
。
122
H
H HBH H
B
H O
B
O
H O
H
多硼酸 xB2O3·yH2O
硼酸是几元酸?
性质: • 一元弱酸 (固体酸,Lewis酸)
H3BO 3 H2O
B(OH)
4
H
K =5.8×10-10
- • 与多羟基化合物加合,甘露醇,甘油等
chapter 16 第16章 硼族

NaOH 滴定。多基化合物(如甘露醇、甘油等)与 H3BO3 反应生成稳定的配合物并使显示强酸性,从 而使滴定法可用于测定硼含量:
Ka值表明 H3BO3 的酸性极弱,不能直接用
•与多羟基化合物加合,加入甘露醇、甘油 等酸性增强
H H
B(OH) + 2
4
R C
C
OH OH
H H
R C
C
O O
B
O O
② 正常的B-B σ 键(2c-2e bond )
③ 开放的B 桥键(3c-2e bond ):
B B B
H
④ 氢桥键(3c-2e bond ):
B
B
B
⑤ 闭合的B 桥键(3c-2e bond ):
B B
例1:B5H9
H H H B H B B H H B B H H H
例2:B6H10
H H H B H B H H B B H B B H H H
与外部B12 成键共用去4e + 6e = 10 e
2. B12 单元内部成键 :
由“多面体顶角规则”确定:
多面体顶点数 n=12 成键轨道数 =n+1=13 成键电子数=2n+2=26 总的价电子数:10 + 26 = 36 与B12价电子数一致。
2. 硼的性质√
(1) B易在空气燃烧(与氧的亲和力超Si)
(3) 与酸的作用:它不与盐酸作用, 仅与氧化性酸作用。
B + 3HNO 3 H 3 BO 3 + 3NO 2 2B + 3H 2 SO4 2H 3 BO 3 + 3SO2
(4) 有氧化剂存在时与强碱共融生成偏硼酸盐:
第16章-硼族元素

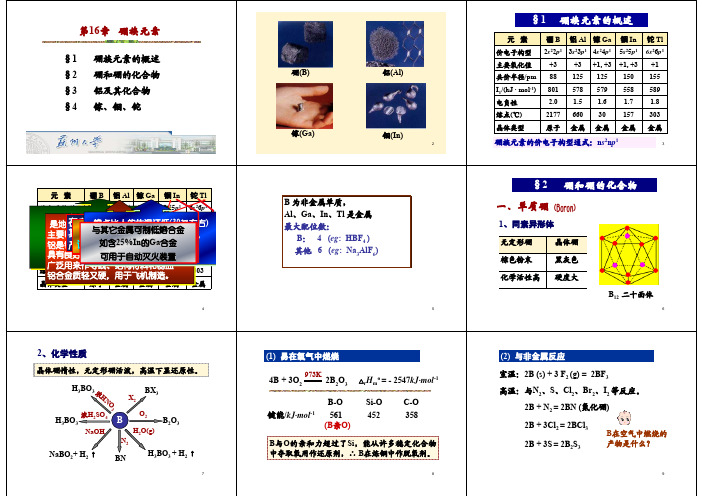
第16章硼族元素16.1 硼族元素的通性16.1.1 硼族元素的通性包括硼、铝、镓、铟、铊五种元素。
硼在自然界中有硼镁矿、硼砂等;铝在地壳中的含量仅次于氧和硅,占第三位,主要以长石、云母、高岭土等硅酸盐形式存在。
镓、铟、铊比较分散,没有单独矿藏,与其他矿物共生。
硼的原子半径最小,核电荷对外层电子的吸引较强,为非金属,其余四种元素为金属,从硼到铝是由非金属突变到金属,不是逐渐过渡的。
●硼族元素氧化物的酸碱性递变规律:硼的氧化物呈酸性,铝和镓的氧化物为两性,铟和铊的氧化物是碱性的。
●硼族元素的价电子构型为ns2np1,一般氧化态为+III。
“惰性电子对效应”,随着原子序数的递增,生成低氧化态的(+I)的倾向增强。
镓、铟、铊在一定的条件下能显示出+I氧化态,特别是Tl ,其+I氧化态常见,Tl(+I)的化合物具有较强的离子健特征。
●硼、铝两元素亲氧特性表现得突出。
●硼族元素价电子轨道(ns和np)数为4,而价电子仅为3,为缺电子原子,它们所形成的化合物有些为缺电子化合物。
有空的价键轨道,这些化合物有很强的接受电子的趋势,容易形成聚合分子(如:Al2Cl6)和配合物(如:HBF4)。
在此过程中,中心原子价轨道由sp2杂化过渡到sp3杂化,相应分子从平面结构过渡到立体结构。
硼原子最高配位数为4,而其它元素外层d轨道可参与成键,最高配位数可以为6。
16.2 硼族元素的单质及其化合物硼在自然界主要以含氧化合物的形式存在。
硼的重要矿石有硼砂Na2B4O7·10H2O,方硼石2Mg3B8O15•MgCl2,硼镁矿Mg2B2O5•H2O等。
铝在自然界分布很广,主要以铝矾土矿形式存在,它是一种含有杂质的水合氧化铝矿。
镓、铟、铊在自然界单独矿物,以杂质的形式分散在其它矿物中。
16.2.1 硼族元素的单质1. 单质硼(1) 单质硼的结构单质硼有多种同素异形体,包括无定形硼和晶体硼。
无定形硼为棕色粉末,晶体硼呈黑灰色。
16 无机化学 第十六章 硼族元素

2Al+2OH-+6H2O=2Al(OH)4-+3H2↑
二、镓单质
Ga具有熔点与沸点相差甚远这一特点,302.8~2676K,即 液态温度范围很宽(拿到水中就可熔化,像水银),可用 来制高温温度计。 镓的另一特点是“热缩冷胀”,从液 体到固体,体积膨胀3%。 制铅字合金,使字更为清晰。
Ga、In多用于电子工业,作P型半导体的掺杂剂。 也可制 Ⅲ—Ⅴ族半导体化合物,如GaAs等,可用于 光电管中。
实验室: 4HBO2+NaOH=NaBO2 + H2O
(浓) H3BO3 +2NaOH=Na2B4O5(OH)4+5H2O (稀)
滴定H+: Na2B4O5(OH)4+3H2O+2HCl=4H3BO3+2NaCl
3-1 铝族元素单质:
一、铝单质:
用 途
铝已遍及每个家庭,铝及合金广泛地 用于建筑材料、机械化工、食品工业 中,铝是光和热的良好反射体。利用 铝能够很好的反射光,可制造探照灯 的灯罩和反射望远镜的镜子。
γ-Al2O3颗粒小,具有强吸附能力和催化活性,又名活性氧 化铝,可以用作吸附剂和催化剂。
4、氢氧化铝:
在Al3+盐中加入CO32-能得到Al(OH)3 (水解完全)。
Al(OH)3结构较为稳定,加热至373K不脱水。 Al(OH)3是典型的两性化合物,新制备的Al(OH)3既 溶于酸又溶于碱。
二、铝盐和铝酸盐:
制备:灼烧Al(OH)3 或水合氧化铝,可制得α-Al2O3
2、β-Al2O3
主要性能:离子传导能力(允许Na+通过),用作钠-硫蓄 电池的电解质,这种电池的蓄电量为铅蓄电池的3—5倍。
加NH3•H2O或碱于铝盐溶液中,都会得到Al2O3nH2O, 长时间放置(脱水)逐渐转变为AlO(OH)或HAlO2。
16第十六章 硼族元素

R-
CH
C H H3H 2O
R'
R'
R
R' R
H C O H HO
OH H O C H
B
H C O H HO
HOCH
R'
R'
第十六章 硼族元素
如:与甘油反应——生成强酸
C H 2-O H
C H 2-O
O -C H 2
B (O H )3+2C H -O H H O -C H BC H -O H+H ++3H 2O
沸点/K 173 286 364 483
均共价化合物,蒸气分子为单分子。
第十六章 硼族元素
1. 分子结构:平面三角形
B采取sp2杂化:
分子内含有
6 4
:未参与杂化的p空轨道与
3个X原子的充满电子的p轨道肩并肩重叠
形成
缺电子分子;BX3均为共价化合物,分子 晶体。
第十六章 硼族元素
2. 主要性质(缺电子分子的性质) (1) 均路易斯酸
1. 共价性:硼所有化合物均为共价化合物。 2. 缺电子性:易与电子对给体形成σ配键 (B F 4),易形成多中心键(例:3c-2e)。 3. 多面体特性:晶体硼和硼的许多化合物 为多面体。
二、单质硼 1. 同素异形体:
第十六章 硼族元素
无定形硼:棕色粉末,反应活性较高
晶形硼:原子晶体,黑灰色,硬度高、电阻
C H 2-O H
C H 2-O O -C H 2
iv. 与醇发生酯化反应:H3BO3的鉴定
H 3 B O 3 + 3 C 2 H 5 O H 浓 H 2 S O 4 B ( O C 2 H 5 ) 3 + 3 H 2 O
16.第十六章 硼族元素

T13、何为“对角线关系”?哪几对元素具有对角线相似性? 、何为“对角线关系” 哪几对元素具有对角线相似性? 一种元素与其左上方或右下方元素性质的相似性, 一种元素与其左上方或右下方元素性质的相似性, 称为对角斜线规则。 称为对角斜线规则。 原因是由于具有相似的半径和离子势。 原因是由于具有相似的半径和离子势。 主族: 主族: ⅠA ⅡA ⅢA ⅣA Li Be B C Na Mg Al Si
7
硼烷的五种键型( 硼烷的五种键型(P778-779) ) H B—H
2c-2e键 键
B B B—B 2c-2e键 键 B B B
3c-2e 开口硼桥键
B B
3c-2e 闭合硼键
B
3c-2e氢桥键 氢桥键
B B B
丁硼烷B 丁硼烷 4H10的结构(巢状) 的结构(巢状)
8
癸硼烷B 癸硼烷 10H14的笼状结构
15
硼酸溶液中加入甘油,酸性增强: 硼酸溶液中加入甘油,酸性增强:
R R R
H
H 3 BO3 + 2
H H
C C
R'
OH OH
H
H
C
C
R'
O
O
B
O O
C C
R'
+ H + + 3H 2 O H
R
R
硼酸酯,易电离。 硼酸酯,易电离。
பைடு நூலகம்
过程: 过程: 硼酸受热易分解
H
H
C
C
R'
O
O
H HO
H HO
B
OH H
△
B O
△
两个B以 杂化成键 两个 以sp杂化成键
第16章 硼族元素..

第十六章硼族元素§16-1 硼族元素的通性硼族元素:B、Al、Ga、In、Tl价电子层结构:ns2np1主要氧化数: B Al Ga In Tl+3 +3 +3,(+1) +1,+3 +1,(+3)从Al开始为金属,但成键时表现为极性共价键+3氧化态化合物特点:缺电子,易聚合,易与路易斯碱形成稳定化合物元素电势图(P769):所有单质都具有还原性,无氧化性,碱性条件下还原性更强。
酸性条件下Tl3+具有较强氧化性,Ga2+、In2+、In+易歧化。
§16-2 硼族元素的单质及其化合物一、硼族元素在自然界中的分布二、硼族元素的单质2Al3.镓、铟、铊Ga: 银白色光泽的软金属。
熔、沸点相差最大,m.p.=302.78K,b.p.=2343K。
凝固时体积膨胀。
在干燥的空气中不起变化。
两性金属。
In: 银白略带淡蓝色金属,比铅还软。
在干燥的空气中不起变化。
不与碱作用。
Tl:灰白色,重而软的金属,在空气中生成一层Tl2O膜。
不与碱作用。
化学性质:M+O2(或S) 灼热M2O3(或M2S3)(M=Ga,In,Tl)M+X2= MX3(M=Ga,In,Tl)(X=Br,Cl; Tl无三溴化物)M+IMI3(或MI)(M=Ga,In)2In(粉末)+6H2O=2In(OH)3+3H2↑M+HCl MCl3(或MCl)+H2↑M+HNO3(稀)M(NO 3)3(或MNO3)+NO↑+H2O2Ga+2NaOH+6H2O=2Na[Ga (OH)4]+3H2↑4.单质的提取和冶炼B的制备:碱法:Mg2B2O5.H2O+2NaOH=2NaBO2+2Mg(OH)24NaBO2+CO2+10H2O=Na2B4O7.10H2O+Na2CO3Na2B4O7+H2SO4+5H2O=4H3BO3+Na2SO42H3BO3O3+3H2OBB2O3+3Mg=2B+3MgO酸法:Mg2B2O5.H2O+2H2SO4=2H3BO3+2MgSO499.95%单质B的制备:2BI3 1000-1300K,钽丝2B+3I2Al的制备:Al2O3+2NaOH+3H2O=2Na[ Al(OH)4]2Na[Al(OH)4]+CO2=2Al(O H)3↓+Na2CO3+H2O2Al(OH)Al2O3+3H2O2Al2O3Na3AlF6, 电解4Al+3O2 Ga的制备:Ga(OH)3OH-Ga(OH)4-电解GaGaCl3+HCl TBP萃取HGaCl4 OH-, 电解Ga三、硼的氢化物(硼烷)两类:B n H n+4:B2H6, B5H9, B6H10……B n H n+6:B3H9,B4H10,B5H11……B2-B4 为气体,B5-B8为液体B2H6制备:质子置换法2B2H6加压B4H10+H2B2H6+2LiH=2LiBH4硼烷中的五种成键情况:端侧的2中心-2电子硼氢键B-H;3中心-2电子氢桥键HB B2中心-2电子硼-硼键B-B开放的3中心-2电子硼桥键 BB B闭合的3中心-2电子硼键 BB B四、卤化物1.B、Al的三卤化物BX3制备:置换法B2O3+6HF=2BF3↑+3H2OB2O3+3CaF2+3H2SO4(浓)=2BF3↑+3H2O+3CaSO4BF3(g)+AlCl3=AlF3+B Cl3↑B2O3+3C+3Cl2=2BCl3+ 3CO2B+3X2=2BX3BX3性质:加合性及水解性4BF3+6H2O=3H3O++3BF4 -+B(OH)3BCl3+3H2O=B(OH)3+3H Cl无水AlCl制备:2Al+3Cl2(g)2AlCl32Al+6HCl(g) 2AlCl 3+3H2↑Al 2O3+3C+3Cl22AlCl3+3COAlX3中AlF3为离子型,其它为共价型。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Tl(OH)3 -0.05 TlOH -0.344 Tl
Tl3+的化合物具有强氧化性 Tl+的化合物特别稳定
§16-2 硼及其化合物
2-1 硼在自然界的存在
——以硼酸盐的形式存在 主要矿有:
硼砂—— Na2B4O7·10H2O 方硼矿—— 2Mg3B8O15 ·MgCl2 白硼钙石——Ca2B6O11·3H2O 等
23 44 36 34 50
2.04 1.61 1.18 1.78 1.62
(1) 基态原子的价电子构型
—— ns2np1——缺电子原子 第二周期的元素,价层电子数小于价层轨道数的原子 是缺电子原子。
(2) 特征氧化态—— +3
B 、Al 只有稳定的+3氧化态。 Ga、In、Tl除+3氧化态外,还有+1氧化态,并且 +1 氧化态随主量子数 n 的增大,GaTl趋于稳定。
(小结惰性电子对效应,并探讨其产生的原因。)
§16-1 硼族元素的通性
表16-1 硼族元素的基本性质
元素 性质 原子序数 价层结构 主要氧化数 共价半径 / pm M3+离子半径 / pm
B Al Ga In Tl
5
13 31 49 81
2s22p1 3s23p1 4s24p1 5s25p1 6s26p1
第十六章 硼族元素
本章主要介绍:硼元素的缺电子特性和 多中心键;硼的重要化合物和金属铝及其重 要化合物制备、性质和用途;对角线规则; 惰性电子对效应。
对镓、铊的单质及其重要化合物的制备、 性质和用途仅作一般了解。
一、教学要求:
1、通过硼、铝及其化合物的结构和性质的学习,了解硼 的缺电子特性,以及硼与铝成键的相似性和差异性。
+3 +3 +3(+1) +3(+1) +3(+1)
82 118 126 144 148
20 50 62 81 95
电离能( kJ·mol-1)
E1 / kJ·mol-1 电负性(xp)
I1 800.6 577.6 578.8 558.3 589.3 I2 2427 1817 1979 1821 1971 I3 3660 2745 2963 2705 2878
B的原子半径小,I1、I2、I3 大,B在形成化合物时: 可以采取sp2杂化成键,例如:BX3、B(OH)3
也可以采取sp3杂化成键,例如:BF4-、 BH4-、 B(OH)4-
Al
AlF63-
-2.13
Al(OH)3 Al(OH)4-
-2.31 Al -2.35
Ga3+ -0.65 Ga2+ -0.45 Ga
Ga(OH)4- -1.22 Ga
-0.52
铝易置换氢氟酸中的 In3+ -0.45 In2+ -0.35 In+ -0.25 In 氢——为什么?
-0.34
Tl3+ 1.25 Tl+ -0.336 Tl 1.36 TlCl -0.557
2、掌握硼、铝、铊的单质及其重要化合物的制备、性质 和用途;了解镓的性质和用途。
3、熟悉Tl+的化合物的稳定性以及TlX与AgX的某些相似 性,Tl2O3、TlF3等在酸性介质中的强氧化性。
4、掌握惰性电子对效应和对角线规则。 5、掌握Al3+的鉴定方法。
二、教学时数: 4学时
三、典型习题: P791-792: 2、3、6、7、8、9(2)(3)(4)、11、14
我国西部地区的内陆盐湖和吉林、辽宁等省有硼矿。
2-2 硼的成键特征
(硼的化学主要表现在缺电子性质上)
(1) 基态B的价层结构
B是缺电子原子
B
2s2
2p1
(2) 硼化合物中激发态B的价层电子分布
B可采取sp2、sp3
杂化轨道成键
B
2s1
2p2
(3) 硼原子成键的三大特征
① 共价性——B以形成共价化合物为特征
Tl+ 的化合物特别稳定。
(3) 成键特征
B 的原子半径较小,电离能在本族元素中最大,电子 亲合能小,电负性较大,成键时形成的是共价键。
Al、Ga、In、Tl虽是金属,但+3这一较高氧化态以及 Ga、In、Tl的18e壳层的结构(离子极化力强),使得它们 形成化合物时化学键也是以共价键为主。
事实上, Al、Ga、In、Tl的化合物中,仅在AlF3、 Al2O3、Al2(SO4)3和Tl+的化合物等中的化学键是离子键。
从下面所列的键能还可以看出: B不但与Al的性质 相似,而且类Si, B、Al均是亲O、亲F的元素。
表16-2 B、Si、C的某些单键的键能
键
B-H Si-H C-H
B是亲O、亲F
键能(kJ·mol-1) 389
318
411 元素,其次是Si。
键
B-O Si-O C-O
键能(kJ·mol-1) 561 452 358
2Al +素的电势2图A(l +图2N16a-O1)H:+ 6H2O === 2NaAl(OH)4 + 3H2
φAθ / V :
Al 在酸、碱介质中 φBθ / V : 都表现出强还原性
H3BO3
-0.73
B
B(OH)4-
-2.5 B
Al3+
-1.67
B、Al不但是缺电子原子,而且形成的+3氧化态的 共价化合物仍具有空的 p 轨道,使得B 、Al 的化合物 (如:BF3、AlCl3等)表现出缺电子性,它们还有很强的继 续接受电子对的能力。这种能力表现在分子的自身聚合 (如Al2Cl6)、同电子给予体形成稳定的配合物(如BF4-)以及 多中心键( 3c-2e 键 )等方面 。
第十六章 硼族元素
ⅢA—— B 、Al 、Ga 、In 、Tl —— 称硼族元素
其中Ga 、In 、Tl 及Ge属分散性稀有元素, 没有单独的矿藏。
本章主要讲述: (1) B 及其化合物中的多中心键( 3c-2e 键 ); (2) B 、Al 及其重要化合物的结构、性质、制备和用途; (3) B与Si的相似性(对角线规则); (4) Tl+的稳定性, Tl(Ⅲ)的化合物的不稳定性。
键
B-F Si-F C-F
键能(kJ·mol-1) 613 565 485
键
B-B Si-Si C-C
键能(kJ·mol-1) 293 222 346
而C 的自相 成键能力最 强
铝热反应:4Al + 3O2 == 2Al2O3 rHm = -3339 kJ·mol-1
冰晶石矿Na3[AlF6]的存在,说明Al也是亲O、F的元素。
