根据化合价书写化学式交叉约简法
九年级化学上学期期末复习
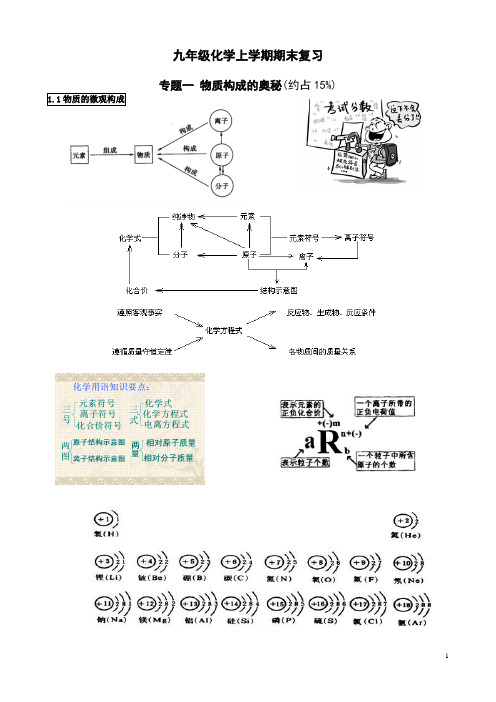
九年级化学上学期期末复习专题一物质构成的奥秘(约占15%)一:分子1.分子、原子的区别和联系2.用原子、分子的观点解释常见现象⑴物质变化:构成物质的 没有改变,只是运动速率、分子间间隔等发生改变,如挥发、扩散、蒸发、三态变化、热胀冷缩、酒精与水等体积混合后总体积变小等。
⑵化学变化: 发生了改变,分裂成原子,原子重新组合成新分子,分子再构成新的物质。
●化学反应的实质:在化学反应中分子 ,原子 。
二:原子1.构成物质的基本微粒有 、 、 ,构成原子的微粒是 、 、 三种。
如:铁是由 构成 ,氯化钠是由 构成,水是由 构成。
分子是保持物质 的最小微粒,而 是化学变化中的最小微粒。
2.五决定:原子的质量主要集中在 上 ;相对原子质量大小取决于 和 之和;与元素化学性质关系最密切的是 ;元素种类 (或元素间的本质区别)决定于 ;元素的化合价与 关系密切。
3.原子的结构①每个质子相对原子质量约等于1,约等于一个 原子的质量。
质子 ②每个质子带一个单位的 电荷。
③决定 种类。
原子核 ①每个中子相对原子质量约等于1,约等于一个氢原子的质量。
原 中子 ② 电荷。
③决定同类元素中的不同种原子。
子 ①质量约等于 (或 )质量的1/1836。
②每个电子带一个单位的 电荷。
③核外电子分层排布, 最外层电子数决定 的性质。
原子中:核电荷数 = 数 = 数 相对原子质量≈质子数 + 中子数。
(为什么?) 阳离子:核电荷数=质子数>核外电子数 阴离子:核电荷数=质子数<核外电子数 三:离子1.概念:带电的原子或原子团叫 。
带正电的离子叫 , 叫阴离子。
2.Fe 、 Fe 2+ 、Fe 3+ 具有相同的 ,属于同一种 ,但它们的 不同因而化学性质也不同。
3.一种元素的原子变成离子:一定改变的是 ,一定不变的 ,可能改变的是 。
(有几个填几个)4.同种元素的原子和离子一定具有相同的 。
一:物质的组成——元素1.元素定义:具有 (或 )的一类 的总称。
化合价和计算2013

SO2
8.填表:写出各物质的化学式
化学式 负价元素 正价 元素
+1
H HCl H2SO4
+2
Mg
Al
+3
-1
Cl
MgCl2
MgSO4
AlCl3
Al 2(SO4)3
-2
SO4
1.(2013· 福州)下列化学用语与含义不相符的是 ( ) A.O2—2个氧原子 B.Ca2+—钙离子 C.P2O5—五氧化二磷 D.2H2O—2个水分子
化学式
会判断
能写出
化合价
1.交叉约简法确定化学式
-2
O
+5
+5
P
PO
-2
P2O5
答案: Al2O3 Cl2O7
-2 O +2 Ca +3 Al
• 写出下列元素或原子团组成的化合物
SO2
+7 Cl
Ca(OH)2
-2 O +4 S
-2 O
-1
OH
2.确定物质中某元素的化合价
确定氯酸钾中氯元素的化合价 【思路】 先写出化学式 KClO3
=1:16:32
注意:各元素的质量比=化合物中各元素的 相对原子质量与原子个数积的比值。
3.计算物质中某元素的质量分数
R元素的质量分数=
R的相对原子质量х化学式中R的原子个数 物质的相对分子质量 Х100%
NH4NO3 中氮元素质量分数= 计算水中氢元素的质量分数是多少? 14 × 2 水中氧元素的质量分数是多少? ×100﹪ =35﹪
三价记住磷酸根;
PO4
通常为负除铵根。
NH4
元素的化合价与离子符号的关系如何 ? +2
化学式的书写及简单化合物的命名。睢中附中

【链接中考】 链接中考】
常州) 元宵节是我国的重要传统节日 元宵节是我国的重要传统节日, (2010常州)1.元宵节是我国的重要传统节日,“接汉疑 常州 星落,依楼似月悬。 星落,依楼似月悬。”是唐代著名诗人卢照邻对其盛况的 写照,我国许多地方至今仍保留着燃灯放焰、 写照,我国许多地方至今仍保留着燃灯放焰、共吃元宵的 风俗。 风俗。 (1)某红焰烟花的配方中包括硫、木炭粉、硝酸锶 )某红焰烟花的配方中包括硫、木炭粉、 【Sr(NO3)2】等。 +2 硝酸锶中Sr的化合价为 的化合价为: ①硝酸锶中 的化合价为: ▲ ; 南京) 金属钒被誉为 合金的维生素” 金属钒被誉为“ (2010南京)2.金属钒被誉为“合金的维生素”。五氧化 南京 中钒元素的化合价为( 二钒(V 二钒 2O5)中钒元素的化合价为( ) 中钒元素的化合价为 D A.-3 B.+ 1 . . C.+ 3 D.+5 . .
课题二 化学式的书写 及简单化合物的命名
睢中附中 许继升
复习: 复习:化合价口诀
一价氢氯 一价氢氯钠钾银 二价氧 二价氧钙钡镁锌 三铝四硅五价磷 三铁, 二、三铁,二、四碳 二、四、六硫都记全 铜汞二价最常见 氧二为标准 氢一氧二 氢一氧二为标准 单质价态总为零。 单质价态总为零。
一、化学式的书写
(一)根据化合价写化学式的方法: 根据化合价写化学式的方法:
1.最小公倍数法: 1.最小公倍数法: 已知磷有一种氧化物,其中磷 已知磷有一种氧化物, 的化合价为 +5 ,写出这种磷 的氧化物的化学式。
化学知识点

(一)、原子(1)由于原子核所带电量与核外电子的电量相等,电性相反,故整个原子不显电性,即核电荷数=质子数=核外电子数。
(2)除相对原子质量为1的普通氢原子不含中子外,其他原子都是由质子、中子、电子三种粒子构成的。
(3)核电荷数(即质子数)决定了元素的种类。
(4)电子的质量很小,可以忽略不计,所以原子的质量主要集中在原子核上。
(二)、相对原子质量以一种碳原子的质量的1/12(约1.66×10-27kg)作为标准,其他原子的质量跟它相比较所得的比值,就是这种原子的相对原子质量,即1、为什么要引入相对原子质量?原子的实际质量很小,一般只有10-27kg左右,这样小的数字,记忆、书写都很不方便,就像用吨作单位来表示一粒稻谷的质量一样,为了解这一问题,就引入了相对原子质量。
2、相对原子质量与原子的质量有什么区别?原子的质量是原子的实际存在的物质的多少,是实际质量或称为真实质量,相对原子质量是以12C原子质量的1/12为标准来表示物质质量多少的相对质量,原子质量的单位是kg,相对原子质量的单位是1。
3、原子质量与相对原子质量的区别与联系4、A、B两原子的相对原子质量之比=A、B两原子的质量之比。
(四)、元素具有相同核电荷数(即核内质子数)的一类原子总称为元素1、地壳中元素的含量地壳中含量较多的四种元素是氧(O)、硅(Si)、铝(Al)、铁(Fe)2、元素符号(1)来源:是这种元素拉丁文名称的第一个大写字母,如果几种元素名称的第一个大写字母相同时,再附加一个小写字母来区别。
(2)书写:第一个字母大写,第二个字母小写,如钙Ca、铜Cu。
(3)表示意义:①表示一种元素;②表示这种元素的一个原子,既有宏观意义,也有微观意义。
如H表示氢元素,也表示一个氢原子,但2H只表示2个氢原子。
3、元素周期表简介元素周期表共有7个横行,18个纵行,每个横行叫做一个周期,每个纵行叫做一个族,所以元素周期表有7周期,16个族(8、9、10三个纵行共同组成一个族)。
2.4化学式及有关计算(2013年版)【中考化学专题复习】

班级 姓名 学号 使用时间:2013年 月 日 计划 专题二 物质构成的奥秘2.4化学式及有关计算(2013年)【中考导航仪】【教材放大镜】用 和 的组合表示物质组成的式子,如H 2O 表示水。
2.每种纯净物的组成是,所以表示每种物质组成的化学式只有 个。
3.4.元素符号周围数字的意义a :表示有a 个R 粒子(原子、分子或离子等)b :表示一个粒子中含有b 个某原子c :表示一个R 离子带c 个正(或负)电荷d :表示(某化合物中)R 元素的化合价为±d 价 5.化学式的书写:6.化学式的读法:①固态单质直接读名称:如Cu读作铜;气态单质在名称后加“气”,如H2读作氢气。
②化合物一般从右向左读“某化某”,例如:ZnS读作硫化锌。
有时还要读出化学式中各元素的个数,如Fe3O4读作四氧化三铁。
数目,是不同元素的原子时表现出来的一种。
它与原子最外层电子数有非常密切关系。
●化合价的实质:元素的一个原子与其他元素的原子化合时,得失电子的数目或共用电子对的数目。
2.化合价的规律:⑴在化合物中氢通常显____价,氧元素通常显______价;⑵在金属化合物中金属元素一般显____价,非金属元素一般显____价;⑶单质中元素的化合价为_______;⑷在化合物里各元素的正负化合价的代数和为____;⑸一些元素在不同物质中可显______的化合价。
3.化合价的表示方法:书写在元素符号的。
【练习】试着标出下列物质中各元素的化合价:CaO Fe2O3H2KOH CO2CO4.例题:求高锰酸钾中锰元素的化合价(KMnO4)①标出常见元素的化合价:KMnO4②设锰元素的化合价为X,列出方程:(+1)×1+X×1+(-2)×4=0③求得X=7 所以:锰元素的化合价为+7价。
⑶根据原子团计算某元素的化合价计算硝酸铵中氮元素的化合价■原子团是指,又叫。
1.元素化合价口诀氢+1,氧-2,银锂钠钾+l价,锌镁钙钡+2价,铝+3,硅+4;只遇金属或是氢,氮磷-3、硫-2,氯碘氟溴总-1。
巧写化学式

巧写化学式
作者:郝玉香
来源:《新课程·中旬》2015年第02期
学好化学的基础是熟练掌握化学语言,而化学式的书写是重中之重,下面我们就来看一下如何根据化合价写出化学式。
一、根据化合价书写化学式
例1.已知硫元素为+4价,氧元素为-2价,写出化学式。
步骤一:先排序(正价在前,负价在后)
SO
步骤二:后标价(标出各元素的化合价)
步骤三:约最简(把化合价的绝对值进行化简)
步骤四:再交叉(交叉相乘,把数字写在元素符号的右下角,“1”可省略)
例2.已知铁元素的化合价为+3价,硫酸根为-2价,写出化学式。
注意:把原子团当成一个整体,当原子团的个数大于1时,原子团要加上括号。
二、巧读化学式
例.读出下列化学式。
1.CO2、P2O5、Al2O3、NaCl
读作:二氧化碳、五氧化二磷、氧化铝、氯化钠
2.H2SO4、HNO3、HCl、H2CO3
读作:硫酸、硝酸、盐酸、碳酸
3.NaOH、Ca(OH)2
读作:氢氧化钠、氢氧化钙
4.Na2CO3、Mg(NO3)2、NH4NO3
读作:碳酸钠、硝酸镁、硝酸铵
小结化学式的读法:
从右往左,读作“某化某”(“几氧化几某”)“某酸”“氢氧化某”“某酸某”等。
编辑范昕欣。
化合价定稿

完成《同步学习》 88-90页
名称(符号) 化合价
氢氧根(OH) -1
硝酸根(NO3) -1
硫酸根(SO4) -2
碳酸根(CO3) -2
铵根(NH4)
+1
离子符号
OH-
NO3SO42CO32NH4+
名称(符号) 化合价
氢氧根(OH) -1
硝酸根(NO3) -1
硫酸根(SO4) -2
碳酸根(CO3) -2
(N) +5
硫 (s)
-2
铜
+1 硫酸根
+4 (Cu) +2 (SO4) -2
+6
氧
氯
锌
碳酸根
(O) -2 (Cl) -1 (Zn) +2 (CO3) -2
钠
钾
银
铵根
(Na) +1 (K) +1 (Ag) +1 (NH4) +1
学习目标
• 1、认识化合价的确定方法,并能正确 表示化合价。
• 2、掌握常见元素的化合价,能根据化 合价书写物质的化学式。
Al2O3 5.检查 正负化合价的代数和为零。
已知铝元素的化合价为+3, 氧元素的化合价为-2,写出氧化 铝的化学式.
Al2O3
正左负右上标价,交叉约简写右下。
+5价的磷元素与-2价的氧元素 组成化合物的化学式。
P2O5
+3价的铁元素与-2价的氧元素 组成化合物的化学式。
Fe2O3
正左负右上标价,交叉约简写右下。
-2
铜
+1
(N) +5 (S) +4 (Cu) +2
化学式与化合价2

一价氢氧硝酸根, 二价硫酸碳酸根, 正一价只有铵根。
熟练掌握常见元素 和五个原子团的化 合价!
6、根据元素化合价写出物质的化学式
例1:已知磷元素的化合价为“+5”价,氧元素的化合价 为 “-2”价,试写出这两种元素组成化合物的化学式。 ①先写出组成化合物的元素符号,一般把正价的写在左边, 负价的写在右边。把化合价注在元素符号上方。 +5 -2 ②求出两种元素化合价绝对值的最小公倍数:10 最小公倍数 = 原子数 ③求各元素的原子数 正价(或负价)的绝对值 10 = 2 O:10 =5 P: 5 2 ④把原子数标在相应的元素符号的右下角,即得化学式. P2O5 ⑤检验各元素正负化合价的代数和是否为零,如不等于零, 化学式不正确. (+5) ×2+2(-5)=+10+(-10)=0
3、已知:Fe为+3价,O为-2价,写出铁的这种氧化物的化学式。 Fe2O3
FeO Fe2O3 注意:氧化亚铁: 氧化铁:
思考:硫酸亚铁和硫酸铁、氯化铁和氯 化亚铁都应怎么书写?
填表:写出各物质的化学式
正价 元素 化学式
负价 元素
H +1
Mg +2
+3 Al
Cl -1
HCl
MgCl2
AlCl3
SO4 -2
A ROH
B R(OH) 2
C
R(OH) 3
D
R(OH) 4
正负总价和为0 判断
化学式
书写
化合价
一般原则:符号、标价、约简、交叉
