(教师参考)高中化学 1.2.2 常见物质的检验课件2 苏教版必修1
合集下载
苏教版高中化学必修一课件1.2.2常见物质的检验
容易做到。 (3)排除干扰物的影响:需要检验的物质中如果有干扰物存 在,则需要选择试剂对干扰物进行排除;要注意加入不同 的鉴别试剂进行检验时,要排除前次加入试剂可能引起的 干扰。
探究:
1.向溶液中加入Ba(NO3)2溶液,产生白色沉淀,能否说明
溶液中一定有SO42-?试分析检验SO42-时应如何操作? 提示:不能。检验SO42-时,加入Ba(NO3)2溶液,CO32-也能 与Ba2+结合生成白色沉淀,故应先加入盐酸排除 CO32-存在的 可能。
稀硝酸白色沉淀不溶解,则表明待测液中肯定含有SO42D.向待测液里加入过量的硝酸无现象,再加入硝酸银溶液, 若产生白色沉淀,则表明待测液中肯定含有Cl-
【解析】选D。钠元素的焰色反应为黄色,故用铂丝蘸取待 测液在火焰上灼烧,若火焰呈黄色,则表明待测液中肯定 含有Na+,A错;向待测液里加入过量的盐酸,若产生能使 澄清石灰水变浑浊的无色无味的气体为CO2,则表明待测液 中可能含有CO32-或HCO3-,B错;向待测液里加入BaCl2溶液, 若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,该
后其现象为:有气体放出;无变化;生成白色沉淀;生成红
褐色沉淀;先生成白色沉淀后溶解。
3.(2011·上海高一检测)鉴定NaCl的最佳方法是()
A.焰色反应呈黄色,加HNO3酸化的AgNO3有白色沉淀
B.焰色反应呈紫色,加盐酸酸化的AgNO3有白色沉淀 C.焰色反应呈黄色,加盐酸酸化的AgNO3有白色沉淀 D.焰色反应呈紫色,加HNO3酸化的AgNO3有白色沉淀 【解析】选A。钠的焰色反应呈黄色,氯离子的检验应用硝 酸酸化的AgNO3,AgNO3溶液不能用盐酸酸化,用盐酸酸化 会产生沉淀,无法用于Cl-的检验。
D.焰色反应是某些金属离子的性质
探究:
1.向溶液中加入Ba(NO3)2溶液,产生白色沉淀,能否说明
溶液中一定有SO42-?试分析检验SO42-时应如何操作? 提示:不能。检验SO42-时,加入Ba(NO3)2溶液,CO32-也能 与Ba2+结合生成白色沉淀,故应先加入盐酸排除 CO32-存在的 可能。
稀硝酸白色沉淀不溶解,则表明待测液中肯定含有SO42D.向待测液里加入过量的硝酸无现象,再加入硝酸银溶液, 若产生白色沉淀,则表明待测液中肯定含有Cl-
【解析】选D。钠元素的焰色反应为黄色,故用铂丝蘸取待 测液在火焰上灼烧,若火焰呈黄色,则表明待测液中肯定 含有Na+,A错;向待测液里加入过量的盐酸,若产生能使 澄清石灰水变浑浊的无色无味的气体为CO2,则表明待测液 中可能含有CO32-或HCO3-,B错;向待测液里加入BaCl2溶液, 若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,该
后其现象为:有气体放出;无变化;生成白色沉淀;生成红
褐色沉淀;先生成白色沉淀后溶解。
3.(2011·上海高一检测)鉴定NaCl的最佳方法是()
A.焰色反应呈黄色,加HNO3酸化的AgNO3有白色沉淀
B.焰色反应呈紫色,加盐酸酸化的AgNO3有白色沉淀 C.焰色反应呈黄色,加盐酸酸化的AgNO3有白色沉淀 D.焰色反应呈紫色,加HNO3酸化的AgNO3有白色沉淀 【解析】选A。钠的焰色反应呈黄色,氯离子的检验应用硝 酸酸化的AgNO3,AgNO3溶液不能用盐酸酸化,用盐酸酸化 会产生沉淀,无法用于Cl-的检验。
D.焰色反应是某些金属离子的性质
原创基础课件-1.2.2 常见物质的检验(化学必修1)

(➁7)将N蘸H有3 浓➀放盐在将酸容粘的器有玻口湿璃,润棒变红放蓝色在石NH容蕊3+器试H口纸Cl,的=产玻_N生_璃H_4白_棒C_烟l__
4 、物质检验的一般步骤: (答题书写)
(1) 对试样进行外观观察:色、态、气味
(2)取少量试样于试管中:(不许原瓶操作)
固体则少量溶解,液体直接取少量
(3) (5)
3.常用检验: (1)H2 点燃有爆鸣声
(2) (3) (4) (5)
O2 H2O CO2 SO2
带火星的木条放入集气瓶,复燃
遇白色无水CuSO4变蓝(CuSO4 •5H2O)
通入澄清石灰水变浑浊的无味气体
a,通入澄清石灰水变浑浊的刺激性气味气体 b,使品红溶液褪色的气体
(6)丝绸,毛(蛋白质) 灼烧 有烧焦羽毛的气味
②醋酸铅或硫酸铜 产生黑色沉淀
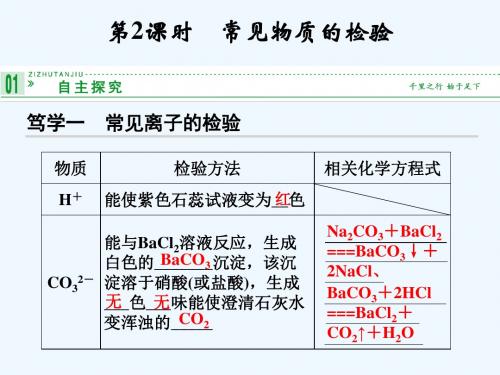
四.阳离子检验: 1.H+ ①紫色石蕊试剂或PH试纸 变红 2.Ag+ 加盐酸和稀HNO3 生成白色沉淀 3.Na+ 焰色反应 黄色火焰
K+ 焰色反应 紫色火焰(透过蓝色钴玻璃)
4.NH4+ 加NaOH溶液并加热,产生使湿润红色石蕊 试纸变蓝的刺激性气味气体
(NH4)2SO4 + 2NaOH == 2NH3 + Na2SO4 + 2H2O
5,Ba2+ 稀硫酸 产生白色沉淀 6,Mg2+ NaOH溶液 产生白色沉淀 7,Cu2+ 溶液蓝色,加NaOH溶液 蓝色絮状沉淀 8.Fe3+ NaOH溶液 生成红褐色沉淀Fe(OH)3
含有苏丹红
1.2.2 常见物质的检验
2004雅典奥运会匈牙利男子铁饼冠军法泽卡斯被取消金牌
1、酸碱指示剂 酸色
苏教版高中化学必修一课件1-2-2常见物质的检验

结论:取两支试管分别加入1mL 未知溶液,再各 加入1mL NaOH溶液,加热试管,将湿润的红色 石蕊试纸靠近试管口 ,能使红色石蕊试纸变蓝的 是(NH4)2SO4溶液,则另一瓶为K2SO4 溶液。
思考:如何鉴别Na2SO4和 K2SO4?
【实验4】取一根铂丝,放在酒精灯火焰上灼 烧至无色,用铂丝蘸取少量NaCl置于火焰上灼 烧,透过钴玻璃观察火焰的颜色。
•肯德基含苏丹红 新奥尔 良烤翅和烤鸡腿堡停售
我国30家企业88种食品被检出
含有苏丹红
1-2-2 常见物质的检验 一、常见物质的检验方法
1、物理方法:依据特殊的物理性质(如颜色、 气味、溶解性、溶解时的热效应等)进行观察、 分析、判断,得出结论。
2、化 学方法:一般包括取样、操作、现象、结 论四部分。
有NH4+。
【实验2】取两支试管分别
加入1mL NH4Cl、KCl溶液, 各滴加 3 滴AgNO3溶液和稀硝酸,观察实验现象。
实验现象:试管内有生白成色,沉再淀滴入几滴稀硝酸
后。
白色沉淀不溶解
反应方程式:
检验方法:取少量试样,滴加 几 滴AgNO3溶液, 产生不溶于稀硝酸的白色沉淀,即有Cl-。
【实验3】取两支试管分别加
加热
使湿润的红色石蕊试纸变蓝
盐酸、澄清 放出无色、无味的气体,且能
石灰水
使澄清石灰水变浑浊。
H+ OH- Na+
K+
紫色石蕊试液
变红
酚酞试液
变红
用铂丝蘸取样品在 酒精灯火焰上灼烧
同上,要透过 蓝色钴玻璃
火焰呈黄色 火焰呈紫色
入1mL (NH4)2SO4、K2SO4溶液,各滴加3滴 BaCl2溶液和稀盐酸,观察实验现象 。
思考:如何鉴别Na2SO4和 K2SO4?
【实验4】取一根铂丝,放在酒精灯火焰上灼 烧至无色,用铂丝蘸取少量NaCl置于火焰上灼 烧,透过钴玻璃观察火焰的颜色。
•肯德基含苏丹红 新奥尔 良烤翅和烤鸡腿堡停售
我国30家企业88种食品被检出
含有苏丹红
1-2-2 常见物质的检验 一、常见物质的检验方法
1、物理方法:依据特殊的物理性质(如颜色、 气味、溶解性、溶解时的热效应等)进行观察、 分析、判断,得出结论。
2、化 学方法:一般包括取样、操作、现象、结 论四部分。
有NH4+。
【实验2】取两支试管分别
加入1mL NH4Cl、KCl溶液, 各滴加 3 滴AgNO3溶液和稀硝酸,观察实验现象。
实验现象:试管内有生白成色,沉再淀滴入几滴稀硝酸
后。
白色沉淀不溶解
反应方程式:
检验方法:取少量试样,滴加 几 滴AgNO3溶液, 产生不溶于稀硝酸的白色沉淀,即有Cl-。
【实验3】取两支试管分别加
加热
使湿润的红色石蕊试纸变蓝
盐酸、澄清 放出无色、无味的气体,且能
石灰水
使澄清石灰水变浑浊。
H+ OH- Na+
K+
紫色石蕊试液
变红
酚酞试液
变红
用铂丝蘸取样品在 酒精灯火焰上灼烧
同上,要透过 蓝色钴玻璃
火焰呈黄色 火焰呈紫色
入1mL (NH4)2SO4、K2SO4溶液,各滴加3滴 BaCl2溶液和稀盐酸,观察实验现象 。
(教师参考)高中化学 1.2.2 常见物质的检验课件1 苏教版必修1

实验 取少量试液于NO试3管中,向试管加入稀HNO3,无现象,再加入AgNO3溶液,若生 步骤 成白色沉淀,证明该试样中含有Cl- 。
实验 反应生成不溶于稀硝酸的白色沉淀
现象
实验 NH4Cl和KCl中含有Cl-
结论
NH4Cl + AgNO3 = NH4NO3 + AgCl
实验
精选ppt
6
讨论与思考
红色石蕊试纸变蓝的气体,证明原溶液中含NH4+
精选ppt
11
现有四瓶失去标签的溶液,分别为NH4Cl溶液、 (NH4)2SO4溶液、KCl溶液、K2SO4溶液四种, 请设计实验方案加以鉴别。
若把NH4Cl溶液换成NaCl溶液,其他溶液不变, 又如何鉴别?
精选ppt
12
实验4 焰色反应 许多金属或他们的化合物在灼烧时都会使火 焰呈现特殊的颜色
(2)取少量废水倒入试管中,加入少量碳酸钠溶液,
振荡试管,若有无色气体生成,证明有酸。
精选ppt
2
鉴定离子
H+ 酸 性 溶 液
所用试剂 ①紫色石蕊试液
或蓝色石蕊试纸 ②pH试纸 ③活泼金属 ④碳酸盐
……
现象 ①变红
②pH<7 ③产生气体 ④产生能使澄清石灰 水变浑浊的无味气体
精选ppt
3
【活动与探究】
专题1 化学家眼中的物质世界 第二单元 研究物质的实验方法
第2课时 常见物质的检验
精选ppt
1
2006年3月,某中学初三年级的几位同学检测到某工 厂向横阳之江里排放的无色废水中含有酸。请你根据酸 的不同性质设计两个实验,检验上述废水经过处理后是 否还含有酸(每个实验要回答所用试剂及现象)。
(1)取少量废水倒入试管中,滴入几滴紫色石蕊试 液,振荡试管,若溶液显红色,证明有酸。
实验 反应生成不溶于稀硝酸的白色沉淀
现象
实验 NH4Cl和KCl中含有Cl-
结论
NH4Cl + AgNO3 = NH4NO3 + AgCl
实验
精选ppt
6
讨论与思考
红色石蕊试纸变蓝的气体,证明原溶液中含NH4+
精选ppt
11
现有四瓶失去标签的溶液,分别为NH4Cl溶液、 (NH4)2SO4溶液、KCl溶液、K2SO4溶液四种, 请设计实验方案加以鉴别。
若把NH4Cl溶液换成NaCl溶液,其他溶液不变, 又如何鉴别?
精选ppt
12
实验4 焰色反应 许多金属或他们的化合物在灼烧时都会使火 焰呈现特殊的颜色
(2)取少量废水倒入试管中,加入少量碳酸钠溶液,
振荡试管,若有无色气体生成,证明有酸。
精选ppt
2
鉴定离子
H+ 酸 性 溶 液
所用试剂 ①紫色石蕊试液
或蓝色石蕊试纸 ②pH试纸 ③活泼金属 ④碳酸盐
……
现象 ①变红
②pH<7 ③产生气体 ④产生能使澄清石灰 水变浑浊的无味气体
精选ppt
3
【活动与探究】
专题1 化学家眼中的物质世界 第二单元 研究物质的实验方法
第2课时 常见物质的检验
精选ppt
1
2006年3月,某中学初三年级的几位同学检测到某工 厂向横阳之江里排放的无色废水中含有酸。请你根据酸 的不同性质设计两个实验,检验上述废水经过处理后是 否还含有酸(每个实验要回答所用试剂及现象)。
(1)取少量废水倒入试管中,滴入几滴紫色石蕊试 液,振荡试管,若溶液显红色,证明有酸。
高一化学苏教版必修一1-2-2常见物质的检验.ppt
________________________________________________。
解析
CaCO3和BaCO3通常都是白色固体,难溶于水,易
溶于稀HNO3并放出CO2气体。步骤②的溶液中含有Ba2+ 和Cl-,还有稀HNO3。BaSO4和AgCl通常都是白色沉 淀,既不溶于水,也不溶于稀硝酸。
NH4
+
【体验 1】下列说法正确的是(
)。
A.某溶液与 NaOH 溶液共热,产生使湿润的蓝色石蕊试纸 变红色的气体,说明原溶液中存在 NH4
+
B.某溶液中加入 AgNO3 溶液时,产生白色沉淀,说明原溶 液中含有 Cl- C.某溶液中滴加稀硝酸无明显现象,再滴加 Ba(NO3)2 溶液
2- 出现白色沉淀,说明原溶液中有 SO4
【慎思1】 某溶液与氯化钡溶液反应,生成不溶于稀盐酸的白
色沉淀,则盐溶液中一定含有硫酸根离子吗?
提示 不一定。还可能为银离子。
【慎思2】 焰色反应是物理变化还是化学变化?在做钾及其化
合物的焰色反应的实验时,需要注意什么问题? 提示 焰色反应是物理变化;需要透过蓝色钴玻璃观察。
【慎思3】 实验室里有两瓶失去标签的试剂,它们分别是硫酸
KCl+AgNO3===AgCl↓+KNO3
K2CO3,现做如下实验:
①将部分粉末加入水中,振荡有白色沉淀生成。 ②向①的悬浊液中加入过量稀HNO3,白色沉淀消失,并 有气泡产生。 ③取少量②的溶液滴入稀硫酸,有白色沉淀生成。 ④另取少量②的溶液滴入稀AgN色粉末的组成成分(写名
称)_____________________________________________。 (2)写出实验步骤①②和③中有关化学反应的方程式 ________________________________________________, ________________________________________________, ________________________________________________, ________________________________________________, ________________________________________________,
2013-2014学年高一化学苏教版必修一:1.2.2 常见物质的检验 PPT课件1

后又做了如下分析,以确定这些离子是否大量存在。
①用pH试纸检测溶液的酸碱性,结果pH试纸显红色。 ②取2 mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。 ③对②中所得的混合物充分静置后,取其澄清的液体用AgNO3溶液和稀 硝酸进行检验,结果又生成了白色沉淀。 请回答下列问题: (1)溶液中一定存在的离子是______________,一定不存在的离子是 ______________。 (2)上述实验操作中,有错误的操作是(填写序号)________。改正该错误 的方法是(要作较详细的说明)______________________________。
如果某溶液中同时存在SO42-和Cl-,应如何检验? [学生交流] 【提示】 (1)取少量溶液,向其中加入过量Ba(NO3)2。如果有白色沉淀, 说明溶液中含有SO42-。 (2)将上述体系过滤,得到滤液。 (3)再向滤液中滴入AgNO3溶液,有不溶于稀HNO3的白色沉淀生成,证明溶液 中有Cl-。 总之,一般先检验SO42-,然后除去SO42-,进一步检验验证溶液中Cl-的存 在。
【提示】 焰色反应的实验步骤可归纳为三烧:“灼烧―→蘸烧―→
洗烧”,其含义分别为: (1)灼烧:将铂丝放在酒精灯火焰里灼烧,直到与原来火焰颜色相同为 止。 (2)蘸烧:用铂丝蘸取欲检测的试液或试样,放在酒精灯外焰上灼烧, 观察火焰的颜色。 (3)洗烧:测试完毕,将铂丝用稀盐酸洗净,在外焰上灼烧到没有颜色 为止,以备下次再用。
为确定某溶液的离子组成,进行如下实验: 1. ①取少量溶液滴加BaCl2溶液,产生白色沉淀。 ②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水
变浑浊的气体;白色沉淀部分溶解。
③取上层清液继续滴加BaCl2溶液至无沉淀时,再滴加AgNO3溶液,产生白 色沉淀。 根据实验,以下推测不正确的是( A.一定有SO42-离 C.不能确定Cl-离子是否存 ) B.一定有CO32-离子 D.不能确定SO42-离子是否存在
苏教版高中化学必修一1.2.2 常见物质的检验

与盐酸反应,产生气体通入 有气体产生,澄清石灰
澄清石灰水
水变浑浊
硫酸盐(SO42-)
先加稀盐酸, 再加入 BaCl2溶液
氯化物 (Cl-) 稀HNO3酸化的AgNO3
生成白色沉淀,说明有 SO42-
生成不溶于稀硝酸的白色 沉淀
铵盐 (NH4+)
与碱混合加热用湿润的红色 石蕊试纸检验
若试纸变蓝,说明 含有NH4+
化学 · 必修1
1.2.2 常见物质的检验
常见物质的检验
如何鉴别真真假元宝?
创设情第景2 页
假元宝
真元宝
常见物质的检验
问题导第学3 页
据反映,滨海化工园区某工厂向周边一小河里排放的无色废水中含有 酸。请你根据酸的不同性质设计两个实验,检验上述废水经过处理后是 否还含有酸(每个实验要回答所用试剂及现象)。
交流讨第 1论0 页
常见物质的检验
观察实第验11 页
常见物质的检验
第 12 页
实验
SO42- (硫酸实盐验)3 的检验方法
取步少骤量试液于(N试H管4)2中SO,4和向K试2管SO内4溶加液稀各盐少酸量,,无各沉滴淀几生滴成稀,盐再酸加,入再各
BaCl2溶液,滴若几生滴成B白a色Cl沉2溶淀液,证明该试样中含有SO42-
常见物质的检验
观察实第验14 页
常见物质的检验
第 15 页
实验4 焰色反应 许多金属或他们的化合物在灼烧时都会使火焰呈现特殊的颜 色
钾 的 焰 色 反 应
常见物质的检验
焰色反应
第 16 页
常见物质的检验
焰色反应
第 17 页
实验操作:
除杂
一根铂丝,将铂丝在稀盐酸中蘸一下,然后在酒精灯火焰上灼烧至无色。 用灼烧后的铂丝蘸取少许待测物,火焰中灼烧观察到不同颜色的火焰 (K的焰色要透过钴玻璃观察)。
高一化学苏教版必修一1-2-2常见物质的检验 PPT课件 图文

自主探究
精要解读
实验探究
要点一 | 物质的检验
1.原则 物质的检验“三个原则”,即一看(颜色、状态)、二嗅(气 味)、三实验(加试剂)。
2.分类 根据实验时生成物所表现的现象不同,检验离子的方法可 归纳为三类: (1)生成气体,如NH4+、CO32-等离子的检验; (2)生成沉淀,如Cl-、SO42-等离子的检验;
实验探究
要点二 | 焰色反应
1.金属丝在使用前要清洗干净,一般用稀盐酸来清洗, 而不用稀硫酸来清洗,因为一般金属的硫酸盐熔沸点 比较高,难以使其挥发,容易对实验造成干扰。
2.观察钾元素的焰色要透过蓝色钴玻璃来观察,因为钾 盐中常混有钠离子而造成干扰。
自主探究
精要解读
实验探究
【例2】► 某物质灼烧时,焰色反应为黄色,下列判断正确的是
( )。
A.该物质一定是钠的化合物 B.该物质一定含钠元素
C.该物质一定是金属钠
D.该物质中不含钾元素
解析 焰色反应是某些金属元素的性质,焰色反应为黄色,
说明该物质中一定含钠元素,既可能是金属钠,也可能是钠
的化合物。但钾的焰色必须透过蓝色钴玻璃滤去黄光后才能
观察到,所以不能确定该物质中是否含有钾元素。
自主探究
精要解读
实验探究
解析 A 项中某溶液与 NaOH 溶液反应不可能产生使湿润的蓝 色石蕊试纸变红的气体(酸性气体);B 项中与 AgNO3 溶液反应 能产生白色沉淀的离子有 Cl-、CO23-、SO32-等多种;C 项中原 溶液中也可能有 SO32-、HSO-3 。 答案 D
自主探究
精要解读
2.操作步骤:将一根_铂__丝__,在酒精灯火焰上灼烧,若火焰 有颜色,可将铂丝在_稀__盐__酸__中蘸一下,再灼烧至无色。 用灼烧后的铂丝蘸取少许待测物,然后再在火焰中灼烧, 可观察到火焰的颜色。流程如下: 铂丝―灼―烧→与原来火焰颜色相同―蘸―取→样品―灼―烧→观察焰色
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 实验药品: (NH4)2SO4、K2SO4、稀HCl 和BaCl2
实验现象: 反应生成不溶于稀盐酸的白色沉淀
实验结论: 硫酸铵、硫酸钾中含有SO42-
化学方程式为(NH4)2SO4 + BaCl2==BaSO4 + 2NH4Cl
问题
稀盐酸的作用是什么?除杂不用稀硝酸
排除CO32-和SO32-的干扰
石蕊试纸
红石蕊试纸:遇碱性物质变蓝色 蓝石蕊试纸:遇酸性物质变红
淀粉试纸 碘 淀粉 蓝
(检验气体需先湿润)
精选ppt
5
实验1. 实验药品: NH4Cl、 (NH4)2SO4 、NaOH 实验现象: 有刺激性气味气体产生,且该气
体能使湿润的红石蕊试纸变蓝 实验结论: NH4Cl和(NH4)2SO4中含有NH4+ 原理(NH4)2SO4+2NaOH==Na2SO4+H2O+NH3
精选ppt
18
4、对下列实验过程的评价,正确的是
A.某固体中加入稀盐酸,产生了无色气体,证明该固 体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一 定含有SO42C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定 是酸溶液
√D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH,再加入AgNO3溶液,有白色沉淀,证明含Cl-
(CO32- )
产生气体通 入澄清石灰
水
灰水变浑浊
酸 用紫色石 紫色石蕊变红;PH试
(H+) 蕊试液; 用PH试纸
纸变色PH<7
碱 用紫色石 紫色石蕊变蓝;PH试
(OH-) 蕊试液; 纸变色PH>7
用PH试纸精选ppt
15
5. 仪器分析法:
• 用元素分析仪测定:物质中是否含C、H、O 、N、S等元素
精选ppt
19
课堂训练
• 以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )
• A、先加入BaClC2溶液,再加入足量的HNO3溶液,产生了白色沉淀, 溶液中一定含有大量SO
• B、加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量
的CO
22-
4
• C、加入足量浓NaOH溶液,产生了3 带有强烈刺激性气味的气体。溶
• 实验方法:
取一根铂丝,放在酒精灯的火焰上灼烧
,若火焰有颜色,可将铂丝在稀盐酸中蘸一
下,再灼烧至无色。用灼烧后的铂丝蘸取少
许待测物,放入火焰中灼烧,就会观察到不
同颜色的火焰
除杂
记 Na 为黄色 K为紫色
精选ppt
12
精选ppt
13
精选ppt
14
一些物质的检验
待检物质 检验方法
现象
碳酸盐 与盐酸反应, 有气体产生,澄清石
专题1 化学家眼中的物质世界 第二单元 研究物质的实验方法
第2课时 常见物质的检验
精选ppt
1
请同学们:规范操作、注意安全
1、注意本桌、邻桌的易打玻璃仪器
2、不要用手接触药品,也不要随意 丢弃,更不能拿出实验室
3、酒精灯只能用火柴点燃,用灯帽 盖灭,不能拿、移燃着的酒精灯
4、对液体加热时,先均匀加热,且
用红外光谱仪来确定:物质中是否 含有某些有机基团
用原子吸收光谱确定:物质中是否含有哪些金 属元素
精选ppt
16
练习
1、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是( B )
A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸
2、在允许加热的条件下,只用一种试剂就可以鉴别 硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是
精选ppt
6
NH4+的检验(铵盐)
取样(少量放在试管中)与碱混合加热,若 有刺激性气味的气体产生,且该气使湿润的红 色石蕊试纸变蓝,证明该试样中含有NH4+。
实验原理: NH4Cl+NaOH==Na Cl +H2O +NH3
NH3 使湿润的红石蕊试纸变__蓝___
精选ppt
7
实验2
• 实验
NH4Cl、KCl、稀HNO3和Ag NO 3
( A)
A.NaOH
B.Na2CO3
C.AgNO3
D.BaCl2
精选ppt
Hale Waihona Puke 173、某溶液中含有大量的Cl-、SO42-、OH-三种离子, 如果只取一次就能够将3种阴离子依次检验出来,
下列实验操作顺序正确的是:
① 滴加Mg(NO3)2溶液 ③ 滴加Ba(NO3)2
② 过滤 ④滴加AgNO3
①②③②④ 或 ③②①②④
试管口不能对着人。
精选ppt
2
警察在检查司机是否酒后开车
酒中的乙醇分 子可以使橙红 色的重铬酸钾 (k2Cr2O7)变 为绿色的硫酸 铬[Cr2(SO4)3]
精选ppt
3
常用的离子检验方法:
• 生成沉淀 ¨生成气体 ¨显现特殊颜色
精选ppt
4
常见试纸: PH试纸:即广范试纸。检 润验(定液量体时时)不能先湿
液中一定含有大量的NH
• D、先加适量的盐酸将溶液酸化,再加入AgNO3溶液,产生了白色沉 淀。溶液中一定含有大量的Cl-
+
4
精选ppt
20
SO32-
硝酸 精选ppt
SO42-
10
SO42-的检验(硫酸盐)
取样并向内加稀HCl、BaCl2溶液,若生 成白色沉淀,证明该试样中含有SO42- 。
不能用稀硝酸,也不能用Ba(NO3)2
思考:
某白色晶体可能是硫酸铵,怎样证明?
精选ppt
11
4.焰色反应
根据焰色反应所呈现的特征焰色,可
检验金属或金属离子的存在
药品 实验现象:: 反应生成不溶于稀硝酸的白色沉淀
实验结论: NH4Cl和KCl中含有Cl-
问
稀硝酸的作用是什么?
题
排除CO32-的干扰
精选ppt
8
Cl-的检验(盐酸盐或称氯化物)
方法
取样并向内加稀HNO3和AgNO3溶液, 若生成白色沉淀,证明该试样中含有 Cl- 。
实验原理?
精选ppt
9
实验3
实验现象: 反应生成不溶于稀盐酸的白色沉淀
实验结论: 硫酸铵、硫酸钾中含有SO42-
化学方程式为(NH4)2SO4 + BaCl2==BaSO4 + 2NH4Cl
问题
稀盐酸的作用是什么?除杂不用稀硝酸
排除CO32-和SO32-的干扰
石蕊试纸
红石蕊试纸:遇碱性物质变蓝色 蓝石蕊试纸:遇酸性物质变红
淀粉试纸 碘 淀粉 蓝
(检验气体需先湿润)
精选ppt
5
实验1. 实验药品: NH4Cl、 (NH4)2SO4 、NaOH 实验现象: 有刺激性气味气体产生,且该气
体能使湿润的红石蕊试纸变蓝 实验结论: NH4Cl和(NH4)2SO4中含有NH4+ 原理(NH4)2SO4+2NaOH==Na2SO4+H2O+NH3
精选ppt
18
4、对下列实验过程的评价,正确的是
A.某固体中加入稀盐酸,产生了无色气体,证明该固 体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一 定含有SO42C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定 是酸溶液
√D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH,再加入AgNO3溶液,有白色沉淀,证明含Cl-
(CO32- )
产生气体通 入澄清石灰
水
灰水变浑浊
酸 用紫色石 紫色石蕊变红;PH试
(H+) 蕊试液; 用PH试纸
纸变色PH<7
碱 用紫色石 紫色石蕊变蓝;PH试
(OH-) 蕊试液; 纸变色PH>7
用PH试纸精选ppt
15
5. 仪器分析法:
• 用元素分析仪测定:物质中是否含C、H、O 、N、S等元素
精选ppt
19
课堂训练
• 以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )
• A、先加入BaClC2溶液,再加入足量的HNO3溶液,产生了白色沉淀, 溶液中一定含有大量SO
• B、加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量
的CO
22-
4
• C、加入足量浓NaOH溶液,产生了3 带有强烈刺激性气味的气体。溶
• 实验方法:
取一根铂丝,放在酒精灯的火焰上灼烧
,若火焰有颜色,可将铂丝在稀盐酸中蘸一
下,再灼烧至无色。用灼烧后的铂丝蘸取少
许待测物,放入火焰中灼烧,就会观察到不
同颜色的火焰
除杂
记 Na 为黄色 K为紫色
精选ppt
12
精选ppt
13
精选ppt
14
一些物质的检验
待检物质 检验方法
现象
碳酸盐 与盐酸反应, 有气体产生,澄清石
专题1 化学家眼中的物质世界 第二单元 研究物质的实验方法
第2课时 常见物质的检验
精选ppt
1
请同学们:规范操作、注意安全
1、注意本桌、邻桌的易打玻璃仪器
2、不要用手接触药品,也不要随意 丢弃,更不能拿出实验室
3、酒精灯只能用火柴点燃,用灯帽 盖灭,不能拿、移燃着的酒精灯
4、对液体加热时,先均匀加热,且
用红外光谱仪来确定:物质中是否 含有某些有机基团
用原子吸收光谱确定:物质中是否含有哪些金 属元素
精选ppt
16
练习
1、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是( B )
A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸
2、在允许加热的条件下,只用一种试剂就可以鉴别 硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是
精选ppt
6
NH4+的检验(铵盐)
取样(少量放在试管中)与碱混合加热,若 有刺激性气味的气体产生,且该气使湿润的红 色石蕊试纸变蓝,证明该试样中含有NH4+。
实验原理: NH4Cl+NaOH==Na Cl +H2O +NH3
NH3 使湿润的红石蕊试纸变__蓝___
精选ppt
7
实验2
• 实验
NH4Cl、KCl、稀HNO3和Ag NO 3
( A)
A.NaOH
B.Na2CO3
C.AgNO3
D.BaCl2
精选ppt
Hale Waihona Puke 173、某溶液中含有大量的Cl-、SO42-、OH-三种离子, 如果只取一次就能够将3种阴离子依次检验出来,
下列实验操作顺序正确的是:
① 滴加Mg(NO3)2溶液 ③ 滴加Ba(NO3)2
② 过滤 ④滴加AgNO3
①②③②④ 或 ③②①②④
试管口不能对着人。
精选ppt
2
警察在检查司机是否酒后开车
酒中的乙醇分 子可以使橙红 色的重铬酸钾 (k2Cr2O7)变 为绿色的硫酸 铬[Cr2(SO4)3]
精选ppt
3
常用的离子检验方法:
• 生成沉淀 ¨生成气体 ¨显现特殊颜色
精选ppt
4
常见试纸: PH试纸:即广范试纸。检 润验(定液量体时时)不能先湿
液中一定含有大量的NH
• D、先加适量的盐酸将溶液酸化,再加入AgNO3溶液,产生了白色沉 淀。溶液中一定含有大量的Cl-
+
4
精选ppt
20
SO32-
硝酸 精选ppt
SO42-
10
SO42-的检验(硫酸盐)
取样并向内加稀HCl、BaCl2溶液,若生 成白色沉淀,证明该试样中含有SO42- 。
不能用稀硝酸,也不能用Ba(NO3)2
思考:
某白色晶体可能是硫酸铵,怎样证明?
精选ppt
11
4.焰色反应
根据焰色反应所呈现的特征焰色,可
检验金属或金属离子的存在
药品 实验现象:: 反应生成不溶于稀硝酸的白色沉淀
实验结论: NH4Cl和KCl中含有Cl-
问
稀硝酸的作用是什么?
题
排除CO32-的干扰
精选ppt
8
Cl-的检验(盐酸盐或称氯化物)
方法
取样并向内加稀HNO3和AgNO3溶液, 若生成白色沉淀,证明该试样中含有 Cl- 。
实验原理?
精选ppt
9
实验3
