2019年领军高考化学易错点26物质结构与性质模拟题训练
易错26 共价键的类型-备战2021年高考化学一轮复习易错题

易错26共价键的类型【易错分析】只有两原子的电负性相差不大时,才能形成共用电子对,形成共价键,当两原子的电负性相差很大(大于1.7)时,不会形成共用电子对,而形成离子键。
1. 当成键原子半径越大,π键越难形成,如Si、O难形成双键。
2.σ键与π键由于原子轨道的重叠程度不同从而导致了两者的稳定性不同,一般σ键比π键稳定,但N2中π键较稳定。
3.并不是所有的共价键都有方向性,如ssσ键没有方向性。
4.原子形成共价键时优先形成σ键。
5.配位键也属于σ键。
6.大π键一般是三个或更多个原子间形成的,是未杂化轨道中原子轨道“肩并肩”重叠形成的π键。
Πn m-m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。
对于多电子的粒子,若中心原子的杂化不是sp3杂化,中心原子与配位原子可能形成大π键。
7. 等电子体结构相同,物理性质相近,但化学性质不同。
【错题纠正】例题1、(1)CS2是一种常用的溶剂,CS2的分子中存在________个σ键。
在H—S、H—Cl两种共价键中,键的极性较强的是______,键长较长的是_____。
(2)氢的氧化物与碳的氧化物中,分子极性较小的是________(填分子式)。
(3)醋酸的球棍模型如图1所示。
①在醋酸中,碳原子的轨道杂化类型有________;②Cu的水合醋酸盐晶体局部结构如图2所示,该晶体中含有的化学键是________(填选项字母)。
A.极性键B.非极性键C.配位键D.金属键【解析】【解析】(1)CS 2的结构与CO 2的相似,均为直线型结构,其结构简式为:S=C=S ,因为一个双键由一个σ键和一个Π键组成,所以CS 2的分子中存在2个σ键;因为Cl 的非金属性比S 的强,所以在H—S 、H—Cl 两种共价键中,键的极性较强的是H—Cl ,因而其键长较短,所以H—S 的键长较长;(2)氢的氧化物为H 2O ,碳的氧化物为CO 2,H 2O 是V 形结构,CO 2是直线形结构,因此分子极性较小的是CO 2;(3)①在醋酸分子中,甲基上C 原子的杂化轨道类型是sp 3杂化,羧基上的C 原子是sp 2杂化;②根据Cu 的水合醋酸盐晶体局部结构可知,该晶体中含有的化学键有碳氧之间的极性键,碳原子与碳原子之间的非极性键以及氧原子与铜原子之间的配位键,答案选ABC 。
上海市2019年高考化学易错点(26)物质结构与性质(模拟题训练含答案)
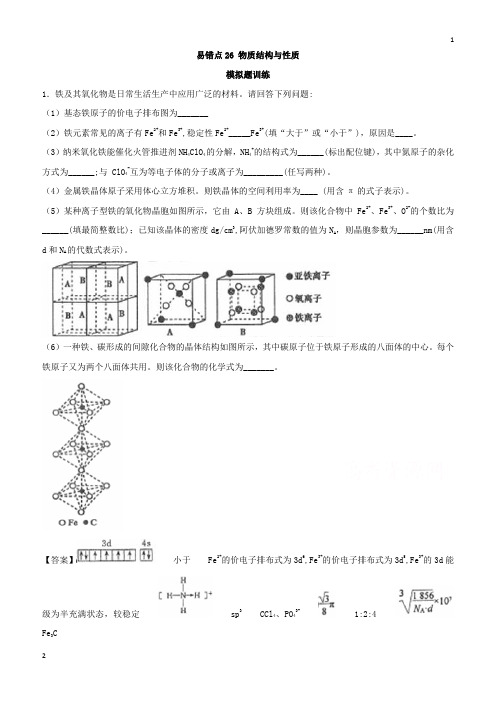
易错点26 物质结构与性质模拟题训练1.铁及其氧化物是日常生活生产中应用广泛的材料。
请回答下列问题:(1)基态铁原子的价电子排布图为_______(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_____Fe3+(填“大于”或“小于”),原因是____。
(3)纳米氧化铁能催化火管推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),其中氮原子的杂化方式为______;与 ClO4-互为等电子体的分子或离子为_________(任写两种)。
(4)金属铁晶体原子采用体心立方堆积。
则铁晶体的空间利用率为____ (用含π的式子表示)。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。
则该化合物中Fe2+、Fe3+、O2-的个数比为______(填最简整数比);已知该晶体的密度dg/cm3,阿伏加德罗常数的值为N A,则晶胞参数为______nm(用含d和N A的代数式表示)。
(6)一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。
每个铁原子又为两个八面体共用。
则该化合物的化学式为_______。
【答案】小于 Fe2+的价电子排布式为3d6,Fe3+的价电子排布式为3d5,Fe3+的3d能级为半充满状态,较稳定 sp3 CCl4、PO43- 1:2:4Fe3C2.铁、钴、镍等金属单质及化合物有广泛的应用。
(1)已知锂离子电池总反应方程式是FePO4(s)+Li(s) LiFePO4(s)。
请写出Fe3+的电子排布式____________,PO43-离子中p原子杂化轨道类型____________。
(2)化合物“钴酞菁”能显著提升二次电池的充放电效率,下图是改性“氨基钴酞菁”分子的结构图。
①一个电子的运动状态取决于______种因素,基态Co原子中空间运动状态不同的电子数为___种。
②氨基钴酞菁中非金属元素的电负性从大到小的顺序为_________③“氨基钴酞菁”比“钴酞菁”显著溶于水,请简述其原因_______。
专题22物质结构与性质-2019年高考化学易错题汇总(原卷版)

易错题 22 物质结构与性质1.铂钻合金是以铂为基含钻二元合金,在高温下,铂与钻可无限互溶,其固溶体为面心立方晶格。
铂钻合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表电子钟表磁控管等。
( 1)基态钴原子的价电子排布图为 。
(2)二氯二吡啶合铂是由 Pt 2+、 Cl -和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体(如图) 科学研究表明,顺式分子具有抗癌活性。
①吡啶分子是大体积平面配体,其结构简式如图所示,每个分子中含有的 __________ σ键数目为 。
二 合铂分子中所含的 C 、 N 、 Cl 三种元素的第一电离能由大到小的顺序是 。
②二氯二吡啶合铂中存在的微粒间作用力有 __ (填字母)。
a .范德华力b .氢键c .金属键d 非极性键 ③反式二氯二吡啶合铂分子是 (填 “极性分子 ”或“非极性分子 ”)。
(3)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行, 构成能导电的 “分子金属 ”,其结构如图所示。
吡啶① “分子金属”可以导电,是因为能沿着其中的金属原子链流动。
②“分子金属”中,铂原子是否以 sp3的方式杂化?__________________________ (填“是”或“否”),其理由是__________________________( 4)筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体 CoO 2,该晶体具有层状结构(如图所示, 小球表示 Co 原子,大球表示 O 原子),图中用粗线画出的重复结构单元示意图不能描述 CoO 2 的化学组成的是 _ (填字母)。
(5)金属铂 品体中,铂原子的配位数为 12,其立方晶胞沿式 x 、y 或 z 轴的投影图如图所示,若金属铂的 密度为 dg?m -3,则晶胞参数 a= nm (列计算式) 。
2.硫、铁及其化合物用途非常广泛。
回答下列问题:中, S 、C 、N 的化合价依次为- 2、+ 2、- 3,Fe 2+与 Fe 3+数目之比为与铁形成配位键的原子是 ____ 。
易错点26 硅元素及其化合物-备战2022年高考化学考试易错题(解析版)

易错点26 硅元素及其化合物易错题【01】硅及其化合物的性质(1)自然界中无游离态的硅,通常原子晶体不导电,但硅是很好的半导体材料,是制作光电池的材料。
SiO2不导电,是制作光导纤维的材料。
(2)工业上制备粗硅,是用过量的C和SiO2在高温下反应,由于C过量,生成的是CO而不是CO2,该反应必须在隔绝空气的条件下进行。
(3)氢氟酸不能用玻璃容器盛放;NaOH溶液能用玻璃试剂瓶,但不能用玻璃塞。
(4)酸性氧化物一般能与水反应生成酸,但SiO2不溶于水;酸性氧化物一般不与酸作用,但SiO2能与HF反应。
(5)硅酸盐大多难溶于水,常见可溶性硅酸盐是硅酸钠,其水溶液称为泡花碱或水玻璃,但却是盐溶液。
硅胶(m SiO2·n H2O)是一种很好的无毒干燥剂。
(6)H2CO3的酸性大于H2SiO3的,所以有Na2SiO3+CO2(少量)+H2O===H2SiO3↓+Na2CO3,但高温下Na2CO3+SiO2Na2SiO3+CO2↑也能发生,原因可从两方面解释:①硅酸盐比碳酸盐稳定;②从化学平衡角度,由高沸点难挥发固体SiO2制得低沸点易挥发的CO2气体。
(7)水泥、玻璃与陶瓷是三大传统无机非金属材料;碳化硅、氮化硅等是新型无机非金属材料。
易错题【02】新型无机非金属材料材料类型主要特性示例用途高温结构陶瓷能承受高温,强度高氮化硅陶瓷汽轮机叶片、轴承、永久性模具等半导体陶瓷具有电学特性二氧化锡陶瓷集成电路中的半导体光学材料具有光学特性光导纤维光缆通讯、医疗、照明等生物陶瓷具有生物功能氧化铝陶瓷人造骨骼、人造关节、接骨螺钉易错题【03】常考非金属及其化合物的性质与用途的对应关系重要性质主要用途①硅是常用半导体材料用于制造芯片、硅太阳能电池②SiO2导光性能强、抗干扰性能好用于生产光导纤维③二氧化硫与O2反应用作葡萄酒中食品添加剂④液氨汽化时吸收大量的热用作制冷剂⑤氢氟酸与玻璃中SiO2反应用氢氟酸刻蚀玻璃工艺⑥次氯酸盐(如NaClO等)用于漂白棉、麻、纸张等具有强氧化性⑦硫酸钡难溶于水和盐酸医疗上用作“钡餐”典例分析例1、陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
新高考化学中“物质的结构与性质专项训练”的类型分析及答案

新高考化学中“物质的结构与性质专项训练”的类型分析及答案一、物质的结构与性质的综合性考察1.硼(B)、铝及其化合物在化学中有重要的地位。
请回答下列问题:Ⅰ.(1)与B的基态原子电子排布式中成单电子数相同的第二周期元素还有______(填写元素符号)。
Ⅱ.硼酸(H3BO3)是白色片状晶体(层状结构如图1),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
(2)硼酸分子以范德华力、共价键和氢键形成环状结构,每个含有B原子的环中平均含有B原子的个数为______个。
其中B原子的杂化类型为______。
(3)加热时,硼酸的溶解度增大,主要原因是______。
(4)硼酸是一元弱酸,其分子式亦可写为B(OH)3,在水中电离时,硼酸结合水电离出来OH-的而呈酸性,写出硼酸的电离方程式______。
(5)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子的结构式或结构简式为______(标出配位键)。
Ⅲ.硼氢化钠是一种常用的还原剂。
其晶胞结构如图2所示:(6)该晶体中Na+的配位数为______。
(7)若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为______。
(8)LiAlH4也是一种特殊的还原剂,可将羧酸直接还原成醇:CH3COOH CH3CH2OH,CH3COOH分子中键角2______键角1(填“>”、“<”或“=”)。
Ⅳ.(9)硼化镁晶体在39K 时呈超导性。
在硼化镁晶体中,镁原子和硼原子是分层排布的,如图3是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。
则硼化镁的化学式为______。
2.第Ⅷ族元素Fe 、Co 、Ni 性质相似,称为铁系元素,主要用于制造合金。
回答下列问题:(1)基态Ni 原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与Ni 相同的元素名称为______________。
(2)3Fe +与酚类物质的显色反应常用于其离子检验,已知3Fe +遇邻苯二酚()和对苯二酚()均显绿色。
(新课标)2019版高考化学: 选考部分 物质结构与性质 考点规范练36 分子结构与性质

考点规范练36 分子结构与性质(时间:45分钟满分:100分)非选择题(共6小题,共100分)1.(2017河南联考)(14分)第ⅢA族和第ⅤA族元素能形成一些具有特殊功能的材料。
例如氮化硼、氮化铝、磷化铝等,磷化铝的结构类似于金刚石。
(1)氮、磷、砷位于同主族,基态砷原子的价层电子排布图(或轨道表示式)为。
基态镓原子核外电子占据能量最高的能级符号是。
(2)同周期元素按第一电离能由大到小排序,磷和铝之间的元素有(填元素符号)。
(3)AlF3、AlCl3晶体的熔点分别为1 040 ℃、194 ℃,其原因是。
(4)As的立体构型为;NCl3中N原子的杂化类型为;与P互为等电子体的分子有(填一种即可)。
(5)①磷化铝的晶体类型是。
②磷化铝晶胞如图所示,两个铝原子最近距离为d pm,N A表示阿伏加德罗常数的值,则磷化铝晶体的密度为ρ=g·cm-3。
2.(2016浙江自选模块)(16分)磷(P)是组成生命物质的重要元素,请回答:(1)基态磷原子外围电子的电子排布图为。
与氮(N)相比,第一电离能P(填“=”“>”或“<”)N。
每个白磷分子中有个σ键。
(2)PH3的分子构型与NH3的分子构型相似。
下列关于PH3和NH3的说法正确的是。
A.P—H键的极性大于N—H键的极性,PH3和NH3均为极性分子B.PH3的沸点高于NH3的沸点C.PH3可形成分子晶体D.PH3中,P—H键的键长大于N—H键的键长,其键角小于BF3分子中的键角(3)磷脂的结构简式为在水中磷脂可能更倾向于形成下列图(填“A”或“B”)所示的双分子层结构,试说明理由:。
3.(2016海南化学)(16分)M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。
元素Y的负一价离子的最外层电子数与次外层的相同。
回答下列问题:(1)单质M的晶体类型为,晶体中原子间通过作用形成面心立方密堆积,其中M原子的配位数为。
(2)元素Y基态原子的核外电子排布式为,其同周期元素中,第一电离能最大的是(写元素符号)。
2019年高考试题物质结构与性质部分

2019年高考试题--物质结构与性质部分1.(2019新课标Ⅰ)在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。
回答下列问题:(1)下列状态的镁中,电离最外层一个电子所需能量最大的是(填标号)。
A.B.C.D.(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是、。
乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是,其中与乙二胺形成的化合物稳定性相对较高的是(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:解释表中氧化物之间熔点差异的原因。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。
图(b)是沿立方格子对角面取得的截图。
可见,Cu原子之间最短距离x= pm,Mg原子之间最短距离y= pm。
设阿伏加德罗常数的值为N A,则MgCu2的密度是g·cm−3(列出计算表达式)。
2.(2019新课标Ⅱ)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。
回答下列问题:(1)元素As与N同族。
预测As的氢化物分子的立体结构为_______,其沸点比NH3的_______(填“高”或“低”),其判断理由是________________________。
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
(3)比较离子半径:F−__________O2−(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
图1 图2图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm−3。
易错点26 沉淀溶解平衡-备战2023年高考化学考试易错题(解析版)

易错点26沉淀溶解平衡易错题【01】沉淀溶解平衡图像(1)明确图像中纵、横坐标的含义:纵、横坐标通常是难溶物溶解后电离出的离子浓度。
(2)理解图像中线上点、线外点的含义:难溶电解质(以BaSO4沉淀曲线为例说明)Q c和K sp 间的关系有以下三种可能:在曲线上任何一点,Q c=K sp,沉淀与溶解达到动态平衡,溶液是饱和溶液。
在曲线右上方Q c>K sp,溶液处于过饱和,有沉淀析出,直至Q c=K sp。
在曲线左下方Q c<K sp,为不饱和溶液,无沉淀析出,直至Q c=K sp。
(3)抓住K sp的特点,结合选项分析判断:溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同。
原溶液不饱和时,离子浓度都增大,原溶液饱和时,离子浓度都不。
易错题【02】有关K sp的相关计算(1)已知溶度积,求溶液中的某种离子的浓度,如K sp(AgCl)=a的饱和AgCl溶液中,c(Ag+)=√a mol·L-1。
(2)已知溶度积、溶液中某离子的浓度,求溶液中的另一种离子的浓度,如某温度下AgCl的K sp=a,在0.1 mol·L-1的NaCl溶液中加入过量的AgCl固体,达到平衡后c(Ag+)=10a mol·L-1。
(3)计算反应的平衡常数,如对于反应Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),K sp(MnS)=c(Mn2+)·c(S2-),K sp(CuS)=c(Cu2+)·c(S2-),该反应的平衡常数K=c(M n2+)c(C u2+)=K sp(MnS)K sp(CuS)。
易错题【03】沉淀的生成(1)利用生成沉淀分离或除去某种离子,首先要使生成沉淀的反应能够发生,其次沉淀生成的反应进行的越完全越好。
如除去溶液中的Mg2+,用NaOH溶液比使用Na2CO3溶液好,原因是Mg(OH)2的溶解度比MgCO3的小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
易错点26物质结构与性质模拟题训练1.铁及其氧化物是日常生活生产中应用广泛的材料。
请回答下列问题:(1)基态铁原子的价电子排布图为_______(2)铁元素常见的离子有Fe 2+和Fe 3+,稳定性Fe 2+_____Fe 3+(填“大于”或“小于”),原因是____。
(3)纳米氧化铁能催化火管推进剂NH 4ClO 4的分解,NH 4+的结构式为______(标出配位键),其中氮原子的杂化方式为______;与ClO 4-互为等电子体的分子或离子为_________(任写两种)。
(4)金属铁晶体原子采用体心立方堆积。
则铁晶体的空间利用率为____(用含π的式子表示)。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B 方块组成。
则该化合物中Fe 2+、Fe 3+、O 2-的个数比为______(填最简整数比);已知该晶体的密度dg/cm 3,阿伏加德罗常数的值为N A ,则晶胞参数为______nm(用含d 和N A 的代数式表示)。
(6)一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。
每个铁原子又为两个八面体共用。
则该化合物的化学式为_______。
【答案】小于Fe 2+的价电子排布式为3d 6,Fe 3+的价电子排布式为3d 5,Fe 3+的3d能级为半充满状态,较稳定sp3CCl 4、PO 43-1:2:4Fe 3C2.铁、钴、镍等金属单质及化合物有广泛的应用。
(1)已知锂离子电池总反应方程式是FePO 4(s)+Li(s)LiFePO 4(s)。
请写出Fe 3+的电子排布式____________,PO 43-离子中p 原子杂化轨道类型____________。
(2)化合物“钴酞菁”能显著提升二次电池的充放电效率,下图是改性“氨基钴酞菁”分子的结构图。
①一个电子的运动状态取决于______种因素,基态Co 原子中空间运动状态不同的电子数为___种。
②氨基钴酞菁中非金属元素的电负性从大到小的顺序为_________③“氨基钴酞菁”比“钴酞菁”显著溶于水,请简述其原因_______。
(3)K 3[Co(NO 2)6]中存在的化学键类型有____________,配位数为_______。
(4)Sr 和Ca 为同族金属元素,CaO 与SrO 熔点更高、硬度更大,请简述原因______。
(5)如上图所示为NiO 晶体的晶胞示意图:①该晶胞中与一个Ni 最近等距离的O 构成的空间几何形状为____________________。
②在NiO 晶体中Ni 2+的半径为apm,O 3-的半径为bpm,假设它们在晶体中是紧密接触的,则其密度为___g/cm3。
(用含字母a、b 的计算式表达)【答案】1s 22s 22p 63s 23p 63d 5或【Ar】3d 5sp 3415N>C>H 引入的氨基可与水分子之间形成氢键离子键、共价键、配位键6CaO 的晶格能大于SrO 的晶格能,所以CaO 比SrO 熔点更高、硬度更大正八面体则其密度为=g/cm 3。
3.(1)基态溴原子的价层电子轨道排布式为________。
第四周期中,与溴原子未成对电子数相同的金属元素有_______种。
(2)铍与铝的元素性质相似。
下列有关铍和铝的叙述正确的有___________(填标号)。
A.都属于p 区主族元素B.电负性都比镁大C.第一电离能都比镁大D.氯化物的水溶液pH 均小于7(3)Al 元素可形成[AlF 6]3-、[AlCl 4]-配离子,而B 元素只能形成[BF 4]-配离子,由此可知决定配合物中配位数多少的因素是______;[AlCl 4]-的立体构型名称为______。
(4)P 元素有白磷、红磷、黑磷三种常见的单质。
①白磷(P 4)易溶于CS 2,难溶于水,原因是________________②黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。
白磷、红磷都是分子晶体,黑磷晶体与石墨类似的层状结构,如图所示。
下列有关黑磷晶体的说法正确的是_________。
A.黑磷晶体中磷原子杂化方式为sp 2杂化B.黑磷晶体中层与层之间的作用力是分子间作用力C.黑磷晶体的每一层中磷原子都在同一平面上D.P 元素三种常见的单质中,黑磷的熔沸点最高(5)F 2中F-F 键的键能(157kJ/mol)小于Cl 2中Cl-Cl 键的键能(242.7kJ/mol),原因是_________。
(6)金属钾的晶胞结构如图。
若该晶胞的密度为a g/cm 3,阿伏加得罗常数为N A ,则表示K 原子半径的计算式为______。
【答案】4BD 中心原子半径、配位原子的半径正四面体P 4、CS 2是非极性分子,H 2O 是极性分子,根据相似相溶原理,P 4难溶于水BDF 的原子半径小,孤电子对之间的斥力大4.钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。
回答下列问题:(1)元素K 的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4B.553.5C.589.2D.670.8E.766.5(2)基态K 原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。
K 和Cr 属于同一周期,且核外最外层电子构型相同,但金属K 的熔点、沸点等都比金属Cr 低,原因是___________________________。
(3)X 射线衍射测定等发现,I 3AsF 6中存在I 3+离子。
I 3+离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO 3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O 分别处于顶角、体心、面心位置,如图所示。
K 与O 间的最短距离为______nm,与K 紧邻的O 个数为__________。
【答案】A N 球形K 的原子半径较大且价电子数较少,金属键较弱V 形sp30.315125.钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。
回答下列问题:(1)写出As 的基态原子的电子排布式_________________。
(2)N、P、As 为同一主族元素,其电负性由大到小的顺序为____________________,它们的氢化物沸点最高的是____________。
将NaNO 3和Na 2O 在一定条件下反应得到一种白色晶体,已知其中阴离子与SO 42-互为等电子体,则该阴离子的化学式是________。
(3)Fe 3+、Co 3+与N 3-、CN -等可形成络合离子。
①K 3[Fe(CN)6]可用于检验Fe 2+,配体CN -中碳原子杂化轨道类型为______________。
②[Co(N 3)(NH 3)5]SO 4中Co 的配位数为____________,其配离子中含有的化学键类型为_______(填离子键、共价键、配位键),C、N、O 的第一电离能最大的为_______,其原因是_____________________。
(4)砷化镓晶胞结构如下图。
晶胞中Ga 与周围等距且最近的As 形成的空间构型为________。
已知砷化镓晶胞边长为apm,其密度为pg·cm -3,则阿伏加德罗常数的数值为__________________(列出计算式即可)。
【答案】[Ar]3d 104s 24p3N>P>As NH 3NO 43-sp 6共价键、配位键N 氮原子2p轨道上的电子为半充满,相对稳定,更不易失去电子正四面体6.氮、磷及其化合物在工农业生产中都有重要作用。
(1)基态磷原子价电子排布的轨道表示式为___________。
(2)元素B、N、O的第一电离能由大到小的顺序为___________。
(3)食品添加剂NaNO 2中NO 2-中心原子的杂化类型是_____,与NO 2-互为等电子体的分子的化学式为___________。
(写1种)。
(4)N 2H 4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是____________。
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应合成。
①三溴化磷分子的空间构型是_________,三溴化硼键角是___________。
②磷化硼晶体晶胞如图所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为___________,该结构中有一个配位键,提供空轨道的原子是___________。
己知晶胞边长apm,阿伏加德罗常数为N A 。
则磷化硼晶体的密度为___________g/cm 3。
③磷化硼晶胞沿着体对角线方向的投影(图中虚线圆圈表示P 原子的投影),用实线圆圈画出B 原子的投影位置(注意原子体积的相对大小)。
______【答案】N>O>B sp 2杂化SO 2、O 3N 2H 4分子间存在氢键,O 2分子间只有范德华力,氢键比范德华力强三角锥形120°面心立方最密堆积4B或【解析】(1)P 为15号元素,基态磷原子价电子排布的轨道表示式为,故答案为:;7.金属铁及其化合物在材料、航空工业上有重要用途。
回答下列相关问题:(1)基态钛原子中有__________个状态不同的电子,最高能层电子的电子云轮廓图形状为__________,写出其价电子的轨道表达式__________。
(2)化合物TiO不仅是常用的白色颜料,也是一些反应的良好催化剂,如:2有机物X中C原子的杂化轨道类型为__________,1mol Y中所含σ键的数目是__________。
(3)已知TiCl 4在常温下是无色液体,TiCl 4的晶体类型是_____晶体,其空间构型是_____。
(4)自然界中有丰富的钛矿资源,如右图表示的是钡钛矿晶体的晶胞结构,经X 射线分析,该晶胞为正方体,晶胞参数为apm。
写出钡钛矿晶体的化学式__________,其密度是__________g·cm -3。
【答案】22球形sp 3、sp216N A 分子正四面体BaTiO 3233/(a ×10-10)3·N Aρ===g/cm 3,故答案为:BaTiO 3;。
8.利用合成的新型三元催化剂[La 0.8Cu 0.2Ni 1-x M x O 3(M 分别为Mn、Fe 和Co)]可以使汽车尾气中NO 和CO 发生反应而减少尾气污染,同时可大大降低重金属的用量。
回答下列问题:(1)Mn 2+的核外电子排布式为:________________,其单电子数为_________________。
