制剂杂质谱对比方式+有关物质方法来源与筛选
罗红霉素原料药及其制剂的有关物质研究

罗红霉素原料药及其制剂的有关物质研究摘要目的:对不同厂家罗红霉素原料药及其制剂进行有关物质检查,从而分析多批次罗红霉素的总体水平。
方法:采用HPLC法对原料药及其制剂的杂质的含量进行检测,采用LC-MS法对制剂中的杂质进行归属。
结果:受试的4批原料药与23批制剂,有关物质合格率为100%,制剂中杂质C、E、H、J、I出现概率大。
结论:通过对不同厂家生产的罗红霉素有关物进行考察,可了解各产品的质量情况,提高药品质量,保证用药安全有效。
关键词:罗红霉素;有关物质;HPLC;LC-MSStudy on the Related Substances of roxithromycin API and its preparationsAbstract Objective: The related substances of roxithromycin API and its preparations from different manufacturers were determined, so as to analyze the overall level of multiple batches roxithromycin. Methods: HPLC was used to detect the content of impurities in API and its preparation, and LC-MS was used to classify the impurities in the preparation..Results: The qualified rate of related substances in 4 batches of APIs and 23 batches of preparations was 100%, and the probability of impurity C, E, H, J and I in the preparation is high Conclusion: The related substances of roxithromycin from different manufacturers were investigated, improve the quality of drugs and ensure the safety and effectiveness of drug use.Key words:Roxithromycin ; Related substances; HPLC; LC-MS;罗红霉素为红霉素的醚肟类衍生物,其抗菌作用优于红霉素,不良反应相较于红霉素来说较少,因为它对细胞色素P450的亲和力低[1]。
一致性评价申报资料立卷自查暨审查工作用表格填写说明【模板】

一致性评价申报资料立卷自查暨审查工作用表填写说明一.品种综合信息1、批准信息(1.1-1.6)应按照申报资料信息填写药品通用名称、商品名、批准文号(包括历年的批准文号\规格、执行标准、药品有效期。
2、申报概况(1.7∙L12)根据《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求》中概要部分内容填写:药品注册及变更批准证明性文件是否提供、临床信息和不良反应是否提供、再评价品种处方工艺是否变更、自评估报告是否提供、是否按照CTD格式提交资料寄言息。
3、检验报告(1.13)根据(3.2.P.5.4)批检验报告部分内容填写1.13检验报告部分。
二.原研产品及参比制剂信息1、原研产品信息(2.1)根据原研产品上市情况填写相关I言息。
2、参比制剂信息(2.2)按照总局2017年第100号公告以及《普通口服固体制剂参比制剂选择和确定指导原则》等规定的要求,选择和确定参比制剂。
申报资料应明确注明参比制剂信息,并提供所用参比制剂来源证明资料;凡是采用非总局公布目录产品作为参比制剂的,221项应选择“其他说明",同时填写生产企业名称及产品相关信息;如提供了参比品标签/样品照片/说明书中的任意一项,则在相应栏目选"提供";三项均未提供,选"未提供"。
说明书采用网络版本(如PDF格式)打印件,不认可。
每个规格原则上应提供3批(至少1批)参比制剂的考察数据,考察与一致性评价紧密相关的关键质量属性,例如性状、溶出度/释放度、含量、有关物质等(检验报告可列为附件%每个规格的参比制剂原则上应提供3批样品的溶出曲线考察数据f以考察其溶出行为的批内和批间均一性。
对有文献报道或者研究资料表明有光照、高湿、高温、氧化等条件下不稳定的品种,建议考察参比制剂溶出曲线稳定性,为实验室复核结果的重复性提供支持。
三.产品研究信息1、处方组成1.1、原料药及辅料(3.1.1-2):应提供原料药及辅料的批准证明文件、质量标准、检验报告、BSE/TSE风险声明等资料制剂可能含有一个或多个原料药,含有多个原料药的可能存在既有国产来源的原料药也有进口原料药,应根据申报品种处方及提供的证明资料如实填写。
制剂C T D格式药学研究信息汇总表(4、5.2)
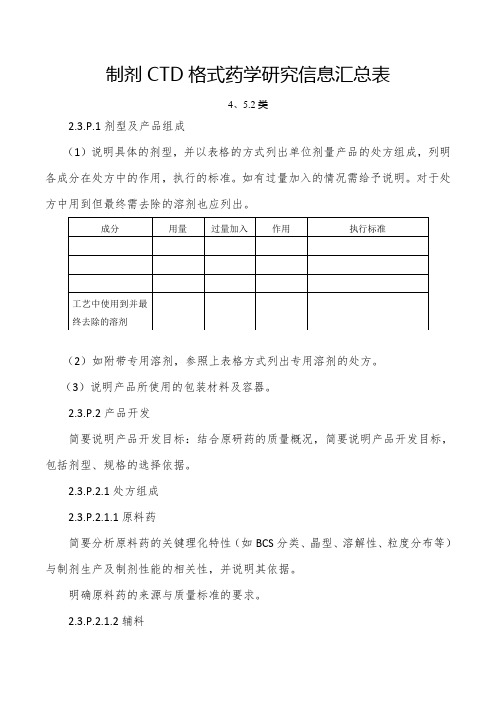
制剂CTD格式药学研究信息汇总表4、5.2类2.3.P.1剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
(2)如附带专用溶剂,参照上表格方式列出专用溶剂的处方。
(3)说明产品所使用的包装材料及容器。
2.3.P.2产品开发简要说明产品开发目标:结合原研药的质量概况,简要说明产品开发目标,包括剂型、规格的选择依据。
2.3.P.2.1处方组成2.3.P.2.1.1原料药简要分析原料药的关键理化特性(如BCS分类、晶型、溶解性、粒度分布等)与制剂生产及制剂性能的相关性,并说明其依据。
明确原料药的来源与质量标准的要求。
2.3.P.2.1.2辅料简述辅料及其用量适合所用的给药途径的依据,结合辅料在处方中的作用简述辅料的与制剂性能相关的关键特性。
简述原料药和辅料的相容性试验的情况,包括试验设计、考察指标、试验结果等。
如未进行原料药和辅料的相容性试验,应提供相应的依据。
2.3.P.2.2 制剂研究2.3.P.2.2.1处方开发过程简述处方研究的主要内容。
包括处方开发的基本思路、试验设计、考察指标和方法、试验结果、与原研药的比较研究情况、处方的放大和调整等。
示例如下:某普通片剂的处方研究小结:参考原研药说明书、原辅料相容性试验情况、相关生产经验等,确定了辅料的基本种类;参考原研药的重量和大小、以及各辅料常规用量,确定了辅料的用量范围,以××××为指标,采用××××方法,对××××的种类和用量进行了比较筛选,对××××处方进行了研究,以原研药为对照药,结果显示××××,根据以上研究确定了初步的处方;在以上研究基础上,进行了影响因素稳定性考察,与原研药进行了××××的质量对比;在批量放大过程中,对××××进行了调整,确定了最终处方。
化学药品仿制药口服固体制剂质量和疗效一致评价申报资料要求

变化)及相关的支持性验证研究,包括生产工艺变更的基本思路、
试验设计、考察指标和方法、试验结果等,以及与原研药或参比
制剂的比较研究情况,批量放大过程中的调整等。
汇总研发过程中代表性批次(应包括但不限于临床研究批、
中试放大批、工艺验证批等)的样品情况,包括:批号、生产时
间及地点、批规模、用途(如用于稳定性试验或生物等效性试验
说明再评价品种具体的已上市信息。包括剂型、规格、批 准时间(批准文号)、执行标准、标准号、有效期等内容,并提 供相关的证明性文件。
简要说明本再评价品种自批准上市以来的生产销售、相关 变更及质量稳定性情况,相关变更提供最新有效证明性文件。
3.自评估报告 申请人应对此次一致性评价具体内容的相关研究进行全面 论述。结合每项研究内容,对处方工艺研究、关键步骤和中间体 的控制、原辅料、包装材料进行分析,重点针对与参比制剂一致 性相关的质量研究情况、体内评价研究结果等的分析,提出对本 品种与参比制剂质量和疗效一致性的综合评价结果。 申请人应保证该品种研发过程及结果和申报资料的科学性、 完整性和真实性。 4.临床信息及不良反应 本品种的临床使用情况,主要不良反应,收集历年来生产企 业统计的不良反应反馈情况,对于治疗窗狭窄的药物说明临床治 疗安全窗口指数。 5.最终确定的处方组成及生产工艺情况
8.3.2.(3.2.P.3.2)批处方
以表格的方式列出典型生产规模产品的批处方组成,列明各
成分执行的标准。如有过量加入的情况需给予说明并论证合理性。
对于处方中用到但最终需去除的溶剂也应列出。
表 XX:典型生产批的处方
成分
用量
过量加入 作用
执行标准
工艺中使用并最终 去除的溶剂
8.3.3.(3.2.P.3.3)生产工艺和工艺控制 (1)工艺流程图:以单元操作为依据,提供完整、直观、 简洁的工艺流程图,其中应涵盖工艺步骤,各物料的加入顺序,
药物的杂质检查含来源和分类、杂质限量(优选内容)

溶HC解l、 氯化物 H2O NH3H2O调节至pH7.0左右
pH3.5缓冲液2.0ml 依一法检查
对照:空坩埚 H2SO4、 HNO3、 HCl、
NH3H2O、 H2O 标准Pb(NO3)2溶液
(1) 保管不善或贮存时间过长 (2) 包装不当
在外界条件
水解、氧化、分解
药品 温度、湿度、日光、空 气、微生物聚合、异构化、晶
型转化、潮解、发霉
产生杂质
严选内容
8
二、杂质限量检查及其计算
(一)杂质的限量检查
在不影响药物疗效、稳定性
及不发生毒性的前提下,药物中
如显浑浊,可反复过滤,至滤液完全澄清,再
加规定量的标准氯化钠溶液与水适量使成 50mL,摇匀,在暗处放置5min,作为对照溶 液;另一份加硝酸银试液1.0mL与水适量使成 50mL,摇匀,在暗处放置5min,对两管进行
比浊。此外,也可采用外消色法,即加入某种 试剂,使供试液褪色后再检查。
严选内容
20
100%
严选内容
12
杂质限量
标准溶液体积 标准溶L液浓V 度 c
供试品量
S
100%
L
V SS
c
100%
式中 L——杂质限量,%(或mg/kg); c——标准溶液浓度,mg/ml(或µg/ml); V——标准溶液的体积,mL; S——供试品取样量,g。
严选内容
13
第三节 一般杂质检查
比较,即得。
严选内容
28
(二)巯基醋酸法
药物:Fe Fe
3 2
20%枸橼酸2ml 巯基醋酸 Fe2
NH3H2O 巯基醋酸 红色
对照:Fe3 20%枸橼酸2ml 巯基醋酸 Fe2
【讨论】浅谈复方制剂的有关物质质量标准的建立

页眉内容【讨论】浅谈复方制剂的有关物质质量标准的建立应斑竹的邀请,开此贴跟大家讨论一下复方制剂杂质的控制以及分析方法建立的一些相关问题。
本人在分析实验室做了6-7年仿制药申报,负责药物CMC方面的质量研究工作,接触了十几个项目。
基本了解FDA/SFDA审评人员的一些要求和想法。
此贴会结合本人的一些经验,探讨复方制剂有关物质分析的一些注意点,并且会结合产品申报以后FDA给的缺陷信,提示大家如何避免同样的问题。
更希望抛砖引玉,各位版友和专家踊跃参与,共同提高。
废话少说,对于有关物质的研究,最近几年国家法规的要求越来越高,可能大家也越来越重视此项研究。
不过一个不可否认的事实是,我们的杂质研究水平和欧美或者印度等国家差距很大。
我们的绝大部分药品企业基本处于食物链的最底端,以前经常听我们老板说他在美国的药厂工作的时候,要从其他公司买API,很多都是西班牙的,意大利的,或者印度的药厂以极其低廉的价格从国内厂家购买的粗品,然后拿回去做一到两步的提纯,再做一些法规文件,就可以以很多倍的价格卖出去。
我们消耗了主要的人力,物力,牺牲了环境,结果回报只有人家的零头,可悲又可气!所以我们就要具体的看一看到底存在哪些差距。
复方制剂有关物质控制的基本原则和单方一样,你就把他当作是在做两个或者三个产品,只不过是同时分析几个物质。
相关的指导原则大家也应该都知道, ICH Q3A和Q3B; FDA也有相关的工业指南,跟这两个基本差不多。
做杂质研究和其他大部分质量研究工作一样,首先要做的第一步就是去收集资料,包括:1. API厂家的技术资料,一般有DMF的会提供它的open part, 里面会大致列出它的工艺流程,合成路径和所有潜在的杂质。
2.药典的各论,包括USP, EP等等,看看药典有那些要求检测的杂质。
3.查阅文献,看看化合物的潜在杂质和降解产物。
这一点对于制剂的杂质控制有时会提供很有用的信息。
4.国内申报仿制药最好弄到进口注册标准,看看原研厂家是怎样控制杂质的。
中药制剂的杂质检查技术

4.结果判断 乙管中显出的颜色比甲管浅或接近,则重金
属限量检查符合规定,若乙管中显出的颜色比 甲管深,则重金属限量检查不符合规定。
(三)第三法(硫化钠法)
本法适用于能溶于碱而不溶于稀酸(或在稀酸中 即生成沉淀)的药品中的重金属限量检查。 1.测定原理:
在碱性条件下,某些重金属的溶解度增大,滴加 硫化钠试液,可与重金属离子生成有色硫化物的均 匀混悬液,与一定量标准铅溶液经同法处理所呈颜 色进行对比,检查供试品中重金属是否超限。
样品量
七、杂质检查方法
(一)比较分析法(比色法)
即取一定量与被检杂质相同的纯物质或其他对照 品配制成标准溶液,与一定量供试品溶液,在相同 实验条件下,比较反应结果(如颜色深浅),从而 确定制剂中杂质的含量是否超过规定的限度。重金 属、砷盐、乌头碱等杂质检查即采用该法。
由于样品(S)中所含杂质的含量是通过与杂质 标准溶液进行比较来确定的,杂质的最大允许量也 就是杂质标准溶液的体积(V)与其浓度(C)的 乘积,因此杂质限量(L)可按下式计算:
2.操作方法
按上述总灰分测定法制备供试品的总灰分。取所 得的灰分,在坩埚中加入稀盐酸约10ml,用表面皿 覆盖坩埚,置水浴上加热10分钟,表面皿用热水 5ml冲洗,洗液并入坩埚中,用无灰滤纸滤过,坩 埚内的残渣用水洗于滤纸上,并洗涤至洗液不显氯 化物反应为止。滤渣连同滤纸移至同一坩埚中,干 燥,炽灼至恒重。根据残渣重量计算供试品中酸不 溶性灰分的含量(%)。
(2)对照品溶液的制备
取配制供试品溶液的试剂,置瓷皿中蒸干后,加 醋酸盐缓冲液(pH3.5)2ml与水15ml,微热溶解 后,移置纳氏比色管(甲管)中,加标准铅溶液一 定量,再用水稀释成25ml,即得。
(3)检查法
高效液相色谱法测定盐酸黄酮哌酯原料和制剂中有关物质探讨

高效液相色谱法测定盐酸黄酮哌酯原料和制剂中有关物质探讨摘要】盐酸黄酮哌酯主要呈现出一种白色粉末或者晶体状态,化学方程式为C24H25NO4.HCl;C24H26ClNO4,其分子量为427.92。
本文将针对盐酸黄酮哌酯试药进行详细的分析,其目的是探究出高效液相色谱法测定盐酸黄酮哌酯的策略。
【关键词】高效液相色谱法;盐酸黄酮哌酯【中图分类号】R927.2 【文献标识码】A 【文章编号】2095-1752(2018)21-0361-01就我国现行的盐酸黄酮哌酯质量标准检测手段来说,主要是依照《中国药典(二部)》的相关内容,针对盐酸黄酮哌酯原料和制剂中有关物质进行检定,主要运用TLC法。
但是随着我国药物技术的不断发展,通过高效液相色谱的手段也能够详细的针对盐酸黄酮哌酯的质量以及物质含量进行分析,并且结合我国相关的药物检测标准进行对照,检测出盐酸黄酮哌酯的含量。
客观来说,传统TLC相比HPLC 检测手段来说,更加繁琐,其灵活度也相对较低。
据笔者的亲身统计与观察总结出,传统TLC检测手段,仅控制杂质3-甲基黄酮-8-羧酸,对其他杂质不能进行有效的检测。
本文将针对高效液相色谱法测定盐酸黄酮哌酯原料和制剂中有关物质进行详细的探讨。
1.盐酸黄酮哌酯试药盐酸黄酮哌酯主要用于尿频、尿急、尿痛、排尿困难及尿失禁等泌尿疾病的治疗中。
作为一中国产的口服药物,我国不同制药厂针对盐酸黄酮哌酯的大多检查项目与原研药品的差异并不大,但是药物的溶解与溶出的情况,不同制药厂会存在一定程度上的差异,但是此类差异对盐酸黄酮哌酯的疗效并没有产生直接的影响[1]。
107批样品按照现行质量标准检验,仅有30批样品检出已知杂质,很难针对盐酸黄酮哌酯中出现的其他杂质与未知物质进行检测,说明现行药典有关物质测定方法专属性和灵敏度均较差,检查结果不能反映药品中杂质的真实含量。
2.高效液相色谱法测定盐酸黄酮哌酯的策略2.1 合理的选择色谱条件针对盐酸黄酮哌酯来说,其极性相对较强,很容易被洗脱。
