催化原理复习题-2018.
《有机化学及实验技术》期末复习题(2018) (1)
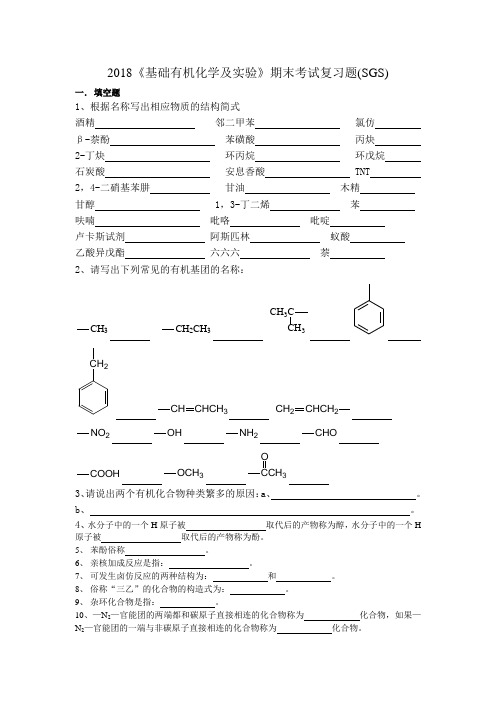
2018《基础有机化学及实验》期末考试复习题(SGS)一.填空题1、根据名称写出相应物质的结构简式酒精邻二甲苯氯仿β-萘酚苯磺酸丙炔2-丁炔环丙烷环戊烷石炭酸安息香酸 TNT 2,4-二硝基苯肼甘油木精甘醇 1,3-丁二烯苯呋喃吡咯吡啶卢卡斯试剂阿斯匹林蚁酸乙酸异戊酯六六六萘2、请写出下列常见的有机基团的名称:CH3CH2CH3CH3C3CH2CHCH3CH CHCH2CH2NO2OH NH2CHOCOOH OCH33O3、请说出两个有机化合物种类繁多的原因:a、。
b、。
4、水分子中的一个H原子被取代后的产物称为醇,水分子中的一个H 原子被取代后的产物称为酚。
5、苯酚俗称。
6、亲核加成反应是指:。
7、可发生卤仿反应的两种结构为:和。
8、俗称“三乙”的化合物的构造式为:。
9、杂环化合物是指:。
10、—N2—官能团的两端都和碳原子直接相连的化合物称为化合物,如果—N2—官能团的一端与非碳原子直接相连的化合物称为化合物。
11、蜜峰蛰人时产生的肿痛是由于分泌了所致。
12、水杨酸构造式为:,硝化甘油构造式为:,苦味酸构造式为:,13、亚硫酸氢钠可与,,反应析出白色结晶。
14、苯酚酸性比羧酸,比碳酸。
15、饱和一元羧酸的烃基上连有吸电子基团时,其酸性会。
饱和一元羧酸的烃基上连有供电子基团时,其酸性会。
16、饱和一元羧酸中,最强的为。
17、根据俗名写出相应物质的结构简式:偶氮苯苦味酸呋喃三乙胺硝化甘油18、饱和一元脂肪族羧酸的烃基上连有吸电子基团时,其酸性会。
19、只与一个碳原子相连的碳原子叫伯碳原子,与两个碳原子相连的碳原子叫仲碳原子,与三个碳原子相连的碳原子叫叔碳原子,与四个碳原子相连的碳原子叫季碳原子。
17.在对烷烃进行命名时,根据主链碳原子的数目,把母体称为某烷。
当碳原子数分别为1-10个时,分别用天干名称:来表示甲,乙,丙,丁,戊,己,庚,辛,壬,癸。
20、碳原子数相同的烯烃和环烷烃互为同分异构体,碳原子数相同的炔烃和环烯烃、二烯烃互为同分异构体。
2018年高考全国卷II理综化学试题和详细解析
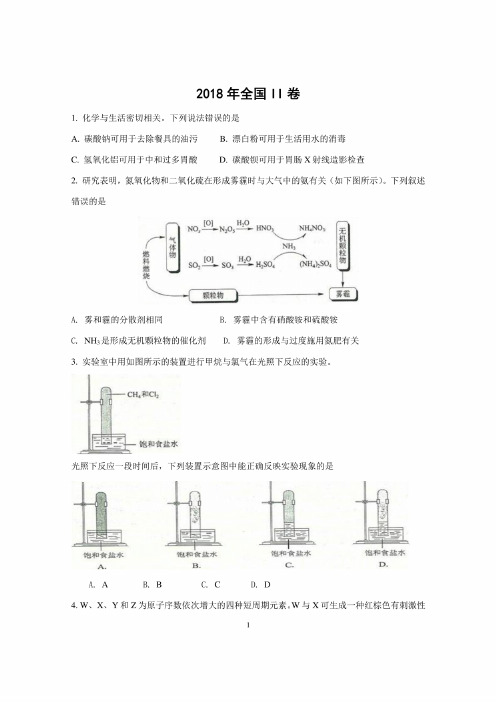
2018年全国II 卷1. 化学与生活密切相关。
下列说法错误的是A.碳酸钠可用于去除餐具的油污B.漂白粉可用于生活用水的消毒C.氢氧化铝可用于中和过多胃酸D.碳酸根可用于胃肠X 射线造影检查2. 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。
下列叙述错误的是A.5NH.NO,B.雾霾中含有硝酸铉和硫酸铉/,燃料燃烧雾和霾的分散剂相同C.3.NH3是形成无机颗粒物的催化剂D.雾霾的形成与过度施用氮肥有关实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
CH,和6饱和食盐水光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是A. D.A. AB.C. CD. DB 4.W 、X 、Y 和Z 为原子序数依次增大的四种短周期元素。
W 与X 可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。
下列叙述正确的是A.X与其他三种元素均可形成两种或两种以上的二元化合物B.Y与其他三种元素分别形成的化合物中只含有离子键C.四种元素的简单离子具有相同的电子层结构D.W的氧化物对应的水化物均为强酸5.M代表阿伏加德罗常数的值。
下列说法正确的是A.常温常压下,124gP4中所含P—P键数目为4N aB,100mL lmol-L-1FeCl3溶液中所含Fe’+的数目为0.1MC.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2MD.密闭容器中,2mol SO2和1mol O2催化反应后分子总数为2M6,我国科学家研发了一种室温下“可呼吸”的Na—CO?二次电池。
将NaC104溶于有机溶剂作为电解液,钠和负载碳纳米管的镣网分别作为电极材料,电池的总反应为:3CQ2+4N a7——^.2Na2C03+Co下列说法错误的是A,放电时,C10「向负极移动B.充电时释放CO?,放电时吸收CO?D,充电时,正极反应为:Na*+e-=Na 7,下列实验过程可以达到实验目的的是C.放电时,正极反应为:3C02+4e-=2C032-+C编号实验目的实验过程A配制0.4000mol•L-1的NaOH溶液称取4.0g固体NaOH于烧杯中,加入少量蒸德水溶解,转移至250mL容量瓶中定容B探究维生素C的还原性向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化C制取并纯化氢气向稀盐酸中加入锌粒,将生成的气体依次通过NaOH 溶液、浓硫酸和KMnO,溶液D 探究浓度对反应速率的影响向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H202溶液,观察实验现象8.我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiCh和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:2稀f酸O r ZnO锌粉1浮选精於f焙广H:浸H氧彳V杂—1还:除杂f滤液f电解»锌气体滤渣1滤渣2波渣3金属离子T73+Zn Cd2+Fe T72+Fe72+开始沉淀的pH 1.5 6.3 6.27.4沉淀完全的pH 2.88.38.29.4相关金属离子[co(M"+)=O.l moLL』]形成氢氧化物沉淀的pH范围如下:回答下列问题:(1)焙烧过程中主要反应的化学方程式为o(2)滤渣1的主要成分除SiO2外还有;氧化除杂工序中ZnO的作用是,若不通入氧气,其后果是o(3)溶液中的CcP+可用锌粉除去,还原除杂工序中反应的离子方程式为o (4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为;沉积锌后的电解液可返回________工序继续使用。
专题十一 反应历程与新信息 (详解版)五年(2018-2022)真题分类集训
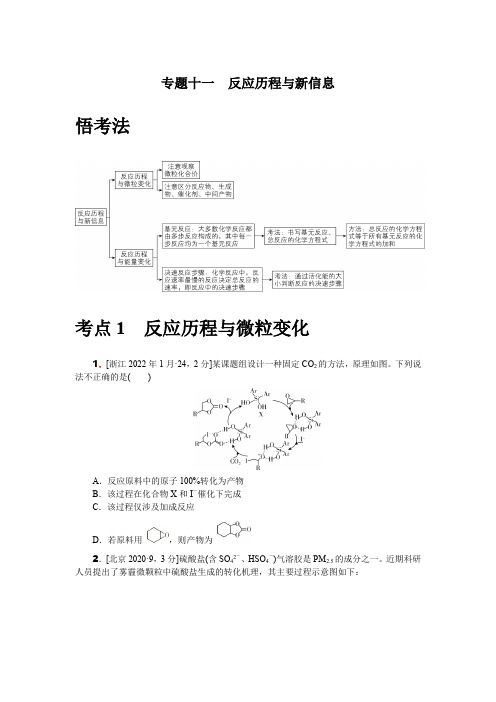
专题十一反应历程与新信息悟考法考点1反应历程与微粒变化1.[浙江2022年1月·24,2分]某课题组设计一种固定CO2的方法,原理如图。
下列说法不正确的是()A.反应原料中的原子100%转化为产物B.该过程在化合物X和I-催化下完成C.该过程仅涉及加成反应D.若原料用,则产物为2.[北京2020·9,3分]硫酸盐(含SO42-、HSO4-)气溶胶是PM2.5的成分之一。
近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:下列说法不正确的是( )A .该过程有H 2O 参与B .NO 2是生成硫酸盐的氧化剂C .硫酸盐气溶胶呈酸性D .该过程没有生成硫氧键3.[浙江2021年6月·24,2分]制备苯甲酸甲酯的一种反应机理如图(其中Ph—代表苯基)。
下列说法不正确的是( )A .可以用苯甲醛和甲醇为原料制备苯甲酸甲酯B .反应过程涉及氧化反应C .化合物3和4互为同分异构体D .化合物1直接催化反应的进行4.[湖北2021·12,3分]甲烷单加氧酶(s -mmo)含有双核铁活性中心,是O 2氧化CH 4生成CH 3OH 的催化剂,反应过程如图所示。
下列叙述错误的是( )A .基态Fe 原子的核外电子排布式为[Ar]3d 64s 2B .步骤③有非极性键的断裂和极性键的形成C .每一步骤都存在铁和氧元素之间的电子转移D .图中的总过程可表示为CH 4+O 2+2H ++2e -――→s -mmoCH 3OH +H 2O5.[全国Ⅱ2020·11,6分]据文献报道:Fe(CO)5催化某反应的一种反应机理如图所示。
下列叙述错误的是()A.OH-参与了该催化循环B.该反应可产生清洁燃料H2C.该反应可消耗温室气体CO2D.该催化循环中Fe的成键数目发生变化6.[全国Ⅰ2020·10,6分]铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
2013复习题

《催化原理》复习题一.填空1.“催化作用”一词最早是由瑞典化学家_________于_________年提出的。
2.在已开发的使用催化剂中,有四类催化剂最具特色,它们分别是_________,_________,_________和_________。
3.在同一个化学反应中,之所以有不同的选择性有以下三种原因,第一个原因是由于_________导致的,第二个原因是由于_________引起的,第三个原因是由于_________造成的。
4.气体在固体表面的吸附可分为两类:_________和_________。
化学吸附类似于化学反应,吸附后,反应物分子与催化剂表面原子之间形成_________,组成表面络合物。
在多相催化过程中,化学吸附是个重要的阶段,催化过程之所以能加快反应速度,一般来说,是由于_________。
5.Langmuir吸附等温式所依据的模型是①___ ______ ②__ _______ ③______ ___ ④____ _____。
6.高活性催化剂常易被外来分子污染而中毒,那些具有_________的分子,如氨、磷化氢、一氧化碳、二氧化硫、硫化氢等分子能与催化剂表面形成_________,因此这些分子是毒性很强的毒物。
7.一个好的固体催化剂必须具有_________;_________ ;________和_________。
8.氧化铝按晶型可分为八种,所有这些氧化铝都是用希腊字母来命名的。
它们可归纳为两大类,低温氧化铝(在低于6000C煅烧而得),包括_________四种;高温氧化铝(在高于6000C煅烧而得),包括_________四种;_________为终态,俗称刚玉。
9.分子筛的基本结构单元是硅氧四面体。
_________原子在四面体的中心,_________占据四面体的顶点。
四面体中的_________原子可被_________原子取代,便成为铝氧四面体。
10.由于人类生产实践的不断扩大,在地球范围内,催化剂出现了许多新的应用领域,这些新的应用领域主要是_________;_________;_________;_________。
全国通用版高考化学考点题型拓展复习专题十二化学能与热能

专题十二化学能与热能备考方向导航考点1 化学反应中能量变化的有关概念1.[2020天津,10,3分]理论研究表明,在101 kPa和298 K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。
下列说法错误的是( )A.HCN比HNC稳定B.该异构化反应的ΔH=+59.3 kJ·mol-1C.正反应的活化能大于逆反应的活化能D.使用催化剂,可以改变反应的反应热2.[2018北京,7,6分]我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如图。
下列说法不正确的是( )A.生成CH3COOH总反应的原子利用率为100%B.CH4→CH3COOH过程中,有C—H键发生断裂C.①→②放出能量并形成了C—C键D.该催化剂可有效提高反应物的平衡转化率3.[2018海南,12,4分][双选]炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。
活化过程的能量变化模拟计算结果如图所示。
活化氧可以快速氧化二氧化硫。
下列说法正确的是( )A.每活化一个氧分子吸收0.29 eV的能量B.水可使氧分子活化反应的活化能降低0.42 eVC.氧分子的活化是O—O的断裂与C—O键的生成过程D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂考点2 热化学方程式4.[2021四川石室中学开学考试]H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。
下列说法错误是( )A.有MnO2条件下的变化曲线是bB.该反应能量变化类型与氢气燃烧反应的相同C.加MnO2后,正反应速率增大,逆反应速率减小D.该反应的热化学方程式为H2O2(l)H2O(l)+1O2(g) ΔH=(E1-E2) kJ·mol-125.[2017全国卷Ⅰ,28(2),5分]下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为、,制得等量H2所需能量较少的是。
化学专题-专题14 基本概念、基本理论综合二-高考化学母题题源系列 Word版含解析
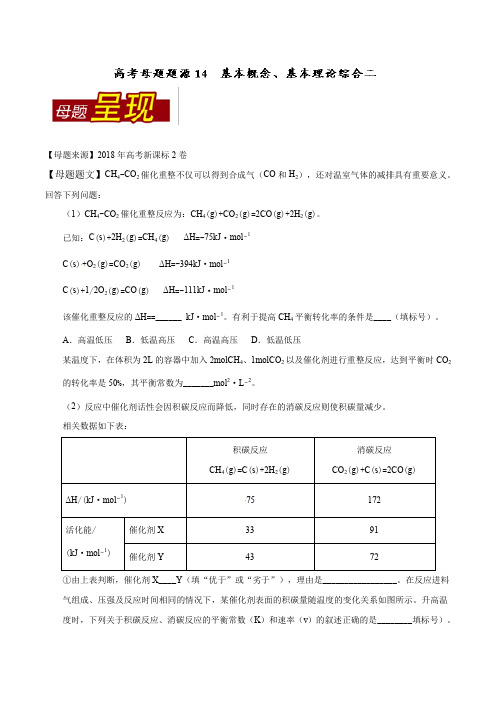
【母题来源】2018年高考新课标2卷【母题题文】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。
回答下列问题:(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol−1C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol−1C(s)+1/2O2(g)=CO(g) ΔH=-111kJ·mol−1该催化重整反应的ΔH==______ kJ·mol−1。
有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压B.低温高压C.高温高压D.低温低压某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L−2。
(2)反应中催化剂话性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:75①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。
在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。
升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。
A.K积、K消均增加B.v积减小,v消增加C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。
在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则p a(CO2)、p b(CO2)、p c(CO2)从大到小的顺序为________________。
催化原理复习题

催化原理复习题催化原理复习题催化反应是化学中一种重要的反应方式,它通过催化剂的作用,降低反应的活化能,加速反应速率。
催化原理是化学学习中的重要内容之一,下面我们来复习一些催化原理的相关问题。
1. 什么是催化剂?它在催化反应中起到什么作用?催化剂是指在化学反应中能够降低反应活化能,促进反应进行的物质。
催化剂在反应中不参与化学反应,因此在反应结束后仍能够重新使用。
催化剂通过提供新的反应路径,使得反应能够以更低的能量进行,从而加速反应速率。
2. 催化剂的选择与反应速率有什么关系?催化剂的选择对反应速率有重要影响。
合适的催化剂能够提供更佳的反应路径,降低反应的活化能,从而加速反应速率。
不同的反应需要选择适合的催化剂,以达到最佳的催化效果。
3. 催化剂的作用机理是什么?催化剂的作用机理主要有两种:表面机理和溶液机理。
表面机理是指催化剂与反应物在催化剂表面发生反应,生成中间体,然后再解离为产物。
溶液机理是指催化剂与反应物在溶液中发生反应,生成中间体,然后再解离为产物。
4. 什么是催化剂的活性中心?催化剂的活性中心是指催化剂中能够与反应物发生作用的部位。
催化剂的活性中心通常是一个或多个原子、离子或分子,具有特定的结构和性质。
活性中心能够吸附反应物,降低反应的活化能,促进反应进行。
5. 催化剂的选择与反应选择性有何关系?催化剂的选择对反应选择性有重要影响。
不同的催化剂能够引导反应物在不同的反应路径上进行,从而产生不同的产物。
合适的催化剂能够提高反应的选择性,使得产物得到更好的纯度和收率。
6. 催化剂的失活是什么原因造成的?催化剂的失活是指催化剂在反应中逐渐失去催化活性的现象。
催化剂的失活原因有多种,包括物理失活和化学失活。
物理失活是指催化剂的物理性质发生变化,如表面积减小、孔隙堵塞等。
化学失活是指催化剂与反应物或产物发生反应,形成不活性物质。
7. 如何减缓催化剂的失活?减缓催化剂的失活可以采取多种方法。
一种方法是定期对催化剂进行再生或修复,恢复其催化活性。
高中化学三年级理综快速提升之微专题一催化剂与活化能
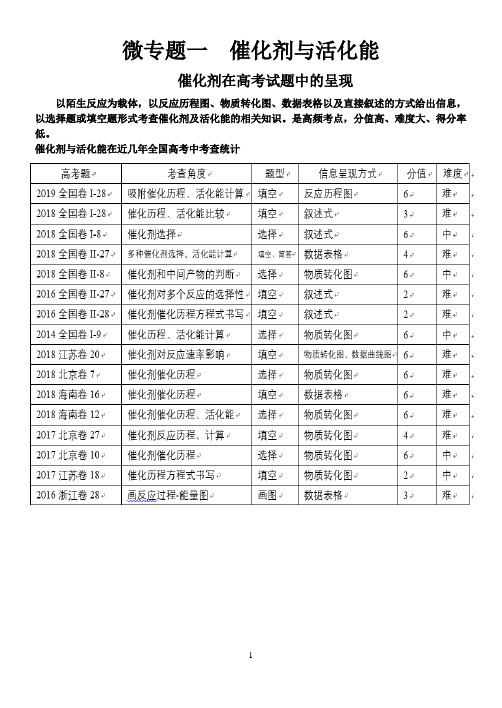
微专题一催化剂与活化能催化剂在高考试题中的呈现以陌生反应为载体,以反应历程图、物质转化图、数据表格以及直接叙述的方式给出信息,以选择题或填空题形式考查催化剂及活化能的相关知识。
是高频考点,分值高、难度大、得分率低。
催化剂与活化能在近几年全国高考中考查统计命题方向为什么工业上热衷于催化剂人教版选修4-p4化学反应理论模型催化剂与反应速率一、催化剂如何影响反应速率二、催化剂对反应速率影响有多大结论:催化剂对反应速率影响远远大于温度对反应速率影响(催化剂高效性)工业上提高生产效率首选“催化剂”三、单峰变双峰(化学选修4 p-22)练习:1、已知H2O2分解反应为:2H2O2=2H2O+O2。
在含少量I-的溶液中,H2O2分解机理为:①.H2O2+I-═H2O+IO- △H>0 慢②.△H>0 快写出反应②离子反应方程式。
思维模型催化剂参与反应历程,确定分反应或总反应方法①判断催化剂和中间产物②反应过程反应物A+催化剂=中间产物中间产物+反应物B=产物+催化剂③配平,相加得总化学反应式高考对催化剂考查新角度一、催化剂判断与催化机理2、(2017年江苏高考题-18)②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。
Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。
M'的化学式为______。
/3、(2016年北京高考题-27)(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:i:2Fe2++ PbO2+4H++SO42−2Fe3++PbSO4+2H2Oii: ……①写出ii的离子方程式:________________。
4、(2018年全国高考I卷-28)(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:第一步 N2O5NO2+NO3快速平衡第二步 NO2+NO3→NO+NO2+O2慢反应第三步 NO+NO3→2NO2快反应其中可近似认为第二步反应不影响第一步的平衡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
.
载体和助剂区别: 载体量大,活性作用缓和、不明显;助剂量少,活性作用明 显。 载体在催化剂中的作用: 1) 支撑作用:决定催化剂的基本物理结构和性能。如:孔结构,比表面,机械 强度等。 2)分散作用:提高活性组分利用率,减少活性组分的用量,降低成本。 3)助催化作用:a)提供附加活性中心,如双功能Pt/Al2O3;b)和活性组分相 互作用,形成具有催化性能的新表面物种。 4)稳定化作用:a)增加催化剂活性组分的抗毒性能,延长寿命;b)提高催化 剂的热稳定性, 如:Cu, Pd 200oC开始半溶,烧结失活, 载在Al2O3 或 SiO2 500oC下可长时间使用。
物理吸附和化学吸附的本质区别是它们的吸附力不同,物理吸附是范德华力; 化学吸附是化学键力。发生物理吸附时被吸附分子结构变化不大;发生化学吸附
页脚
.
时被吸附分子结构发生变化。另外物理吸附是单层或多层吸附,吸附时无选择性, 热效应较小,吸附速率较快不受温度影响,不需活化能;而化学吸附是单层吸附, 吸附时有选择性,热效应较大小,吸附速率较慢,需活化能; 2. 吸附强弱的度量方法:
kSbA pA pB 1 bA pA bC pC
第四章 固体酸碱催化剂及其催化作用
1. 酸、碱催化的定义和性质
3.催化作用的实现 A:改变反应历程,不参与最终产物 ; B:催化剂只能加速热力学上认为可能发生的反应,对于热力学计算表明不可能发 生的反应,使用任何化学催化剂是徒劳的。 C:催化剂只能加速反应趋向平衡,而不能改变化学平衡位置。 D:催化剂对化学反应具有选择性。 4.催化剂的稳定性指的是哪几个方面? (1)化学稳定性:保持稳定的化学组成和化合状态。 (2)耐热稳定性:能在反应条件下不因受热而破坏其物理化学状态,能在一定 温度范围内保持良好的稳定性。
1 bp 解离吸附的 Langmuir 方程
混合吸附的 Langmuir 方程
(2)Brunaauer-Emmett-Teller 吸附等温式-BET 方程(四个假定) • BET 方程是建立在 Langmuir 吸附理论基础上的,但同时还认为: • 1、物理吸附为分子间力,被吸附的分子与气相分子之间仍有此种力,故 可发生多层吸附,多层吸附与气体的凝聚相似。 • 2、吸附达到平衡时,每个吸附层上的蒸发速度等于凝聚速度,故能对每 层写出相应的吸附平衡式,经过一定的数学运算得到 BET 方程。
.
催化作用原理
第二章 催化作用的化学基础
1、催化剂的性能指标 活性: 衡量催化剂效能大小、表示催化剂加快化学反应速率程度的一种度量。
选择性 工厂常用产率来表示催化剂的优劣:
催化剂的活性可用以下三种方法来表示: (1)反应速率
反应速率用来表示反应的快慢。当用反应速率比较催化剂的活性时,应保证 反应时的温度压力和原料的配比等均相同,此时反应速率越快表示催化剂的 活性越好。 (2)转化率 转化掉的反应物的量占反应物总量的百分数。是常用的比较催化剂活性的参 量。
页脚
.
• 其中 V 为吸附量,P 为吸附平衡时的压力,P。为吸附气体在给定温度下
的饱和蒸气压,Vm 为表面形成单分子层的饱和吸附量,C 为与吸附热有
关的常数。
• 此等温式被公认为测定固体表面积的标准方法。
• 求比表面的关键,是用实验测出不同相对压力 P/Po
下所对应的一组平衡吸附体积,然后将 P/V(P-Po)对
A
dcA dt
kcAacBb
k
a b
AB
6.机理模型法建立速率方程
(1) 理想吸附模型的速率方程
a、表面反应为速率控制步骤
只有一种反应物:
A B 若反应
的机理为:
(S 表示催化剂表面活性中心)
1)吸附表面反应: A S kB S (慢)
3)解吸: B S B S (快)
物理吸附与 化学吸附
物理吸附与 化学吸附
化学吸附
多层物理吸 附
4. 多相催化反应的步骤 (1) 反应物由气体主体向催化剂外表面扩散; (2) 反应物由外表面向催化剂内表面扩散; (3) 反应物吸附在表面上; (4) 反应物在表面上进行反应,生成产物;
页脚
.
(5) 产物从表面上解吸;
(6) 产物从内表面向外表面扩散;
吸附物种与催化剂表面键合形成化学吸附键的强弱,由反应物与催化剂的性 质及吸附条件决定。其数值大小可由化学吸附热度量。吸附热越大,吸附键 愈强;反之,吸附热越小.吸附键越弱。因此,吸附热是选择催化剂时要考 虑的因素之一。 (1)积分吸附热:在一定温度下,当吸附达到平衡时,平均吸附 1mol 气体所 放出的热量称为积分吸附热 q 积,它反映了吸附过程中在一个比较长的时间内, 热量变化的平均结果,常用于区分物理吸附与化学吸附。 (2)微分吸附热:催化剂表面吸附的气体从 n mol 增加到 (n+dn) mol 时,平 均吸附每摩尔气体所放出的热量-微分吸附热。 • 反映了吸附过程某一瞬间的热量变化。 • 微分吸附热是表面覆盖度 的函数 • 表面覆盖度-已被吸附分子覆盖的表面积占总表面积的分率。 • 用初始吸附热与催化活性相关联,比较不同催化剂的催化活性。 • 微分吸附热是覆盖度 的函数,其变化关系比较复杂。有三种类型。 类型 I,吸附热与覆盖度无关,即吸附热为常数。这是理想的吸附情况,实际遇 到的较少。此类吸附称为朗格缪尔(Langmuir)吸附。 类型 II,微分吸附热随覆盖度增加呈线性下降。此类吸附称为焦姆金(Temkin)
吸附等温式或称吸附平衡式,绘制的曲线称为吸附等温线。 (1)Langmuir 等温方程
页脚
.
是一种理想的化学吸附模型。 其基本假设如下: (i) 固体表面对气体的吸附是单分子层的(即固体表面上每个吸附位只能吸附一个 分子,气体分子只有碰撞到固体的空白表面上才能被吸附); (ii) 固体表面是均匀的(即表面上所有部位的吸附能力相同); (iii) 被吸附的气体分子间无相互作用力(即吸附或脱附的难易与邻近有无吸附分 子无关); (iV) 吸附平衡是动态平衡(即达吸附平衡时,吸附和脱附过程同时进行,不过速 率相同)。 bp
(7) 产物从外表面向气体主体扩散。
5. 表面质量作用定律
气固多相催化反应是在催化剂的表面进行的,所以反应速率与
反应物的表面浓度或覆盖度有关。表面质量作用定律认为发生在
理想吸附层中的表面基元反应,其速率与反应物在表面上的浓度
成正比,而表面浓度的幂是化学计量方程的计量系数。如
aA + bB + ••• → 产物
吸附。q=q0-βθ
页脚
.
类型 III,微分吸附热随覆盖度增加呈对数下降。此类吸附称为费兰德利希 (Frundlich)吸附 q=q0-αlnθ 。后两类吸附热皆随覆盖皮变化,称为真实吸 附。
(3)吸附 活化能、 脱附活化能 随覆盖度的变化: 类型 I,活化能与覆盖度无关 类型 II Ea=Ea0+γθ;Ed=Ed0+ηθ 类型 III Ea=Ea0+μ lnθ ; Ed=Ed0-γ lnθ 尽管吸附热 、吸附活化能、脱附 活化能等都随着覆盖度的变化而变化,但在某 个固定的覆盖度时,三者要服从如下公式: Ed=Ea+q (4)产生真实吸附的原因:
页脚
.
在用转化率比较活性时,要求反应温度、压力、原料气浓度和停留时间都相 同。此时,转化率越高,催化剂的活性越大。 (3)活化能 一般说,一个反应在某催化剂上进行时活化能低,则表示该催化剂的活性高, 反之亦然。通常都是用总包反应的表观活化能作比较 2.固体催化剂的组成
四部分:主催化剂,共催化剂,助催化剂(助剂),载体 A:主催化剂(主活性组分): 在催化剂中产生活性的组分。 B:共催化剂:即和主催化剂同时起作用的组分。 C:助催化剂:(助剂,促进剂)本身无活性或活性较小,加入少量后,可大大 提高催化剂的活性、选择性、寿命、稳定性等性能的物质。它又可以区分为: (1)结构性助剂:改变活性组分的物理性能。 (2)调变性(电子性)助剂:改变活性组分的电子结构(化学性能)来提高活 性组分的活性和选择性等的物质。 K2O:使V2O5能级发生变化,改变了它的电子结构性能,提高了活性—调变性。 (3)晶格缺陷型助剂:使活性相原子排列无序化,从而使活性物质微晶间形成 更多的晶格缺陷,产生了新的活性中心,使活性提高的物质。 (4)扩散型助剂: 加入硝酸盐、碳酸盐或有机物,使之在焙烧时分解而在催化 剂中形成孔,提高体相内活性组分的利用率的物质。 (5)毒化型助剂:消除 D:载体:担载活性组分和助剂的物质。
页脚
.
(3)抗毒稳定性:催化剂对有害杂质毒化的抵抗能力,这种能力越强越好。 (4)机械稳定性:固体催化剂颗粒抵抗摩擦、冲击、重压、温度等引起的种种 应力的程度。 稳定性或寿命
第三章 吸附作用与多相催化 1.吸附作用几个关键概念: 现象:当气体与清洁的固体表面接触时,在固体表面上气体的浓度高于气相.这 种现象称为吸附现象。 吸附质:被吸附的气体称为吸附质。 吸附剂:吸附气体的固体称为吸附剂。 吸附态:吸附质在固体表面上吸附后存在的状态称为吸附态。 吸附中心或吸附位:通常吸附是发生在固体表面的局部位置,这样的位置称为吸 附中心或吸附位。 表面吸附络合物:吸附中心与吸附态共同构成表面吸附络合物。 吸附过程:当固体表面上的气体浓度由于吸附而增加,称为吸附过程。 脱附过程:气体浓度在表面上减少的过程,则称为脱附过程。 吸附平衡:当吸附过程进行的速率与脱附过程进行的速率相等 时,表面上气体 的浓度维持不变,这样的状态称为吸附平衡。 2. 简述物理吸附和化学吸附的区别?
应为速控步骤。
例2 反应 A+B→C的机理如下:
1)吸附: A SAS
(快)
2)表面反应:A S B ks CS
(慢)
3)解吸: CS C S
(快)
因为控制步骤为表面双分子反应,按表面质量作用定律,
所以有:
dpA dt
