物理化学表面张力的测定
物理化学实验报告-表面张力讲解

溶液表面张力的测定——最大气泡法实验者:杨岳洋 同组实验者:张知行学号:2015012012 班级:材54实验日期:2016年10月10日助教:汤妍1 引言1.1实验目的(1)测定不同浓度正丁醇溶液的表面张力。
(2)根据吉布斯公式计算正丁醇溶液的表面吸附量。
(3)掌握用最大气泡法测定表面张力的原理和技术。
1.2实验原理在液体内部,任何分子受周围分子的吸引力是平衡的。
可是表面层的分子受内层分子的吸引与受表面层外介质的吸引并不相同,所以,表面层的分子处于力不平衡状态,表面层的分子比液体内部分子具有较大势能,如欲使液体产生新的表面,就需要对其做功。
在温度、压力和组成恒定时,可逆地使表面积增加dA 所需做的功为dA W γδ=- (1)比例系数γ表示在等温等压下形成单位表面所需的可逆功,其数值等于作用在界面上每单位长度边缘的力,称为表面张力。
纯物质表面层的组成与内部的组成相同,因此纯液体降低表面自由能的唯一途径是尽可能缩小其表面积。
对于溶液,由于溶质使溶剂表面张力发生变化,因此可以调节溶质在表面层的浓度来降低表面自由能。
根据能量最低原则,溶质能降低溶剂的表面张力时,表面层溶质的浓度比溶液内部大;反之,溶质使溶剂的表面张力升高时,表面层溶质的浓度比内部的浓度低。
这种表面浓度与溶液内部浓度不同的现象叫做溶液的表面吸附。
显然,在指定的温度和压力下,溶质的吸附量与溶液的浓度及溶液的表面张力随浓度的变化率有关,从热力学方法可知它们之间的关系遵守吉布斯公式:PT dc d RT c 、⎪⎭⎫ ⎝⎛-=Γγ (2) 式中:Г为表面吸附量(mol •m -2);γ为表面张力(N •m -1);c 为溶质的浓度(mol •m -3);T 为热力学温度(K );R 为摩尔气体常数(8.314 J •mol •K -1)。
Г值可正可负,正值为正吸附,负值为负吸附。
显然,Г不仅能表明吸附的性质,而且其值还能说明表面吸附的程度:Г=0表明无吸附现象;其值越远离0;表明吸附程度越大。
物理化学-表面张力及表面吸附量的测定-175
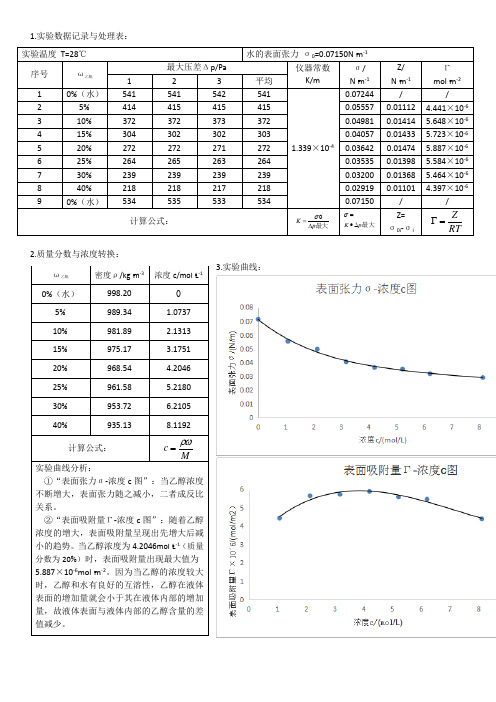
1.实验数据记录与处理表:2.质量分数与浓度转换:3.实验曲线:实验温度 T=28℃ 水的表面张力 σ0=0.07150N ▪m -1序号 ω乙醇 最大压差Δp/Pa仪器常数K/mσ/ N ▪m -1 Z/ N ▪m -1 Γmol ▪m -2 1 2 3 平均 1 0%(水) 541 541 542 541 1.339×10-40.07244 //2 5% 414 415 415 415 0.05557 0.01112 4.441×10-63 10% 372 372 373 372 0.04981 0.01414 5.648×10-6 4 15% 304 302 302 303 0.040570.01433 5.723×10-6 5 20% 272 272 271 272 0.03642 0.014745.887×10-66 25% 264 265 263 264 0.03535 0.01398 5.584×10-67 30% 239 239 239 239 0.03200 0.01368 5.464×10-6 8 40% 218 218 217 218 0.02919 0.01101 4.397×10-6 90%(水)5345355335340.07150/ /计算公式:最大p K ∆=σ最大p K ∆•=σZ= σ0i -σiRTZ=Γ ω乙醇 密度ρ/kg ▪m -3浓度c/mol ▪L -10%(水) 998.20 05% 989.34 1.0737 10% 981.89 2.1313 15% 975.17 3.1751 20% 968.54 4.2046 25% 961.58 5.2180 30% 953.72 6.2105 40%935.138.1192计算公式:Mc ρω=实验曲线分析:①“表面张力σ-浓度c 图”:当乙醇浓度不断增大,表面张力随之减小,二者成反比关系。
最大泡压法测定溶液的表面张力

南昌大学物理化学实验报告学号:5802216018 实验日期:2018-3-27实验二最大泡压法测定溶液的表面张力一、实验目的1、 掌握最大泡压法测定表面张力的原理及操作;2、 了解表面张力、表面功、表面吉布斯函数、表面吸附的概念及相互关系3、 测定不同浓度正丁醇溶液的表面张力。
二、实验原理液体表面层中的分子与体相中的分子所处的力场不同,内部分子所受合力为 零,而表面层中的分子,所受到的作用力指向液体内部,这种作用力使表面层中的 分子有离开液面进入内部的趋势,即液体表面有自动缩小的倾向。
这种使液面收 缩的单位长度上的力即为 表面张力(Y ,单位N-m -1) 0液体的表面张力是液体的 重要性质之一,与液体的温度、压力和组成均有关系。
从热力学角度看,液体表面 层中的分子比内部分子具有更高的平均位能,即表面吉布斯自由能(表面吉布斯 函数)。
通常把增加单位面积表面所引起系统的吉布斯函数的改变量称为单位表 面吉布斯函数(单位为J ・m -2) °它等于恒温恒压下增加单位面积表面,系统从外 界得到的可逆非体积功,即单位表面功(单位为J ・m -2) °表面张力与单位表面吉 布斯函数、单位表面功虽为不同的物理量,但其量值与量纲均相同:恒温恒压下,系统表面吉布斯函数减小的过程为自发过程。
与纯液体依靠缩 小表面积来低表面吉布斯函数不同,溶液除了缩小表面积,还可以通过改变表面 层中溶质的浓度来降低表面吉布斯函数。
一定温度下,将溶质加入到纯液体中,会出现溶液表面层中溶质浓度与溶液 本体浓度不同的现象,称为表面吸附。
若溶质加入后溶液表面张力下降,则溶质将 自动富集于表面层,这种情况称为正吸附;反之则为负吸附;单位面积表面层中溶 质物学生姓名:李江生 专业班级:安工161Y (dA s质的量与溶液本体中等量溶剂所含溶质物质的量的差值,称为溶质的表面过剩3(也称为表面吸附量)。
一定的温度、压力下,溶质的表面过剩与溶液表面张力、浓度之间的关系满足吉布斯吸附等温式:C B ? d YRT dc B式中,r B为溶质B的表面过剩,mol ・m2;c B为溶质B在溶液本体中的平衡浓度,mol • dm 3;丫为溶液的表面张力,N • m 1;T为热力学温度,K。
物理化学实验报告:最大泡压法测定溶液的表面张力

欲使液体产生新的表面 ΔA,就需对其做功,其大小应与 ΔA 成正比:
-W′=σ·ΔA
(1)
它表示液体表面自动缩小趋势的大小,σ 称为比表面自由能,其量纲为 J·m-2。因其量 纲又可以写成 N·m-1,所以 σ 还可称为表面张力。其量值与溶液的成分、溶质的浓度、温
度及表面气氛等因素有关。
2、溶液的表面吸附
至于恒温水浴内恒温 10min。毛细管需垂直并注意液面位置,然后按图接好测量系统。慢慢
打开抽气瓶活塞,注意气泡形成的速率应保持稳定,通常控制在每分钟 8-12 个气泡为宜,
即数字微压微压差测量仪的读数(瞬间最大压差)约在 700-800pa 之间。读数 3 次,取平均
值。
4、测量乙醇溶液的表面张力
按实验步骤三分别测量不同浓度的乙醇溶液。从稀到浓依次进行。每次测量前必须用少量
根据能量最低原理,溶质能降低溶剂的表面张力时,表面层中溶质的浓度比溶液内部
大;反之,溶质使溶剂的表面张力升高时,它在表面层中的浓度比在内部的浓度低,这种
表面浓度与内部浓度不同的现象叫做溶液的表面吸附。在指定的温度和压力下,溶质的吸
附量与溶液的表面张力及溶液的浓度之间的关系遵守吉布斯(Gibbs)吸附方程:
1.3435
25%乙醇
-0.478
1.3465
30%乙醇
-0.452
1.3491
35%乙醇
-0.450
1.3516
40%乙醇
-0.422
1.3539
2.数据处理:
(1)以纯水的测量结果按方程计算 K′值。
解得 K′=σ1∕△p1=71.97*10-3N*m-1/(-0.765kpa)=0.094 (2)根据所测折光率,由实验提供的浓度-折光率工作曲线查出各溶液的浓度。
表面张力的测定

大学化学实验II实验报告——物理化学实验学院:化学与化工学院专业:班级:图1 被吸附的分子在界面上的排列图1中(1)和(2)是不饱和层中分子的排列,(3)是饱和层分子的排列。
图2 表面张力和浓度关系图当界面上被吸附分子的浓度增大时,它的排列方式在不断改变,最后,当浓度足够大时,被吸附分子盖住了所有界面的位置,形成饱和吸附层,分子排列方式如图1中(3)所示。
这样的吸附层是单分子层,随着表面活性物质的分子在界面上愈益紧密排列,则此界面的表面张力也就逐渐减小。
如果在恒温下绘成曲线γ=f(c)(表面张力等温线),当c 增加时,γ在开始时显著下降,而后下降逐渐缓慢下来,以至γ的变化很小,这时γ的数值恒定为某一常数(见图2)。
利用此图求出其在一定浓度时曲线的切线斜率,代入吉布斯吸附方程就可求得表面吸附量。
或者在曲线上某一浓度c 点作切线与纵坐标交于b 点,再从切点a 作平行于横坐标的直线,交纵坐标于b′点,以Z 表示切线和平行线在纵坐标上截距间的距离,故有:(3)根据朗格缪尔(Langmuir)公式:(单分子层吸附)KcKc +Γ=Γ∞1 (4)其中 Г∞为饱和吸附量,即表面被吸附物铺满一层分子时的吸附量,整理可得:浓度(mol/l)0.02 0.04 0.06 0.08 0.10 0.12 0.16 0.20 0.24△P最大(kpa)598 553 536 499 475 467 425 409 391实验数据处理平均温度=17.8℃平均大气压=88.87kpa 表面张力—浓度关系曲线由上图可计算的个点的Γ,结合温度制的下图正丁醇溶液吉布斯吸附等温线:再以c/Γ对c作图得知该直线的斜率为0.013×107,则根据∞∞Γ+Γ=ΓK c c 1 1/∞Γ=1.3×105 1/(K ∞Γ)=0.811×107所以正丁醇饱和吸附量∞Γ=1/(1.3×105)=7.692×10-6mol·m -2问题讨论及 误差分析 问题讨论:1、在毛细管升高法中,影响实验结果的因素有哪些?答:①毛细管及试管的洁净程度;②毛细管的内径大小(内径小,测量的高度误差小);③毛细管粗细是否均匀;④毛细管内半径的测量是否准确;⑤测量时,毛细管是否垂直液面。
物理化学实验报告-溶液表面张力的测定及等温吸附(2)

p最大 = p大气 − p系统 = ∆p
毛细管内气体压力必须高于大试管内液面上压力的附加压力以克服气泡的表面张力,此附加压力∆p与 表面张力γ成正比,与气泡的曲率半径R成反比,其关系式为:
2γ ∆p = R
如果毛细管半径很小,则形成的气泡基本上是球形的。随着气泡的形成曲率半径逐渐变小,直到形成
装
半球形。这时曲率半径R与毛细管内半径r相等,曲率半径达到最小值。
数字式微压差测量仪当表面张力仪的活塞使水缓慢下滴而减小系统压力这样毛细管内液面上受到一个比试管中液面上大的压力当此压力差在毛细管尖端产生的作用力稍大于毛细管管口液体的表面张力时气泡就从毛细管口逸出这一最大压力差可由数字式微压差测量仪测出
1.精密恒温水槽;2.带有毛细管的表面张力仪; 3.滴液漏斗;4.数字式微压差测量仪
答:实验中,气泡的速度对实验数据有很大的影响。速度过快,会使数据变大。因此,保持相同的气泡速
度对于实验的成败有很大的关系。而实验装置中,随着滴液漏斗中水的不断流出,滴液的速度会减慢,装
置的此处有待改进。另外,毛细管的竖直以及毛细管进入液面的深度,对于测定结果都有一定的影响,实
装
验中应该注意。实验的数据处理也是很关键的一步,对测量结果有较大影响。
=
71.97 280.7
=
0.2564
mN
∙
m−1
∙
Pa−1
2. 求出各浓度正丁醇溶液的表面张力。
γ溶液 = K∆p溶液
表 1 正丁醇溶液表面张力的测定数据记录表
c mol ∙ L−1
0
0.02 0.04 0.06 0.09 0.12 0.16 0.2 0.24
∆pm1 Pa ∆pm2 Pa ∆pm3 Pa ∆pm Pa γ mN ∙ m−1
溶液表面张力的测定——最大气泡法(物理化学实验报告)

3 结果与讨论
3.1 原始数据
以下为软件处理界面截图:
图3
数据处理软件截图
将原始数据提取后如表 2 所示:
正丁醇浓度 c/M 0 0.025 0 0.050 0 0.100 0 0.150 0 0.200 0 0.300 0 0.400 0 0.500 0
表 2 正丁醇浓度-电势差原始数据表
电势差 ΔE / mV 0.308 0.300 0.272 0.250 0.222 0.198 0.184 0.169 0.163
-0.2164
2.146×10-6
-0.1623
3.220×10-6
-0.1082
4.293×10-6
-0.08115
4.830×10-6
-0.06492
5.152×10-6
-0.04637
5.520×10-6
-0.03607
5.724×10-6
-0.02951
5.854×10-6
为得出表面吸附量 Γ 和正丁醇浓度 c 之间关系,作 c/Γ – c 曲线,数据如下:
2.3.2 仪器常数的测定
(1) (2) (3) (4)
(5) (6)
向大试管中加去离子水,调整液面高度使毛细管与液面相切; 将大试管至于恒温水浴中; 关闭气密活塞使体系与大气相隔离; 打开抽气瓶活塞,使水缓慢流下,观察毛细管处,使气泡产生的速 度约为 10~20 秒一个; 打开气密活塞,使体系与大气相连; 启动软件开始测量体系压力;
正丁醇浓度 c/M 0.025 0 0.050 0 0.100 0 0.150 0 0.200 0 0.300 0 0.400 0 0.500 0
* γ = ΔE / 0.308 * 0.07118
化学物质的表面张力测定

化学物质的表面张力测定正文:化学物质的表面张力测定化学物质的表面张力是指液体表面上分子间存在的一个相互作用力,它是液体表面在静平衡状态下能够抵抗外界压力的能力。
表面张力的测定对于许多化学领域具有重要意义,包括生物化学、材料科学等领域。
本文将介绍几种常见的测定表面张力的方法。
一、杜瓦诺等法杜瓦诺等法是一种常用的表面张力测定方法。
该方法利用杜瓦诺等方程,通过测量液滴的形状来计算表面张力。
首先,将待测液体滴入一容器中,使其形成一滴悬挂在容器口的液滴。
然后,通过变化容器口的尺寸,观察液滴的形状变化。
根据杜瓦诺等方程,可以推导出液滴的形状与表面张力间的关系。
通过测量液滴的形状参数,如直径和接触角等,可以计算出表面张力的数值。
二、浮力法浮力法是另一种常用的表面张力测定方法。
该方法利用浸泡在液体中的物体所受的浮力与表面张力的平衡关系来测定表面张力。
测定过程中,首先选取一个小而轻的物体,如铂经纬仪丝,将其浸入待测液体中。
通过测量物体在液面上浸没的深度,可以推导出物体所受的浮力大小。
由于物体所受的浮力与液体的表面张力之间存在着平衡关系,因此可以通过测量浸没深度来计算表面张力的数值。
三、气泡法气泡法是一种间接测定表面张力的方法,适用于较粘稠的液体。
该方法利用气泡在液体中的上升速度与表面张力的关系来测定表面张力。
测定过程中,首先要制备一个气泡发生器,使其能够稳定的产生气泡。
然后,将气泡放入待测液体中,观察气泡在液体中的上升速度。
通过测量上升速度,可以计算出表面张力的数值。
四、滴定法滴定法是一种基于液体的表面张力与溶液浓度的关系来测定表面张力的方法。
测定过程中,首先需要通过稀释液体,制备一系列不同浓度的溶液。
然后,利用滴定仪器将不同浓度的溶液滴入一容器中。
通过观察滴液在容器表面的扩散速度,可以判断液体表面张力的大小。
根据溶液浓度与表面张力的关系,可以计算出表面张力的数值。
总结:以上所介绍的几种方法是常用的测定化学物质表面张力的方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学实验报告院系化学与环境工程学院班级0409403学号040940302姓名实验名称表面张力的测定——最大气泡法日期2011-12-6同组者姓名室温9.2℃气压975.45mmHg成绩一、实验目的1.掌握最大气泡法测定表面张力的原理和技术。
2.通过对不同浓度正丁醇溶液表面张力的测定,加深对表面张力、表面自由能和表面吸附量关系的理解。
3.学习用Origin或Excel处理实验数据。
二、实验原理在液体的内部任何分子周围的吸引力是平衡的。
可是在液体表面层的分子却不相同。
因为表面层的分子,一方面受到液体内层的邻近分子的吸引,另一方面受到液面外部气体分子的吸引,而且前者的作用要比后者大。
因此在液体表面层中,每个分子都受到垂直于液面并指向液体内部的不平衡力(如图20-l 所示)。
这种吸引力使表面上的分子向内挤促成液体的最小面积。
要使液体的表面积增大就必须要反抗分子的内向力而作功增加分子的位能。
所以说分子在表面层比在液体内部有较大的位能,这位能就是表面自由能。
通常把增大一平方米表面所需的最大功A 或增大一平方米所引起的表面自由能的变化值ΔG 称为单位表面的表面能其单位为J ·m -3。
而把液体限制其表面及力图使它收缩的单位直线长度上所作用的力,称为表面张力,其单位是Nm -1。
液体单位表面的表面能和它的表面张力在数值上是相等的。
欲使液体表面积增加△S 时,所消耗的可逆功A 为:-A =△G =σ△S图11.1 分子间作用力示意图液体的表面张力与温度有关,温度愈高,表面张力愈小。
到达临界温度时,液体与气体不分,表面张力趋近于零。
液体的表面张力也与液体的纯度有关。
在纯净的液体(溶剂)中如果掺进杂质(溶质),表面张力就要发生变化,其变化的大小决定于溶质的本性和加入量的多少。
当加入溶质后,溶剂的表面张力要发生变化。
把溶质在表面层中与本体溶液中浓度不同的现象称为溶液的表面吸附。
使表面张力降低的物质称为表面活性物质。
用吉布斯公式(Gibbs)表示:Tc d RT dc σ⎛⎫Γ=⎪⎝⎭ (11-1) 式中:Γ为表面吸附量(mol ·m -2),σ为表面张力(J ·m -2)。
Td dc σ⎛⎫⎪⎝⎭表示在一定温度下表面张力随浓度的改变率。
即:0Td dc σ⎛⎫< ⎪⎝⎭,Г>0,溶质能降低溶剂的表面张力,溶液表面层的浓度大于内部的浓样品管滴液瓶压力计样品管恒温槽滴液瓶通大气玻璃管精密数字压力计图11.2 最大气泡法表面张力测定装置度,称为正吸附作用。
0Td dc σ⎛⎫> ⎪⎝⎭,Г<0,溶质能增加溶剂的表面张力,溶液表面层的浓度小于内部的浓度,称为负吸附作用。
由此,测定溶液的浓度和表面张力,可以求得不同浓度下溶液的表面吸附量。
如图11-2是最大气泡法测定表面张力的装置示意。
待测液体置于支管试管中,使毛细管端面与液面相切,液面随毛细管上升。
打开滴液漏斗缓慢抽气。
此时,由于毛细管液面所受压力大于支管试管液面所受压力,毛细管液面不断下降,将从毛细管缓慢析出气泡。
在气泡形成的过程中,由于表面张力的作用,凹液面产生一个指向液面外的附加压力△P ,因此有以下关系:P 大气 = P 系统 +△P附加压力与表面张力成正比,与气泡的曲率半径R 成反比。
2p Rσ∆=若毛细管管径较小,则形成的气泡可视为球形。
气泡刚形成时,由于表面几乎是平的,所以曲率半径R 极大;当气泡形成半球形时,曲率半径R 等于毛细管半径r ,此时R 值最小。
随着气泡的进一步增大,R 又趋增大,直至逸出液面。
R=r 时,附加压力最大:2m p rσ∆=(11-2) 最大附加压力由数字微压差计或U 型管压差计读出。
用数字微压差可以直接读出压差的值(Pa ),体系的导气管接数字微压差计的负压口,正压口与大气相通。
若用U 型管压差计,压差则以△h m 表示。
下式中,ρ为工作介质密度,g 为重力加速度,则:12图11.3气泡形成过程m m p h g ρ∆=∆ 12m r h g σρ=∆ 在实验中,使用同一支毛细管和压差计, 12r g ρ为常数(仪器常数),用K 表示,即:m K h σ=∆ (11-3)用已知表面张力的液体作为标准,可以测得仪器常数K ,也可以测定其它求知液体的表面张力。
吸附量与浓度之间的关系可以用Langmuir 等温吸附方程式表示: 1kckc∞Γ=Γ+ (11-4) ∞Γ为饱和吸附量, k 为经验常数。
将上式整理得:11c c k ∞∞=+ΓΓΓ (11-5) 以/c ∞Γ对c 作图可得到一条直线,其斜率的倒数为∞Γ。
如果以N 代表1平方米表面层的分子数,则A N N ∞=Γ (11-6)式中N A 为Avogadro 常数,则每个分子的截面积A ∞为: 23116.0210A A N ∞∞==Γ⨯⨯三、仪器和试剂恒温槽装置; 数字微压差计(或U 型管压差计) 滴液漏斗(250rnL )l 个; 支管试管(φ25×20cm ) 毛细管(0.2~0.3mm )1支; 烧杯(250mL )T 形管1个; 重蒸馏水 正丁醇(AR );四、实验步骤1.仪器常数的测定:(1)仔细洗净支管试管与毛细管,连接装置。
(2)加入适量的重蒸馏水于支管试管中,毛细管端面与液面相切。
恒温(20℃)20分钟。
(3)打开滴液漏斗缓慢抽气,使气泡从毛细管缓慢逸出,调节逸出气泡每分钟20个左右。
读出压差计最大高度差,读3次,取平均值。
2.待测样品表面张力的测定:配制从0.02~0.80mol.L -1系列(0.025, 0.05, 0.10, 0.15, 0.20, 0.25, 0.30, 0.40,0.60,0.80)的正丁醇溶液。
(正丁醇ρ=0.8109)可先配制0.80mol/L 的溶液,其它的浓度用稀释的办法配制。
3.用待遇测溶液洗净支管试管和毛细管后,方法同1,装入待测样品,测定气泡缓慢逸出时的最大压差。
五、数据记录与处理由于需要在实验数据绘制的曲线图上作切线,求斜率,手工作图将会有很大的随意性并带来误差,因此应该用计算机处理数据。
以下是手工处理数据的步骤: 原始数据(1):标准溶液折光率p : 浓度 折光率1n 折光率2n 折光率3n 平均折光率n 5% 1.3365 1.3355 1.3375 1.3365 10%1.34001.34011.34001.340015% 1.3431 1.3430 1.3429 1.343020% 1.3474 1.3465 1.3476 1.347225% 1.3515 1.3525 1.3510 1.351730% 1.3545 1.3550 1.3540 1.354540% 1.3600 1.3612 1.3607 1.360850% 1.3635 1.3642 1.3647 1.3641 (2):试验样品测得的折光率p样品 1 2 3 平均蒸馏水 1.3340 1.3341 1.3341 1.33410号 1.3350 1.3350 1.3349 1.33501号 1.3374 1.3374 1.3375 1.33742号 1.3480 1.3477 1.3478 1.34783号 1.3574 1.3582 1.3580 1.35794号 1.3640 1.3645 1.3640 1.36425号 1.3665 1.3665 1.3662 1.3664(3):压力差p样品 1 2 3 4 5 6 7 8 平均0.725 0.713 0.742 0.750 0.743 0.703 0.745 0.722 0.730 蒸馏水0 0.623 0.633 0.640 0.640 0.634 0.648 0.632 0.633 0.6351 0.592 0.586 0.594 0.598 0.595 0.592 0.594 0.599 0.5942 0.478 0.505 0.486 0.483 0.486 0.521 0.508 0.508 0.4973 0.432 0.439 0.438 0.447 0.445 0.444 0.446 0.449 0.4424 0.412 0.405 0.409 0.416 0.408 0.422 0.410 0.413 0.4125 0.408 0.409 0.408 0.400 0.405 0.400 0.401 0.413 0.4071.计算仪器常数并计算溶液的表面张力。
解:仪器常数:33110.210 1.0109.80.9822r g ρ-=⨯⨯⨯⨯⨯= 表面张力:σ=340.2100.7300.7301022m r p --⨯⨯⨯==⨯ 2.以浓度C 为横坐标,以σ为纵坐标作图,横坐标从0开始,连成光滑曲线。
解: 浓度 折光率1n 折光率2n 折光率3n 平均折光率n 5% 1.3365 1.3355 1.3375 1.3365 10% 1.3400 1.3401 1.3400 1.3400 15% 1.3431 1.3430 1.3429 1.3430 20% 1.3474 1.3465 1.3476 1.3472 25% 1.3515 1.3525 1.3510 1.3517 30% 1.3545 1.3550 1.3540 1.3545 40% 1.3600 1.3612 1.3607 1.3608 50% 1.36351.36421.36471.3641y = 0.0006x + 1.33411.331.341.351.361.370102030405060样品123平均蒸馏水 1.3340 1.3341 1.3341 1.3341 0号 1.3350 1.3350 1.3349 1.3350 1号 1.3374 1.3374 1.3375 1.3374 2号 1.3480 1.3477 1.3478 1.3478 3号 1.3574 1.3582 1.3580 1.3579 4号 1.3640 1.3645 1.3640 1.3642 5号1.36651.36651.36621.3664因为Y=0.006X+1.3341,将(1.3341 1.3350 1.3374 1.3478 1.3579 1.3642 1.3664)代入方程,得到浓度C 分别为0% 1.5% 5.5% 22.8% 39.2% 50.2% 53.8%。
样品 1 2 3 4 5 6 7 8 平均 蒸馏水 0.7250.7130.7420.7500.7430.7030.7450.7220.7300 0.623 0.633 0.640 0.640 0.634 0.648 0.632 0.633 0.635 1 0.592 0.586 0.594 0.598 0.595 0.592 0.594 0.599 0.594 2 0.478 0.505 0.486 0.483 0.486 0.521 0.508 0.508 0.497 3 0.402 0.409 0.408 0.407 0.405 0.404 0.406 0.409 0.406 4 0.312 0.305 0.309 0.316 0.308 0.322 0.310 0.313 0.312 50.2580.2590.2580.2500.2550.2500.2510.2530.25734000.2100.6350.6351022m r p σ--⨯⨯⨯===⨯34110.2100.5940.5941022m r p σ--⨯⨯⨯===⨯34220.2100.4970.4971022m r p σ--⨯⨯⨯===⨯34330.2100.4420.4061022m r p σ--⨯⨯⨯===⨯34440.2100.3120.3121022m r p σ--⨯⨯⨯===⨯34550.2100.2070.2571022m r p σ--⨯⨯⨯===⨯有表格:样品 浓度 表面张力蒸馏水 0 40.73010-⨯0号 1.5 40.63510-⨯ 1号 5.5 40.59410-⨯ 2号 22.8 40.49710-⨯3号 39.2 40.40610-⨯4号 50.2 40.31210-⨯ 5号53.840.25710-⨯3.在曲线上取若干(0.03, 0.05, 0.10, 0.15, 0.20, 0.30, 0.40,0.60 )点,求其斜率。
