[化学]第三章 酰化反应
第三章 酰化反应

RCOOCOR
R
C
+
R
C
O
H
混合酸酐的应用: ①羧酸-三氟乙酸混合酸酐(适用于立体位阻较大的羧酸的酯化)
O
O C R +CF 3 COOH
(CF 3 CO) 2 O+RCOOH
F 3C
C O
(CF3CO)2O H 2N CH 2OH + CH 3CH 2COOH
H2N
CH 2OCOCH 2CH 3
O RH2C C OR' + RH2C
O C OR'
R'ONa RH2C
O C
O H C COEt R
O RH2C C OR ' + Ar
O C OR '
O EtONa Ar C
O CHC R OR '
影响因素:
i)碱
O H3C C R 用 O CH C O R H2 C C
EtONa
R
用
Ph3CNa NaH NaNH2(强碱) 强
HO
C H 2O A c
NaOH HO 或 C H 3O N a
A cO
C H 2 OH
第三节 碳原子上的酰化反应
一、芳烃的C-酰化
1、Friedel-Crafts(傅-克酰化反应)
O O
+
R
C
Z
Lewis
C
R
(Z= -X,-OCOR,-OH,OR')
(1) 酰化剂的影响:酰卤﹥酸酐﹥羧酸﹥酯
羰基的α位为叔碳时发生烃化反应
AlCl3 AlCl3 O
配位键(增加C的正电性)
O R C OH
有机化学酰化反应

R-C
ALCL4
R-C
+ ALCL4
F-C反应的影响因素
(1)酰化剂的影响:酰卤﹥酸酐﹥羧酸、酯
O C 的 α位 为 叔 碳 时 发 生 烃 化 反 应
H3C
AlCl3 Cl
H3C H3C
AlCl3 O Cl H3C
O
CH3
C
CO2(碳酸酐)
CO(甲酸酐)
(3)酰氯
O CH3-C-Cl , O C-Cl , H 3C SO2Cl , O Cl-C-Cl , Cl N N
Cl N Cl
(4)羧酸酯
ClCH2COOC2H5, CH3COCH2COOC2H5
O , H C N CH3 CH3
(5)酰胺
O H2N C NH2
(6)其他:如双乙烯酮、二硫化碳
醇或酚分子中的羟基氢原子被酰基取代 而生成酯的反应,叫做O-酰化反应,也叫做 酯化反应。 酰化试剂:羧酸; 酸酐; 酯(酯交换)
8.3.1 用羧酸的酯化
反应历程 质子酸催化下的双分子历程
O R-C-OH + H+ OH R-C-OH
R'OH
OH R-C-OH + H O R'
O OH OH + -H2O -H 互变异构 R-C-OR' R-C-OR' R-C-OR' OH2
NHCOCH3 R
• 羧酸作酰化剂 DCC脱水法(二环己基碳化二亚胺)
O O H O R C O C N O R C O R' + N H O C N H NH + R' O H
化学反应中的酰化反应

化学反应中的酰化反应化学反应是我们日常生活中不可缺少的一部分,它不仅应用于我们周围的生活和工作中,也是科研领域中不可或缺的一个技术支撑。
而酰化反应则是其中的一个十分重要的反应类型。
本篇文章将介绍酰化反应的定义、机理、应用等方面的内容。
1. 酰化反应的定义酰化反应是一种有机合成反应,指的是酸酐(anhydrides)或酸卤(acyl halides)与醇(alcohol)或酚(phenol)等亲核试剂发生酰化反应。
其中,酸酐和酸卤均具有电子丰富的羰基(carbonyl)结构,容易被亲核试剂进行攻击,产生新的酯(ester)化合物。
2. 酰化反应的机理酰化反应的机理可分为两步:亲核试剂攻击和质子转移。
在第一步中,亲核试剂(如醇或酚)的亲核性中心(如羟基)攻击羰基碳原子,形成一个稳定的中间体:酸酐或酸卤与亲核试剂的加合物。
接着,在第二步中,质子转移将中间体中的酰基(acyl)基团从原来的酸酐或酸卤转移到了亲核试剂中,同时释放出质子(H+),生成酯化合物。
3. 酰化反应的应用酰化反应在有机合成领域中具有广泛的应用,尤其是在制备大分子化合物和药物研发中更是不可或缺。
例如,酰化反应被用于制备各种功能酯和酰胺(amides)等有机化合物,这些化合物在多种领域都有广泛的应用。
同时,酰化反应还可以被用作催化反应的催化剂。
除了有机合成领域外,酰化反应还在食品、香料、染料等领域中有应用。
例如,在香水制造过程中,酰化反应可以用于制备各种具有特殊香味的酯化合物。
4. 酰化反应的影响因素酰化反应的影响因素有很多,其中最为重要的因素是反应物的浓度和反应温度。
反应物浓度的影响是非常明显的。
当反应物浓度越高时,相同的酰化反应所需要的时间和反应温度就相对较低。
这是因为反应物浓度高,反应速度快,反应所需要的时间和温度就自然而然地降低了。
反应温度也是影响酰化反应的重要因素。
当反应温度较低时,由于分子运动较慢,分子之间的相对位置不稳定,酰化反应的过程会较为缓慢。
化学反应中的酰化反应

化学反应中的酰化反应化学反应是一种物质之间发生转化的过程,其中酰化反应是一种重要的有机合成反应。
它通过酰化剂和醇或酚反应,生成酯的化学过程。
酰化反应在有机合成中具有广泛的应用,被广泛用于制备酯类化合物。
酰化反应的机理基本上可以分为两步:酰化质子化和取代反应。
首先,酰化剂和醇或酚发生质子化反应,生成酰化质子。
然后,酰化质子与酯或醇的氢原子发生取代反应,生成酯类产物。
酰化反应具有以下特点:1. 反应条件温和:酰化反应通常在室温或较低温度下进行,因此可以避免大量的能量损失和副反应的发生。
2. 反应速度较快:酰化反应反应速度较快,通常只需较短的反应时间即可完成。
3. 可逆性较强:酰化反应具有一定的可逆性,可以通过调整反应条件实现反应的正向或逆向进行。
4. 应用广泛:酰化反应可以用于制备不同性质的酯类化合物,这些化合物在医药、农药、香料等领域都有重要的应用。
以苯甲酸和乙醇为例,来具体介绍酰化反应的实际应用。
苯甲酸和乙醇反应生成乙酸苯酯,反应方程式为:苯甲酸 + 乙醇→ 乙酸苯酯 + 水通常情况下,酰化反应需要催化剂的存在,常用的催化剂有酸性催化剂和酶。
在酸性催化剂存在下,酰化反应的速率更快,但是酸性催化剂的存在也可能引发副反应,如酸催化剂引发的醇酸缩聚反应。
酰化反应除了通过酸性催化剂进行外,还可以通过酶进行催化。
酶催化的酰化反应具有选择性高、效率高以及环境友好的优点。
然而,酶催化反应的应用范围受限于酶的稳定性和高成本等因素。
在实际应用中,酰化反应常常需要考虑反应条件、催化剂的选择、废气处理等问题。
对于工业化生产,酰化反应的反应条件优化可以降低生产成本,提高产物的选择性和产率。
总之,酰化反应是化学反应中的一种重要反应,具有温和条件、反应速度快和广泛的应用等特点。
通过对酰化反应的研究和优化,可以实现高效合成有机化合物,推动有机合成领域的发展。
《药物合成反应》第三章 酰化反应

HS R CHO +
HS
R`X - LiX
RS C
RS
S
R CH S
n-C4H9Li
S RC Li S
H2O/HgCl2
O R C R`
药物合成反应
二、自由基反应机理
药物合成反应
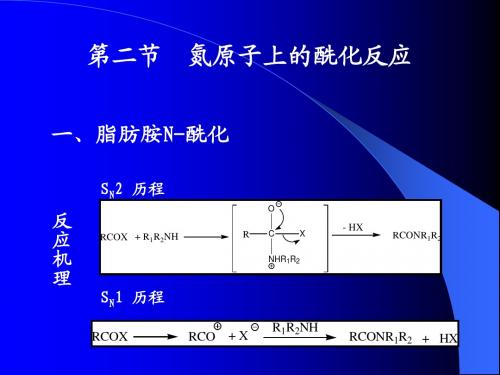
第二节 氧原子上的酰化反应
• 醇的O-酰化反应 • 酚的O-酰化反应 • 醇、酚羟基的保护
药物合成反应
一、醇的O-酰化反应
药物合成反应
教学内容
1.酰化反应机理 2.氧原子上的酰化反应 3.氮原子上的酰化反应 4.碳原子上的酰化反应
药物合成反应
第一节 酰化反应的机理
药物合成反应
一、电子反应机理
1.亲电反应机理: (1) 单分子历程
限速步骤:动力学一级反应
采用酰卤、酸酐等强酰化剂的酰化反应趋向于单分子历程进行。
药物合成反应
药物合成反应 (v)偶氮二羧酸二乙酯法(DEAD)(Mitsunobu reaction)
药物合成反应
(4)应用特点
A 伯醇酯的制备:伯醇羟基活性最大,对伯醇进行选择性酰化或保护 伯、仲醇的选 择性
药物合成反应
例:镇痛药盐酸哌替啶的合成
杜 冷 丁
例:降血脂药氯贝丁酯的合成
药物合成反应
•例:局部麻醉药盐酸普鲁卡因的合成
CH3COOH + CH3OH 10min
CH3COOCH3 (94%)
药物合成反应 (iv) DCC法( dicyclohexylcarbodiimide,二环己基碳二亚胺)
药物合成反应
4-dimethylaminopyridine;DMAP
DCC类似物:
CH3-N=C=N-C(CH3)3
第三章:酰化反应(2节)
RCOHN
NH2
CH3 SO2Cl
RCOHN
NHSO2CH3
H 2O , H +
H3CO H3CO Cl
N H2N NHSO2CH3
HN
NHSO2CH3
N
H2C HO HO
NH2
O
H2C NH2
NHR
O
苄基磺酰氯 DMAP
NH2 RO RO
H2N O HO O O O H2N OH O
NHR
RHN O HO O O O RHN OR O
的合成
S H2N N O O Cl O COCH2C6H4NO2 O CHCOOH S CHCO HN N3 N Cl COCH2C6H4NO2
. HCl
N3
H2 / Pd-C
S CHCO HN NH2 O COOH N Cl
临床用于秘尿道、呼吸道、皮肤、软组织、五官感染,疗效较好
加入缩合剂提高反应活性(一)缩合剂 : DCC、 DIC
O O N O CH3 CH3 O C O C
CH3
(AcO)2 Cu
O C O C O
CH3
H C OH
HO HO
O C O C
H2 H C N
O C O
H2 C
CH3
CH3
O C O C
CH3
O
H2 C
1. H2, Pd/ C 2. CH3COOH
H2 C NH2
酰化
抗溃疡药西曲酸酯(Cetraxate)的合成
慢性关节风湿病的治疗药物布西拉明(Bucillamine) 的合成
CH3 CH2S C CH3 COOH CH3
SOCl2
CH2S C CH3 COCl
第三章 酰化反应

Friedel-Crafts酰化反应
酰卤、酸酐、羧酸、羧酸酯、 烯酮等酰化剂在Lewis酸催化下对 芳烃进行亲电取代而生成芳香酮类 的反应称为Friedel-Crafts酰化反应。 它是制备芳酮的最重要的方法之一。
例:
(CH2)nCOCl
O
+
O
O Zn—Hg
[H]
AlCl 3
(CH2)n n=2 (90%) 五环
(95%)
4 酰卤为酰化剂
N RCOCl + R'OH
RCOOR' + HCl
( 可吸收HCl,催化此反应)
N
R COCl + N
N
OC R
+ R' O H Cl
O + HCl + R C R'
N
4-取代氨基吡啶催化剂
NR2
NR2
R'OH
H
+ RCOX
OR'
N
N
OC
NR2 R
RCOOR' +
N H
O R C X -HX
HNR'R''
RCONR'R''
(SN2)
RCOX>(RCO)2O≥ RCON3> RCOOR'>RCONH2>RCOOH>RCOR'
AgCN/HMPT Me3CCOCl + t—BuOH 800C,10min Me3C COOBu t
(94%)
COCl
COOC(C2H5)3
CH3
RCHCOOEt RCH2COOEt
OR RCH2 C CHCOOEt
第三章 酰化反应[学习课堂]
![第三章 酰化反应[学习课堂]](https://img.taocdn.com/s3/m/4cc9108079563c1ec5da71f8.png)
当羰基的α位上连有不饱和烃基和芳基时,除受到基团的诱 导效应影响外,同时还受到共轭效应的影响,其结果是:不饱和 脂肪酸、芳酸的酸性略微强于相应的饱和脂肪酸。除此之外,芳 环上取代基的种类及位置对芳酸的酸性也有影响。
p-O2NC6H4COOH >p-ClC6H4COOH >C6H4COOH >p-CH3OC6H4COOH o-O2NC6H4COOH> p-O2NC6H4COOH > m-O2NC6H4COOH > C6H4COOH
O
H+
OH
R C OH
R C OH
OH R C OH
NH2 HOOCCH2CH2CHCOOH
ROH/HBF4/Na2SO4 25-60oC
NH2 ROOCCH2CH2CHCOOH
H CH2COOH TsOH/PhH
OH H
H O O
H
课件类别
25
2) Lewis酸催化法:BF3, AlCl3, FeCl3, TiCl4
酸酐 酰胺
O C
O C
O
O
C NHபைடு நூலகம் ,
O 酰卤 * C X
O C NR2
乙烯酮 CH2=C=O
课件类别
10
一、电子反应机理
1.亲电反应机理
在氧、氮和碳原子上的大部分酰化反应都属于亲电酰化,这 是因为在通常反应条件下羰基的碳原子显部分正电性。由于酰 化试剂种类和酰化能力的强弱不同,又可将酰化历程分为单分 子历程和双分子历程。
加成
OH CH3-C-OH
HO+ C2H5
质子转移
四面体正离子
OH CH3-C-O+ H2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)影响因素
a.羧酸结构的影响
作为酰化剂的羧酸的酸性越强,其酰化能力越强。羧酸 的酸性主要受其结构中的电子效应(诱导效应、共轭效 应)及立体效应的影响。
诱导效应:羰基的α位带吸电子基团利于反应进行; 带给电子基团不利于反应进行; 共轭效应:共轭效应有利于反应进行; 立体效应:R的体积若庞大(芳酸),则亲核试剂对 羰基的进攻有位阻,不利于反应进行。
L: X, OCOR, OH, OR', NHR Nu: R'O(O), R''NH(N), Ar(C)
产物:酯、酰胺、酮(醛)
3
应用:
氯霉素VS棕榈氯霉素
常用的酰化试剂
O 羧酸 * C OH O 酸酐 C C O O 酰胺 C NH2 , O C NR2 O 酰卤 * 羧酸酯 * O C O R
12
(4)被酰化物的活性 被酰化物的亲核能力越强,越容易被酰化,活性大小可 以用被酰化物R-YH的碱性来衡量,其碱性越强,越容易被 酰化。 若R基团为芳基,芳基与Y原子之间有共轭效应,使其亲 和性降低,反应活性下降。 R基团立体位阻越大,反应越难进行。 胺基>羟基 脂胺>芳胺 醇 >酚 伯胺>仲胺 伯醇>仲醇>叔醇
R
R R R R
R C
9
一、电子反应机理
1. 亲电反应机理 (1)单分子历程
R1 Z 快 R R-Y R-YH -H+ C OH R R-Y C O 慢 R1 C O + Z
C O
酰化剂的解离过程是反应的限速步骤 酰化速率仅与酰化剂的浓度相关 酰卤、酸酐等强酰化剂的酰化反应按单分子历程进行
第三章 酰化反应
Acylation Reaction
酰化反应
定义:在有机化合物分子结构中的碳、氮、氧
或硫等原子上导入酰基的反应称为酰化反应。
酰基:含氧无机酸、有机酸或磺酸分子结构中
去掉羟基后所剩的部分。
2
有机酸酰基:
O R
O R C L + 酰化剂 Nu-H 被酰化物 R
C
O C Nu + HL
O R C OH H+ OH R C OH OH R C OH
H CH2COOH OH H H
23
H
TsOH/PhH △,
O O
(b) Lewis酸催化法: AlCl3, SnCl4,FeCl3,等
AlCl3 O R C OH AlCl3 O
配位键(增加C的正电性)
R C OH
CH=CH-COOHO C X Nhomakorabea7
酰化反应的类型 a. 根据酰基的引入方式不同,酰化反应可分为
直接酰化法
间接酰化法 b. 根据接受酰基的原子不同酰化反应可分为 氧酰化 氮酰化
碳酰化
8
第一节 酰化反应机理
O C O O C C O O C C O
亲电反应机理 电子反应机理
O R C 亲核反应机理 O R C O 自由基反应机理 R C
21
b.醇结构的影响
立体效应的影响: 伯醇(-CH2-OH)>仲醇(>CH-OH)> 叔醇(≡C-OH)
R O
立体效应
R R
C
C
OH
<
O
R
C
OH
电子效应的影响: 羟基α位的吸电子基团不利于反应进行,共轭效应不利于反应进 行。(与羧酸结构的影响相反)
22
c. 催化剂的影响 ⅰ.提高羧酸反应活性的催化剂 (a) 质子酸催化法: 浓硫酸、氯化氢气体、磺酸等
10
(2)双分子历程(加成——消除机理)
R1 C Z
O
R-YH +
R1 Z
C O
加成
O
消除
R1 R-Y
C O + HZ
R-YH
(Z=OH、 OR、 OC-R、 X、 NH2等 )
酰化速率与酰化剂和被酰化物的浓度都相关 羧酸、羧酸酯和酰胺等酰化剂的酰化反应按双分子历 程进行
11
(3)酰化剂的强弱顺序 酰化剂的酰化能力与离去基团Z的电负性和离去能力有 关。离去基团的电负性越大,离去能力越强,其酰化能力 越强 Z-碱性越强,共轭酸HZ的酸性越弱,越不容易离去。 Cl- 是很弱的碱,-OCOR的碱性较强些,OH-、OR-是相 当强的碱,NH2-是更强的碱。 RCOCl>(RCO)2O>RCOOH 、RCOOR’>RCONHR’
H2N
COOCH2CH2N(C2H5)2· HCl
19
(2) 反应机理 —— 直接亲电酰化
OHR R'-C-OH OH
R'COOH
H
R-OH
R'-C-OH OH
OR R'-C-OH OH2
-H2O
R'-C-OR OH
-H
可逆 反应
R'COOR
提高反应收率: 增加反应物的浓度 减小生成物的浓度
13
2. 亲核反应机理
极性反转:用某些手段、方法使介入反应的双方之一的 原子或原子团的特征反应性发生暂时性的反转(或称逆 转)来完成这一反应。
O
羰基的极性反转
O C
C
14
二、自由基反应机理
过氧化物、光照等条件下,酰化剂在羰基的碳原子处解 离成羰基自由基和氢原子自由基,羰基自由基再与被酰 化物进行自由基反应生成酰化产物
+ CH3OH
BF3/Et2O
CH=CH-COOCH3
(c) Vesley法(酸性树脂催化法) :
采用强酸型离子交换树脂加硫酸钙
O
酰化剂:
O R' C OH
酸酐
R' C O O R' C
羧酸 羧酸酯
酰氯
酰胺
17
O R' C Cl
O R' C N R2
O R' C OR1
R1
1. 羧酸为酰化剂
(1) 反应通式
R-OH + R'COOH
R'COOR+ H2O
酰化剂:脂肪族羧酸、芳香族羧酸 被酰化物:伯醇、仲醇、叔醇 催化剂:质子酸、路易斯酸 溶剂:醇类、醚类、卤代烃类
R1 H R1 C O + R-YH R R-Y C OH + H 过氧化物 C O R1 C O + H
15
第二节 氧原子上的酰化反应
醇的O-酰化反应
酚的O-酰化反应
16
一、醇的O-酰化反应
O ROH + R' C L
是一类形成羧酸酯的反应 是羧酸的酯化反应 是羧酸衍生物的醇解反应
O R' C OR + HL
18
例:镇痛药盐酸呱替啶的合成
H3C N COOH
CH3OH/C6H6/△ HCl(gas)
H3C N COOC2H5 ·HCl
例:局部麻醉药盐酸普鲁卡因的合成
HOCH2CH2N(C2H5)2/ 二甲苯
O2N
COOH
HCl(gas)
O2N
COOCH2CH2N(C2H5)2
Fe/HCl 45℃,2h
