大学有机化学反应方程式总结(较全)
有机物化学反应方程式汇总

有机物化学反应方程式汇总有机物类别官能团主要化学性质烷烃——取代反应:CH4+Cl2CH3Cl+HCl烯烃碳碳双键加成反应:CH2=CH2+HBr CH3-CH2Br,(还可与Br2、H2O、H2在一定条件下发生加成反应)加聚反应:nCH2=CH2-[CH2-CH2氧化反应:使酸性KMnO4溶液褪色炔烃碳碳三键同烯芳香烃苯——取代反应:加成反应:苯的同系物——取代反应:氧化反应:使酸性KMnO4溶液褪色卤代烃—X取代反应:CH3CH2Br+NaOH CH3CH2OH+NaBr消去反应:CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O 醇—OH与活泼金属反应:2CH3CH2OH+2Na2CH3CH2ONa+H2↑取代反应:CH3CH2OH+HBr CH3CH2Br+H2O消去反应:CH3CH2OH CH2=CH2↑+H2O氧化反应:2CH3CH2OH+O22CH3CHO+2H2O 醛—CHO还原反应(加成反应):CH3CHO+H2CH3CH2OH氧化反应:2CH3CHO+O22CH3COOHCH3CHO+2Ag(NH3)2OH CH3COONH4+2A g↓+3NH3+H2OCH3CHO+2C u(O H)2 +NaOH CH3COONa+Cu2O↓+2H2O 羧酸—COOH酸的通性:如CH3COOH+NaHCO3CH3COONa+H2O+CO2↑酯化反应:CH3COOH+ CH3CH2OH CH3COOCH2CH3+H2O酯—COO—水解反应:CH3COOCH2CH3+H2O CH3COOH+ CH3CH2OH酚极弱的酸性:取代反应:催化剂△催化剂浓硫酸170℃催化剂△催化剂△催化剂△△△催化剂加热催化剂加热光照+HBr+Br2Br催化剂+HNO3—NO2+H2O浓硫酸△+3 H2催化剂△—CH3+3HNO3CH3NO2O2N NO2浓硫酸△+3H2O OHOH+ NaOHONa+ H2OOH+3Br2OHBrBrBr+3HBr↓从反应试剂归纳有机反应反应试剂有机物类别或官能团反应类型反应方程式举例X2氯气、液溴烷烃、苯环取代反应CH4+Cl2CH3Cl+HCl浓溴水苯酚取代反应溴水或溴的四氯化碳溶液“C=C”或“C≡C”加成反应H2C=CH2 + Br2 BrH2C-CH2BrHX “C=C”或“C≡C”加成反应H2C=CH2+HBr H3C-CH2Br醇取代反应CH3CH2OH+HBr CH3CH2Br+H2OH2O “C=C”或“C≡C”加成反应H2C=CH2+H2O H3C-CH2OH酯水解反应CH3COOCH3+H2O CH3COOH+CH3OHNa 醇、苯酚、—COOH置换反应CH3CH2OH+ Na CH3CH2ONa+H2↑NaOH 苯酚、—COOH中和反应HCOOH+NaOH HCOONa+H2O酯水解反应CH3COOCH3+ NaOH CH3COONa+CH3OH卤代烃取代反应CH3CH2Br+NaOH CH3CH2OH+NaBr消去反应CH3CH2Br+NaOH CH2= CH2↑+NaBr+H2ONa2CO3苯酚、—COOH复分解反应NaHCO3—COOH 复分解反应HCOOH+NaHCO3==HCOONa+CO2↑+H2OH2“C=C”或“C≡C”加成反应H2C=CH2+H2 H3C-CH3苯环加成反应羰基、醛基加成反应(还原反应)CH3CHO +H2 CH3CH2OH银氨溶液、新制Cu(OH)2醛、葡萄糖氧化反应略O2醛、醇氧化反应2CH3CHO+O22CH3COOH 大多数有机物氧化反应大多数有机物可燃烧生成CO2和H2O酸性KMnO4溶液醛、醇、酚、“C=C”、“C≡C”苯的同系物氧化反应略催化剂△△催化剂△催化剂△催化剂△乙醇OH+3Br2OHBrBrBr+3HBr↓+3 H2催化剂△。
有机化学反应方程式小结

有机化学反应方程式小结有机化学反应方程式小结有机化学反应方程式小结一.取代反应1.CH4+Cl2--光→CH3Cl+HCl2.C2H6+Cl2--光→C2H5Cl+HCl3.C6H6+Br2Fe→C6H5Br+HBr4.C2H5OH+HBr--加热→C2H5Br+H2O5.C6H6+HNO3--H2SO4水浴加热→C6H5NO2+H2O6.C6H5Cl+H2O--NaOHCu,高温,加压→C6H5OH+HCl7.C2H5Cl+H2ONaOH→C2H5OH+HCl8.CH3COOC2H5+H2O稀硫酸,加热→CH3COOH+C2H5OH9.(C17H35COO)3C3H5+3NaOH→C3H5(OH)3+3C17H35COOH10.2CH3CH2OH+2N a→2CH3CH2ONa+H211.2C6H5OH+2Na→2C6H5ONa+H2↑12.2CH3COOH+2Na→2CH3COONa+H2↑(分子间脱水)C2H5OH+C2H5OH--浓H2SO4,140℃→C2H5OC2H5+H2O二.加成反应13.CH2=CH2+H2→Ni,加热→CH3CH314.CH2=CH2+HCl--催化剂,加热→CH3CH2Cl15.C2H2+H2--Ni,加热→CH2=CH216.C2H2+2H2--Ni,加热→CH3CH317.C2H2+2HCl--催化剂,加热→CH3CHCl218.CH2=CH-CH=CH2+Br2→CH2=CH-CHBr-CH2Br19.CH2=CH-CH=CH2+Br2→CH2Br-CH=CH-CH2Br20.CH2=CH-CH=CH2+2Br2→BrCH2-CHBr-CHBr-CH2Br21.CH3CHO+H2Ni→CH3CH2OH22.CH2OH-(CHOH)4-CHO+H2--Ni→CH2OH-(CHOH)4-CH2OH23.C6H6+3H2Ni→C6H12(环己烷)24.C6H6+3Cl2--光→C6H6Cl625.CH2=CH2+H2O--H2SO4,加热,加压→CH3CH2OH三.消去反应26.CH3CH2OH--浓H2SO4,170℃→CH2=CH2↑+H2O27.CH3CH2Br+NaOH--醇,加热→CH2=CH2↑+NaBr+H2O四.酯化反应(取代反应)28.CH3COOH+CH3CH2OH--浓H2SO4,加热→CH3COOC2H5+H2O29.C3H5(OH)3+3HNO3--浓H2SO4→C3H5(ONO2)3+3H2O五.水解(卤代烃、酯、油脂的水解见上,亦是取代反应)30.CH3COONa+H2O→CH3COOH+NaOH31.CH3CH2ONa+H2O→CH3CH2OH+NaOH32. C6H5ONa+H2O→C6H5OH+NaOH33.C17H35COONa+H2O→C17H35COOH+NaOH34.(C6H 10O5)n+nH2O--H2SO4,加热→nC6H12O6六.氧化反应35.2C2H5OH+O2--Cu或Ag,加热→2CH3CHO+2H2O36.C6H12O6+6O2→6CO2+6H2O+热37.2CH3CHO+O2→2CH3COOH38.CH3CHO+2[Ag(NH3)2]OH→CH3COONH4+2Ag↓+3NH3+H2O39.CH3CHO+2Cu (OH)2加热→CH3COOH+Cu2O↓+2H2O40.CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH→CH2OH(CHOH)4COONH4+2Ag↓+3NH 3+H2O41.CH2OH(CHOH)4CHO+2Cu(OH)2--加热→CH2OH(CHOH)4COOH+Cu2O↓+2H2O42.HCOOH+2[Ag(NH3)2]OH→NH4HCO3+2Ag↓+3NH3+H2O43.HCOOH+2Cu(OH)2加热→CO2+Cu2O↓+3H2O44.HCOONa+2[Ag(NH3)2]OH→NaHCO3+4NH3+2Ag↓+H2O45. HCOONH4+2[Ag(NH3)2]OH→NH4HCO3+2Ag↓+4NH3+H2O46.HCOOR+2[Ag(NH3)2]OH→NH4OCOOR+2Ag↓+3NH3+H2O47.HCHO+2[Ag(NH 3)2]OH→HCOONH4+2Ag↓+3NH3+H2O48.HCHO+4[Ag(NH3)2]OH→NH4HCO3+4Ag↓+7NH3+2H2O49.HCHO+4Cu(OH)2加热→CO2+2Cu2O↓+5H2O七.还原反应50.CH3COCH3+H2--Ni→CH3CHOHCH360.HCHO+H2--Ni→CH3OH51.C6H5CH=CH2+4H2--Ni→C6H11CH2CH3八.加聚反应52.nCH2=CH2→[CH2-CH2]n53.nCH3-CH=CH2→[CH-CH2]n67.nCH2=C-COOCH3→[CH2-C]n68.nCH2=C-CH=CH2→[CH2-C=CH-CH2]n九.缩聚反应氨基酸合成蛋白质扩展阅读:有机化学反应方程式小结有机化学反应方程式小结一.取代反应1.CH4+Cl2--光→CH3Cl+HClC2H6+Cl2-光→C2H5Cl+HCl2.C6H6+Br2Fe→C6H5Br+HBr3.C2H5OH+HBr--加热→C2H5Br+H2O4.C6H6+HNO3--H2SO4水浴加热→C6H5NO2+H2O6.C6H5Cl+H2O--NaOHCu,高温,加压→C6H5OH+HCl7.C2H5Cl+H2ONaOH→C2H5OH+HCl8.CH3COOC2H5+H2O--无机酸或碱→CH3COOH+C2H5OH9.(C17H35COO)3C3H5+3NaOH→C3H5(OH)3+3C17H35COOH二.加成反应10.CH2=CH2+H2→Ni加热→CH3CH313.CH2=CH2+HCl--催化剂,加热→CH3CH2Cl14.C2H2+H2--Ni,加热→CH2=CH2C2H2+2H2--Ni,加热→CH3CH315.C2H2+2HCl--催化剂,加热→CH3CHCl216.CH2=CH-CH=C H2+Br2→CH2=CH-CHBr-CH2Br17.CH2=CH-CH=CH2+Br2→CH2Br-CH=CH-CH2Br18.CH2=CH-CH=CH2+2Br2→BrCH2-CHBr-CHBr-CH2Br19.CH3CHO+H2Ni→CH3CH2OH20.CH2OH-(CHOH)4-CHO+H2--Ni→CH2OH-(CHOH)4-CH2OH21.C6H6+3H2Ni→C6H12(环己烷)22.C6H6+3Cl2--光→C6H6Cl6(六六六)23.CH2=CH2+H2O--H2SO4或H3PO4,加热,加压→CH3CH2OH三.消去反应24.CH3CH2OH--浓H2SO4,170℃→CH2=CH2↑+H2O25.CH3CH2Br+NaOH--醇,加热→CH2=CH2↑+NaBr+H2O四.酯化反应(亦是取代反应)26.CH3COOH+CH3CH2OH--浓H2SO4,加热→CH3COOC2H5+H2O27.C3H5(OH)3+3HNO3--浓H2SO4→C3H5(ONO2)3+3H2O28.[C6H7O2(OH)3]n+3nHNO3(浓)--浓H2SO4→[C6H7O2(ONO2)3]n+3nH2O29.[C6H7O2(OH)3]n+3nCH3COOH--浓H2SO4→[C6H7O2(OOCCH3)3]n+3nH2O30.葡萄糖+乙酸乙酸酐五.水解(卤代烃、酯、油脂的水解见上,亦是取代反应)31.CH3COONa+H2O→CH3COOH+NaOH32.CH3CH2ONa+H2O→CH3CH2OH+NaOH33. C6H5ONa+H2O→C6H5OH+NaOH34.C17H35COONa+H2O→C17H35COOH+NaOH35.(C6H10O5)n+nH2O--淀粉酶→nC12H22O11淀粉麦芽糖36.2(C6H10O5)n+nH2O--H2SO4,加热→nC6H12O6淀粉葡萄糖37.(C6H10O5)n+nH2O--H2SO4,常时间加热→nC6H12O6纤维素葡萄糖38.C12H22O11+H2O--H2SO4→C6H12O6+C6H12O6蔗糖葡萄糖果糖39.C12H22O11+H2O--H2SO4→2C6H12O6麦芽糖葡萄糖40.蛋白质--胃蛋白酶或胰蛋白酶→各种a-氨基酸六.氧化反应(一)被强氧化剂氧化41.2C2H5OH+O2--Cu或Ag→2CH3CHO+2H2O42.C6H12O6+6O2→6CO2+6H2O+热43.2CH3CHO+O2→2CH3COOH★44.5CH2=CH2+6KMnO4+18H2SO4→6K2SO4+10CO2+12MnSO4+28H2O★45.5 C6H5CH3+6KMnO4+9H2SO4→5C6H5COOH+3K2SO4+6MnSO4+14H2O★46.5C6H5CH2CH3+12KMnO4+18H2SO4→5C6H5COOH+5CO2+6K2SO4+12MnSO 4+28H2O(二)被弱氧化剂氧化47.CH3CHO+2[Ag(N H3)2]OH→CH3COONH4+2Ag↓+3NH3+H2O48.CH3CHO+2Cu (OH)2加热→CH3COOH+Cu2O↓+2H2O49.CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH→CH2OH(CHOH)4COONH4+2Ag↓+3NH 3+H2O50.CH2OH(CHOH)4CHO+2Cu(OH)2--加热→CH2OH(CHOH)4COOH+Cu2O↓+2H2O51.HCOOH+2[Ag(NH3)2]OH→NH4HCO3+2Ag ↓+3NH3+H2O52.HCOOH+2Cu(OH)2加热→CO2+Cu2O↓+3H2O53.HCOONa+2[Ag(NH3)2]OH→NaHCO3+4NH3+2Ag↓+H2O54. HCOONH4+2[Ag(NH3)2]OH→NH4HCO3+2Ag↓+4NH3+H2O55.HCOOR+2[Ag(NH3)2]O H→NH4OCOOR+2Ag↓+3NH3+H2O56.HCHO+2[Ag(NH3)2]OH→HCOONH4+2Ag↓+3NH 3+H2O57.HCHO+4[Ag(NH3)2]OH→NH4HCO3+4Ag↓+7NH3+2H2O58.HCHO+4Cu(OH) 2加热→CO2+2Cu2O↓+5H2O七.还原反应59.CH3COCH3+H2--Ni→CH3CHOHCH360.HCHO+H2--Ni→CH3OH61.C6H5CH=CH2+4H2--Ni→C6H11CH2CH3八.加聚反应62.nCH2=CH2→[CH2-CH2]n63.nCH3-CH=CH2→[CH-CH2]n64.nCH2=CHX→[CH2-CH]n65.nCF2=CF2→[CF2-CF2]n66.nCH2=CHCN→[CH2-CH]n67.nCH2=C-COOCH3→[CH2-C]n68.nCH2=C-CH=CH2→[CH2-C=CH-CH2]n69.nCH2=CH-CH=CH2→[CH2-CH=CH-CH2]n70.nCH2=CH-CH=CH2+nC6H5CH=CH2→[CH2-CH=CH-CH2-CH2-CH]n或[CH2-CH=CH-CH2-CH-CH2]n71.3CHCH→C6H6(苯)72.nCH2=CH2+nCH3-CH=CH2→[CH2-CH-CH2-CH2]n 或[CH-CH2-CH2-CH2]n九.缩聚反应72.H-N-CH2-C-OH+H-N-CH2-C-OH+...→H-N-CH2-C-N-CH2-C-...+nH2O73.nC6H5OH+nHCHO---浓HCl,加热→[C6H3OHCH2]n+nH2O74.HOOC--COOH+nHO-CH2CH2-OH→[CO--COOCH2CH2O]n+2nH2O十.其他(一)有机物跟钠的反应75.2CH3CH2OH+2Na→2CH3CH2ONa+H76.2C6H5OH+2Na→2C6H5ONa+H2↑77. 2CH3COOH+2Na→2CH3COONa+H2↑(二)炭化78.C12H22O11--浓H2SO4→12C+11H2O(三)分子间脱水79.2C2H5OH--浓H2SO4,140℃→C2H5OC2H5+H2O(四)氨基酸的两性80.CH2-COOH+HCl→[CH2-COOH]Cl-81.CH2-COOH+NaOH→CH2-COONa+H2O友情提示:本文中关于《有机化学反应方程式小结》给出的范例仅供您参考拓展思维使用,有机化学反应方程式小结:该篇文章建议您自主创作。
大学有机化学反应方程式总结(较全)
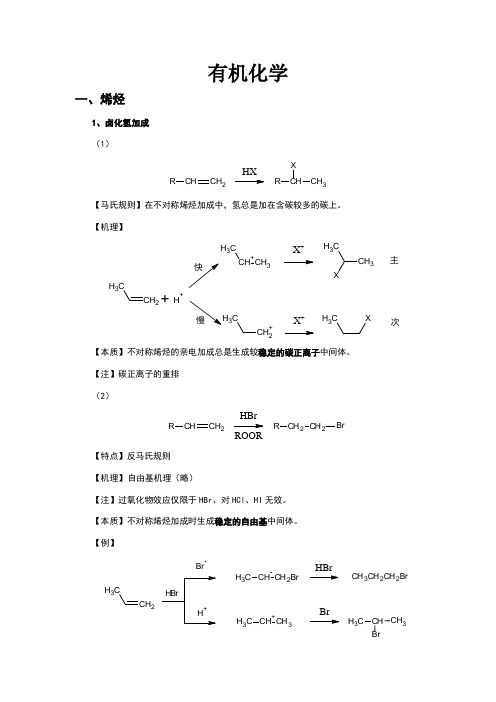
有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3CH +CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH 33H 323H 32CH CH 2CH 32CH CH=CH (CH 3CH 2CH 2)3-H 3CH 2CH 2C22CH 3CH 2OCH2CH 2CH 3H 3CH 2CH 2C2CH 2CH 3+OH -OHB-OC H 2CH 2CH 3CH 2CH 2CH 3H 3CH 2CH 2BOC H 2CH 2CH 3CH 2CH 2CH 3H 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3B(OCH 2CH 2CH 3)3+3NaOH 3NaOH3HOC H 2CH 2CH 33+Na 3BO 32【例】CH 31)BH 32)H 2O 2/OH-CH 3HH OH3、X 2加成C CBr 2/CCl 4CC Br【机理】CC CC BrBrC Br +CC Br OH 2+-H +CC Br OH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
大学有机方程式总结(完美)

完美基本有机反应:烷烃的化学反应:⒈卤代(F 2,I 2不可作卤化剂)CH 4+Cl 2−→−γh CH 3Cl+CH 2Cl 2+CHCl 3+CCl 4+HCl CH 3CH 2CH 3+Cl 2 −−−→−︒)25(h C γCH 3CHClCH 3(57%)+CH 3CH 2CH 2Cl(43%)⒉硝化,磺化,氧化(略) 烯烃的化学反应:⒈加卤素:CH 3CH=CH 2+Br 2−−→−4CCl CH 3CHBr -CH 2Br⒉加氢卤酸:CH 3CH=CH 2+HBr →CH 3CHBr -CH 3 有区域选择,符合马氏规则 ⒊与无机酸:CH 3CH=CH 2+H 2SO 4→CH 3CH(OSO 3H)-CH 3 CH 3CH=CH 2+HOCl →CH 3CH(OH)-CH 2Cl⒋与水加成:CH 3CH=CH 2−−→−42SO H CH 3CH(OSO 3H)-CH 3−−→−OH 2CH 3CH(OH)CH 3⒌与硼烷加成:CH 3CH=CH 2−−→−62H B (CH 3CH 2CH 2)3B −−−→−)O(OH H -2CH 3CH 2CH 2OH 顺式加成,反马氏取向生成1︒醇⒍过氧化物存在下,反马氏取向:CH 3CH=CH 2+HBr →−−−→−过氧化物CH 3CH 2CH 3Br HCl 无此反应⒎催化加氢成烷烃:用Pt,Pd,Ni 等 ⒏高锰酸钾氧化:酸性:CH 3CH=CH 2+KMnO 4−−→−-OH CH 3CH(OH)CH 2OH+MnO 2+KOH 碱性:CH 3CH=CH 2+KMnO 4−−→−∆+/H CH 3COOH+CO 2↑ ⒐臭氧化: R ORRC=CHR’−→−3OC CHR’→ 可根据产物推断反应物结构R O -O 故多用于双键位置判定−−−→−O璈O H 222RCOR+R’COOH−−→−O H -Zn 2RCOR+R’CHO−−→−4LiAlH RRCHOH+R’CH 2OH⒑催化氧化:CH 2=CH 2+O 2−−−−→−︒C300-Ag/200CH 2-CH 2 OCH 2=CH 2+O 2−−−−→−22CuCl ~PdCl CH 3CHO 多用于工业生产 ⒒α-取代反应:氯代:CH 2=CHCH 3−−−−→−︒C 600-/400Cl 2CH 2=CH -CH 2Cl 溴代:CH 2=CHCH 3−−→−NBSCH 2=CH -CH 2Br 两个反应均为自由基取代反应,NBS 即N-溴代琥珀酰亚胺⒓重排:(CH 3)3CCH=CH 2−−→−HCl(CH 3)2CClCH(CH 3)2(主)+(CH 3)3CCHClCH 3(次) 这一重排是由于分步加成和第一步中,由H +对双键的加成生成碳正离子,其稳定性3︒>2︒>1︒,故在可能的情况下,它将以重排的方式趋于更稳定的状态。
有机化学常用反应方程式汇总

有机化学常⽤反应⽅程式汇总光照光照光照光照⾼温CaO△催化剂加热、加压催化剂△催化剂有机化学⽅程式汇总1. CH 4 + Cl 2CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 2312. nCH 2 = CH 2 ] n13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2ONaOHH 2O 醇△140℃催化剂△24. + 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O32. CH 3CH 2OH CH2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 33738. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O41CH 3O42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸CH2-CH244. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O46. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO 252. C12H22O11+H2O C6H12O66蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH257. C17H35COO-CH2 CH2-OHC17H35COO-CH +3NaOH 3C17H35COONa+ CH-OH C17H35COO-CH2 CH2-OH58. CH2OH COOHCH2OH COOH1.HClClCHClCH+→24光HClClCHClClCH+→+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-= 9.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+?→??18.19.20.21.⾼中有机化学知识点总结 1.需⽔浴加热的反应有:(1)、银镜反应(2)、⼄酸⼄酯的⽔解(3)苯的硝化(4)糖的⽔解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不⾼于100℃的条件下反应,均可⽤⽔浴加热,其优点:温度变化平稳,不会⼤起⼤落,有利于反应的进⾏。
有机化学方程式(70个)

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:CnH2n+2)甲烷的制取:CaO△(1)氧化反应甲烷的燃烧:点燃甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应光照一氯甲烷)+HCl光照二氯甲烷)+HCl光照三氯甲烷)+HCl(CHCl3又叫氯仿)光照四氯化碳)+HCl(3)分解反应甲烷分解:高温2. 乙烯(烯烃通式:CnH2n)乙烯的制取:CH3CH2OH浓硫酸170℃CH2=图2 乙烯的制取图1 甲烷的制取CH2↑+H2O(消去反应)(1)氧化反应乙烯的燃烧:CH2=点燃乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH2=—CH2Br与氢气加成:CH2=CH2+H2催化剂CH3CH3与氯化氢加成:CH2=CH2+HCl 催化剂CH3CH2Cl与水加成:CH2=CH2+H2O 催化剂CH3CH2OH(3)聚合反应乙烯加聚,生成聚乙烯:n CH2=CH2催化剂[CH2—CH2 ] n适当拓展:CH3CH =CH2+Cl2CH3׀ Cl CH -׀ Cl CH2 CH3CH =CH2+H2催化剂CH3CH2CH3CH3CH =CH2+HCl 催化剂CH3CH2CH2Cl 或CH3׀Cl CH CH3CH3CH =CH2+H2O 催化剂CH3CH2CH2OH 或CH3׀ OH CHCH3nCH2=CH -CH3催化剂 [CH2—׀ CH3CH ] n(聚丙烯)3. 乙炔(炔烃通式:CnH2n-2)乙炔的制取: CH↑+Ca(OH)2(1)氧化反应点燃乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应CHBr=CHBrCHBr=—CHBr2图3 乙炔的制取与氢气加成:HC≡CH+H2催化剂H2C=CH2与氯化氢加成:HC≡CH+HCl催化剂CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:nCH2=CHCl催化剂CH ] n[CH2—׀Cl乙炔加聚,得到聚乙炔:n HC≡CH催化剂[CH=CH ]n4. 1,3-丁二烯与溴完全加成:CH2=CH-CH=CH2+2Br2CH2Br-CHBr-CHBr-CH2Br与溴1,2-加成:CH2=CH-CH=CH2+Br2CH2Br-CHBr-CH=CH2与溴1,4-加成:CH2=CH-CH=CH2+Br2CH2Br-CH=CH-CH2Br5. 苯苯的同系物通式:CnH2n-6(1)氧化反应苯的燃烧:2点燃苯不能使溴水和酸性高锰酸钾溶液褪色。
有机化学反应方程式大全

有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH CH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3+CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH33H323H32 CH CH2CH32CH CH=CH(CH3CH2CH2)3-H3CH2CH2C22CH3CH2B OCH2CH2CH33CH2CH2C2CH2CH3+O H-OHB-OCH2CH2CH3CH2CH2CH3H3CH2CH2B OCH2CH2CH3CH2CH2CH32CH2CH3HOO-B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO32【例】CH31)BH32)H2O2/OH-CH3HHOH3、X2加成C CBr2/CCl4C CBrBr【机理】CCC CBrBr CBr+C CBrOH2+-H+C CBrOH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
有机化学方程式(70个)

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:C n H 2n +2)甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 2 点燃CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+Cl 光照3Cl(一氯甲烷)+HClCH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HClCH 2Cl 2+Cl 光照3(三氯甲烷)+HCl (CHCl 3又叫氯仿)CHCl 3+Cl 光照4(四氯化碳)+HCl(3)分解反应甲烷分解:CH 高温22. 乙烯(烯烃通式:C n H 2n )乙烯的制取:CH 3CH 2浓硫酸170℃2=CH 2↑+H 2O(消去反应)(1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 点燃2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2Br —CH 2Br与氢气加成:CH 2=CH 2+H 2催化剂CH 3CH 3 与氯化氢加成:CH 2=CH 2+HCl 催化剂CH 3CH 2Cl 与水加成:CH 2=CH 2+H 2O催化剂CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH 2=CH 2催化剂 [CH 2—CH 2 ] n 适当拓展:CH 3CH =CH 2+Cl 3׀ Cl CH -׀ ClCH 2 CH 3CH =CH 2+H 2催化剂CH 3CH 2CH 3 CH 3CH =CH 2+HCl 催化剂CH 3CH 2CH 2Cl 或CH 3׀ ClCHCH 3 CH 3CH =CH 2+H 2O 催化剂CH 3CH 2CH 2OH 或CH 3׀ OHCHCH 3 n CH 2=CH -CH 3催化剂 [CH 2—׀ CH 3CH ] n (聚丙烯) 3. 乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】【本质】不对称烯烃的亲电加成总是生成较 稳定的碳正离子中间体。
【注】碳正离子的重排 (2)HBrR —CH = CH 2R — CH 2 一 CH 2—BrROOR【特点】反马氏规则 【机理】自由基机理(略)【注】过氧化物效应仅限于 HBr 、对HCI 、HI 无效。
【本质】不对称烯烃加成时生成 稳定的自由基 中间体。
【例】【特点】不对称烯烃经硼氢化 一氧化得一反马氏加成 的醇,加成是顺式的,并且不重排。
【机理】烯烃1、卤化氢加成 (1)有机化学HXR —CH=CH 2-------R —CH-CH 3H 3 CH 3 CCH-CH 3X +-----------H 3C—CH 3 X+CH 2X + H 3CX 次H 3C--------------------- AHBr-CH 2nI.氧化R- — CH CH 2H 3C —CH-CH 2Br+H 3C-CH-CH 3HBrCH 3CH 2CH 2BrBrH 3C —CH — CHBrR -CH 2 一 CH 2-OH2)H 2O 2/OH -H 3CBr2、硼氢化H3C H3C H3CH3CCH -CH2CH2BH2CH3C2CH2H --------- B H23H --------- B H2CH2CH2CH3I-4 (CH3CH2CH2)3B0_0£ H3CH2CH2C —B—O—OH BH2CH 2CH 2CH 3CH2CH2CH3» H3CH2CH2C—B——O + HOCH2CH2CH3I-HO—OCH2CH2CH3H3CH2CH2C-B——OCH 2CH2CH3■O-OHCH2CH2CH3HOO-B ——OCH 2CH2CH3B(OCH 2CH 2CH 3)3OCH 2CH 2CH 3B(OCH 2CH2CH3)3+ 3NaOH 3NaOH 3HOCH 2 CH 2 CH 33+Na 3 BO3 【例】CH33、X2加成Br【机理】C=CBrC CBrH2OBrc—C c—Cl' +Br +-H■J rC—C/ l\HO「Br C +C一:-\l /c—c/ l\Br【注】通过机理可以看出,反应先形成三元环的溴鎓正离子, 然后亲和试剂进攻从背面进攻,不难看出是 反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
【特点】反式加成 4、烯烃的氧化1)稀冷高锰酸钾氧化成邻二醇。
H 3CCH 3H 3CCH3 稀冷 KMnO 4H 3CH 3CCH 3O O、/MhO O CH 3H 2OH 3C—* H3C―厂OH OHCH 3CH 32) 热浓酸性高锰酸钾氧化R 2KMnO 4c=c R i------- »H +O IIR iO//R 2—cOH3) 臭氧氧化4) 过氧酸氧化AgO5、R 严R 2 R - O+HHR烯烃的复分解反应 H 2C=CH 2CH 2 CH 2催化剂+RR iR ic=c 【例】《有机总结》二、脂环烃1、环丙烷的化学反应【描述】三元环由于张力而不稳定,易发生加成反应开环,类似碳碳双键。
孑出―CH2—卡出HH严2-CH 2—律2Br Br CH 2—CH 2—CH 2IIH OH严一凶2_律2HX【特点】环烷烃都有 抗氧化性,可用于区分不饱和化合物。
【注】遵循马氏规则 【例】6、 1) H 2C 共轭二烯烃 卤化氢加成 OCH 2C 6H 5Grubbs catalystOC 6H5+ H 2C =CH 2HXH 3C咼温4加成为主HXH 2C低温2加成为主CH 3狄尔斯-阿德尔(Diels-Alder ) 【描述】共轭二烯烃和烯烃在加热的条件下很容易生成环状的 【例】 2) 反应 1, 4加成产物。
CH 2CH 2CH 2 CHOCH 2H 2/Ni《有机总结》CH 2— CH 2 — CH — CH 3I H Br2、环烷烃制备1)武兹(Wurtz )反应【描述】通过碱金属脱去卤素,制备环烷烃。
【例】C —C I I X X2)卡宾① 卡宾的生成A 、多卤代物的a 消除X- \ -X 3C —H+ YC+ X + HYNaOH,RONa,R-LiB 、由某些双键化合物的分解② 卡宾与烯烃的加成反应 【特点】顺式加成,构型保持 【例】CH 3AHBrZnC 2H 5OHH 2C =C =O » H 2C:+ CO+ ■ 一H 2C =NN -------- >“O-CI 2C —C T O ----------- > 5H 2C:+ CI 2H 2C: +N 2Cl -+ CO 2双键的保护③类卡宾【描述】类卡宾是一类在反应中能起到卡宾作用的非卡宾类化合物,最常用的类卡宾是 ICH 2Znl 。
三、炔烃1、还原成烯烃1)、顺式加成Cat NaBH 4(CH 3COO) 2Ni2)、反式加成2、亲电加成1)、加 X 2CI 3CH/NaOH-----------:相转移催化剂H 3CCHBr BrBr 3CH/KOC(CH 3)3HOC(CH 3)3R 1Br 2R 1 BrBrR 2CH 2I 2+ Cu(Z n)CH 2Znl 制备【特点】顺式加成, 【例】CH 2I 2CH 3 Zn(Cu)H 3C'HCH 3R 1 R 2H2R 1R 2Cat=[Pb/BaSO 4,Pb/CaCO 3,Ni 3B...]R iR 2CatCat=[Na/液氨…]R 2构型保持 H 3CCH 2I 2 Zn (Cu)H【机理】R 2【特点】反式加成2)、加 HXHBr2HBrBrCHBr3)、加 H 2OH 2OCHHgSO 4/H 2SO 4【机理】2+HgCH------------ s R_C+HgH 3C — C — CH 3BrR (一摩尔的卤化氢主要为反式加成)RCH2HORCH 3H 2OH 2O+Hg-H +HO+Hg+Hg・平IO 一H -【特点】炔烃水合符合马式规则。
【注】只有乙炔水合生成乙醛,其他炔烃都生成相应的酮。
HO H +HRCH 3《有机总结》3、亲核加成1)、HC 三CHO Zn (CH3C00) 1----------------------H 2C ^=CH _ O — C - CH 3A+ CH 3COOCH 3HCHOH+维尼纶合成纤维就是用聚乙烯醇甲酯2)、NH4CI,CuCI2aqHC 三CH + HCNH3CCH -X 3CNCH2CH — HC N n2’人造羊毛3)、HC 三CH+C2H5OHH2C=CH—OC 2H5150 C〜180 C /压力【注】干燥的炔银和炔铜受热或震动时 易发生爆炸 物分解。
6、炔基负离子R i -L(L=X,OTs)R —CWC —R 1R 1:1。
烷基(2) H 2O⑵H ?O4、聚合Cu 2CI 25、端炔的鉴别HC 三CHHC 三 CH HC 三 CHHC 三 CHNH 4CI CU 2CI 2NH 4CIH 2C=CH金属羰基化合物Ni(CN) 2R —C 三 CHCu(NH 3)2+_R —C 三 C R —C 三 CH+Ag(NH 3)2R — C= C CH =CH 2+Ag J 白色+Cu 红色- +R —C 三C NaO⑴一OHR iR — C= C —CH 2 CH - R 1O(1)R i-C —R 2OHR —CWC —C —R"!,实验完毕,应立即加浓硫酸把炔化 R 2【例】三、芳烃1、苯的亲电取代反应1)卤代4)傅-克(Friedel-CraftS 反应①傅-克烷基化反应NaNH2HC 三CH- +HC三C NaH3COCH3 H2OHC三C OHCH3CH3CH3 AI2O3H2CCH3CH22)硝化3)磺化23HHBrH2OH2O+R —CIAICI 3《有机总结》【注】碳正离子的重排,苯环上带有第二类定位基不能进行傅-克反应。
【例】【机理】R—ci + AICI3 + +- -AICI4 + R — CH2HCH 1Cl 3 + 3《有机总结》Cl AICI3/ -------- »O2、苯环上取代反应的定位效应1)第一类定位基,邻对位定位基,常见的有OIL—HN-C-ROU—O_C— R -R —Ar —X(F,CI,Br,l)2)第二类定位基,间位定位基,常见的有:—CN —SO 3H —CHO【注】第一类定位基除卤素外,均使苯环活化。
第二类定位基使苯环钝化。
卤素比较特殊,为弱钝化的第一类定位基。
②傅-克酰基化反应【例】—NR2 —NHR —NH2—OH — OR—NR3 —NO 2—CF 3—Cl3— COR —COOHO—C — OROR3、苯的侧链卤代【机理】自由基机理4、苯的侧链氧化1)用高锰酸钾氧化时,产物为酸。
【描述】苯环不易被氧化,当其烷基侧链上有a 氢的时候,则该链可被高锰酸钾等强氧 化剂氧化,不论烷基侧链多长。
结果都是被氧化成苯甲酸。
CH 2CINBSCH 3ClCH 3ClCH 3KMnO 4COOHH 3C —C —CH 3CH 3CH3CH 32)用CrO 3+Ac 20为氧化剂时,产物为醛。
【例】3)用MnO 2为氧化剂时,产物为醛或酮。
5、萘【特点】萘的亲电取代反应,主要发生在定,反应速度快。
【例】a 位,因为进攻a 位,形成的共振杂化体较稳NO 2HNO 3 H 2SO 4Br 2 CCl 4CH sN02CH 3CH 2CH 33BrOHR—X ------------ R—OHSH -R—SH SO3HHNO3HOAcNO2HNO3H2SO4四、卤代烃1、取代反应(1)水解R—X CH3 NO2CH3 CH3(2) 醇解1 R 1ONa“1 R —X R —0—R1R SNa 1R_X ------------- R —S R(3) 氰解CN - “1 R —X R —S —RC 2H 5OH(4) 氨解NH 3R —XR — NH 2NH 3R —XR 3N(5) 酸解R 1COO1R —X ----------- R COOR(6) 与炔钠反应1 _ - 1 _R 一X+R C ------------------ R —C=C —R(7) 卤素交换反应NalR —XR —I丙酮2、消除反应(1)脱卤化氢 ①3 -消除B aNaOHR — CH — CH 2RC 帀 CH 2~~匚―5_ 乙醇H Cl【注】当有多种3 -H 时,其消除方向遵循萨伊切夫规律,即卤原子总是优先与含氢较 少的3碳上的氢一起消除。
【例】81%KOH----------- 1乙醇CH 3+H 3 CCH 219%《有机总结》②a -消除(2)脱卤素CH3ClCl——C・HCl2R R1R C—C-Br BrRKOH乙醇KOH乙醇CH2BrCH2BrH2CH3CCH3NaOH---- ►:CCl23、与活泼金属反应(1)与金属镁反应RXMg无水乙醚(2)与金属钠反应武兹(Wurtz )反应2RX (3)与金属锂反应RX + 2 Li2RLi + CuI【注】二烷基铜锂主要是与卤代烃Zn [------ »乙醇ZnNa无水乙醚2R R RRMgX(格式试剂)RLi + LiX无水乙醚R2CuLi + LiI 偶联成烷烃R—X R2CuLiR — R[五、醇1、卢卡斯(Lucas )试剂无水氯化锌与浓盐酸的很合溶液叫卢卡斯试剂,用于鉴别伯、仲、叔醇伯醇2、把羟基变成卤基(1)、醇与卤化磷(P«、PX0反应很慢长时间不出现混浊PX 3R — OH -------------- R —X(2)、醇与亚硫酰氯(SOC 2)SOCI 2R —OH3、醇的氧化(1)沙瑞特(Sarret )试剂R —H【注】沙瑞特试剂,是CrO 3和吡啶的络合物。
