酸和碱化学方程式总结
酸和碱的反应方程式与现象

酸和碱的反应方程式与现象
酸和碱之间会发生反应,产生水和盐。
反应的化学方程式通常可以表示为:
酸 + 碱 → 水 + 盐
其中,酸和碱分别用化学式表示,而水和盐用化学式表示。
例如,如果将氢氧化钠溶液 碱)和盐酸 酸)混合,则会发生反应,产生水和氯化钠 盐)。
反应的化学方程式可以表示为:
HCl + NaOH → H2O + NaCl
如果将硫酸 酸)和氢氧化钾溶液 碱)混合,则会发生反应,产生水和氢氧化钾 盐)。
反应的化学方程式可以表示为:
H2SO4 + KOH → K2SO4 + H2O
当酸和碱发生反应时,通常会发现有一些现象。
例如,反应过程中会产生热量,可能会感到温暖。
此外,反应过程中也可能会产生气体,例如氢气或二氧化碳。
反应过程中,还可能出现改变颜色的现象。
例如,将蓝色的硫酸铜溶液和白色的氢氧化钠溶液混合,则会发生反应,产生绿色的氢氧化铜溶液。
需要注意的是,酸和碱之间的反应是非常激烈的,应该注意安全。
例
如,如果将盐酸 酸)和硫酸钠 碱)混合,则会产生二氧化硫气体,这是一种有毒气体。
因此,在进行酸碱反应时,应该注意安全,并使用适当的安全装置。
化学方程式大全

化学方程式大全化学方程式可以说是在学习化学的过程中不可避免的一环,因此掌握化学方程式的情况对于深入学习化学有很大的帮助。
这篇文章将分别介绍酸碱反应、氧化还原反应、置换反应、凝固反应等不同的反应类型及其相应的化学方程式。
一、酸碱反应1、酸和碱可以中和生成盐和水酸 + 碱→ 盐 + 水例如:HCl + NaOH → NaCl + H2O2、酸与碱物质会生成相应的盐酸 + 碱→ 相应盐 + 水例如:HNO3 + KOH → KNO3 + H2O3、酸氧化金属,产生相应的盐与氢气酸 + 金属→ 相应盐 + 氢气例如:2HCl + Mg → MgCl2 + H24、碱氧化非金属,产生相应的盐与水碱 + 非金属→ 相应盐 + 水例如:2NaOH + CO2 → Na2CO3 + H2O二、氧化还原反应1、单质和氧气反应生成氧化物元素 + 氧气→ 氧化物例如:Mg + O2 → MgO2、金属还原非金属含氧化合物生成相应的氧化物和金属氧化物金属 + 非金属氧化物→ 相应氧化物 + 金属氧化物例如:M g + Fe2O3 → MgO + Fe3、非金属元素被金属离子还原金属离子 + 非金属→ 相关金属 + 非金属离子例如:Cu2+ + Zn → Cu + Zn2+三、置换反应1、金属拆开化合物中的其他金属金属1 + 化合物2 → 金属2 + 化合物1例如:Zn + CuSO4 → Cu + ZnSO42、氧化物的部分材料相互置换非金属1氧化物 + 非金属2 → 非金属2氧化物 + 非金属1例如:CO + 2H2 → CH4 + H2O四、凝固反应1、离子相互聚合生成盐阳离子1 + 阴离子2 → 盐1-2例如:Na+ + Cl- → NaCl2、离子交换生成不同的盐阳离子1 + 阴离子2成为阳离子2 + 阴离子1例如:NaNO3 + AgCl → NaCl + AgNO3以上就是常见的化学方程式大全,通过大量的实践和学习,我们可以更好地理解。
酸和碱的性质化学方程式

酸和碱的性质化学方程式
一.两个置换反应
1.酸+金属→盐+氢气反应条件:①酸常用稀硫酸、盐酸。
不能用硝酸、浓硫酸
②金属必须位于氢以前(常用Mg、Al、Zn、Fe)Mg + HCl==Fe + HCl==
Al + HCl== Al+ H2SO4==
Zn+ H2SO4==Fe+ H2SO4===
2.盐+金属→新盐+新金属反应条件:①参加反应的盐必须溶于水
②参加反应的金属单质比盐中金属活泼, 且一般不用钾、钙、钠Fe+CuSO4==Al+ CuSO4==
Zn+CuSO4== Cu+ AgNO3==
Cu+Hg(NO3)2==
二.四个化合反应:
1.金属+氧气:铁燃烧:;加热铜
2.金属氧化物+水→碱(可溶性):生石灰加水:
3.非金属+氧气:磷燃烧:;氢气燃烧
4.非金属氧化物+水:CO2+H2O== SO3+H2O==SO2+H2O==
三.复分解反应:
Ca(OH)2+ HCl== Al(OH)3+ HCl==
Cu(OH)2+H2SO4== Mg(OH)2+ HNO3==
CaCO3+ HCl== Na2CO3+ HCl==
NaHCO3+ HCl==
Fe2O3+ HCl== CuO+ HCl==
Fe2O3+H2SO4== MgO+ HNO3==
四.其它反应
NaOH+CO2==NaOH+SO2==
NaOH+SO3==
Ca(OH)2+CO2==Ca(OH)2+SO3==。
九年级化学全册 第7单元 常见的酸和碱基础知识总结与应用 鲁教版
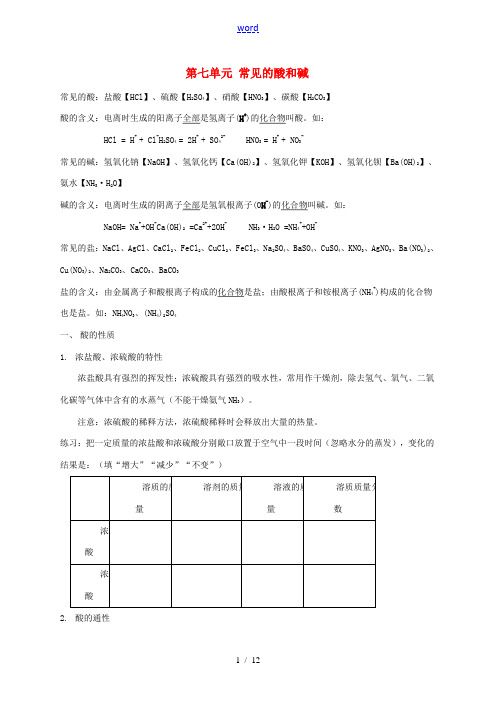
第七单元常见的酸和碱常见的酸:盐酸【HCl】、硫酸【H2SO4】、硝酸【HNO3】、碳酸【H2CO3】酸的含义:电离时生成的阳离子全部是氢离子(H+)的化合物叫酸。
如:HCl = H+ + Cl-H2SO4 = 2H+ + SO42- HNO3 = H+ + NO3-常见的碱:氢氧化钠【NaOH】、氢氧化钙【Ca(OH)2】、氢氧化钾【KOH】、氢氧化钡【Ba(OH)2】、氨水【NH3·H2O】碱的含义:电离时生成的阴离子全部是氢氧根离子(O H-)的化合物叫碱。
如:NaOH= Na++OH-Ca(OH)2 =Ca2++2OH- NH3·H2O =NH4++OH-常见的盐:NaCl、AgCl、CaCl2、FeCl2、CuCl2、FeCl3、Na2SO4、BaSO4、CuSO4、KNO3、AgNO3、Ba(NO3)2、Cu(NO3)2、Na2CO3、CaCO3、BaCO3盐的含义:由金属离子和酸根离子构成的化合物是盐;由酸根离子和铵根离子(NH4+)构成的化合物也是盐。
如:NH4NO3、(NH4)2SO4一、酸的性质1.浓盐酸、浓硫酸的特性浓盐酸具有强烈的挥发性;浓硫酸具有强烈的吸水性,常用作干燥剂,除去氢气、氧气、二氧化碳等气体中含有的水蒸气(不能干燥氨气NH3)。
注意:浓硫酸的稀释方法,浓硫酸稀释时会释放出大量的热量。
练习:把一定质量的浓盐酸和浓硫酸分别敞口放置于空气中一段时间(忽略水分的蒸发),变化的结果是:(填“增大”“减少”“不变”)2.酸的通性⑴酸溶液能使紫色的石蕊溶液变红,不能使无色的酚酞溶液变色。
⑵酸+金属→盐+氢气Fe+2HCl=FeCl2+H2↑ Mg+2HCl=MgCl2+H2↑Zn+H2SO4=ZnSO4+H2↑ 2Al+3H2SO4=Al2(SO4)3+3H2↑要求:能够熟练写出镁、锌、铁、铝分别与稀盐酸、稀硫酸反应的化学方程式,并叙述实验现象。
注意:氯化亚铁的溶液是浅绿色。
酸碱中和反应的化学方程式

酸碱中和反应的化学方程式
酸碱中和反应是一种常见的化学反应,当酸与碱反应时,生成盐和水。
下面将
通过化学方程式来解释酸碱中和反应的过程。
1.酸碱中和反应的一般方程式如下所示:酸 + 碱→ 盐 + 水
2.举例说明:以盐酸(HCl)和氢氧化钠(NaOH)的中和反应为例,其化
学方程式如下所示:HCl + NaOH → NaCl + H2O
在这个反应中,盐酸(HCl)是酸,氢氧化钠(NaOH)是碱。
它们反应生成
盐(NaCl)和水(H2O)。
3.方程式解释:盐酸(HCl)和氢氧化钠(NaOH)之间发生酸碱中和反应。
酸(HCl)中的氢离子(H+)和碱(NaOH)中的氢氧根离子(OH-)结合生成水(H2O)。
同时,氯离子(Cl-)和钠离子(Na+)结合形成盐
(NaCl)。
4.中和反应的特点:酸碱中和反应具有以下特点:
•pH值变化:酸和碱中和后,产生的溶液呈中性,pH值约为7。
•离子交换:酸中的正离子与碱中的负离子结合,形成盐。
•水的生成:酸和碱中和后,生成水。
总结:酸碱中和反应的化学方程式描述了酸和碱反应生成盐和水的过程。
通过离子交换,酸中的氢离子与碱中的氢氧根离子结合生成水,并生成相应的盐。
这种反应具有pH值变化、离子交换和水的生成等特点。
na和h2so4反应方程式

na和h2so4反应方程式NA和H2SO4反应可以得到Na2SO4和H2O。
这是一种酸碱中和反应,也称为酸碱反应。
在这个反应中,氢氧根离子(OH-)来自NaOH (氢氧化钠),它是一种碱。
硫酸(H2SO4)是一种酸,它会释放出氢离子(H+)。
当这两种物质混合在一起时,氢离子和氢氧根离子结合形成水,同时生成的钠离子(Na+)和硫酸根离子(SO4^2-)结合形成Na2SO4。
具体反应方程式如下:2NaOH + H2SO4 -> Na2SO4 + 2H2O在这个反应中,氢氧根离子和氢离子结合形成水的过程被称为中和反应。
这是因为在酸碱反应中,酸和碱的性质相互抵消,形成中性物质水。
这个反应在实际应用中有很多重要的作用。
首先,这个反应可以用来制备硫酸钠(Na2SO4)。
硫酸钠是一种重要的化学品,在工业生产中有广泛的应用。
其次,这个反应也可以用来测定酸和碱的浓度。
通过知道酸和碱的摩尔比例,可以计算出它们的浓度。
此外,这个反应还可以用来调节溶液的酸碱度,使其达到所需的pH值。
在这个反应中,酸和碱的摩尔比例非常重要。
如果酸的摩尔量多于碱的摩尔量,剩余的酸会使溶液保持酸性。
相反,如果碱的摩尔量多于酸的摩尔量,剩余的碱会使溶液保持碱性。
只有当酸和碱的摩尔比例完全符合化学方程式中的系数时,才能实现完全中和。
反应速率也是一个重要的因素。
加热反应混合物可以加快反应速率,因为加热会增加反应物分子的动能,使它们更容易碰撞并发生反应。
另外,催化剂的添加也可以加快反应速率。
催化剂是一种物质,可以降低反应的活化能,从而促进反应的进行。
总结起来,NA和H2SO4反应可以得到Na2SO4和H2O。
这是一种酸碱中和反应,通过酸和碱的摩尔比例完全符合化学方程式中的系数,可以实现完全中和。
这个反应在实际应用中有很多重要的作用,如制备硫酸钠、测定酸碱浓度和调节溶液的酸碱度。
反应速率可以通过加热或添加催化剂来加快。
这个反应是化学中重要的基础反应之一,对于理解酸碱中和和溶液的性质具有重要意义。
初三化学酸碱盐归纳总结
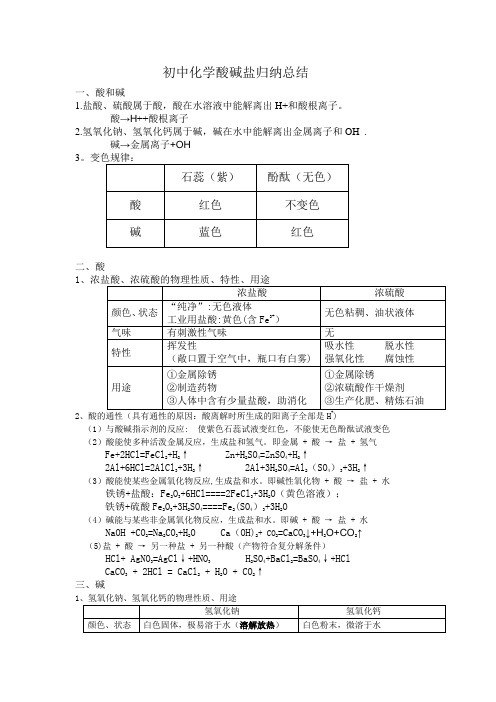
初中化学酸碱盐归纳总结一、酸和碱1.盐酸、硫酸属于酸,酸在水溶液中能解离出H+和酸根离子。
酸→H ++酸根离子2.氢氧化钠、氢氧化钙属于碱,碱在水中能解离出金属离子和OH¯. 碱→金属离子+OH ¯ 3二、酸12(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色 (2)酸能使多种活泼金属反应,生成盐和氢气。
即金属 + 酸 → 盐 + 氢气Fe+2HCl=FeCl 2+H 2↑ Zn+H 2SO 4=ZnSO 4+H 2↑2Al+6HCl=2AlCl 3+3H 2↑ 2Al+3H 2SO 4=Al 2(SO 4)3+3H 2↑(3)酸能使某些金属氧化物反应,生成盐和水。
即碱性氧化物 + 酸 → 盐 + 水 铁锈+盐酸:Fe 2O 3+6HCl====2FeCl 3+3H 2O (黄色溶液); 铁锈+硫酸Fe 2O 3+3H 2SO 4====Fe 2(SO 4)3+3H 2O(4)碱能与某些非金属氧化物反应,生成盐和水。
即碱 + 酸 → 盐 + 水 NaOH +CO 2=Na 2CO 3+H 2O Ca (OH)2+ CO 2=CaCO 3↓+H 2O+CO 2↑ (5)盐 + 酸 → 另一种盐 + 另一种酸(产物符合复分解条件) HCl+ AgNO 3=AgCl ↓+HNO 3 H 2SO 4+BaCl 2=BaSO 4↓+HClCaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 三、碱12、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH )(1)碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色 (2)酸性氧化物+碱 → 盐+水 2NaOH+CO 2=Na 2CO 3+H 2O (3)酸+碱 → 盐+水NaOH + HCl = NaCl + H 2O(4)盐+碱 → 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)HCl+ AgNO 3=AgCl ↓+HNO 3 H 2SO 4+BaCl 2=BaSO 4↓+HCl CaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 注:①难溶性碱受热易分解(不属于碱的通性) 如Cu(OH )2 ΔCuO +H 2O 2Fe(OH)3 ΔFe 2O 3+3H 2O②常见沉淀:AgCl ↓ BaSO 4↓ Cu(OH)2↓ F e (OH)3↓ Mg (OH)2↓ BaCO 3↓ CaCO 3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
酸和碱的中和反应(基础) 知识讲解

酸和碱的中和反应(基础)撰稿:熊亚军审稿:于洋【学习目标】1.掌握酸和碱之间发生的中和反应。
2.了解酸碱性对生命活动和农作物的影响,以及中和反应在实际中的应用。
3.会用pH试纸检测溶液的酸碱性,了解溶液的酸碱度在实际中的意义。
【要点梳理】要点一、中和反应1.概念:酸与碱作用生成盐和水的反应,叫做中和反应。
2.实质:酸溶液中的H+和碱溶液中的OH-结合生成了中性的水。
表达式为:H+ + OH-=H2O。
3.现象:有些中和反应进行时有明显的现象,生成的盐以沉淀的形式析出;有些中和反应没有明显的实验现象,所以要判断中和反应是否发生或是否恰好完全反应需要借助酸碱指示剂。
【要点诠释】1.向滴有酚酞试液的氢氧化钠溶液中滴加稀盐酸时,一定要用滴管慢慢滴入稀盐酸,并不断搅拌溶液,直到溶液颜色恰好变成无色为止,否则容易使稀盐酸过量。
从指示剂的变色情况分析,当红色恰好变为无色时,溶液由碱性变为中性,因此,可以利用中和反应改变溶液的酸碱性。
2.注意理解中和反应的概念。
生成盐和水的反应不一定是中和反应,例如:2NaOH+CO2=Na2CO3+H2O,生成盐和水但不是中和反应。
要点二、中和反应在实际中的应用1.用于医药(1)人的胃液呈酸性,当胃液的pH为0.9~1.5时,有助于食物消化。
如果饮食过量时,胃会分泌出大量的胃酸,胃酸过多就会使人感到不适,这时医生就会让你口服某些含有碱性物质的药物,使碱和胃酸反应生成无毒的中性物质。
俗语“烧心”其实是“烧胃”也就是胃酸过多了,一般服用小苏打或胃舒平,它们均可以降低胃酸的浓度,但一旦并发有胃溃疡或胃穿孔症状,那么用小苏打就不合适了,因为反应产生的二氧化碳会刺激胃粘膜,反而使胃酸分泌更多;气体的存在也有加剧胃穿孔的危险。
氢氧化铝与胃酸反应不产生二氧化碳气体,同时生成具有收敛作用的氯化铝,治疗效果好一些。
Al(OH)3 + 3HCl = AlCl3 + 3H2O(2)我们可能都被蚊虫叮咬过。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
澄清石灰水变浑浊
*⎪⎩⎪⎨⎧↑+=+↑+=+++2342342233)(323262H SO Al SO H Al H Cl Al HCl Al ⎪⎩⎪⎨⎧↑
+=+↑+=+++24242222Fe 2Fe H SO Fe SO H H Cl Fe HCl ⎩⎨⎧+=++=+O H SO Fe SO H O O H FeCl HCl O 2342423223323)(3Fe 326Fe 一、酸的有关化学方程式:酸根酸+→+H 1.酸和活泼金属反应:↑+→+2H 盐酸活泼金属(置换反应) (固体逐渐消失,产生均匀气泡) ⎪⎩⎪⎨⎧↑
+=+↑
+=+244222g 2g H MgSO SO H M H MgCl HCl M ⎪⎩⎪⎨⎧↑+=+↑+=+2442222n H ZnSO SO H Zn H ZnCl HCl Z
2.酸与金属氧化物反应:O H 2+→+盐酸金属氧化物 ⎩⎨⎧+=++=+O H MgSO SO H O M O H MgCl HCl O M 244222g 2g ⎩
⎨⎧+=++=+O H CaSO SO H O O H CaCl HCl O 244222Ca 2Ca
二、碱的有关化学方程式:-OH +→金属离子碱 碱与非金属氧化物反应:O H 2+→+盐非金属氧化物碱
⎪⎩⎪⎨⎧+=++=++=+O H SO Na SO OH N O H SO Na SO OH N O H CO Na CO OH N 242323222322a 2a 2a 2 ⎪⎩⎪⎨⎧+↓=++↓=++↓=+O
H CaSO SO OH O H CaSO SO OH O H CaCO CO OH 243223222322)Ca()Ca()Ca(
三、酸与碱之间化学方程式(中和反应) 通式:)(实质:盐碱酸O H OH H O H 2-2=++→++
⎩⎨⎧+=++=+O H SO Fe SO H OH O H Cl HCl OH F 23424232336)(3)2Fe(3Fe 3)e(⎩⎨⎧+=++=+O H CuSO SO H OH C O H Cl C HCl OH C 244222222)u(2u 2)u(由无色变为蓝色红褐色固体消失,溶液*无色变为蓝色蓝色沉淀消失,溶液由*无色白色固体消失,溶液呈*⎩⎨⎧+=++=+O H SO l SO H OH l O H lCl HCl OH l 23424232336)(A 3)(2A 3A 3)(A (用于胃酸过多) ⎩⎨⎧+=++=+O H SO Na SO H OH N O H NaCl HCl OH N 242422a 2a ⎩⎨⎧+↓=++=+O H CaSO SO H OH C O H Cl C HCl OH C 244222222)a(2a 2)a(。
