高效液相色谱(HPLC)基础知识
高效液相色谱-HPLCppt课件.ppt

色谱法的分类
按固定相的形态分:
平面色谱 o 纸色谱
o 薄层色谱
柱色谱
▪篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
色谱法的分类示意图
▪篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
▪ 高压梯度洗脱(高压混合,高压进柱,2个 泵。)
▪篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
▪安捷伦泵:小视频 ▪色谱学堂:泵
▪篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
色谱法原理及分类
什么是色谱法 色谱法溯源 Tswett(茨维特)的实验 色谱法原理 色谱法的分类
▪篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
什么是色谱法
色谱法是一种现代的分离分析方法 1906年正式命名(见诸文献) 20世纪30年代开始广泛研究和应用 高效液相色谱法的广泛应用始于20世纪70年代
1. 紫外—可见光度检测器:
①固定波长:254nm , 低压汞 灯。
② 可 调 波 长 : 190 ~ 800mm , 钨灯,氘灯。
UV
③光电二极管矩阵检测器: 190~700nm。
接色谱柱 石英窗 光电倍增管
废液
▪篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
高效液相色谱(HPLC)基础知识
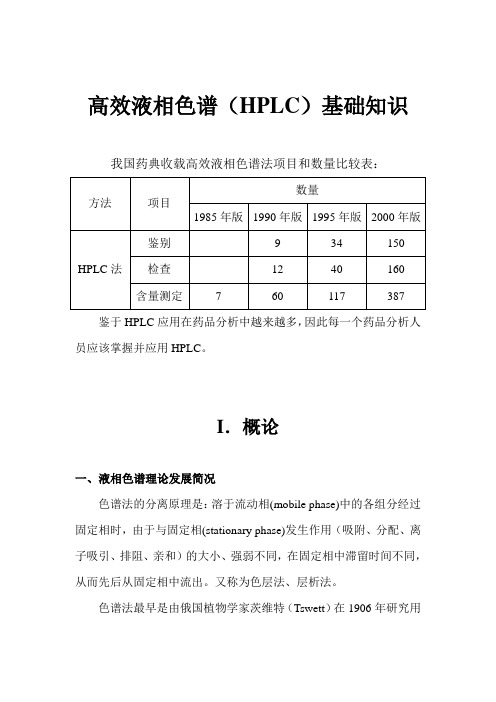
高效液相色谱(HPLC)基础知识我国药典收载高效液相色谱法项目和数量比较表:方法项目数量1985年版1990年版1995年版2000年版HPLC法鉴别9 34 150 检查12 40 160 含量测定7 60 117 387鉴于HPLC应用在药品分析中越来越多,因此每一个药品分析人员应该掌握并应用HPLC。
I.概论一、液相色谱理论发展简况色谱法的分离原理是:溶于流动相(mobile phase)中的各组分经过固定相时,由于与固定相(stationary phase)发生作用(吸附、分配、离子吸引、排阻、亲和)的大小、强弱不同,在固定相中滞留时间不同,从而先后从固定相中流出。
又称为色层法、层析法。
色谱法最早是由俄国植物学家茨维特(Tswett)在1906年研究用碳酸钙分离植物色素时发现的,色谱法(Chromatography)因之得名。
后来在此基础上发展出纸色谱法、薄层色谱法、气相色谱法、液相色谱法。
液相色谱法开始阶段是用大直径的玻璃管柱在室温和常压下用液位差输送流动相,称为经典液相色谱法,此方法柱效低、时间长(常有几个小时)。
高效液相色谱法(High performance Liquid Chromatography,HPLC)是在经典液相色谱法的基础上,于60年代后期引入了气相色谱理论而迅速发展起来的。
它与经典液相色谱法的区别是填料颗粒小而均匀,小颗粒具有高柱效,但会引起高阻力,需用高压输送流动相,故又称高压液相色谱法(High Pressure Liquid Chromatography,HPLC)。
又因分析速度快而称为高速液相色谱法(High Speed Liquid Chromatography,HSLP)。
也称现代液相色谱。
二、HPLC的特点和优点HPLC有以下特点:高压——压力可达150~300 Kg/cm2。
色谱柱每米降压为75 Kg/cm2以上。
高速——流速为0.1~10.0 ml/min。
高效液相色谱知识收藏

高效液相色谱知识收藏1. 分离原理:HPLC利用固定在填料中的固定相和流动相(溶剂)之间的相互作用来分离混合物中的化合物。
固定相通常是多孔填料,而流动相则是溶解样品混合物的溶剂。
在流动相的作用下,样品中的化合物会以不同速率通过固定相,从而实现分离。
2. 设备组成:HPLC主要由溶剂输送系统、样品进样器、固定相柱和检测器组成。
溶剂输送系统用于向柱中输送流动相,样品进样器用于将样品注入HPLC系统,固定相柱用于实现化合物的分离,检测器用于检测分离出的化合物。
3. 应用领域:HPLC广泛应用于药物分析、环境监测、食品安全、生命科学研究等领域。
它可以用于分离和测定各种化合物,包括药物、天然产物、食品添加剂等。
4. 操作要点:在进行HPLC分析时,需要注意溶剂的选择、固定相柱的条件、检测器的调试等细节。
同时,样品的预处理和进样器的设定也会影响分析结果的准确性和稳定性。
5. 数据分析:HPLC分析通常会生成大量的数据,包括色谱图谱、保留时间、峰面积等。
对这些数据进行分析和解释是HPLC分析的关键步骤,可以借助数据处理软件进行数据分析和处理。
总的来说,HPLC是一种高效、准确的分析技术,可广泛应用于化学、生物和医药领域。
了解HPLC的基本原理和操作要点,可以有效提高样品分析的准确性和效率。
HPLC是一种高效、准确的分析技术,可广泛应用于化学、生物和医药领域。
了解HPLC的基本原理和操作要点,可以有效提高样品分析的准确性和效率。
在HPLC分析中,固定相柱是至关重要的部分,不同的固定相柱适用于不同的样品类型和分离要求。
以下是一些常见的固定相类型:1. 反相色谱柱:反相色谱利用极性差异来进行化合物的分离,通常用于水溶性化合物的分离。
反相色谱柱的填料通常是非极性的,比如碳链分子。
常见的反相色谱柱填料包括C18、C8、C4等,它们的碳链长度不同,可以实现对不同极性化合物的分离。
2. 正相色谱柱:正相色谱是基于化合物在极性填料上的分离,适用于非极性化合物的分离。
HPLC-基础知识

烃类族组成、石油中微量成分
无机化工产品、合成高分子化合物、表面活性剂、洗涤剂成分、 化妆品、染料
液晶材料、合成高分子材料
无机阴阳离子、有机酸、氨基酸、糖、维生素、脂肪酸、香料、 甜味剂、防腐剂、人工色素、病原微生物、霉菌毒素、多核芳 烃
氨基酸、多肽、蛋白质、核糖核酸、生物胺、多糖、酶、天然 高分子化合物
目录
❖ 色谱分析法简介 ❖ 色谱法的分类 ❖ HPLC的特点及应用领域 ❖ HPLC的分类 ❖ HPLC相关的基本术语 ❖ HPLC的相关理论
❖ HPLC的定性分析 ❖ HPLC的定量分析 ❖ HPLC仪器的组成
输液泵 检测器 色谱柱 进样器 工作站
❖ P230的基本操作 ❖ HPLC方法的建立 ❖ 液相色谱常见问题及其对策 ❖ 液相色谱容易出问题的部件 ❖ 仪器的维修和保养
(1)软质凝胶 葡聚糖凝胶、琼脂凝胶等。多孔网状结构 水为流动相。适用于常压排阻分离
(2)半硬质凝胶 苯乙烯-二乙烯基苯交联共聚物,有机凝胶 非极性有机溶剂为流动相,不能用丙酮、乙醇等极性溶剂
(3)硬质凝胶 多孔硅胶、多孔玻珠等 化学稳定性、热稳定性好、机械强度大,流动相性质影响 小,可在较高流速下使用 可控孔径玻璃微球,具有恒定孔径和窄粒度分布
化学键合固定相: 目前应用最广、性能最佳的固定相 a. 硅氧碳键型: ≡Si—O—C b. 硅氧硅碳键型:≡Si—O—Si — C
稳定,耐水、耐光、耐有机溶剂,应用最广
c. 硅碳键型: ≡Si—C d. 硅氮键型: ≡Si—N C18 十八烷基硅烷键合硅胶
化学键合固定相的特点
(1)传质快,表面无深凹陷,比一般液体固定相传质快 (2)寿命长,化学键合,无固定液流失,耐流动相冲击
HPLC基础知识

第一章高效液相色谱仪的特点混合物最有效的分离、分析方法。
俄国植物学家茨维特在1906年分离叶绿素,色谱法是一种分离技术。
混合物分离过程:试样中各组分在称之为色谱分离柱中的两相间不断进行着的分配。
一相固定不动,称为固定相。
另一相是携带试样混合物流过固定相的流体(气体或液体),称为流动相。
特点:高压、高效、高速、高灵敏适合高沸点、热不稳定有机及生化试样的高效分离分析方法。
与GC 互补性三、液相色谱组成:(一)、输液系统泵、进样阀、色谱柱、检测器、工作站(记录仪)(二)、附件过滤装置、脱气装置、柱温箱、收集装置等等。
(三)、工作程序:液体进入泵-压力传感器-脉动缓冲器-进样阀-色谱柱检测器(四)、泵体组成部分:电机、马达、双柱塞串联泵腔、缓冲器、压力传感器、面贴(五)、检测器组成部分:1、电器部分(变压器、氘灯板、系统电源伴、控制板、显示板、前置板、面贴)2、光学部分(氘灯、灯箱、光学盒、凹面镜、分光镜、小参比、单色器、流通池、前置板)(六)、HPLC的分类1、吸附色谱Adsorption Chromatography用固体吸附剂作固定相,以不同极性溶剂做流动相依据样品中各组分在吸附剂上吸附性能的差别来实现分离。
2、分配色谱Partition Chromatography用载带在固相基体上的固定液做固定相,以不同极溶剂作流动相。
依据样品中各组分在固定液上分配性能的差别来实现分离。
3、离子色谱Ion Chromatography用高效微粒离子交换剂作固定相,以具有一定PH值的缓冲液做流动相,依据离子型化合物中各离子组分与离子交换剂上表面带电荷基团进行可逆离子交换能力的差别来实现分离。
4、体积排阻色谱Size Exclusion Chromatography用化学惰性的多孔性凝胶做固定相,按固定相对样品中组分分子体积阻滞作用的差别来实现分离。
又分:a、Gel Filtration Chromatography(GFC)以水为流动相的体积排阻色谱b、Gel Permeation Chromatography(GPC)以有机溶剂为流动相的体积排阻色谱5、亲和色谱以在不同基体上,键合多种不同特性的特性的配位体做固定相用具有不同PH值的缓冲溶液作流动相,依据生物分子(氨基酸、肽、蛋白质、核碱、核酸、核苷酸、酶等)与基体上键合的配位体之间存在的特异性亲和作用能力的差别而实现对具有生物活性的生物分子的分离。
关于HPLC的基础知识(中文)
高效液相色谱提纲

高效液相色谱提纲色谱的基础知识第一章色谱分析法概述一、色谱分析法发展简介二、色谱法分类1、按两相状态分类2、按操作形式分类3、按分离原理分类三、HPLC与其他方法的比较1. 色谱法与精馏、萃取分离比较2. 色谱法与光谱、质谱分析方法比较3. 高效液相色谱与经典色谱的比较4. 液相色谱与气相色谱的比较四、色谱法特点五、现代色谱法应用领域六、有关色谱主要期刊与书籍第二章色谱分析法的理论基础一、色谱流出曲线二、色谱图中的基本术语三、分配平衡四、色谱法的基本理论五、色谱法基本分离方程第三章色谱定性分析和定量分析一、定性分析二、定量分析高效液相色谱的知识第四章高效液相色谱仪第五章色谱分离系统一、液相色谱分离原理及分类(一)分离原理(二)高效液相色谱法的主要类型二、高效液相色谱的固定相1. 高效液相色谱固定相以承受高压能力来分类2.高效液相色谱固定相按孔隙深度分类3. 高效液相色谱固定相以化学组成来分类三、流动相1.对流动相溶剂的要求:2. 流动相及流动相的极性3. 流动相的组成四、色谱柱1. 色谱柱的构型2. 色谱柱寿命第六章液固色谱法和液液色谱法一、液一固吸附色谱法(LSAC)1.分离原理 2.固定相 3.流动相二、液一液分配色谱法(LLPC)1.分离原理 2.固定相 3.流动相第七章化学键合相色谱法一、化学键合固定相二、反相键合相色谱法三、正相键合相色谱法四、离子性键合相色谱法第八章离子交换和离子色谱法一、离子交换色谱法1.离子交换色谱原理2.固定相3.流动相二、离子色谱法1.离子色谱法原理2.离子色谱具有以下优点3.离子色谱装置类型4.离子色谱的应用第九章体积排阻色谱法高效液相色谱同时测定食品中的苯甲酸、山梨酸、糖精钠、维生素C高效液相色谱同时测定药品中的苯甲酸与水杨酸样品处理、条件优化及应用第十章色谱分析样品处理一、样品的采集二、常用样品制备技术(一)溶剂萃取***1. 液-液萃取液-液萃取新技术——液相微萃取2. 液-固萃取3. 液-气萃取(溶液吸收)4. 萃取溶剂的选择(二)蒸馏1. 简单蒸馏2. 分馏3. 减压蒸馏4. 水蒸气蒸馏(三)固相萃取***1. 固相萃取的模式及原理2. 固相萃取的常用吸附剂3. 固相萃取的装置及操作程序4. 固相萃取技术的应用(四)膜分离(五)衍生化技术*(六)其它样品制备技术*1. 超临界流体萃取2. 微波萃取技术第十一章衍生化技术及浓缩柱一、衍生化技术(一)按衍生化反应分类1.衍生化反应满足条件2. 按衍生化反应类别分类(二)按衍生化的方式分类1. 柱前衍生2. 柱后衍生二、浓缩柱第十二章高效液相色谱分离条件的优化及建立分析方法的一般步骤一、高效液相色谱分离条件的优化(一)高效液相色谱中色谱参数的相关性1. 色谱参数的分类2. 色谱参数的相关性(二)色谱分离条件优化标准的选择1. 难分离物质对的峰对分离优化标准2. 整体色谱图的优化标准二、建立HPLC分析方法的一般步骤(一)样品的性质及柱分离模式的选择1. 样品的溶解度2. 样品的分子量范围3. 样品的分子结构和分析特性(二)分离操作条件的选择1. 容量因子和死时间的测量2. 色谱柱操作参数的选择3. 样品组分保留值和容量因子的选择4. 相邻组分的选择性系数和分离度的选择第十三章高效液相色谱法的实验技术和分析应用一、高效液相色谱法的实验技术1. 溶剂的纯化技术2. 色谱柱的装填技术3. 色谱柱的平衡、保护与清洗、再生技术二、HPLC法的分析应用第十四章液相制备色谱。
高效液相色谱基础知识总结

(LC-MS),有效的弥补了色谱法定性分析特征性差的弱 点,成为最重要的分离分析方法之一, LC-MS在选择性、 灵敏度、分子量测定和提供结构信息方面具有明显的优 势,能够同时获得可靠的定性定量结果,因而被广泛应 用于药物的质量控制(杂质、副产物、降解产物等的鉴 定和测定)、药物在生物体内的吸收、分布和代谢研究 (包括代谢物的结构确定及定量)和临床医学研究(如 蛋白异常的研究)。 LC-MS已成为新药研究必不可少的 手段。20世纪70年代,高效液相色谱法崛起克服了
高效液相色谱基础知识总结
二、基本概念和术语
一、色谱图和峰参数 1、色谱图(chromatogram)--样品流经色谱柱和检测器, 所得到的信号-时间曲线,又称色谱流出曲线(elution profile)。 2、基线(base line)--经流动相冲洗,柱与流动相达到 平衡后,检测器测出一段时间的流出曲线。一般应平行 于时间轴。基线反映仪器及操作条件的恒定程度,主要 由流动相中的杂质等因素决定。
键合相色谱法是将类似于气相色谱中的固定液的液 体,通过化学反应键合到硅胶表面,从而形成固定相。
高效液相色谱基础知识总结
采用化学键合固定相的色谱法称为键合相色谱。若采用 极性键合相、非极性流动相,则称为正相色谱;采用非 极性键合相、极性流动相,则称为反相色谱。这种分离 的保留值大小,主要决定于组分分子与键合固定液分子 间作用力的大小。
高效液相色谱基础知识总结
气相色谱法不能直接用于分析难挥发、热不稳定及高分 子化合物等的弱点,大大扩大了色谱法的应用范围,把 色谱法推进到一个新水平。
高效液相色谱(high performance liquid chromatography, HPLC)是一种高效、快速的分离分析 技术,具有灵敏度高、选择性好的特点。HPLC具有的同 时分离和分析的功能对于体内药物分析和体内内源性物 质的分析及成分复杂的中药分析尤其重要。 HPLC的分离 功能还广泛用于药物的纯化和制备,如用制备色谱分离
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高效液相色谱(HPLC)基础知识我国药典收载高效液相色谱法项目和数量比较表:方法项目数量1985年版1990年版1995年版2000年版HPLC法鉴别9 34 150 检查12 40 160 含量测定7 60 117 387鉴于HPLC应用在药品分析中越来越多,因此每一个药品分析人员应该掌握并应用HPLC。
I.概论一、液相色谱理论发展简况色谱法的分离原理是:溶于流动相(mobile phase)中的各组分经过固定相时,由于与固定相(stationary phase)发生作用(吸附、分配、离子吸引、排阻、亲和)的大小、强弱不同,在固定相中滞留时间不同,从而先后从固定相中流出。
又称为色层法、层析法。
色谱法最早是由俄国植物学家茨维特(Tswett)在1906年研究用碳酸钙分离植物色素时发现的,色谱法(Chromatography)因之得名。
后来在此基础上发展出纸色谱法、薄层色谱法、气相色谱法、液相色谱法。
液相色谱法开始阶段是用大直径的玻璃管柱在室温和常压下用液位差输送流动相,称为经典液相色谱法,此方法柱效低、时间长(常有几个小时)。
高效液相色谱法(High performance Liquid Chromatography,HPLC)是在经典液相色谱法的基础上,于60年代后期引入了气相色谱理论而迅速发展起来的。
它与经典液相色谱法的区别是填料颗粒小而均匀,小颗粒具有高柱效,但会引起高阻力,需用高压输送流动相,故又称高压液相色谱法(High Pressure Liquid Chromatography,HPLC)。
又因分析速度快而称为高速液相色谱法(High Speed Liquid Chromatography,HSLP)。
也称现代液相色谱。
二、HPLC的特点和优点HPLC有以下特点:高压——压力可达150~300 Kg/cm2。
色谱柱每米降压为75 Kg/cm2以上。
高速——流速为0.1~10.0 ml/min。
高效——可达5000塔板每米。
在一根柱中同时分离成份可达100种。
高灵敏度——紫外检测器灵敏度可达0.01ng。
同时消耗样品少。
HPLC与经典液相色谱相比有以下优点:速度快——通常分析一个样品在15~30 min,有些样品甚至在 5min内即可完成。
分辨率高——可选择固定相和流动相以达到最佳分离效果。
灵敏度高——紫外检测器可达0.01ng,荧光和电化学检测器可达0.1pg。
柱子可反复使用——用一根色谱柱可分离不同的化合物。
样品量少,容易回收——样品经过色谱柱后不被破坏,可以收集单一组分或做制备。
三、色谱法分类按两相的物理状态可分为:气相色谱法(GC)和液相色谱法(LC)。
气相色谱法适用于分离挥发性化合物。
GC根据固定相不同又可分为气固色谱法(GSC)和气液色谱法(GLC),其中以GLC应用最广。
液相色谱法适用于分离低挥发性或非挥发性、热稳定性差的物质。
LC同样可分为液固色谱法(LSC)和液液色谱法(LLC)。
此外还有超临界流体色谱法(SFC),它以超临界流体(界于气体和液体之间的一种物相)为流动相(常用CO2),因其扩散系数大,能很快达到平衡,故分析时间短,特别适用于手性化合物的拆分。
按原理分为吸附色谱法(AC)、分配色谱法(DC)、离子交换色谱法(IEC)、排阻色谱法(EC,又称分子筛、凝胶过滤(GFC)、凝胶渗透色谱法(GPC)和亲和色谱法。
(此外还有电泳。
)按操作形式可分为纸色谱法(PC)、薄层色谱法(TLC)、柱色谱法。
四、色谱分离原理高效液相色谱法按分离机制的不同分为液固吸附色谱法、液液分配色谱法(正相与反相)、离子交换色谱法、离子对色谱法及分子排阻色谱法。
1.液固色谱法使用固体吸附剂,被分离组分在色谱柱上分离原理是根据固定相对组分吸附力大小不同而分离。
分离过程是一个吸附-解吸附的平衡过程。
常用的吸附剂为硅胶或氧化铝,粒度5~10μm。
适用于分离分子量200~1000的组分,大多数用于非离子型化合物,离子型化合物易产生拖尾。
常用于分离同分异构体。
2.液液色谱法使用将特定的液态物质涂于担体表面,或化学键合于担体表面而形成的固定相,分离原理是根据被分离的组分在流动相和固定相中溶解度不同而分离。
分离过程是一个分配平衡过程。
涂布式固定相应具有良好的惰性;流动相必须预先用固定相饱和,以减少固定相从担体表面流失;温度的变化和不同批号流动相的区别常引起柱子的变化;另外在流动相中存在的固定相也使样品的分离和收集复杂化。
由于涂布式固定相很难避免固定液流失,现在已很少采用。
现在多采用的是化学键合固定相,如C18、C8、氨基柱、氰基柱和苯基柱。
液液色谱法按固定相和流动相的极性不同可分为正相色谱法(NPC)和反相色谱法(RPC)。
正相色谱法采用极性固定相(如聚乙二醇、氨基与腈基键合相);流动相为相对非极性的疏水性溶剂(烷烃类如正已烷、环已烷),常加入乙醇、异丙醇、四氢呋喃、三氯甲烷等以调节组分的保留时间。
常用于分离中等极性和极性较强的化合物(如酚类、胺类、羰基类及氨基酸类等)。
反相色谱法一般用非极性固定相(如C18、C8);流动相为水或缓冲液,常加入甲醇、乙腈、异丙醇、丙酮、四氢呋喃等与水互溶的有机溶剂以调节保留时间。
适用于分离非极性和极性较弱的化合物。
RPC在现代液相色谱中应用最为广泛,据统计,它占整个HPLC应用的80%左右。
随着柱填料的快速发展,反相色谱法的应用范围逐渐扩大,现已应用于某些无机样品或易解离样品的分析。
为控制样品在分析过程的解离,常用缓冲液控制流动相的pH值。
但需要注意的是,C18和C8使用的pH值通常为2.5~7.5(2~8),太高的pH值会使硅胶溶解,太低的pH值会使键合的烷基脱落。
有报告新商品柱可在pH 1.5~10范围操作。
正相色谱法与反相色谱法比较表正相色谱法反相色谱法固定相极性高~中中~低流动相极性低~中中~高组分洗脱次序极性小先洗出极性大先洗出从上表可看出,当极性为中等时正相色谱法与反相色谱法没有明显的界线(如氨基键合固定相)。
3.离子交换色谱法固定相是离子交换树脂,常用苯乙烯与二乙烯交联形成的聚合物骨架,在表面未端芳环上接上羧基、磺酸基(称阳离子交换树脂)或季氨基(阴离子交换树脂)。
被分离组分在色谱柱上分离原理是树脂上可电离离子与流动相中具有相同电荷的离子及被测组分的离子进行可逆交换,根据各离子与离子交换基团具有不同的电荷吸引力而分离。
缓冲液常用作离子交换色谱的流动相。
被分离组分在离子交换柱中的保留时间除跟组分离子与树脂上的离子交换基团作用强弱有关外,它还受流动相的pH值和离子强度影响。
pH值可改变化合物的解离程度,进而影响其与固定相的作用。
流动相的盐浓度大,则离子强度高,不利于样品的解离,导致样品较快流出。
离子交换色谱法主要用于分析有机酸、氨基酸、多肽及核酸。
4.离子对色谱法又称偶离子色谱法,是液液色谱法的分支。
它是根据被测组分离子与离子对试剂离子形成中性的离子对化合物后,在非极性固定相中溶解度增大,从而使其分离效果改善。
主要用于分析离子强度大的酸碱物质。
分析碱性物质常用的离子对试剂为烷基磺酸盐,如戊烷磺酸钠、辛烷磺酸钠等。
另外高氯酸、三氟乙酸也可与多种碱性样品形成很强的离子对。
分析酸性物质常用四丁基季铵盐,如四丁基溴化铵、四丁基铵磷酸盐。
离子对色谱法常用ODS柱(即C18),流动相为甲醇-水或乙腈-水,水中加入3~10 mmol/L的离子对试剂,在一定的pH值范围内进行分离。
被测组分保时间与离子对性质、浓度、流动相组成及其pH 值、离子强度有关。
5.排阻色谱法固定相是有一定孔径的多孔性填料,流动相是可以溶解样品的溶剂。
小分子量的化合物可以进入孔中,滞留时间长;大分子量的化合物不能进入孔中,直接随流动相流出。
它利用分子筛对分子量大小不同的各组分排阻能力的差异而完成分离。
常用于分离高分子化合物,如组织提取物、多肽、蛋白质、核酸等。
II.基本概念和理论一、基本概念和术语1.色谱图和峰参数色谱图(chromatogram)——样品流经色谱柱和检测器,所得到的信号-时间曲线,又称色谱流出曲线(elution profile)。
基线(base line)——经流动相冲洗,柱与流动相达到平衡后,检测器测出一段时间的流出曲线。
一般应平行于时间轴。
噪音(noise)——基线信号的波动。
通常因电源接触不良或瞬时过载、检测器不稳定、流动相含有气泡或色谱柱被污染所致。
漂移(drift)——基线随时间的缓缓变化。
主要由于操作条件如电压、温度、流动相及流量的不稳定所引起,柱内的污染物或固定相不断被洗脱下来也会产生漂移。
色谱峰(peak)——组分流经检测器时响应的连续信号产生的曲线。
流出曲线上的突起部分。
正常色谱峰近似于对称形正态分布曲线(高斯Gauss曲线)。
不对称色谱峰有两种:前延峰(leading peak)和拖尾峰(tailing peak)。
前者少见。
拖尾因子(tailing factor,T)——T=,用以衡量色谱峰的对称性。
也称为对称因子(symmetry factor)或不对称因子(asymmetry factor)。
《中国药典》规定T应为0.95~1.05。
T<0.95为前延峰,T>1.05为拖尾峰。
峰底——基线上峰的起点至终点的距离。
峰高(peak height,h)——峰的最高点至峰底的距离。
峰宽(peak width,W)——峰两侧拐点处所作两条切线与基线的两个交点间的距离。
W=4σ半峰宽(peak width at half-height,W h/2)——峰高一半处的峰宽。
W h/2=2.355σ标准偏差(standard deviation,σ)——正态分布曲线x=±1时(拐点)的峰宽之半。
正常峰的拐点在峰高的0.607倍处。
标准偏差的大小说明组分在流出色谱柱过程中的分散程度。
σ小,分散程度小、极点浓度高、峰形瘦、柱效高;反之,σ大,峰形胖、柱效低。
峰面积(peak area,A)——峰与峰底所包围的面积。
A=×σ×h=2.507 σh=1.064 W h/2 h2.定性参数(保留值)死时间(dead time,t0)——不保留组分的保留时间。
即流动相(溶剂)通过色谱柱的时间。
在反相HPLC中可用苯磺酸钠来测定死时间。
死体积(dead volume,V0)——由进样器进样口到检测器流动池未被固定相所占据的空间。
它包括4部分:进样器至色谱柱管路体积、柱内固定相颗粒间隙(被流动相占据,V m)、柱出口管路体积、检测器流动池体积。
其中只有V m参与色谱平衡过程,其它3部分只起峰扩展作用。
为防止峰扩展,这3部分体积应尽量减小。
V0=F×t0(F为流速)保留时间(retention time,t R)——从进样开始到某个组分在柱后出现浓度极大值的时间。
