第8章醚和环氧化合物
第十章 醚和环氧化合物

H CH3 HO
OCH 3 H H
不对称的取代环氧乙烷,在碱性条件下,是按SN2机制进 行的。亲核试剂主要进攻含取代基较少(空间位阻小)的碳 原子。立体化学:反式开环。
H2O, H + CH3OH, H + OH
HO CH2 CH2 OH CH3O CH2 CH2 OH O CH2 CH2 OH
OH
200 C
o
14
OH
CH2CH=CH2
200oC
14
CH2CH=CH2
克莱森重排机理(P373)
• Claisen 重排是个协同反应,中间经过一个环状 过渡态,所以芳环上取代基的电子效应对重排无 影响。
• 邻位已被取代基占据,无法发生互变异构,接着 又发生一次[3,3]σ迁移到对位,然后经互变异构 得到对位烯丙基酚。
• (CH3)2COCH3 + O2
优先形成稳 定的自由基。
(CH3)2COCH3 OO •
(CH3)2COCH3 + (CH3)2CHOCH3 OO • • (CH3)2COCH3 + (CH3)2COCH3 OOH
关键中间体
第七节 冠醚 含有多个氧的大环醚
15 16 17 14 18 O 13 O1 2 O 12 11 O 10 9 O 8 7 6 O4 3 5
应用实例:
• Claisen 重排具有普遍性,在醚类化合物中,如 果存在烯丙氧基与碳碳双键相连的结构,就有可 能发生Claisen 重排。
四 自动氧化(过氧化物的生成)
1 定义:
化学物质和空气中的氧在常温下温和地进行氧化, 而不发生燃烧和爆炸,这种反应称为自动氧化。
第八章醚和环氧化合物(etherandepoxides)

第一节醚(ether)一、醚的结构、分类与命名二、醚的物理性质三、醚的化学性质四、冠醚五、硫醚混醚对于 Ar—O—R 型芳香醚,芳香烃基名称在前,脂肪烃基名称在后。
苯甲醚多元醚首先写出多元醇的名称,再写出另一部分烃基的数目和名称,最后写 “醚”字。
CH3OCH2CH2O CH3乙二醇二甲醚CH3OCH2CH2O CH2CH3乙二醇甲乙醚较复杂的醚以较大的烷基、不饱和烃基或芳香烃基所对应的烃作为母体,另一烃基与氧组成的烃氧基作为取代基。
HOCH2CH2OCH2CH3 2-甲氧基戊烷2-乙氧基乙醇环醚多用俗名;或按杂环化合物命名的方法命名。
(1)命名或写结构式(2)(3)CH 3CHCHCH 2CH 2CH 3OC 2H 5CH 32-甲基-3-乙氧基己烷CH 3CH 2OCH(CH 3)2O 乙基异丙基醚苯基环丙基醚一些常见醚的物理性质0.994158.3-37.3苯甲醚35CH 2═CHOCH ═CH 2二乙烯基醚0.769141-97.9(CH 3CH 2CH 2CH 2)2O 正丁醚0.72568-86(CH 3)2CHOCH(CH 3)2异丙醚0.73690.5-122(CH 3CH 2CH 2)2O 正丙醚0.71434.6-116CH 3CH 2OCH 2CH 3乙醚0.69710.8CH 3OCH 2CH 3甲乙醚0.661-24.9-138CH 3OCH 3甲醚密度/(g·cm -3)沸点/℃熔点/℃结构式化合物(续表)0.86383-68CH 3OCH 2CH 2OCH 3乙二醇二甲醚1.033101111,4-二氧六环0.88865.4-108四氢呋喃0.88211环氧乙烷 1.07425927二苯醚密度/(g·cm -3)沸点/℃熔点/℃结构式化合物三、醚的化学性质RCH 2 -O-CH 2R●●1、 盐的生成2、醚键的断裂3、过氧化物的生成H +(一) 盐的生成醚分子中氧原子上的孤对电子能接受质子而生成 盐。
有机化学(北大版)第8章醇酚醚(习题)

(1)间苯三酚
3SO3 HO3S
SO3H NaOH
SO3H
NaOH
熔融 NaO
ONa H3O
ONa HO
OH OH
(2)4-乙基-1,3-苯二酚
NaOH
C2H5 SO3Na NaOH 熔融
SO3Na
C2H5 ONa
H3O
ONa
C2H5 OH
OH
(3)4-乙基-2-溴苯酚
SO3H
H2SO4
NaOH NaOH 熔融
C2H5Br AlCl3
OH
Br2 CCl4
OH Br
ONa H3O
C2H5 (4)4-硝基-2-羟基苯甲酸
C2H5
CH3 HNO3 H2SO4
CH3
CH3
发烟H2SO4
SO3H KMnO4
NO2 COONa
NaOH NaOH 熔融
ONa
NO2 H3O
COOH OH
OH
COOH SO3H
NO2
NO2
(2)
CH2CHCH3 H ?
OH
(3)
CH2CHCH(CH3)2 H ?
(4) CH3CH OH
OH CHCH3 Al2O3
OH
(5) OH
H2SO4 ? NaOH ? C2H5I ?
160℃
熔融
(6)
H2SO4 ? Br2 ? 稀 H2SO4 ?
NaOH
?
100℃
AlCl3
CH2 CHCH2Cl
OH
(A)
(B)
(C)
(D)
(E)
(F)
CH3
Cl
C2H5
OCH3
醚和环氧化合物

OR
H3C
HO HO H
NHR H3C
OH OR NHR
11
醚的制备
• 1.醇的脱水——简单醚
• 2.醇钠与卤代烷反应(Williamson反应)——混醚,
SN2历程
CH3
+ H3C C OK H3C
Br CH3
CH3 C2H5 H3C C O
CH3
ONa I
+
CH3 CH3COCH3 56oC
OCH 3
OH+ C2H5
- H+
CH3
HO CH3 OH+ C6H5
- H+
HO CH3
OH OC 2H5
CH3 OC 6H5
CH3
OH
10
环氧化合物(碱催化)
1. H3C 2. H3C 3. H3C
HO- O-
O H3C
R O- O-
O H3C
ORNH 2
O H3C
HO HO H
OH
H3C
HO HO H
第八章 醚和环氧化合物
醚(ROR)——
醇或酚的羟基中氢原子被烃基取代后生成的 化合物
环氧化合物——
含三元环的醚及其衍生物。 官能团:醚键(C—O—C)
1
8.1 醚
• 8.1.1 分类和命名
单醚
直链醚 混醚
• 分类(醚键是否成环)
芳香醚
• 命名
环醚:四氢呋喃(THF, ) O
普通命名——简单的,烃基后加醚
CH3 1,2-二甲氧基乙烷
OCH 3
1-(对甲氧基)苯基丙烯
14
环醚命名
• 环醚通常用习惯命名
O
有机化学第8章第三节醚2013
二巯基丙醇(BAL)
CH2 CH CH2 SH SH SO3Na
二巯基丙磺酸钠
HS HC CO2Na HS HC CO2Na
二巯基丁二酸钠
上述解毒剂与金属离子的亲和力较强,它们不仅能 与进入体内的重金属离子结合成不易解离的无毒配合物 由尿排出体外,以保护酶系统,而且还能夺取已经与酶 结合的重金属离子,使酶的活性恢复,从而达到解毒的 目的。但若酶的巯基与重金属离子结合过久,酶的活性 则难以恢复,故重金属中毒需尽早用药抢救。
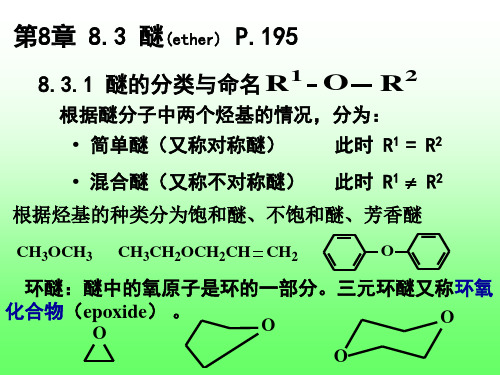
第8章 8.3 醚(ether) P.195
1 O R 8.3.1 醚的分类与命名
R2
根据醚分子中两个烃基的情况,分为:
• 简单醚(又称对称醚) 此时 R1 = R2
• 混合醚(又称不对称醚)
此时 R1 R2
根据烃基的种类分为饱和醚、不饱和醚、芳香醚
CH3OCH3 CH3CH2OCH2CH CH2 O
CH3CH2OCH2CH3 + O2
CH3CHOCH2CH3 O OH
形成的过氧化物遇热容易爆炸,所以储存时间长的醚在 使用前必须进行检查,若会使湿的KI-淀粉试纸变蓝或使 FeSO4-KCNS 混合液变红,则表明醚中含有过氧化物。 加铁粉或用FeSO4水溶液洗涤,可破坏其中的过氧化物。
8.3.3 醚的制备
1)酸性
RSH + NaOH
RSNa + H2O
C2H5SH > H2O >C2H5OH pKa 10.5 15.7 15.9
2).与重金属作用
与无机硫化物类似,硫醇可与 Pb、 Hg 、Cd、 Ag 、Cu 等重金属盐或氧化物作用生成不溶于水 的硫醇盐。
第八章 开环聚合

d[N] k tr,M [C][M] dt
两式相除,得:
k tr,M CM d[N] d[M] k p k tr,M 1 C M
(8-5)
其中CM为向单体转移常数。
19
将式上式积分,得:
CM [N] [N]0 ([M]0 [M]) (8-6) 1 CM
2
开环聚合的推动力是环张力的释放。从机理上分 析,大部分开环聚合属于连锁机理的离子聚合,小部分 属于逐步聚合。 可以进行开环聚合单体包括环醚、环缩醛、环 酯、环酰胺、环硅烷等。 环氧乙烷、环氧丙烷、己内酰胺、三聚甲醛等的开 环聚合都是重要的工业化开环聚合反应。
3
8.1 环烷烃开环聚合热力学
环的大小(元数)、构成环的元素(碳环或杂环)、环上 的取代基等对开环的难易都有影响。 有的环状化合物难以开环,如γ—丁氧内酯、六元环醚等; 有的聚合过程中环状单体和聚合物之间存在平衡,如己内 酰胺。 此外,双官能度单体线性缩聚还有环化倾向。 这些现象都取决于环和线性结构的相对稳定性,属于热力 学因素。
以OP-10 [C8H17C6H4O(EO)10H]为例,辛基酚起始剂提供端 基分子量为189,10单元的环氧乙烷分子量440,属于低聚 物,端基不能忽略。
16
RX(EO)nH
改变疏水基R、连接元素X、环氧烷烃种类及聚合度n,可衍生 出上万种聚醚产品。起始剂有脂肪醇、烷基酚、脂肪酸、胺类 等,可形成多种聚醚型表面活性剂。
21
8.4 环醚的阳离子开环聚合
1)丁氧环(四元环醚) 在0℃或较低温度下,丁氧环经Lewis酸引发,易开环聚 合成聚氧化三亚甲基。但有应用价值的单体却是3,3’-二氯 亚甲基丁氧环(丁氧环的衍生物,聚合产物俗称氯化聚 醚),机械强度比氟树脂好,可用作工程塑料。
第8章 醚和环氧化合物

HCl
O
H+,CH3OH
(2)、 (2)、碱催化开环反应
碱性条件下与NaOH、RONa、ArONa、 强亲核试剂反应 碱性条件下与NaOH、RONa、ArONa、NH3等强亲核试剂反应 条件下与NaOH
OH- , H2O
CH2 OH CH2 OH CH2 OH
CH2 OH CH2 NH2 CH2 OCH3
3-甲氧基戊烷 甲氧基戊烷 3-methoxypentane
HOCH2CH2OCH2CH3
2-乙氧基乙醇 乙氧基乙醇 2-ethoxyethanol
3.环醚 3.环醚
命名常采用俗名,没有俗名的称为环氧某烷, 命名常采用俗名,没有俗名的称为环氧某烷, 或看成杂环 的衍生物。 的衍生物。
O
四氢呋喃
(tetrahydrofuran
酸性条件下亲核试 剂进攻点
主要受电子效应控制
H3C H3C C O
H C H
碱性条件下亲核 试剂进攻点
主要受立体因素控制
本 章 要 点
1. 醚的结构 2. 醚的分类 3. 醚的命名 4. 醚的性质 醚键中氧为 sp3 杂化 脂肪醚, 芳香醚; 单醚, 脂肪醚, 芳香醚; 单醚, 混醚 基醚” 某烃氧基某烃” “A基B基醚”;“某烃氧基某烃” 形成 ;醚键断裂;形成过氧化物 醚键断裂; 氧化某烯” 环氧乙烷” “氧化某烯”;“环氧乙烷”
C2H5 O C2H5
H+
C2H5
O H
IC2H5 SN2
CH3CH2 I-
O C2H5 H
SN2过渡态 过
对于SN2历程若被亲核试剂进攻的碳 对于SN2历程若被亲核试剂进攻的碳 SN2历程若被亲核试剂进攻的 有手性, 则生成的卤代烃构型翻转 构型翻转. 有手性, 则生成的卤代烃构型翻转.
第8章 醚
C O C
H
+
C
C O H+
Nu
C OH
C
O H C H 3C H 2
O
H
H
H
OH
H C H 3C H 2
Cl
C H 3C H 2
Cl
19
第八章 醚和环氧化合物
第二节 环氧化合物 (二、开环反应)
(二) 碱催化开环反应
环氧化合物在强碱作用下, 环 被打开,生成相应的加成产物。
O H , H 2O H 2C CH2 乙二醇
配合物 K+ [18-冠-6]
12
第八章 醚和环氧化合物
第二节 环氧化合物
第二节 环氧化合物
一、环氧化合物的结构与命名
环氧化合物(epoxides)是指含有三元环的醚及其衍生物。
O H 2C CH2
~105º
O
O
61.6º
C
59.2o
149pm
C
13
第八章 醚和环氧化合物
第二节 环氧化合物 (一、结构与命名)
1. 环氧化合物的普通命名法是根据相应的烯烃 称为“氧化某烯”。氧化乙烯又称为环氧乙烷。
O H 2C CH2
H 2C O CHCH3
H 2C O C
CH3 CH3
氧化乙烯 (环氧乙烷) (ethylene oxide)
氧化丙烯 氧化异丁烯 (propylene oxide) (isobutylene oxide)
21
第八章 醚和环氧化合物
第二节 环氧化合物 (三、开环反应机制)
碱催化开环反应机制
碱催化的开环反应, 是亲核试剂直接进攻环氧 化合物本身, 而不是先生成质子化环氧化合物, 因 此开环需要在强碱条件下或强亲核试剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
1
O H3CHC CHCH3
3 2
O H2C CHCH2CH3
3 2
2,3-二甲基环氧乙烷 二甲基环氧乙烷
2-乙基环氧乙烷 乙基环氧乙烷
1
O CH 3 H2C C 3 2 CH2CH3
2-甲基 乙基环氧乙烷 甲基-2-乙基环氧乙烷 甲基
二、环氧化合物的开环反应 醚较稳定, 醚较稳定,环氧化合物由于三元环张力较大 易开环,具有高度活泼性。在酸碱催化下,易与 易开环,具有高度活泼性。在酸碱催化下, 许多试剂作用,发生开环反应。 许多试剂作用,发生开环反应。 (一)酸催化开环反应 环氧化合物与其它醚一样,在酸存在下先质 环氧化合物与其它醚一样, 子化。然后亲核试剂去进攻环氧碳原子, 环氧碳原子 子化。然后亲核试剂去进攻环氧碳原子,使环破 裂,得到相应的产物。 得到相应的产物。
芳香醚断裂,则生成酚和卤代烷。 芳香醚断裂,则生成酚和卤代烷。如:
57%HI 120~130℃ ℃
O CH 3
OH
+ CH3 I
两个烃基都是芳香基, 两个烃基都是芳香基,则不易发生醚键的 断裂。环醚与氢卤酸作用,醚键断裂生成双官 断裂。环醚与氢卤酸作用, 能团化合物 。
O
HI HOCH 2CH2 CH 2 CH 2I
醚较稳定,其稳定性仅次于烷烃。 醚较稳定,其稳定性仅次于烷烃。醚不能与 强碱、稀酸、氧化剂、还原剂或活泼金属反应。 强碱、稀酸、氧化剂、还原剂或活泼金属反应。 在一定条件下可发生反应,反应与醚氧原子上的 在一定条件下可发生反应, 孤电子对有关。 孤电子对有关。 (一)醚的质子化: 醚的质子化:
CH 3CH2 O CH 2CH 3 + H 2SO4
C O C
,醚键中
的氧为sp 不等性杂化 键角约为110 杂化, 110° 的氧为 3不等性杂化,键角约为110°。
.
.. ..
O
136pm
CH3
142pm
H3C
112 °
121
O 142pm CH3 o
(二)醚的分类 根据分子中烃基的结构,醚可分为脂肪醚 脂肪醚和 根据分子中烃基的结构,醚可分为脂肪醚和 芳香醚。 芳香醚。如:
(三) 过氧化物的生成 三 烷基醚在空气中久置, 碳上的氢可被氧化 碳上的氢可被氧化, 烷基醚在空气中久置,α-碳上的氢可被氧化 生成醚的过氧化物。 生成醚的过氧化物。
CH3CH2 O CH2CH3 + O2 CH3CH2 O CHCH3 O O H
乙醚
过氧化乙醚
过氧化醚受热易分解爆炸, 过氧化醚受热易分解爆炸,蒸馏醚时应避免蒸干 过氧化醚的检验:酸性碘化钾 淀粉试纸 过氧化醚的检验:酸性碘化钾-淀粉试纸
O
H2 C C CH3 H + HCl HOCH2CHCH3 Cl + ClCH2CHCH3 OH
2-甲基环氧乙烷 甲基环氧乙烷 (二)碱催化开环反应
(90%)
(10%)
环氧化合物在强碱或强亲核试剂作用下, 环氧化合物在强碱或强亲核试剂作用下 , 环 被打开,生成相应的加成产物。 被打开,生成相应的加成产物。如:
C C O
环氧化合物的环 (二)环氧化合物的命名 1.普通命名法 环氧化合物的普通命名法是根据相应的烯烃称 氧化某烯” 为“氧化某烯”。最简单的环氧化合物是氧化乙烯 又称为环氧乙烷。例如: 又称为环氧乙烷。例如: 环氧乙烷
O H2C CH2
氧化乙烯 环氧乙烷) (环氧乙烷)
O H2C CHCH3
CH3ONa O H2C CHCH3 + CH3OH
CH3OCH2CHCH3 OH
1-甲氧基 丙醇 甲氧基-2-丙醇 甲氧基 (三)环氧化合物开环反应机制 1. 酸催化开环反应机制 环氧化合物的酸催化开环反应是属于S 反应。 环氧化合物的酸催化开环反应是属于SN反应。 环氧化合物在酸性条件下, 环氧化合物在酸性条件下,环氧化合物首先质子 质子化环氧化合物, 化生成质子化环氧化合物 化生成质子化环氧化合物,然后亲核试剂进攻质 子化环氧化合物中的环氧碳原子 环氧碳原子, 子化环氧化合物中的环氧碳原子,质子化环氧化 合物迅速开环生成产物。 合物迅速开环生成产物。如:
H
R-O-R’ 醚
H
H H
O
环氧化合物
第一节 醚(Ethers) )
一、醚的结构和命名
(一)醚的结构
R O R'
sp3杂化 醚与醇、水相似,其分子中氧原子也是sp3 与醇、水相似, 分子中氧原子也是 不等性杂化 杂化。 不等性杂化。
醚的通式为R-O-R(R’)、Ar-O-R或Ar-O的通式为 、 或 Ar(Ar’)。醚的官能团为醚键 。
H+
C C O
C C O+ H
H
:Nu
Nu C C OH
质子化环氧化合物
O H R H
+
O H
δ+
OH H R Nu
R
弱亲核试剂) Nu (弱亲核试剂)
H O H H3C H+ O δ H H3C
+
OH H R Cl
Cl
2. 碱催化开环反应机制 环氧化合物的碱催化开环反应是属于S 环氧化合物的碱催化开环反应是属于SN2反 碱催化开环反应, 应。 碱催化开环反应, 是亲核试剂直接进攻环氧 化合物的本身, 而不是先生成质子化环氧化合物, 化合物的本身, 而不是先生成质子化环氧化合物, 因此开环需要在强碱条件下或强亲核试剂。 因此开环需要在强碱条件下或强亲核试剂。如:
CH3 H3 C C O CH 2CH3 CH3
O
CH 3
HI
CH3 CHCH 2 CH 3
CH3 H3 C C I CH3
OH + CH 3I
HI
+ CH 3 CH 2OH
醚键断裂机理(亲核取代反应机理) 醚键断裂机理(亲核取代反应机理)
CH3 I H
SN2 机理(伯烷基醚) 机理(伯烷基醚)
CH3 O CH3 I
O O
Li
+
O
+
O O
O O
O O
O K+ O O
O MnO4 O
Na
O
KMnO4 18-Crown-6 室温, 快
COOH COOH ~100% %
第二节
环氧化合物( 环氧化合物(Epoxides) )
一、环氧化合物的结构与命名
(一)结构 环氧化合物是指含有三元环的醚及其衍生物。 环氧化合物是指含有三元环的醚及其衍生物。
氧化丙烯
O CH 3 H2C C CH3
氧化异丁烯
2.系统命名法 2.系统命名法 环氧化合物的系统命名法通常将母体命名为 “环氧乙烷”,三元环中氧原子编号为1,将取 环氧乙烷” 三元环中氧原子编号为1 代基的位次、个数及名称写在“环氧乙烷” 前面。 代基的位次、个数及名称写在“环氧乙烷” 前面。 如:
CH 3 O CH3 O CH 3 O
脂肪醚
芳香醚
根据两个烃基是否相同或分子形状, 根据两个烃基是否相同或分子形状,又可分 简单醚(单醚) 混合醚(混醚) 环醚。 为简单醚(单醚)、混合醚(混醚)和环醚。
CH3 CH 2
O
CH2 CH 3
H 3 C O CH2 CH 3 O
单醚 (三)醚的命名
混醚
第八章 醚和环氧化合物 (Ethers and Epoxides) 学习要求: 学习要求:
1.掌握醚的结构、命名和化学性质。 1.掌握醚的结构、命名和化学性质。 掌握醚的结构 2.掌握环氧化合物的结构、命名和化学性质。 2.掌握环氧化合物的结构、命名和化学性质。 掌握环氧化合物的结构 醚 (ethers) 是两个烃基通过氧原子连接起来 的化合物。环氧化合物 多指含有三元 的化合物。环氧化合物(epoxides)多指含有三元 多指含有 及其衍生物。 环的醚及其衍生物 环的醚及其衍生物。
CH3 CH3 CH3 CH3 O H C CH3 I CH3 I OH + CH3 C CH3 CH3
CH3 H CH3 O H CH3 H
SN2
CH3 CH3 I + HO CH3 H
SN1 机理
CH3 CH3 I H O C CH3
SN1
SN1,中间体 , 稳定性为主
CH3 I C CH3
CH3
CH 3 O CH3 + HI CH3I + CH3OH HI
CH3I + H2O
混合醚与氢卤酸作用时, 一般是较小的烷基 混合醚与氢卤酸作用时 , 生成卤代烷, 当氧原子上连有叔烷基时, 生成卤代烷 , 当氧原子上连有叔烷基时 , 则主要 生成叔卤代烷。 生成叔卤代烷。
CH3 CHCH 2 CH 3
C2H5OC2H5 冷浓 SO 冷浓H2 4 n-C5H12
乙醚溶解, 乙醚溶解,呈一相 戊烷不溶解, 戊烷不溶解,分层
(二)醚键的断裂
醚键在中性、碱性或弱 醚键在中性、
酸性条件下不会断裂。醚在浓HX存在下加热,醚 存在下加热, 酸性条件下不会断裂。醚在浓HX存在下加热 键断裂,生成醇和卤代烷,生成的醇可进一步与 键断裂,生成醇和卤代烷, 过量的氢卤酸反应。 过量的氢卤酸反应。 氢卤酸使醚链断裂能力:HI>HBr>>HCl 氢卤酸使醚链断裂能力:
O O
O O
O O O O O O
O O O O O O
12-冠-4 冠 (12-crown-4)
18-冠-6 (18-crown-6) 冠
冠醚分子当中有一个空穴。只有与此空穴大小 冠醚分子当中有一个空穴。只有与此空穴大小 空穴 空穴 适合的M 才能进入空穴内 空穴内, 适合的Mn+才能进入空穴内,从而对金属离子具有 较高的络合选择性 络合选择性。 18只可与K 络合。 较高的络合选择性。例如 18-冠-6 只可与K+络合。 可用来分离及测定某些金属离子。 因此冠醚 可用来分离及测定某些金属离子。 冠醚对金属离子的络合 相转移催化剂
