生物工程与下游技术知识点整理
生物工程下游技术

d. 对于含有半胱氨酸的蛋白,在增溶时应 加入还原剂(如DTT、GSH、β-ME)打开蛋 白质中所有二硫键,对于没有二硫键的目 标蛋白有时也应使用还原剂,因为含二硫 键的杂蛋白会影响包涵体的溶解。 e. 同时还应加入金属螯合剂,如EDTA或 EGTA,用来螯合Cu2+、Fe3+等金属离子以 防止其与还原状态的巯基发生氧化反应。
优点: ① 一定的选择性; ② 细胞外形完整,核酸释放少,有利于进一 步分离过程 缺点:(只能用于实验室) ① 产物抑制造成效率低下; ② 溶酶价格高; ③ 通用性差, 不易确定最佳条件;
6、微波加热法
• 机理:微波加热导致细胞内极
性物质,尤其是水分子吸收微波 能,产生大量热量,使胞内温度 迅速上升,液态水汽化产生的压 力将细胞膜和细胞壁冲裂,形成 微小孔洞,进一步加热可导致细 胞内部和细胞壁水分减少,细胞 收缩,表面出现裂纹。
缺点:复性活性回收率低,而且难与杂蛋白分
离。稀释法大大增加溶液体积,不利于后续的
分离纯化,且处理量太大,不利于工业放大 ;
透析法耗时长,易形成无活性蛋白质聚集体; 超滤法在膜上聚集变性,易造成膜污染。
2、高蛋白浓度下的复性方法:
(一个成功的复性过程在于能够在高蛋白浓度下仍
能得到较高的复性率。)
①缓慢地连续或不连续地将变性蛋白加入到 复性缓冲液中,使得蛋白质在加入过程中或 加入阶段之间有足够的时间进行折叠复性。 因为完全折叠的蛋白通常不会与正在折叠 的蛋白一起聚集。
团状、丝状真菌、 几乎所有的微生物 较小革兰阳性菌不 细胞,包括含有包 宜,包含体不宜 含体的基因工程菌 的破壁
X-Press挤压机,把浓缩的细胞悬液冷却 至-25~-30℃,形成冰晶,用500MPa以上
生物工程下游技术

生物工程下游技术生物工程下游技术生物工程下游技术的定义指从动植物与微生物的有机体或器官、生物工程产物(发酵液、培养液)及其生物化学产品中提取、分离、纯化有用物质的技术过程。
实质:是研究如何从混合物中把一种或几种物质分离出来的科学技术。
1.生化工程分离技术预处理结晶干燥离心法:离心过滤、离心沉降、超离心萃取法:有机溶剂、双水相、液膜、反胶团、超临界层析法:凝胶过滤层析、反相层析、亲和、疏水相互作用、聚焦、离子交换膜分离:微滤、超滤、反渗透、透析、电渗透2.生物物质常用的分离技术氨基酸:结晶和离子交换法蛋白质和多肽:离子交换层析、电泳糖类:吸附层析脂质:有机溶剂萃取、超临界流体萃取和层析抗生素:有机溶剂萃取、离子交换、结晶和吸附层析3. 生物分离方法的选择与评价原则:步聚少,次序合理,产品规格(注射,非注射),生产规模,物料组成,产品形式,产品稳定性,危害性,物性:溶解度、电荷、分子大小、功能团、稳定性、挥发性,废水处理4.浓缩率:浓缩程度一般用浓缩率(concentration factor)表达,是一个以浓缩为目的的分离过程的最重要指标。
浓缩率为m,mt=mx则目标产物未得到任何程度的分离纯化。
5.分离因子:分离因子又称分离系数。
产品中目标产物浓度越高,杂质浓度越低,则分离因子越大,分离效率越高。
6. 回收率:无论是以浓缩还是以分离为目的操作过程,目标产物均应以较大的比例回收, 回收率R:生物分离操作多为间歇过程(分批操作),若原料液和产品溶液的体积分别为VC和VP。
1 生物产品与普通化工产品分离过程有何不同?2 设计生物产品的分离工艺应考虑哪些因素?3 分离纯化的回收率与浓缩率如何计算?4 现代生物分离工程研究方向有哪些特点?5 分离纯化指标有哪些?简述pH对发酵液过滤特性的影响,并举例说明。
答:(1) pH直接影响发酵液中某些物质的电离程度和电荷性质,因此适当调节pH值可以改善发酵液的过滤特性。
生物下游技术总结提纲

一、生物产品的特点:1、是产物浓度低的溶液原因:①细胞间接触抑制限制细胞量②产物对细胞有反馈抑制③培养条件限制氧传递2、培养环境组分复杂3、产物稳定性差:①产物易受物化条件影响发生化学降解②产物易受生物酶降解4、由于分批操作,细胞变异性大,使产物批间差异大。
5、产品用于食品与药物,对质量要求高。
二、生物工程下游加工一般工艺流程:1、预处理和固液分离该步对产物浓缩与质量改善不大,可选用操作有限。
①预处理:将悬浮液中与溶液浓度相近的细胞分离出来方法:加热、调pH、絮凝②固液分离:不溶物的去除方法:I、细胞移动:沉降、浮选II、溶液移动:过滤(上压力、下压力、错流过滤)III、离心IV、膜分离(不常用)此外,若目标产物为胞内产物,则需要:①细胞破壁:匀浆法、研磨法、酶解法②碎片分离:离心、双水相、膜分离2、提取(初步分离)该步去除与目标产物性质差异大的杂质,使产物浓度与质量显著提高。
其可选操作范围广:沉淀、吸附、萃取、超滤、结晶、膜分离3、精制(高度纯化)该步去除与目标产物有类似化学功能和物理性质的杂质。
其可选操作要求对产物有高度选择性:重结晶、离子交换、色谱分离、膜分离4、成品加工该步采用方法由产品最终用途要求决定,方法:浓缩、干燥、无菌过滤、成型等。
一、悬浮液预处理方法:根据可分离物质的性质选择处理方法:1、对热稳定性好的产品:加热作用:降低黏度,加速聚集以除杂。
要求:温度不宜过高,处理时间不宜过长。
2、利用产品不同的电离度与电荷性质:调节pH方法:加入草酸、无机盐或碱应用:等电点沉淀、膜过滤、絮凝3、根据产品在不同条件下分散状态的差异:凝聚与絮凝①凝聚:加入无机带电离子(如铁盐)中和胶粒电荷、胶体脱稳,胶粒聚集形成凝聚体。
②絮凝:加入天然或合成的大分子量聚电解质(如甲壳素或PAM)将胶粒交联成网形成絮凝团。
4、为防止滤孔阻塞使用惰性助滤剂。
如将硅藻土、石棉等预涂在滤布上或按一定比例与悬浮液混合后进行过滤,使混合颗粒形成格子型滤饼结构,方便清液通过。
生物工程下游知识点总结

生物工程下游知识点总结一.名词解释1.清洁生产(cleaner production):是指将综合预防的环境保护策略持续应用于生产过程和产品中,以期减少对人类和环境的风险。
它包括三个方面的内容,即清洁生产工艺(技术)、清洁产品、清洁能源。
2.凝聚作用:向胶体悬浮液中加入某种电解质,在电解质中异电离子作用下,胶粒的双电层电位降低,使胶体体系不稳定,胶体粒子间因相互碰撞而产生凝集的现象。
3.絮凝作用:絮凝剂通过静电引力范德华力或氢键的作用,强烈地吸附在胶粒的表面。
当一个高分子聚合物的许多链节分别吸附在不同的胶粒表面上,产生桥架联接时,就形成了较大的絮团。
4.下游工程(下游技术,下游加工过程,downstream processing):对于由自然界自然产生的或由微生物菌体发酵的、动植物细胞组织培养的、酶反应等各种生物工业生产过程获得的生物原料,经提取分离、加工并精制目的成分,最终使其成为产品的技术5.协萃:两种或两种以上的萃取剂同时萃取某一溶质或其它化合物时,萃取性能优于它们各自萃取性能之和的效应。
6.萃取因数:萃取平衡后,溶质在萃取相与萃余相中数量(质量或物质的量)的比值。
(E=DR)7.带溶剂:在纯气体溶剂中,加入被萃取物亲和力强的组分以提高其对被萃取组分的选择性和溶解度的一类物质。
8.离子交换带:溶液的组成和树脂的组成达到平衡时所对应的树脂层的高度。
9.反胶团(reversed micelles):两性表面活性剂在非极性有机溶剂中亲水基团自发地向内聚集而成,内含微小水滴的,空间尺度仅为纳米级的集合性胶体。
10.浓差极化:当溶剂透过膜而溶质留在膜上因而使膜面浓度增大,并高于主体浓度的现象。
(指在分离过程中,料液中的溶剂在压力驱动下透过膜,溶质被截留,于是在膜表面与临近膜面区域浓度越来越高。
在浓度梯度作用下,溶质由膜面向本体溶液扩散,形成边界层,使流体阻力与局部渗透压增加,从而导致溶剂透过量下降。
生物工程下游技术

生物工程下游技术第五章1、目标产物分离基本的两个阶段:产物的初级分离和产物的纯化精制阶段。
(1)初级分离:位于生物反应之后,其任务是分离细胞和培养液,破碎细胞释放产物,溶解包涵体,复原蛋白质,浓缩产物和去除大部分杂物等。
(2)纯化精制:在初级分离的基础上,用各种高选择手段(主要是各种色谱层析)将目标产物和干扰杂物尽可能的分离开,达到产物的高纯度,最后储藏运输和使用产品。
(1)机械破碎(高压匀浆、高速研磨)—离心法提取包含体—加变性剂溶解—除变性剂复性特点:利用了包含体与细胞碎片的密度差,离心法可获得干净的包含体,再对其复性。
这样首先摆脱了大量的杂质,使后面的分离纯化简单了,缺点是需要经过几次离心,加工时间较长(2)机械破碎—膜分离除可溶性蛋白—变性剂溶解包含体—除变性剂复性特点:应用了膜分离技术,用微孔膜除去可溶性蛋白质,但细胞碎片与包含体一起被膜挡住,难以分开,其次膜的堵塞和浓差极化常常导致可溶性蛋白的滞留,优点是封闭式操作,不污染环境也不受污染,能量也消耗少(3)化学破碎(加变性剂)—离心除细胞碎片—除变性剂复性特点:化学法破菌,试剂既可以破菌又可以溶解包含体,这样节约了时间和设备,缺点是所有的可溶性杂质都没有被除去,混杂在产物中间,给后面的分离带来困难。
第六章1、膜分离技术:是用半透膜作为选择障碍层,允许某些组分透过而保留混合物中其他组分从而达到分离目的技术。
优点:1)处理效率高,设备易于放大2)可在室温或低温下操作,适宜于热敏感物质分离浓缩3)化学与机械强度小,减少失活4)无相转变,省能5)有相当好选择性,可在分离、浓缩的同时达到部分纯化目的6)选择合适膜与操作参数,可得到较高回收率7)系统封闭循环,防止外来污染8)不外加化学物,减少了成本,也减少了对环境的污染2、膜的清洗:物理方法和化学方法。
物理方法一般是指用高速水冲洗,海绵球机械擦洗和反洗等,他们的特点是简单易行。
化学清洗通常是用化学清洗剂,如碱、酸、酶表面活性剂、络合剂和氧化剂等。
【课堂笔记】《生物工程下游技术》-沉淀分离部分

第一章沉淀分离技术1.1沉淀的目的1)通过沉淀达到浓缩的目的。
2)通过沉淀、固液分相后,除去留在液相或沉积在固体中的非必要成分3)沉淀可以将已纯化的产品由液态变成固态,加以保存或进一步处理1.2沉淀法的概念沉淀法是指采用适当的措施改变溶液的理化参数,控制溶液的各种成分的溶解度,从而将溶液中的欲提取的成分呢和其他成分分开的技术。
1.3沉淀法操作步骤1)加入沉淀剂2)沉淀剂的陈化促进粒子的生长3)离心或过滤、收集沉淀物PS:陈化是指将有沉淀的溶液静置,使沉淀中的分子等有归律的排列,并排列紧密,还有使沉淀聚沉,颗粒变大1.4沉淀过程应当考虑的问题1)沉淀能否发生2)沉淀剂或沉淀条件下对活性结构是否有破坏作用3)沉淀剂是否容易除去4)沉淀剂是否对人体有害1.5蛋白质的分离提取1.5.1优缺点优点:设备简单,成本低,原材料易得,便于小批量生产缺点:所得沉淀物可能聚集有多种物质,或含有大量的盐类,或包裹着溶剂,产品纯度常比结晶法低,过滤也较困难。
1.5.2沉淀法分离蛋白质的特点1)生产前期可使原料液体体积很快减小10~50倍,从而简化生产工艺、降低生产费用;2)使中间产物保持在一个中性温和的环境;3)可及早将目标蛋白从其与蛋白水解酶混合液中分离出来,避免蛋白质的降解,提高产物稳定性;4)用蛋白质沉淀法作为色谱分离的前处理技术,可使色谱分离使用的限制因素降低到最少。
1.5.3蛋白质的溶解特性1)蛋白质的溶解行为是一个独特的性质,由其组成、构象以及分子周围的环境所决定。
2)蛋白质在自然环境中通常是可溶的,所以其大部分是亲水的,但其内部大部分是疏水的。
3)一般而言,小分子蛋白质比起在化学上类似的大分子蛋白质更易溶解。
1.5.4蛋白质胶体溶液的稳定性1.5.4.1防止蛋白质凝聚沉淀的屏障1)水化层:蛋白质周围的水化层可以使蛋白质形成稳定的胶体溶液2)电荷:蛋白质分子间的静电排斥作用1.5.4.2颗粒间的相互作用1)蛋白质分子间的静电斥力2)范德华力1.6蛋白质的沉淀方法1)中性盐盐析法2)等电点沉淀法3)有机溶剂沉淀法4)非离子型聚合物沉淀法5)聚电解质沉淀法6)金属沉淀法等1.6.1中性盐沉淀法1.6.1.1概念在高浓度的中性盐存在下,蛋白质(酶)等生物大分子物质在水溶液中的溶解度降低,产生沉淀的过程。
生物工程下游技术知识要点(总复习).pdf
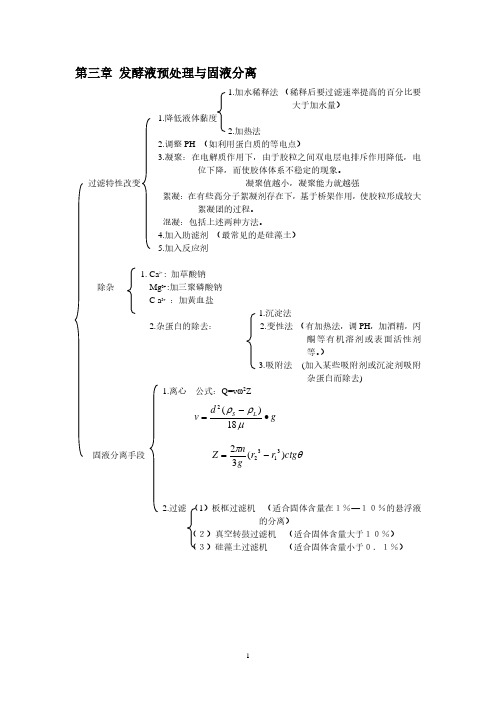
第三章 发酵液预处理与固液分离1.加水稀释法 (稀释后要过滤速率提高的百分比要大于加水量)1.降低液体黏度2.加热法2.调整PH (如利用蛋白质的等电点)3.凝聚:在电解质作用下,由于胶粒之间双电层电排斥作用降低,电位下降,而使胶体体系不稳定的现象。
过滤特性改变 凝聚值越小,凝聚能力就越强絮凝:在有些高分子絮凝剂存在下,基于桥架作用,使胶粒形成较大絮凝团的过程。
混凝:包括上述两种方法。
4.加入助滤剂 (最常见的是硅藻土)5.加入反应剂1. Ca 2+: 加草酸钠除杂 Mg 2+ :加三聚磷酸钠 C a 2+ :加黄血盐1.沉淀法2.杂蛋白的除去: 2.变性法 (有加热法,调PH ,加酒精,丙酮等有机溶剂或表面活性剂等。
)3.吸附法 (加入某些吸附剂或沉淀剂吸附杂蛋白而除去)1.离心 公式:Q=v ω2Zg d v L S •−=μρρ18)(2固液分离手段 θπctg r r gn Z )(323132−=2.过滤 (1)板框过滤机 (适合固体含量在1%—10%的悬浮液的分离)(2)真空转鼓过滤机 (适合固体含量大于10%) (3)硅藻土过滤机 (适合固体含量小于0.1%)第五章细胞破壁细胞破壁1.破壁方法:(1)珠磨法原理:进入珠磨机的细胞悬浮液与极细的玻璃小珠,石英砂,氧化铝等研磨剂一起快速搅拌或研磨,研磨剂,珠子与细胞之间的互相剪切,碰撞,使细胞破碎。
(2 )高压匀浆法原理:利用高压使细胞悬浮液通过针形阀,由于突然减压和高速冲击撞击环使细胞破碎。
是大规模细胞破碎的常用方法。
(3)超声破碎法(适合实验室用)(4 )酶溶法1 .外加酶法2. 自溶法(1)加热法(2)干燥法(5)化学渗透法2.破碎率的测定(1)直接测定法破碎前利用显微镜计数器直接计数破碎后用染色的方法把破碎的细胞与未受损的细胞分开。
即可直接计算破碎率。
(2)目的产物测定法通过测定破碎液中目的产物的释放量来估算破碎率。
(3)导电率测定法根据导电率随着破碎率的增加而呈线性增加第五章.溶剂萃取与浸取一、溶剂萃取过程的理论基础:——是把目标物质从第一个液相中依靠更强大的溶解力抽提到第二个液相中。
生物工程下游技术简答题

答案仅供参考1.从生物工程概念及学科分支着手,分析生物工程下游技术的概念。
生物工程是分子遗传学、微生物学、细胞生物学、生物化学、化学工程和能源学等各学科的结合,应用于医药、食品、农林、园艺、化工、冶金、采油、发酵罐新技术和新底物的环保等方面的工程技术;生物工程下游技术就是研究,应用和设计生物产品的提取、分离、纯化、精制及加工工艺,使其变为产品的一门学科。
2.谈谈生物工程下游技术课程主要研究哪些问题?在整个生物工程技术领域的地位如何?有何作用?研究生物工程产品的提取、分离、纯化、精制加工等技术的基本原理和方法。
下游技术是生物制品产业化的必经之路和关键所在,直接影响产品的质量和成本。
作用是可以培养对生物产品的分离,纯化技术的掌控和应用能力,以及对生物物质提纯最佳方案的设计能力。
3.生物工程下游技术处理对象有哪些特点?目标物质浓度低、组分复杂、产物稳定性差、质量要求高(纯度、卫生和生物活性)4.原料中目的物的浓度与产品价格是否有关联?目的物浓度越低,产品的价格就越高5.提取步骤数及各步收率对总收率有何影响?提取步骤数越多,最终的总收率就越低6.通过查阅资料,介绍生物工程发展史。
第一阶段:古代酿造业,不存在下游技术一说,主要产品是酒、酱油、醋之类的发酵产品。
第二阶段:近代酿造业,可以进行过滤、蒸馏、精馏等简单的单元操作,主要产品是丙酮、丁醇等无活性的小分子物质。
第三阶段:可以进行目前大部分的化工单元操作,主要产品是抗生素、多糖、蛋白质等具有一定生物活性的大分子物质。
第四阶段:现代生物工业,可以进行各种新型分离技术(色谱、萃取等),主要产品是基因工程的高附加值产品。
7.介绍生物下游技术的一般流程,划分依据是什么?1.预处理(固体细胞与液体发酵液)2.提取(初步分离)3.精制(高度纯化)4.成品制作(最后加工,层析、电泳等)划分依据一般是分离产物的物相,分离物的大小,难度,方法等。
8.生物下游分离与化工分离有何区别?生物下游分离常无固定操作方法可循,生物材料组成非常复杂,分离操作步骤多,不易获得高收率,培养液(或发酵液)中所含目的物浓度很低,而杂质含量却很高,分离进程必须保护化合物的生理活性,生物活性成分离开生物体后,易变性、破坏,基因工程产品,一般要求在密封环境下操作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生物工程与下游技术知识点整理第十三章β内酰胺类抗生素1、(掌握青霉素的性质并分析流程,会设计提取分离纯化的流程)青霉素的理化性质(1)酸碱性:有一个酸性基团;解离常数pK值为 2.7;(2)溶解度:青霉素是有机酸,易溶于醇,酸,醚,酯;氯仿是多种青霉素游离酸的很好溶剂;在水中溶解度很小,迅速丧失抗菌能力;青霉素的金属盐易溶于水;易溶于低级醇;略溶于乙醇,丁醇,酮类,醋酸乙酯;含有少量水分时,溶解度大大增加;不溶于乙醚,氯仿,醋酸戊酯;青霉素的分离纯化工艺(工业钾盐生产工艺流程)课本277页发酵液,冷到10℃下,1/3体积中性过滤,板框压滤或鼓式过滤,10%硫酸调pH5,加PPB溶液(十五烷基溴化吡啶,絮凝剂),板框过滤或鼓式过滤,冲水量20-30%;滤洗液;加1/3BA(醋酸丁酯),加PPB,10%硫酸调pH2-2.5,逆流萃取;得一次丁酯萃取液;加0.3%活性炭搅拌10min,压滤,-10℃冷冻脱水,水分在0.9%以下,过滤得BA清液;加温到15℃,加醋酸钾-乙醇溶液适当搅拌,结晶后静置1h以下,甩滤,得湿晶体;湿晶体放洗涤罐,丁醇(4-6L/10亿)洗涤,乙酸乙酯(2L/10亿)顶洗,挖出粉子真空干燥;得青霉素G钾盐成品;2、头孢菌素C(1)头孢菌素C性质:为两性化合物,C为氨基酸,水溶性很大,稳定性差;大孔网状吸附剂从发酵液中初步分离头C,离子交换法纯化,络盐沉淀法结晶;(2)分离纯化工艺流程头C发酵液,硫酸酸化,板框过滤,得头C滤液;大孔网状吸附剂吸附,得饱和树脂;丙酮水溶液解吸,得一次头C解吸液;阴离子树脂吸附,醋酸钠解吸;加醋酸锌,得头C锌络盐结晶;板框过滤,得头C锌盐湿品;气流干燥,得头C锌盐成品;(3)头C分离纯化工艺要点A、发酵液预处理发酵液冷到15℃以下,硫酸酸化到pH2.5-3,放置一段时间;板框或真空鼓式过滤机过滤,并用水顶洗滤渣;收集,合并滤液,洗液,低温10℃保存;B、大孔网状吸附剂的吸附和解吸头C最适吸附pH2.5-3,XAD4的吸附容量为15-20g/L;2-4倍体积去离子水洗涤,除去硫酸根等阴离子,以免干扰离子交换树脂的纯化;15-25%乙醇,丙酮,或异丙醇水溶液来解吸。
C、离子交换树脂的纯化采用弱碱性阴离子交换树脂,树脂用醋酸溶液处理成醋酸型,开始吸附;去离子水洗涤树脂,1.5-2.5%醋酸钠(钾)水溶液解吸;D、沉淀结晶头C可与二价重金属离子铜锌钴铁铅Ni形成难溶性络盐微晶沉淀;锌盐最普遍;头C锌盐,淡黄色微晶粉末,不溶于水及氯仿,甲醇,乙醇;离子交换解吸液,放结晶罐中,5℃,加醋酸锌,搅拌溶解,加结晶液体积30%的乙醇或丙酮,析出头C锌盐微晶沉淀;选择性较差,需在一定浓度下才能析出络盐结晶;只适用于纯化后的头C溶液;E、膜分离发酵液通过微孔滤膜MF,除去菌丝,固形物;超滤UF(除大分子物质),除去分子量10000以上的蛋白质,多糖,深棕色色素,获得色浅的头C滤液;反渗透膜RO浓缩(除水)3、克拉维酸的分离纯化(1)萃取:溶剂萃取法发酵滤液,盐酸调pH2,3/4体积正丁醇,多级逆流萃取,5℃萃取;1/20体积水,用20%氢氧化钠水溶液调pH7;液液离心机,水相反抽提液;浓缩洗脱液,5℃Zerolit FFIP氯型阴离子交换树脂,0-0.35M氯化钠梯度吸脱,合并活性部分,减压浓缩;Amberlite XAD4树脂脱盐,能吸附克拉维酸,不吸附无机盐;1%正丁醇或无盐水洗脱,混合活性部分,真空浓缩和冷冻干燥;(2)离子交换:吸附于强碱性阴离子交换树脂上,用含盐水溶液洗脱;发酵滤液,pH6.2,通过Zerolit FFIP氯型强碱性阴离子交换树脂,冷的1mol/L氯化钠洗脱;浓缩液,pH6,25℃的滤液,通过Amberlite XAD4树脂,用0.1mol/L氯化钠洗涤,5℃无盐水洗脱;脱盐浓缩液,离子交换色层分离;Zerolit FFIP树脂氯型阴离子交换树脂,0-0.35M氯化钠梯度洗脱,5℃;浓缩洗脱液,5℃Amberlite XAD4树脂脱盐,混合活性部分,浓缩和冷冻干燥。
第十四章氨基糖苷类抗生素1、离子交换法分离纯化链霉素(强碱)的工艺发酵液,1-2倍量水稀释,(高价离子在稀溶液中优先吸附)草酸酸化,pH2.8-3.2,加热70-75℃,板框过滤或固体排出式离心分离,冷到15℃以下;10%氢氧化钠中和pH6.7-7.2,110-Na型树脂吸附,得饱和树脂,水洗到澄清,5-6%硫酸洗脱;洗脱液;401树脂吸附,得饱和树脂,先用无盐水挤压,再以8%硫酸单罐循环洗脱3-4次;得二次洗脱液,1X14H型精制,330-OH型中和;调pH4.3-5,0.2-3%炭,透光度90%以上;小于35℃薄膜浓缩,硫酸调pH4.5,加2-3%活性炭,得酸性脱色液;氢氧化钙调pH5.5-6,加1.5%-2%活性炭到透光度90%以上;无菌过滤,喷雾干燥进风120-135℃,出风84-85℃;2、卡那霉素的分离纯化工艺(1)硫酸卡那霉素:易溶于水,不溶于乙醇(水中加乙醇沉淀),丙酮,苯,醋酸乙酯;(2)分离纯化工艺流程发酵液,盐酸调pH5-5.5,加水稀释,1X12H型强酸阳离子树脂吸附,搅拌4h,用稀盐酸,氯化铵洗涤,无盐水洗到无氯离子;强碱型树脂201X4脱色,2-2.8%氨水洗脱,硫酸调pH3.2-3.4,乙醇中结晶2h,离心得粗晶;95%及50%乙醇分次洗涤,无盐水溶解到20万u/ml,调pH7,加1-5%活性炭脱色达滤;精制液,无菌过滤,喷雾干燥,进风116℃出风88℃,得粉针剂原药;精制液,制成水针剂;3、庆大霉素的分离纯化工艺(1)庆大霉素:易溶于水,不溶于乙醇,丙酮,氯仿,乙醚,苯;(2)分离纯化工艺流程发酵液,盐酸调pH1.5-2.5,氢氧化钠中和到pH6.8-7.2;加水稀释;1x2H型吸附6h;得饱和树脂;用稀盐酸,氯化铵洗涤,无盐水洗到无氯离子,4-5%氨水洗脱;强碱性201x4脱色;浓缩去氨,10%硫酸调pH5,加4%活性炭,40℃脱色;成品浓缩液;无菌过滤进风115℃,出风85℃,得硫酸庆大霉素成品;第十五章四环类抗生素(两性物质,沉淀法)四环类抗生素的分离纯化沉淀法:四环类抗生素在碱性下能和钙,镁,钡,某些季铵碱形成复合物而沉淀;一)钙镁1 四环素:发酵液调pH9,加氯化钙形成钙盐沉淀;将沉淀以草酸溶解,析出草酸钙;过滤,滤液调pH4.6-4.8;析出四环素粗碱;粗碱溶于草酸水,活性炭脱色;调pH4,得四环素碱成品;2金霉素:发酵液加碳酸钙,氯化镁,调pH7.8形成沉淀;沉淀用草酸-盐酸调pH1.6-1.7溶解;加黄血盐(除铁离子),硫酸锌去蛋白;过滤,加4-6%盐酸,升温40℃,金霉素盐酸盐析出;3土霉素加0.5-1%溴代十六烷吡啶(季铵碱),调pH9.6-10;沉淀析出;沉淀用水洗涤,溶于4份体积5%草酸和1份体积浓盐酸;得到的溶液pH1-1.2;活性炭脱色;调pH4-4.5;析出土霉素碱粗品;第十六章大环内酯类抗生素(弱碱,萃取)1、性质:无色碱性化合物,微溶于水,在水中溶解度随温度升高降低;易溶于醇酮酯(醋酸乙酯,醋酸丁酯),氯仿;易溶于酸性水溶液且成盐,盐易溶于水2、红霉素分离纯化工艺(溶剂萃取法)(1)单纯溶剂萃取法提取红霉素发酵液预处理:加甲醛,硫酸锌,氢氧化钠调pH7.8-8.2;过滤,滤洗液;萃取:BA(醋酸丁酯)二级逆流萃取,一级pH10-10.2,二级pH10.4-10.6;一次BA萃取液;反萃取:醋酸缓冲液作二级逆流萃取,一级pH5,二级pH4.6;醋酸缓冲液;萃取:BA作二级萃取;二次BA萃取液;结晶:加10%丙酮,-5℃静置24-36h;离心,蒸馏水洗涤,得湿晶体;干燥:制颗粒干燥20h,70-80℃真空干燥;得红霉素碱成品;(2)溶剂萃取法结合中间盐沉淀的工艺流程发酵液预处理:提取:BA二次逆流萃取,BA萃取液;中间盐沉淀:缓缓加入计量的乳酸,加完后继续搅拌30min;得红霉素乳酸盐湿晶体;BA洗涤,55℃干燥;干晶体;搅拌下加入计量的水-丙酮液溶解,pH6左右;氨水或碳酸氢钠调pH10,搅拌30min,55℃,得红霉素湿晶体;甩滤,水洗到pH7-8,55℃烘干,得红霉素碱成品;(3)大孔树脂吸附法的工艺流程发酵液,0.1%甲醛,3%硫酸锌,氢氧化钠调pH7.8-8.2;过滤;树脂吸附:CAD40树脂吸附,流速1/25v/v.min;树脂洗涤:饱和树脂,40℃水洗涤;树脂解吸:氨水pH10,丁酯用2%氨水混合,流速1/130v/v.min;丁酯萃取液;反萃取:pH4.7-5.2,醋酸缓冲液;BA萃取:碱化pH9.8-10,38-40℃;结晶:加10%丙醇,-5℃静置24h离心过滤洗涤;干燥:湿晶体,制颗粒,70-80℃干燥;得红霉素碱成品;3、麦迪霉素分离纯化工艺发酵液,草酸酸化pH2.5-3;滤洗液;氢氧化钠调pH8.5-9,BA提取二次;得一次BA萃取液;盐酸调pH2-2.5,一次酸水提取液;氢氧化钠调pH8.5-9,BA提取2次;盐酸调pH2-3.5,蒸馏水提取;去残溶剂:减压空气搅拌;结晶:5%氢氧化钠调pH8.5-9,40℃搅拌20min;洗涤,干燥:热pH8.5无盐水洗涤,60-70℃真空干燥,得成品;4、螺旋霉素分离纯化工艺发酵液,加硫酸铝,搅拌20min,过滤,得滤液;加15-20%BA,氢氧化钠调pH9,得BA萃取液;洗涤:无盐水洗涤BA;5-10%磷酸缓冲液,补加6M盐酸调pH2-2.5;得磷酸缓冲液;除残余BA后过滤;结晶:10M氢氧化钠调pH9,升温到60℃,保温20min;得湿晶体;分离去母液;干燥:70-80℃真空干燥;得螺旋霉素成品;第十七章氨基酸类药物的分离纯化1、氨基酸的理化性质(1)物理性质无色晶体,具特殊晶型;易溶于酸碱溶液;在水中溶解度差异大,精氨酸,组氨酸,赖氨酸(都是碱性氨基酸)溶解度最大;胱氨酸,酪氨酸溶解度最小;不溶于有机溶剂,但脯氨酸溶于乙醇;(2)两性解离及等电点PI(可用等电点沉淀法)带电情况取决于溶液的pH;pH>PI时,氨基酸带负电;pH<PI时,氨基酸带正电;pH=PI时,溶解度最低,易于沉淀;不同氨基酸PI各异;同一pH下各种氨基酸所带电荷的质和量不一致,可应用离子交换法或电泳法分离;2、氨基酸分离纯化实例(给出条件会设计)胱氨酸(1)特性:六角形片状白色结晶,或结品性粉末,无味,pI4.6;难溶于水,不溶于乙醇,乙醚,及其他有机溶剂;易溶于酸碱溶液中,热碱液中易分解;(2)提取和纯化:毛发酸水解,等电点沉淀,盐酸溶解,活性炭脱色,除酪氨酸,结晶;水解:人发或猪毛,洗净,2倍量10M盐酸,预热70-80℃,间歇搅拌,1-1.5h内升温到110℃,6.5-7h;过滤,得滤液;中和:用30-40%的氢氧化钠中和到pH4.8,继续搅拌15min,复测pH,放置36h,过滤得胱氨酸粗品;滤液可分离精氨酸,亮氨酸,谷氨酸初步纯化:取胱氨酸粗品,加10M盐酸,加热到65-70℃,搅拌溶解30min,加2%活性炭,升温到85-90℃,保温30min,过滤,滤液加热到80-85℃,搅拌,用30-40%氢氧化钠中和到pH4.8,静置,结晶析出,趁热过滤得沉淀,离心甩干;滤液回收酪氨酸;纯化:取胱氨酸沉淀,加1M盐酸,加热到70℃溶解,加活性炭,升温到85℃,搅拌30min脱色,过滤,得无色透明澄清滤液;加15倍蒸馏水,加热到75-80℃,搅拌下用12%氨水中和到pH3.5-4;胱氨酸结晶析出;过滤得胱氨酸结晶;蒸馏水洗到无氯离子,真空干燥;异亮氨酸(1)特性:无臭,味微苦;pI6.02;几乎不溶于乙醇或乙醚;乙醇中形成菱形叶片状或片状结晶;溶于热乙醇,25℃在水中溶解度4.17,7.5℃为6.08;(2)制备,分离,纯化菌种培养与发酵:菌种AS1.998;种子培养基:葡萄糖,尿素,玉米浆,豆饼水解液,pH6.5;1000ml三角瓶装200ml;30℃摇床培养16h;二级种子:另加菜籽油;接种量3.5%,培养8h;发酵培养基:硫酸铵,豆饼水解液,玉米浆,淀粉水解糖,碳酸钙,pH7.2;30-32℃,通气发酵60h,25-50h间不断补加尿素,氨水;预处理:发酵液100℃10min,冷却过滤,滤液加硫酸和草酸调pH3.5,过滤除沉淀;离子交换分离:滤液以 1.5%树脂量的流速经007X1(732)阳离子交换树脂H型(40X100cm),100L去离子水洗涤,氨水(60℃,0.5M氨水)以3L/min流速洗脱,分步收集;合并pH3-12的洗脱液,70-80℃减压蒸馏浓缩到黏稠状,加去离子水,浓缩,重复三次,以除去氨;脱色,浓缩,结晶:浓缩液加去离子水到原体积的1/4,搅拌均匀,2M盐酸调pH3.5,加1%活性炭,70℃搅拌1h,过滤,滤液减压浓缩;2M氨水调pH6,5℃过夜,滤取沉淀,105℃烘干得异亮氨酸粗品;精制:取异亮氨酸粗品,加浓盐酸,去离子水,加热到80℃,搅拌溶解,加氯化钠到饱和,用氢氧化钠调pH10.5,过滤,滤液用盐酸调pH6,5℃过夜,滤取沉淀;沉淀用去离子水加热80℃溶解,加氯化钠和1%活性炭,70℃搅拌1h,过滤,滤液减压浓缩;氨水调pH6,5℃结晶过夜;滤取结晶,105℃烘干得异亮氨酸粗品;天冬氨酸(酸性氨基酸)(1)特性:白色菱形叶片状结晶,pI2.97;溶于水及盐酸,25℃水中溶解度0.8,75℃水中为2.88;不溶于乙醇,乙醚;(2)制备,分离,纯化天冬氨酸酶的制备:大肠杆菌AS1.881,斜面:肉汁培养基;摇瓶:玉米浆,延胡索酸,硫酸镁,氨水调pH6;37℃振荡培养24h;逐级扩大培养;发酵液用1M盐酸调pH5,45℃1h,冷却到室温,离心收集菌体(含天冬氨酸酶);细胞固定:湿菌体,悬浮于生理盐水,40℃保温,加明胶溶液(40℃,12%),戊二醛溶液,充分搅拌均匀,5℃过夜,切成3-5mm的立方小块,浸于戊二醛溶液中过夜;蒸馏水充分洗涤,滤干得含天冬氨酸酶的固定化细胞;装于填充床式反应器,制成生物反应堆,备用;转化反应:延胡索酸铵底物液37℃,按一定流速流过生物反应堆,收集转化液;分离,纯化:过滤,滤液用1M盐酸调pH2.8,5℃结晶过夜;滤取结晶,少量冷水洗涤,抽干,105℃干燥得天冬氨酸粗品;粗品用稀氨水溶解成15%溶液,加1%活性炭,70℃搅拌脱色1h,过滤,滤液用1M盐酸调pH2.8,5℃结晶过夜,滤取结晶,少量冷水洗涤,抽干,85℃真空干燥得天冬氨酸精品;谷氨酸分离纯化利用谷氨酸与锌作用,在pH6.3条件下生成难溶于水的谷氨酸锌盐沉淀,达到从谷氨酸发酵液中分离谷氨酸的目的。
