华南理工大学本科生期末考试2015年物理化学考题及答案
华南理工大学《物理化学》64-2试卷

2.理想气体等温过程的 Δ A A.>Δ G B.<Δ G C.=Δ G D.不能确定
3.理想气体从状态 I 经自由膨胀到状态 II,可用哪个热力学函数来判断过程的自 发性? A.Δ H B.Δ G C.Δ S D.Δ U
4.在标准压力下,用水蒸汽蒸馏法提纯某不溶于水的有机物时,系统的沸点: A.必低于 373.2K C.取决于水与有机物的相对数量 B.必高于 373.2K D.取决于有机物的分子量大小
C. △G=△A+△pV=△A+nR△T =△A C. 一般过程只能用熵来判断 A 因水和有机物都有一定的蒸气压, 故系统的沸点低于水的沸点
0.25 2 =2
1
△G1 = △G2 + △G3 , —z1F E1 = —z2F E2 —z3F E3
E3=2 E1-E2 = 2×0.337V - 0.521V = 0.153V
5.已知温度为 T 时反应 2NH3 = N2 + 3H2 的标准平衡常数为 0.25,那么在同温下, 反应
1 2
N2 +
3 2
H2 = NH3 的标准平衡常数为 B. 1 C. 2 D. 4
A.0.5
6. 298K 时,Cu2+ + 2e— = Cu Cu+ + 则反应 Cu2+ + e— = A.-0.153V e— = Cu
E1 ADVANCE \ll6 E2 ADVANCE \ll6
O ADVANCE \l5
O ADVANCE \l5
ADVANCE \l6
= 0.337V
O ADVANCE \l5
ADVANCE \l6
= 0.521V
物化期末考试试卷A-2015

中山大学本科生期末考试考试科目:《物理化学(上)》(A卷)学年学期:2014学年第三学期姓名:学院/系:化学与化学工程学院学号:考试方式:闭卷+A4纸双面小结年级专业:考试时长:120分钟班别:第八条:“考试作弊者,不授予学士学位。
”------------以下为试题区域,共3道大题,总分100分,考生请在答题纸上作答------------一、选择题(共15 小题,每小题 2 分,共30 分)1. 硫酸与水可形成H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s)三种水合物,问在 101 325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种? ( )(A) 3 种 (B) 2 种(C) 1 种 (D) 不可能有硫酸水合物与之平衡共存。
2. 理想气体卡诺循环的图为下列四种情况中的哪一种? ( B、C ) 答案为何无C?3. 液体B比液体A易于挥发,在一定温度下向纯A液体中加入少量纯B液体形成稀溶液,下列几种说法中正确的是:( )(A) 该溶液的饱和蒸气压必高于同温度下纯液体A的饱和蒸气压(B) 该液体的沸点必低于同样压力下纯液体A的沸点(C) 该液体的凝固点必低于同样压力下纯液体A的凝固点(溶液凝固时析出纯固态A)(D) 该溶液的渗透压为负值4. 在下列状态变化中,哪些可以应用公式d U = T d S-p d V ?O2(A) NO2气体缓慢膨胀,始终保持化学平衡NO2===NO+12(B) NO2气体以一定速度膨胀,解离出来的NO+1O2总是落后于平衡组成2O2的条件下膨胀(C) SO3气体在不解离为SO2+12(D) 水在-10℃时等温结冰5. 假定某原子的电子态有两个主要能级,即基态和第一激发态,能级差为1.38⨯10-21J,其余能级可以忽略,基态是二重简并的。
则在100 K时,第一激发态与基态上的原子数之比为:( )(A) 3 (B) 0.184 (C) 1 (D) 0.016. 下列条件哪一个错误? ( )理论上使公式ΔH p = Q p成立的条件是:(A) 封闭体系(B) 只做体积功(C) 恒压可逆(D) 等压不可逆7. 主要决定于溶解在溶液中粒子的数目,而不决定于这些粒子的性质的特性叫________。
物理化学64学时试卷B及答案精品文档8页
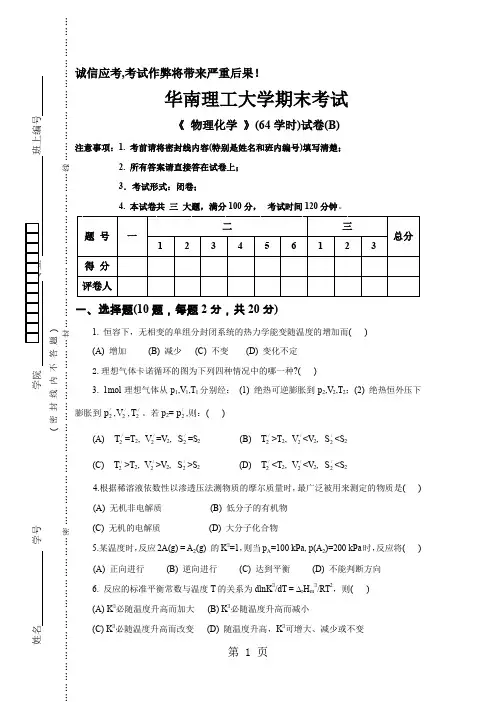
诚信应考,考试作弊将带来严重后果!华南理工大学期末考试《 物理化学 》(64学时)试卷(B)注意事项:1. 考前请将密封线内容(特别是姓名和班内编号)填写清楚; 2. 所有答案请直接答在试卷上; 3.考试形式:闭卷;4. 本试卷共 三 大题,满分100分, 考试时间120分钟。
题 号 一二 三总分1 23456123得 分 评卷人一、选择题(10题,每题2分,共20分)1. 恒容下,无相变的单组分封闭系统的热力学能变随温度的增加而( ) (A) 增加 (B) 减少 (C) 不变 (D) 变化不定2.理想气体卡诺循环的图为下列四种情况中的哪一种?( )3. 1mol 理想气体从p 1,V 1,T 1分别经: (1) 绝热可逆膨胀到p 2,V 2,T 2;(2) 绝热恒外压下膨胀到/2p ,/2V ,/2T 。
若p 2=/2p ,则:( )(A) /2T =T 2, /2V =V 2, /2S =S 2 (B) /2T >T 2, /2V <V 2, /2S <S 2 (C) /2T >T 2, /2V >V 2, /2S >S 2 (D) /2T <T 2, /2V <V 2, /2S <S 24.根据稀溶液依数性以渗透压法测物质的摩尔质量时,最广泛被用来测定的物质是( ) (A) 无机非电解质 (B) 低分子的有机物 (C) 无机的电解质 (D) 大分子化合物5.某温度时,反应2A(g) = A 2(g) 的K ∃=1,则当p A =100 kPa, p (A 2)=200 kPa 时,反应将( ) (A) 正向进行 (B) 逆向进行 (C) 达到平衡 (D) 不能判断方向6. 反应的标准平衡常数与温度T 的关系为dln K ∃/d T = ∆r H m ∃/RT 2,则( ) (A) K ∃必随温度升高而加大 (B) K ∃必随温度升高而减小(C) K ∃必随温度升高而改变 (D) 随温度升高,K ∃可增大、减少或不变_____________ ________姓名 学号学院 专业 班上编号( 密 封 线 内 不 答 题 ) …………………………密………………………………………………封………………………………………线……………………………………7. 某系统存在C(s),H2O(g),CO(g),CO2(g),H2(g),它们之间存在三个平衡C(s)+H2O(g) = CO(g)+ H2(g);CO2(g)+H2(g) = CO(g)+ H2O(g);C(s)+ CO2(g) = 2CO(g)则该系统的独立组分数C为( )(A) 1 (B) 2 (C) 3 (D) 48. 当一定的直流电通过一含有金属离子的电解质溶液时,在阴极上析出金属的量正比于( )(A) 阴极的表面积(B) 电解质溶液的浓度(C) 通过的电量(D) 电解质溶液的温度9.同种液体在相同温度下,不同形状液面的蒸气压p关系是( )(A) p(凸形)> p(凹形)> p(平面) (B) p(凸形)< p(凹形)< p(平面)(C) p(凸形)> p(平面)> p(凹形) (D) p(凸形)<p(平面)< p(凹形)10.对行反应,当温度一定时由纯A开始反应,下列说法中哪一点是不对的? ( )(A) 起始时A的消耗速率最快(B) 反应进行的净速率是正逆两向反应速率之差(C) k1/k-1的值是恒定的(D) 达到平衡时正逆两向的速率常数相同。
华南理工大学物理化学期末考试

,考试作弊将带来严重后果!华南理工大学期末考试《物理化学》试卷B1. 考前请将密封线内各项信息填写清楚;所有答案请直接答在试卷上(或答题纸上);.考试形式:闭卷;1.6分,共16分)1)今有AX、BX和CY三种离子化合物,离子半径分别为:r X =0.181nm,rY=0.130nm,rA=0.095nm,rB=0.169nm,rC=0.034nm。
这三种化合物的阳离子配位数大小顺序排列是():(A)BX>AX>CY (B)AX>CY>BX(C)BX>CY>AX (D)CY>BX>AX2)下列硅酸盐矿物。
属于链状结构的是():(A)镁橄榄石Mg2[SiO4] (B)顽火辉石Mg2[Si2O6](C)绿柱石Be3Al2[Si6O18] (D)叶腊石Al2[Si4O10](OH)23)斜长石是由钠长石和钙长石所形成的完全互溶固溶体。
欲测定斜长石的性):(A)单一物质(B)混合物质(C)钠长石和钙长石两者的加和性(D)钠长石或钙长石单一物质4)在Al2O3中掺加0.5%(mol)的NiO和0.02%(mol)的Cr2O3所制备的金黄色人经分析认为是形成了置换型固溶体,此人造黄玉的化学式可写成():(A)Al1.996Ni0.005Cr0.0002O2.9975(B)Al1.996Ni0.005Cr0.0002O3(C)Al1.9948Ni0.005Cr0.0002O3(D)Al1.9948Ni0.005Cr0.0002O2.99755)尖晶石(MgAl2O4)型晶体中,O2-作面心立方最紧密堆积,Mg2+填入():(A)四面体空隙的半数(B)四面体空隙的八分之一(C)八面体空隙的半数(D)八面体空隙的八分之一(6)若有一个变价金属氧化物MO,在还原气氛下形成阴离子缺位型非计量化合物,金属原子数和氧原子数之比为:M:O=1.1:1,则其化学式为():(A)M1.1O (B)MO0.89(C)MO0.91(D)MO1.1(7)能单独形成玻璃的氧化物,其单键强度为():(A)小于250KJ/mol (B)250~335KJ/mol(C)大于335KJ/mol (D)大于350KJ/mol(8)对于一般的玻璃网络中间体,其阳离子电负性值范围为():(A)大于2.1 (B)1.8~2.1(C)1.5~1.8 (D)0.7~1.7(9)在氧离子立方密堆中,若一半八面体空隙均填充一种阳离子,则该阳离子的价态为():(A)+1价(B)+2价(C)+3价(D)+4价(10)某晶面与各轴的截距分别是2a、3b和6c,则其晶面指数为():(A)(236)(B)(123)(C)(632)(D)(321)二、回答下列问题(共24分)1、电冰箱能致冷。
华工物化试题精解

T=J(J+1)h2/82kR02
=1*2*(6.6*10-34)2/{8*3.1422*1.38×10-23*(35*10-3/6.022*1023)*(1.988×10-10)2}
=0.3480K
4.某化学反应在恒压、绝热和只做膨胀功的条件下进行,系统的温度由T1升高至T2,则此过程的焓变_______零;如果这一反应在恒温T1、恒压和只做膨胀功的条件下进行,则其焓变______零。
华南理工大学《物理化学》试卷(80学时)
专业班级________姓名________学号_________分数_______
华南理工大学化学学院葛华才老师解答,有错请留言,谢谢!
一、选择题(共10题,每题2分,20分)
1.含有非挥发性溶质B的水溶液,在101.325kPa和270.15K时开始析出冰,已知水的Kf=1.86K.kg.mol-1,Kb=0.52K.kg.mol-1,该溶液的正常沸点是:()
相图和冷却曲线见下图。
(3)可得到MgCu2。根据杠杆规则有
m(MgCu2)(0.25-0.1606)=(1kg-m(MgCu2))(0.33-0.25)
得m(MgCu2)=0.472kg
2.气态正戊烷和异戊烷的fGm(298.15K)分别为–194.4 kJ.mol-1,-200.8 kJ.mol-1;液体的饱和蒸气压分别为:
(C)反应级数由二级变为一级(D)反应级数由一级变为二级,k由小变大
[答]C
r=k1k2cA2/(k-1cA+k2)=kcA,k=k1k2cA/(k-1cA+k2)
cA→∞,k=k1k2/k-1;cA→0,k=k1cA
8.下列系统中为非胶体的是( )
华南理工大学物化试卷AB+作业

诚信应考,考试作弊将带来严重后果!华南理工大学期末考试《 物理化学 》(64学时)试卷(B)注意事项:1. 考前请将密封线内容(特别是姓名和班内编号)填写清楚; 2. 所有答案请直接答在试卷上; 3.考试形式:闭卷;4. 本试卷共 三 大题,满分100分, 考试时间120分钟。
题 号 一二 三总分1 2345612得 分 评卷人一、选择题(10题,每题2分,共20分)1. 一定量的理想气体从同一初态分别经历等温可逆膨胀、绝热可逆膨胀到具有相同压力的终态,终态体积分别为V 1,V 2,则: ( )(A) V 1> V 2 (B) V 1< V 2 (C) V 1= V 2 (D) 无法确定2. 理想气体在等温条件下反抗恒定外压膨胀,该变化过程中体系的熵变∆S 系及环境的熵变∆S 环应为: ( )(A) ∆S 系>0,∆S 环=0 (B) ∆S 系<0,∆S 环=0 (C) ∆S 系>0,∆S 环<0 (D) ∆S 系<0,∆S 环>03. 冬季建筑施工中,为了保证施工质量,通常在浇注混凝土时加入少量盐类,其主要作用是( )(A) 吸收混凝土中的水分 (B) 防止建筑物被腐蚀 (C) 增加混凝土的强度 (D) 降低混凝土的固化温度4. 某温度时,反应2NO 2(g) = N 2O 4(g) 的K ∃=8,则当p (NO 2)=100 kPa, p (N 2O 4)=200 kPa 时,反应将( )(A) 向生成N 2O 4方向进行 (B) 向生成NO 2方向进行 (C) 反应恰好达到平衡 (D) 不能判断其进行的方向5. 硫酸与水可形成H 2SO 4·H 2O(s)、H 2SO 4·2H 2O(s)、H 2SO 4·4H 2O(s)三种水合物,问在_____________ ________名 学号学院 专业 班上编号( 密 封 线 内 不 答 题 ) …………………………密………………………………………………封………………………………………线……………………………………101325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种? ( )(A) 3种 (B) 2种 (C) 1 种 (D) 不可能有硫酸水合物与之平衡共存6. 电池反应达平衡时,电池的电动势E 有( )(A) E >0 (B) E <0 (C) E = E ∃ (D) E =07. 在一个绝热的刚壁容器中,发生一个化学反应,使系统的温度从T 1升高到T 2,压力从p 1升高到p 2,则( )(A) Q >O ,W <0,△U <O (B) Q =0,W =0,△U =0 (C) Q =0,W <0,△U <0 (D) Q >0,W =0,△U >08. 一定体积的水,当聚成一个大水球或分散成许多水滴时,在同温度下,两种状态相比,以下性质保持不变的有( )(A) 表面能 (B) 表面张力 (C) 比表面 (D) 液面下的附加压力9.对某基元反应 A+2B →3D ,用A 、B 、D 的浓度变化表示的反应速率常数分别为 k A 、k B 、k D ,它们之间的关系为( )(A) k A =k B =k D (B) k A =2k B =3k D (C) k A =(1/2)k B =(1/3)k D (D) (1/2)k A =k B =(2/3)k D 10.某反应速率系数与各基元反应速率系数的关系为2/1412)2/(k k k k =,则该反应的表观活化能E a 与各基元反应活化能的关系是: ( )(A) E a =E 2+(1/2)E 1-E 4 (B) E a =E 2+(1/2)(E 1-E 4) (C) E a =E 2+ (E 1-E 4)1/2(D) E a =E 2+E 1-E 4二、计算题(6题,共65分)1. 甲醇在101.325kPa 下的沸点为64.65℃,在此条件下的摩尔蒸发焓△vap H m = 35.32 kJ mol -1。
华南理工本科物理化学80学时试卷A及参考答案
D. ( U/ nB)T,p,nB
6. 298K 时 A 和 B 两种气体在某一溶剂中溶解的享利系数分别为 kA 和 kB,且知 kA>kB,则
当 A 和 B 压力相同时,在该溶剂中所溶解的量是( )
A. A 的量大于 B 的量
B. A 的量小于 B 的量
C. A 的量等于 B 的量
C. A 的量与 B 的量无法比较
《
》试卷第 2 页 共 7 页
多分子层)吸附。
5 .对 于反 应 A2+B2 k1 A2B2( 慢 ) , A2B2 k2 2AB( 快) ,中 间物 的 浓 度 可用
______________( 稳 态 近 似 法 , 平 衡 态 近 似 法 ) 处 理 得 到 , 反 应 速 率 AB=____________________。
(2) 计算 25 ℃时乙醇浓度为 0.1mol·dm-3 的表面吸附量。 (8 分)
7.已知反应 NO2(g) =NO(g) + (1/2)O2(g) 以 NO2 的消耗速率表示的反应速率常数与温度 的关系为
ln(k/dm3·mol-1·s-1)=-12884K/T +20.2664 (1) (1) 试求反应的级数,活化能 Ea 及指前因子 A。
6. 对于连串反应,若中间物为主产物,为得到较多的主产物,应采取的手段是控制 ____________(反应温度,反应时间,反应物浓度)。
三. 计算题(7 题,共 64 分)
1. 1mol 理想气体从 300K ,100kPa 下恒压加热到 600K,求此过程的 Q、W、U、H、 S、G。已知此理想气体 300K 时的 Sm=150.0J·K-1·mol-1,cp,m=30.00 J·K-1·mol-1。 (10 分)
物化期末考试含答案B
,考试作弊将带来严重后果!华南理工大学期末考试《物理化学》(48、56、64学时)试卷(B)1. 考前请将密封线内填写清楚;2. 所有答案请直接答在试卷上;3.考试形式:闭卷;选择题.(每题2分,10题共20分)1. 已知反应CO(g)+1/2O2(g) →CO2(g) 的焓变为△H,下列说法中何者是不正确?A. △H是CO2(g) 的生成焓B. △H是CO(g)的燃烧焓C. △H是负值D. △H与反应△U的数值不等2. 室温下,10 p O-的理想气体绝热节流膨胀至5p O-的过程有:(1) W < 0 ;(2) T1> T2;(3) Q = 0 ;(4) △S > 0A. (3)、(4)B. (2)、(3)C. (1)、(3)D. (1)、(2)3. 反应N2(g) + 3H2(g) = 2NH3(g) 可视为理想气体间反应,在反应达平衡后,若维持系A. K pθ不变,平衡时N2和H2的量将增加,而NH3的量减少B. K pθ不变,且N2,H2,NH3的量均不变C. K pθ不变,平衡时N2和H2的量将减少,而NH3的量增加D. K pθ 增加,平衡时N2和H2的量将减少,NH3的量增加4. 298K时A和B两种气体在某一溶剂中溶解的享利系数分别为k A和k B,且知k A>k B,A和B压力相同时,在该溶剂中所溶解的量是( )A. A的量大于B的量B. A的量小于B的量C. A的量等于B的量 C. A的量与B的量无法比较5. NH4HS(s) 和任意量的NH3(g) 及H2S(g) 达平衡时有( )A. C = 2,P = 2,F = 2;B. C = 1,P = 2,F = 1;C. C = 2,P = 3,F = 2;D. C = 3,P = 2,F = 3;6. 下列纯物质两相平衡有关的描述,不正确的是( )A.沸点将随压力增加而升高B. 熔点将随压力增加而升高C.蒸气压将随温度升高而加大D. 升华温度将随压力增大而升高7. 同一温度、压力下,一定量某纯物质的熵值______________ 。
华南理工大学物理化学期末考试期末试卷
华南理工大学期末考试《物理化学》试卷A注意事项:1. 考前请将密封线内各项信息填写清楚;2. 所有答案请直接答在试卷上(或答题纸上);3.考试形式:闭卷;4. 本试卷共五大题,满分100分,考试时间120分钟。
题号一二三四五六七总分得分评卷人一.下列各小题中提供的4个答案中只有1个是正确的,请将这个正确的答案选出来,将代表这个答案的字母(A或B或C或D)填入相应的空位中,或在相应的答案上标出记号(打勾、画圈等)。
(共10小题,每小题2分,共20分)1.电解质材料应该是。
(A) 电子导体;(B) 离子导体;(C)混合导体;(D)绝缘体2.右边的图可能表示的是。
(A)强电解质的导电率随浓度的变化(B)弱电解质的导电率随浓度的变化(C)强电解质的摩尔导电率随浓度的变化(D)弱电解质的摩尔导电率随浓度的变化第一大题第2小题的图3.实验表明,光气的合成反应CO(g) + Cl(g) == COCl2(g)的反应速率方程为r==k[CO][Cl2]3/2, 该反应的级数为。
(A) 1级;(B)5/2级;(C) 3/2级;(D) 无法确定。
4.高分子化合物对溶胶的絮凝作用有很大的实用价值,如用于污水处理、过滤、洗涤等等。
在这些应用中,高分子化合物的用量。
(A)越少越好;(B)越多越好;(C)有一最佳用量;(D)多少都可以。
5.下面哪种性质属于化学吸附的性质?(A) 无选择性;(B) 需要活化能;(C) 不稳定,易解析;(D) 吸附速率较快,不受温度影响6.胶体分散系统中,分散相粒子(胶体离子)的大小范围是。
(A) r<1nm;(B) 1nm<r<100nm;(C) 100nm<r<1000nm;(D) r>1000nm。
7.在正、反两个方向都能进行的化学反应称作。
(A)对峙反应;(B)平行反应;(C)连续反应;(D)链反应。
8.已知25℃时,一些电解质的无限稀溶液的摩尔电导率为:Λm∞(NaAc) = 91.0×10-4 S·m2·mol-1,Λm∞ (HCl)=426.2×10-4S·m2·mol-1,Λm∞ (NaCl)=126.5×10-4 S·m2·mol-1,请问25℃时Λm∞ (HAc)是多少?。
(完整版)华南理工大学期末考试物理化学试卷2008.643(1)
华南理工大学《物理化学》64-3试卷 (参考答案其它试题)专业________ 班级编号______ 姓名分数一、选择体(每题2分,共20分)1. 在恒T、pθ下,C(石墨) + O2 (g)─→CO2(g) 的反应焓为△r H mθ,下列哪种说法是错误的( )A. △r H mθ是CO2(g)的标准生成焓B. △r U mθ< △r H mθC. △r H mθ是石墨的燃烧焓D. △r H mθ=△r U mθ2. 1mol的纯液体在其正常沸点时汽化为蒸气,该过程中增大的量是( )A. 蒸气压B. 汽化焓C. 系统熵D. 吉氏函数3. 根据依数性以渗透压法来测定化合物的摩尔质量时,最广泛被用来测定的化合物是( )A. 无机非电解质B.低分子的有机物C.无机的电解质D.大分子化合物4. 反应 CO(g) + H2O(g) = CO2(g) + H2(g) 在 600℃、100kPa下达到化学平衡,当压力增大到 5000kPa 时,各气体的逸度系数为:ϕ(CO2) = 1.90 ϕ(H2) = 1.10 ϕ(CO) = 1.23 ϕ(H2O) = 0.77 则平衡点( )A. 向右移动B. 不移动C. 向左移动D. 无法确定5. 将NH4Cl(s)置于抽空容器中,加热到597K,使NH4Cl(s)分解, NH4Cl(s)=NH3(g)+HCl(g)达平衡时系统总压力为100kPa,则热力学标准平衡常数K pθ为( )A. 0.5B. 0.025C. 0.05D. 0.256. 下列各电池中,其电池电动势与氯离子的活度a(Cl-)无关的是( )A. Zn |ZnCl2(aq) | Cl2(p),PtB. Zn | ZnCl2(aq) KCl(aq) | AgCl(s) | AgC.Pt,H2(p1) | HCl(aq)| Cl2 (p2),PtD. Ag | AgCl(s) | KCl(aq) | Cl2(p),Pt7. 当表面活性物质加入溶剂后,所产生的结果是( )A. dγ/d c < 0,正吸附B. dγ/d c <0,负吸附C. dγ/d c > 0,正吸附D. dγ/d c >0,负吸附8. 微小晶体与普通晶体相比较,那一种性质不确?( )A. 微小晶体的饱和蒸气压大B. 微小晶体的溶解度大C. 微小晶体的熔点较低D. 微小晶体的溶解度较小9. 反应速率常数随温度变化的阿累尼乌斯(Arrhenius)经验公式适用于( )A. 基元反应B. 基元反应和大部分非基元反应C. 对行反应D. 所有化学反应10. 憎液溶胶是热力学上的( )A. 不稳定、可逆的系统B. 不稳定、不可逆系统C. 稳定、可逆的系统D. 稳定、不可逆系统二、填空题(共12分)1. 一个过程系统的熵变为△S,而另一个过程的始终态与前过程相同,但路径不同,则此过程系统的熵变应为___________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3. 已知 298 K 和 p时反应 C2H4(g) + H2O(l) = C2H5OH(l) 的有关数据如下: C2H5OH(l)
$ Δ f Hm /(kJ·mol1) $ Sm /(J·K1·mol1)
C2H4(g) 5226 2196 43.56
H2O(l) 285.83 69.91 75.291
学号
4. 不挥发的溶质溶于溶剂中形成稀溶液之后,相对于溶剂而言将会引起溶液的
姓名
《物理化学》48 学时试卷 A 第 9 页 共 8 页
5. 某温度下,反应 CH3OH(g) =HCHO(g) + H2(g) 的 K=8.283,假设体系为理想 气体反应系统,则当 p(CH3OH)=1 kPa , p(HCHO)=5 kPa , p(H2)=10 kPa 时,反应将 ( ) 。 (A) 向正反应方向进行 (C) 刚好处于平衡状态 (B) 向逆反应方向进行 (D) 不能判断其进行的方向
《物理化学》48 学时试卷 A 第 5 页 共 8 页
4. 银(熔点为 960℃)和铜(熔点为 1083℃)在 779℃时形成一最低共熔混合物,其组 成为含铜的摩尔分数 x(Cu)=0.399。该系统有 和 两个固溶体,在不同温度时其组成 如下表所示: t/ ℃ 779 500 200 xCu(固溶体) 0.141 0.031 0.0035 0.951 0.990 0.999
(1) 绘制该系统的温度-组成图; (2) 在图中标出各相区的相态和自由度数; (3) 画出含 Cu 的摩尔分数为 x(Cu)=0.60 的溶液从 1100℃冷却时的冷却曲线, 并指 明相态变化。 (10 分)
0.0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1.0
《物理化学》48 学时试卷 A 第 6 页 共 8 页
3. 某理想气体从同一始态(p1,V1,T1)出发,分别经恒温可逆压缩和绝热可逆压缩至同 一体积 V2,若环境所做功的绝对值分别为 WT 和 WA, 则有 ( (A) WT>WA (C) WT =WA ( )。 (A) 凝固点下降 (B) 沸点降低 (C) 蒸汽压升高 (D) 化学势不变 (B) WT <WA (D) WT 和 WA 无确定关系
277.7 161 111.5
Cp,m / (J·K1·mol1)
$ $ $ (1) 试求反应在 25℃时的 Δ r H m 、 Δ r Sm 和 Δ r Gm 及 K。
(2)
$ $ $ 计算 500K 和 p时反应的 Δ r H m 、 Δ r Sm 和 Δ r Gm ? 此时反应能否进行? (10 分)
(B) 随浓度增大而单调地减小 (D) 随浓度增大而先减小后增大
(C) 表面张力 )。
(D) 粘性
10.处理复杂反应动力学的稳态近似法要求条件为(
(B) 反应物浓度不变 (D) 中间物浓度不变
二、简答题(2 题,共 15 分)
1. 简要说明和解释下列系统将会出现何种现象: (1) 稀糖水溶液的凝固点和沸点。 (2) 非常纯的水的凝固点。 (3) 水中加表面活性剂。 (5 分)
6. MgCO3(s)与其分解产物 MgO(s)和 CO2(g)达到平衡,该情况下系统的组分数 C、 相数 P 和自由度数 F 分别为( (A) C=3, P=3, F=2 (C) C=1, P=3, F=0 (A) = kcAcB (C) = kcAcB /(1+KAcAcB) )。 (B) C=2, P=3, F=1 (D) C=1, P=2, F=1 )。 (B) = kcAcB (D) 无法直接确定 ) 。
5. 醋 酸 酐 的 分 解 反 应 活 化 能 Ea=144.4 kJ·mol-1, 已 知 284℃ 时 的 速 率 常 数 k=3.3×10-2s-1。试解决如下问题: (1) 反应的级数。 (2) 现在控制反应在 10 分内转化率达 90%,试求其速率常数。 (3) 满足条件(2)的反应温度? (10 分)
题号 得分
一
二 1 2 1 2 3
三 4 5 6 7
总分
专业班级
一、选择题(10 题,每题 2 分,共 20 分) 1. 热力学第三定律完善的描述为( )。
_____________ ________ 学院
(A) 凝聚系统在恒温过程中的熵变, 随温度趋于 0K 而趋于 0 (B) 凝聚系统在恒温过程中的熵变为 0 (C) 纯物质完美晶体的熵, 随温度趋于 0K 而趋于 0 (D) 纯物质完美晶体的熵, 0K 时为 0 2. 工作在 393K 和 293K 的两个大热源的卡诺热机,其效率为( (A) 83% (B) 25% (C) 100% (D) 20% )。 )。
(6) 25℃, ( 电极 ZnSO4(a)|Zn 电极电势为 E(Zn2+|Zn),这就是该电极的标准电动势。
)
(7) 因为熵是状态函数,熵变与过程无关,因而绝热可逆过程和绝热不可逆过程的熵变亦 相等。( ) ) ) )
(8) 克拉佩龙方程适用于纯物质的任何两相平衡。( (9) 理想气体的内能和焓都仅是温度的函数。(
6. MgCO3(s)与其分解产物 MgO(s)和 CO2(g)达到平衡,该情况下系统的组分数 C、 相数 P 和自由度数 F 分别为( (A) C=3, P=3, F=2 (C) C=1, P=3, F=0 (A) = kcAcB (C) = kcAcB /(1+KAcAcB) )。 (B) C=2, P=3, F=1 (D) C=1, P=2, F=1 )。 (B) = kcAcB (D) 无法直接确定 ) 。
( 密 封 线 内 不 答 题 ) ……………………………………………密………………………………………………封………………………………………线……………………………………
诚信应考,考试作弊将带来严重后果!
班内编号
华南理工大学本科生期末考试
《物理化学》48 学时 A 卷
注意事项:1. 开考前请将密封线内各项信息填写清楚; 2. 所有答案请直接答在试卷上; 3.考试形式:闭卷; 4. 本试卷共三大题,满分 100 分,考试时间 120 分钟。
《物理化学》48 学时试卷 A 第 3 页 共 8 页
2. 两种挥发性液体 A 和 B 混合形成理想液态混合物, 某温度时液面的蒸汽总压为 5.41×104 Pa,气相中 A 物质的量分数为 0.450,液相中为 0.650。试求此温度时纯 A 和 纯 B 的蒸汽压?(5 分)
《物理化学》48 学时试卷 A 第 4 页 共 8 页
《物理化学》48 学时试卷 A 第 2 页 共 8 页
2. 判断下列问题是否正确(使用√或×。每题 1 分,共 10 分) (1) 平衡常数值改变了, 平衡一定会移动; 反之, 平衡移动了, 平衡常数值一定会改变。 ( ) )
(2) 在水的相图中,冰熔化曲线的斜率为负,即压力随温度升高而下降。( (3) 任何一个偏摩尔量均是温度,压力,组成的函数。( (4) 稀溶液中溶剂服从拉乌尔定律,溶质必服从亨利定律。( (5) 同温度下,小液滴的饱和蒸气压恒大于平液面的蒸气压。( ) ) )
_____________ ________ 学院
(A) 凝聚系统在恒温过程中的熵变, 随温度趋于 0K 而趋于 0 (B) 凝聚系统在恒温过程中的熵变为 0 (C) 纯物质完美晶体的熵, 随温度趋于 0K 而趋于 0 (D) 纯物质完美晶体的熵, 0K 时为 0 2. 工作在 393K 和 293K 的两个大热源的卡诺热机,其效率为( (A) 83% (B) 25% (C) 100% (D) 20% )。 )。
3. 某理想气体从同一始态(p1,V1,T1)出发,分别经恒温可逆压缩和绝热可逆压缩至同 一体积 V2,若环境所做功的绝对值分别为 WT 和 WA, 则有 ( (A) WT>WA (C) WT =WA ( )。 (A) 凝固点下降 (B) 沸点降低 (C) 蒸汽压升高 (D) 化学势不变 (B) WT <WA (D) WT 和 WA 无确定关系
注意事项:1. 开考前请将密封线内各项信息填写清楚; 2. 所有答案请直接答在试卷上; 3.考试形式:闭卷; 4. 本试卷共三大题,满分 100 分,考试时间 120 分钟。
题号 得分
一
二 1 2 1 2 3
三 4 5 6 7
总分
专业班级
一、选择题(10 题,每题 2 分,共 20 分) 1. 热力学第三定律完善的描述为( )。
《物理化学》48 学时试卷 A 第 8 页 共 8 页
( 密 封 线 内 不 答 题 ) ……………………………………………密………………………………………………封………………………………………线……………………………………
诚信应考,考试作弊将带来严重后果!
班内编号
华南理工大学本科生期末考试
《物理化学》48 学时 A 卷
(10) 法拉第定律不受温度,压力,电解质浓度,电极材料和溶剂性质诸因素的影响。(
三、计算题(7 题 在 373 K 下小心恒温压缩,在没有灰尘情况下获得了压力为 2×101.325 kPa 的过热蒸气,但不久全凝结为液态水,请计算该凝聚过程的 Q,W,H, S,G。 H2O(g, 373 K, 2×101.325 kPa) H2O(l, 373 K, 2×101.325 kPa) 已知在 373 K, 101.325 kPa 下, 水的汽化热为 46.024 kJ·mol-1, 设气体为理想气体, 水的密度为 1000 kgm-3,液体体积不受压力影响。 (1 0 分)
学号
4. 不挥发的溶质溶于溶剂中形成稀溶液之后,相对于溶剂而言将会引起溶液的
姓名
《物理化学》48 学时试卷 A 第 1 页 共 8 页
5. 某温度下,反应 CH3OH(g) =HCHO(g) + H2(g) 的 K=8.283,假设体系为理想 气体反应系统,则当 p(CH3OH)=1 kPa , p(HCHO)=5 kPa , p(H2)=10 kPa 时,反应将 ( ) 。 (A) 向正反应方向进行 (C) 刚好处于平衡状态 (B) 向逆反应方向进行 (D) 不能判断其进行的方向
