初中化学用语
化学用语集锦
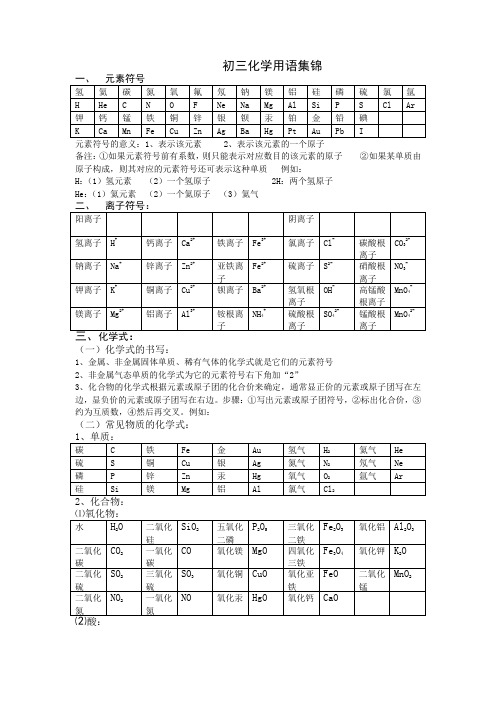
初三化学用语集锦元素符号的意义:1、表示该元素 2、表示该元素的一个原子备注:①如果元素符号前有系数,则只能表示对应数目的该元素的原子②如果某单质由原子构成,则其对应的元素符号还可表示这种单质例如:H:(1)氢元素(2)一个氢原子 2H:两个氢原子He:(1)氦元素(2)一个氦原子(3)氦气(一)化学式的书写:1、金属、非金属固体单质、稀有气体的化学式就是它们的元素符号2、非金属气态单质的化学式为它的元素符号右下角加“2”3、化合物的化学式根据元素或原子团的化合价来确定,通常显正价的元素或原子团写在左边,显负价的元素或原子团写在右边。
步骤:①写出元素或原子团符号,②标出化合价,③约为互质数,④然后再交叉。
例如:(二)常见物质的化学式:其他:过氧化氢 H2O2甲烷 CH4乙醇 C2H5OH 醋酸CH3COOH 葡萄糖C6H12O6尿素 CO(NH2)2O附录一、常见物质的颜色1、固体的颜色2、溶液中离子的颜色3、沉淀的颜色二、火焰的颜色三、离子的共存离子能否共存取决于两种离子相遇后能否生成水、气体或沉淀,如能生成上述物质则离子不能共存。
常见的有:1、H+和OH-会反应会生成H2O2、NH4+和OH-生成NH3和H2O3、H+和CO32-会生成H2CO3,分解后生成H2O和CO2气体4、Ca2+和CO32-会生成CaCO3沉淀,Cu2+、Fe3+与OH-会生成Cu(OH)2、Fe(OH)3沉淀,Ag+与Cl-生成AgCl沉淀,Ba2+与SO42-、CO32-生成BaSO4和BaCO3沉淀。
初中全部化学方程式方程式:4H2O+3Fe 高温Fe3O4+4H2式量: 72 168 232 8描述:赤热的铁跟水蒸气反应生成四氧化三铁和氢气。
方程式:4FeS2+11O2 高温2Fe2O3+8SO2式量: 480 352 320 512描述:燃烧硫铁矿(主要成分是FeS2)生成Fe2O3和SO2方程式:C+O2 点燃CO2式量: 12 32 44 描述:碳在氧气中充分燃烧方程式:S+O2 点燃SO2式量: 32 32 64 描述:硫粉在空气中燃烧方程式:4P+5O2 点燃2P2O5式量: 124 160 284 描述:红磷在空气中燃烧方程式:3Fe+2O2 点燃Fe3O4式量: 168 64 232 描述:铁在氧气中燃烧方程式:2C2H2+5O2 点燃4CO2+2H2O式量: 52 160 176 36 描述:方程式:CH4+2O2 点燃CO2+2H2O式量: 16 64 44 36 描述:甲烷在空气中燃烧方程式:2H2+O2 点燃2H2O式量: 4 32 36 描述:氢气中空气中燃烧方程式:2Mg+O2 点燃2MgO式量: 48 32 80 描述:镁在空气中燃烧方程式:2Cu+O2 △2CuO式量: 127 32 159 描述:铜在空气中受热方程式:4Al+3O2 △2Al2O3式量: 108 96 204 描述:铝在空气中燃烧方程式:2KClO3 △2KCl+3O2↑式量: 245 149 96描述:加热氯酸钾方程式:2KClO3MnO2△2KCl+3O2↑式量: 245 149 96描述:加热氯酸钾(有少量的二氧化锰)方程式:2KMnO4 △K2MnO4+MnO2+O2↑式量: 316 197 87 32 描述:加热高锰酸钾方程式:NH4HCO3 △NH3↑+H2O+CO2↑式量: 79 17 18 44 描述:方程式:Cu2(OH)2CO3 △2CuO+CO2↑+H2O式量: 221 159 44 18描述:加热碱式碳酸铜方程式:2HgO △2Hg+O2↑式量: 434 402 32 描述:方程式:2H2O 电解2H2↑+2O2↑式量: 36 4 64描述:水在直流电的作用下分解方程式:Zn+H2SO4 ZnSO4+H2↑式量: 65 98 161 2描述:锌和稀硫酸方程式:Mg+H2SO4 MgSO4+H2↑式量: 24 98 120 2描述:镁和稀硫酸方程式:Zn+2HCl ZnCl2+H2↑式量: 65 73 136 2描述:锌和稀盐酸方程式:Fe+2HCl FeCl2+H2↑式量: 56 73 127 2描述:铁和稀盐酸方程式:ZnO+2HCl ZnCl2+H2O 式量: 81 73 136 18描述:方程式:8Al+3Fe3O4 点燃9Fe+4Al2O3式量: 216 696 504 408 描述:方程式:Al2O3+3H2SO4 Al2(SO4)3+3H2O 式量: 102 294 342 54描述:方程式:CuO+H2 △Cu+H2O式量: 79.5 2 63.5 18描述:氢气还原氧化铜方程式:CuSO4+2NaOH Na2SO4+Cu(OH)2↓式量: 159.5 80 142 97.5描述:方程式:Fe3O4+4CO 高温3Fe+4CO2式量: 232 112 168 176描述:一氧化碳还原四氧化三铁方程式:Fe2(SO4)3+6NaOH 2Fe(OH)3↓+3Na2SO4式量: 400 240 214 426 描述:方程式:MnO2+4HCl △MnCl2+2H2O+Cl2↑式量: 87 146 126 36 71 描述:方程式:2C2H6+7O2 点燃4CO2+6H2O式量: 60 224 176 108描述:方程式:Cu+4HNO3 Cu(NO3)2+2NO2↑+2H2O 式量: 63.5 252 187.5 92 36描述:方程式:Zn+CuSO4 ZnSO4+Cu式量: 65 159.5 161 63.5描述:方程式:2Al+3H2SO4 Al2(SO4)3+3H2↑式量: 54 294 342 6描述:铝和稀硫酸方程式:C2H4+3O2 点燃2CO2+2H2O式量: 28 96 88 36描述:方程式:2Na+2H2O 2NaOH+H2↑式量: 46 36 80 2描述:方程式:CO2+C 高温2CO式量: 44 12 56 描述:方程式:CuO+CO △Cu+CO2式量: 79.5 28 63.5 44 描述:一氧化碳还原氧化铜方程式:2CO+O2 点燃2CO2式量: 56 32 88 描述:一氧化碳在氧气中燃烧方程式:2CuO+C △2Cu+CO2↑式量: 159 12 127 44 描述:木炭还原氧化铜方程式:2Fe2O3+3C 高温4Fe+3CO2↑式量: 320 36 224 132 描述:焦炭还原氧化铁方程式:CO2+H2O H2CO3 式量: 44 18 62描述:二氧化碳溶解于水方程式:H2CO3 H2O+CO2↑式量: 62 18 44描述:碳酸不稳定而分解方程式:CaCO3 高温CaO+CO2↑式量: 100 56 44描述:高温煅烧石灰石方程式:CaCO3+CO2+H2O Ca(HCO3)2式量: 100 44 18 162描述:方程式:Ca(HCO3)2 CaCO3↓+H2O+CO2↑式量: 162 100 18 44描述:方程式:CaCO3+2HCl CaCl2+H2CO3式量: 100 73 111 62描述:方程式:CaCO3+2HCl CaCl2+H2O+CO2↑式量: 100 73 111 18 44描述:大理石与稀盐酸反应方程式:C+H2O 高温CO+H2↑式量: 12 18 28 2描述:方程式:Na2CO3+2HCl 2NaCl2+H2O+CO2↑式量: 106 73 188 18 44 描述:碳酸钠与稀盐酸反应方程式:C2H5OH+3O2 点燃2CO2+3H2O式量: 46 96 88 54 描述:酒精在空气中燃烧方程式:2CH3OH+3O2 点燃2CO2+4H2O式量: 64 96 88 72 描述:方程式:Fe+H2SO4 FeSO4+H2↑式量: 56 98 152 2描述:方程式:Fe+CuSO4 FeSO4+Cu 式量: 56 159.5 152 63.5描述:方程式:Fe2O3+6HCl 2FeCl3+3H2O式量: 160 219 325 54描述:方程式:Cu(OH)2+2HCl CuCl2+2H2O式量: 97.5 73 134.5 36描述:方程式:AgNO3+HCl AgCl↓+HNO3式量: 170 36.5 143.5 63描述:方程式:Fe2O3+3H2SO4 Fe2(SO4)3+3H2O 式量: 160 294 400 54描述:方程式:Cu(OH)2+H2SO4 CuSO4+2H2O式量: 97.5 98 159.5 36描述:方程式:BaCl2+H2SO4 BaSO4↓+2HCl式量: 208 98 233 73描述:方程式:ZnO+2HNO3 Zn(NO3)2+H2O式量: 81 126 189 18描述:方程式:Mg(OH)2+2HNO3 Mg(NO3)2+2H2O 式量: 58 126 148 36描述:方程式:CuO+H2SO4 CuSO4+H2O式量: 79.5 98 159.5 18描述:方程式:NaOH+HCl NaCl+H2O式量: 40 36.5 58.5 18描述:方程式:2NaOH+CO2 Na2CO3+H2O式量: 80 44 106 18描述:方程式:2NaOH+SO2 Na2SO3+H2O式量: 80 64 126 18描述:方程式:2NaOH+H2SO4 Na2SO4+2H2O式量: 80 98 142 36描述:方程式:NaOH+HNO3 NaNO3+H2O式量: 40 63 85 18描述:方程式:2NaOH+CuSO4 Cu(OH)2↓+Na2SO4 式量: 80 159.5 97.5 142描述:方程式:3NaOH+FeCl3 Fe(OH)3↓+3NaCl式量: 120 162.5 107 175.5描述:方程式:CaO+H2O Ca(OH)2式量: 56 18 74描述:生石灰(CaO)溶于水生成熟石灰Ca(OH)2方程式:Ca(OH)2+SO3 CaSO4+H2O式量: 74 80 136 18描述:方程式:Ca(OH)2+CO2 CaCO3↓+H2O式量: 74 44 100 18描述:方程式:Ca(OH)2+Na2CO3 CaCO3↓+2NaOH 式量: 74 106 100 80描述:方程式:2NaOH+SO3 Na2SO4+H2O式量: 80 80 142 18描述:方程式:Zn+CuSO4 ZnSO4+Cu式量: 65 159.5 161 63.5描述:方程式:Hg(NO3)2+Cu Cu(NO3)2+Hg式量: 325 63.5 187.5 201描述:方程式:NaOH+NH4NO3 NaNO3+NH3↑+H2O 式量: 40 80 85 17 18。
(完整版)初三化学全册必背知识点(精华).doc

一分耕耘一分收获初中化学全册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属:O氧H氢N氮Cl氯C碳P磷S硫金属:K钾Ca钙Na钠Mg镁Al铝Zn锌Fe铁Cu铜Hg汞Ag银Mn锰Ba钡原子团 ( 根 ) :氢氧根硝酸根碳酸根硫酸根铵根--OH NO 32-CO 32-+SO4NH 42、 (1) 常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2)常见原子团 ( 根 ) 化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。
3、必须熟记的常见物质的俗称、化学名称、化学式、用途俗称化学名称化学式用途金刚石、石墨、木炭等碳单质 C 金刚石做钻头、切割玻璃石墨做铅笔芯、电极干冰二氧化碳固体CO 人工降雨,致冷剂2水水H2O 最常见溶剂铁锈氧化铁Fe2O3生石灰氧化钙CaO 食品干燥剂熟石灰、消石灰(澄清石灰水)氢氧化钙Ca(OH)2 改良酸性土壤石灰石、大理石(蛋壳、水垢等)碳酸钙CaCO 建筑材料、工业制取 CO3 2 火碱、烧碱、苛性钠氢氧化钠NaOH 氢氧化钠固体作干燥剂、化工原料、清洁剂盐酸( 氯化氢 ) HCl 除铁锈、胃酸主要成分纯碱、苏打碳酸钠23玻璃、造纸、纺织、洗涤Na CO碳酸氢钠小苏打 3 发酵粉、治疗胃酸过多NaHCO天然气、沼气、瓦斯甲烷CH4 燃料酒精乙醇C2H5OH 燃料、乙醇汽油4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑( 2)实验室制取氧气二:2H 2O2 ===2H2O+O2↑(3)实验室制取氧气三: 2KClO 3===2KCl+3O2↑(4)实验室制法 CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑( 5)实验室制取氢气:Zn+H 2SO4==ZnSO4+H2↑ Zn + 2HCl = ZnCl 2 +H2↑(6)电解水制取氢气: 2H 2O===2H↑ +O2↑( 7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu(Fe与盐、酸反应都生成的是+2 价亚铁离子)( 8)炼铁原理:3CO+Fe2O3===2Fe+3CO(Fe2O3与酸反应生成的是+3 价铁离子)(9)熟灰水 [Ca(OH) 2 ] 的制取方法: CaO+H2O==Ca(OH)2(10)生石灰 ( 氧化钙 ) 制取方法: CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱:K Ca Na Mg Al,Zn Fe Sn Pb (H),Cu Hg Ag Pt Au。
初中化学必背知识点打印版

初中化学必背知识点打印版一、化学用语。
1. 元素符号。
- 前20号元素:氢(H)、氦(He)、锂(Li)、铍(Be)、硼(B)、碳(C)、氮(N)、氧(O)、氟(F)、氖(Ne)、钠(Na)、镁(Mg)、铝(Al)、硅(Si)、磷(P)、硫(S)、氯(Cl)、氩(Ar)、钾(K)、钙(Ca)。
- 常见金属元素:铁(Fe)、铜(Cu)、锌(Zn)、银(Ag)、金(Au)、汞(Hg)等。
2. 化学式。
- 单质化学式。
- 金属单质:用元素符号表示,如铁(Fe)、铜(Cu)等。
- 固态非金属单质:一般用元素符号表示,如碳(C)、硫(S)等;但碘(I₂)除外。
- 稀有气体:用元素符号表示,如氦气(He)、氖气(Ne)等。
- 气态非金属单质:在元素符号右下角写上表示分子中所含原子数的数字,如氢气(H₂)、氧气(O₂)、氮气(N₂)等。
- 化合物化学式。
- 书写原则:正价在前,负价在后,根据化合物中正负化合价代数和为零的原则确定原子个数比。
- 例如:水(H₂O),其中氢元素化合价为 + 1,氧元素化合价为 - 2;氯化钠(NaCl),钠元素化合价为+1,氯元素化合价为 - 1。
3. 化学方程式。
- 书写原则。
- 一是必须以客观事实为基础;二是要遵守质量守恒定律,等号两边各原子的种类和数目必须相等。
- 例如:- 镁在空气中燃烧:2Mg + O₂{点燃}{===}2MgO。
- 实验室制取氧气:- 加热高锰酸钾:2KMnO₄{}{===}K₂MnO₄+MnO₂+O₂↑。
- 过氧化氢分解:2H₂O₂{MnO_2}{===}2H₂O+O₂↑。
- 化学方程式的意义。
- 质的方面:表示反应物、生成物和反应条件。
如氢气和氧气在点燃条件下反应生成水。
- 量的方面:- 宏观上:表示反应物、生成物之间的质量比。
在2H₂+O₂{点燃}{===}2H₂O中,氢气、氧气和水的质量比为4:32:36 = 1:8:9。
- 微观上:表示反应物、生成物之间的粒子个数比。
初中化学用语汇总

初中化学用语汇总1. 原子:构成分子的最小粒子。
2. 元素:由同种原子组成的物质。
4. 分子:由两个及以上原子组成的不带电荷的粒子。
6. 原子量:一个原子质量单位。
8. 周期表:元素根据其原子核结构的排列方式排列的表格。
9. 金属:具有良好的导电性和热传导性质的物质。
11. 金属元素:处于周期表左侧的元素。
16. 原子核:由质子和中子组成的原子中心部分。
17. 共价键:由电子对共享形成的键。
18. 离子键:带正电荷和负电荷之间的相互作用。
21. 化学键:元素通过共享或转移电子形成的化学物质的力。
22. 化学式:用元素符号表示化合物的组成。
23. 反应物:在化学反应中参与反应的物质。
25. 化学反应:物质之间的化学相互作用。
26. 酸:会释放出氢离子的物质。
28. 盐:由阳离子和阴离子组成的离子化合物。
30. 溶解:由固体或气体转变为液体。
31. 溶质:溶解在溶剂中的物质。
34. 沉淀:在溶液中形成的固体颗粒。
36. 电离:在溶液中将电解质分解为离子。
39. 化学平衡:反应物和生成物在化学反应中达到平衡状态。
40. 配位化合物:由中心金属离子和其它分子和离子中的原子和分子共价结合而成的化合物。
41. 化学式计算:根据化学式计算元素的质量。
42. 摩尔质量:化学式中一个摩尔的质量。
43. 密度:单位体积内的物质质量。
44. 燃烧:化合物与氧气彻底反应的化学反应。
46. 温度:温度代表了物体内部分子的平均运动速度。
47. 热力学系统:研究热和压力与化学反应之间的关系。
48. 热能:热能是物体或系统储存的能量。
49. 热动力学:热的能量学,研究物质内部热运动的规律。
50. 热量:由于温度差异而流动的能量。
51. 热容:物质单位质量的温度变化时吸收或释放的热量。
52. 热传导:热能通过物质的传递。
53. 热平衡:两个物体之间热能的交换达到相同的温度。
54. 热力学第一性原理:能量守恒。
55. 内能:热力学系统内分子内部相互作用引起的能量总和。
初中化学知识点归纳

初中化学知识点归纳化学是一门充满神奇和趣味的学科,对于初中生来说,掌握好化学的基础知识至关重要。
下面就为大家归纳一下初中化学的重要知识点。
一、化学用语1、元素符号元素符号是用来表示元素的特定符号,如氢(H)、氧(O)、碳(C)等。
记住常见元素的符号是学习化学的基础。
2、化学式用元素符号表示物质组成的式子叫化学式。
例如,水的化学式为H₂O,表示一个水分子由两个氢原子和一个氧原子构成。
3、化学方程式用化学式来表示化学反应的式子叫做化学方程式。
它不仅能表示反应物、生成物和反应条件,还能体现出反应中各物质之间的质量比。
例如,氢气和氧气反应生成水的化学方程式为:2H₂+ O₂点燃2H₂O二、物质的性质和变化1、物理变化和化学变化物理变化是指没有生成新物质的变化,如物质的状态改变(冰融化成水)、形状改变(铁块被压成铁片)等。
化学变化是指生成新物质的变化,如铁生锈、燃烧等。
2、物理性质和化学性质物理性质是指物质不需要发生化学变化就表现出来的性质,如颜色、状态、气味、熔点、沸点、硬度、密度等。
化学性质是指物质在化学变化中表现出来的性质,如可燃性、氧化性、还原性等。
三、物质的组成1、分子分子是保持物质化学性质的最小粒子。
例如,水是由水分子构成的。
2、原子原子是化学变化中的最小粒子。
在化学反应中,原子的种类和数目不变。
3、离子离子是带电的原子或原子团。
例如,钠离子(Na⁺)、氯离子(Cl⁻)等。
四、常见的物质1、氧气(O₂)氧气是一种无色无味的气体,能支持燃烧和供给呼吸。
2、二氧化碳(CO₂)二氧化碳是一种无色无味的气体,能使澄清石灰水变浑浊,是植物光合作用的原料。
3、水(H₂O)水是生命之源,在常温常压下为无色无味的液体。
4、金属常见的金属有铁(Fe)、铜(Cu)、铝(Al)等,具有良好的导电性、导热性和延展性。
五、化学实验基本操作1、药品的取用固体药品通常用镊子或药匙取用,液体药品通常用倾倒法或量筒量取。
2、给物质加热用酒精灯加热时,要用外焰加热,先预热,再集中加热。
初中化学知识点归纳

初中化学知识点归纳化学是一门神奇而有趣的学科,对于初中生来说,掌握好化学知识不仅能在考试中取得好成绩,还能为今后的学习和生活打下坚实的基础。
下面我们来一起归纳一下初中化学的重要知识点。
一、化学用语1、元素符号元素符号是用来表示元素的化学符号,如氢(H)、氧(O)、碳(C)等。
记住常见元素的符号是学习化学的基础。
2、化学式用元素符号表示物质组成的式子叫做化学式。
例如,水的化学式是H₂O,二氧化碳的化学式是 CO₂。
3、化学方程式化学方程式是用化学式来表示化学反应的式子。
它能反映出反应物、生成物以及反应条件。
例如,氢气燃烧生成水的化学方程式为:2H₂+ O₂点燃 2H₂O二、物质的组成和结构1、原子原子是化学变化中的最小粒子。
原子由原子核和核外电子构成,原子核又由质子和中子组成。
2、分子分子是保持物质化学性质的最小粒子。
例如,氧气(O₂)是由氧分子构成的。
3、离子离子是带电的原子或原子团。
例如,钠离子(Na⁺)、氯离子(Cl⁻)。
三、物质的性质和变化1、物理性质和化学性质物理性质包括颜色、状态、气味、熔点、沸点、密度等。
化学性质则是物质在化学变化中表现出来的性质,如可燃性、氧化性等。
2、物理变化和化学变化物理变化没有新物质生成,例如水的蒸发。
化学变化有新物质生成,如铁的生锈。
四、常见的化学反应类型1、化合反应由两种或两种以上物质生成一种物质的反应。
例如,C + O₂点燃CO₂2、分解反应由一种物质生成两种或两种以上其他物质的反应。
例如,2H₂O₂二氧化锰 2H₂O + O₂↑3、置换反应一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。
例如,Fe + CuSO₄= FeSO₄+ Cu4、复分解反应两种化合物相互交换成分,生成另外两种化合物的反应。
例如,HCl + NaOH = NaCl + H₂O五、溶液1、溶液的概念一种或几种物质分散到另一种物质里,形成均一、稳定的混合物叫做溶液。
2、溶解度在一定温度下,某固态物质在 100g 溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
初三化学全册必背知识点(精华)

初三化学全册必背知识点(精华)初中化学全册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属: O 氧 H 氢 N 氮 Cl 氯 C 碳 P 磷 S 硫 金属: K 钾 Ca 钙 Na 钠 Mg 镁 Al 铝 Zn 锌 Fe 铁 Cu 铜 Hg 汞 Ag 银 Mn 锰 Ba 钡 原子团(根):氢氧根 硝酸根 碳酸根 硫酸根 铵根 OH - NO 3- CO 32- SO 4 2- NH 4+ 2、(1) 常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2) 常见原子团(根)化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。
3、必须熟记的常见物质的俗称、化学名称、化学式、用途俗称化学名称化学式用途金刚石、石墨、木炭等碳单质C 金刚石做钻头、切割玻璃石墨做铅笔芯、电极干冰二氧化碳固体CO 2人工降雨,致冷剂水水H 2O 最常见溶剂铁锈氧化铁Fe 2O 3生石灰氧化钙CaO 食品干燥剂熟石灰、消石灰(澄清石灰水)氢氧化钙Ca(OH)2改良酸性土壤石灰石、大理石(蛋壳、水垢等)碳酸钙CaCO 3建筑材料、工业制取CO 2火碱、烧碱、苛性钠氢氧化钠NaOH 氢氧化钠固体作干燥剂、化工原料、清洁剂盐酸(氯化氢)HCl 除铁锈、胃酸主要成分纯碱、苏打碳酸钠Na 2CO 3玻璃、造纸、纺织、洗涤碳酸氢钠小苏打NaHCO3发酵粉、治疗胃酸过多天然气、沼气、瓦斯甲烷CH4燃料酒精乙醇C2H5OH燃料、乙醇汽油4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三: 2KClO3===2KCl+3O2↑(4)实验室制法CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑ Zn + 2HCl= ZnCl2 +H2↑(6)电解水制取氢气: 2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu (Fe与盐、酸反应都生成的是+2价亚铁离子)(8)炼铁原理:3CO+Fe2O3===2Fe+3CO2 (Fe2O3与酸反应生成的是+3价铁离子)(9)熟灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱: K Ca Na Mg Al , Zn Fe SnPb (H) ,Cu Hg Ag Pt Au 。
初中化学知识点总结大全

初中化学知识点总结大全一、化学用语1、元素符号元素符号是用来表示元素的化学符号,通常用一个大写字母或一个大写字母加上一个小写字母来表示。
例如,氢元素用“H”表示,氧元素用“O”表示,铁元素用“Fe”表示。
2、化学式化学式是用元素符号表示物质组成的式子。
例如,水的化学式为“H₂O”,表示一个水分子由两个氢原子和一个氧原子构成;二氧化碳的化学式为“CO₂”,表示一个二氧化碳分子由一个碳原子和两个氧原子构成。
3、化学方程式化学方程式是用化学式表示化学反应的式子。
它反映了反应物、生成物以及反应条件之间的关系。
例如,氢气在氧气中燃烧生成水的化学方程式为“2H₂+ O₂点燃 2H₂O”。
二、物质的组成和结构1、原子原子是化学变化中的最小粒子。
原子由原子核和核外电子构成,原子核由质子和中子构成。
质子数决定了元素的种类。
2、分子分子是保持物质化学性质的最小粒子。
例如,氧气由氧分子(O₂)构成,水由水分子(H₂O)构成。
3、离子离子是带电的原子或原子团。
例如,钠离子(Na⁺)、氯离子(Cl⁻)等。
三、物质的性质和变化1、物理性质和化学性质物理性质是指物质不需要发生化学变化就表现出来的性质,如颜色、状态、气味、熔点、沸点、密度等。
化学性质是指物质在化学变化中表现出来的性质,如可燃性、氧化性、还原性等。
2、物理变化和化学变化物理变化是指没有生成新物质的变化,如物质的状态变化、形状变化等。
化学变化是指生成新物质的变化,如燃烧、生锈等。
四、常见的化学反应类型1、化合反应由两种或两种以上物质生成一种物质的反应。
例如,碳在氧气中燃烧生成二氧化碳:C + O₂点燃 CO₂2、分解反应由一种物质生成两种或两种以上其他物质的反应。
例如,电解水生成氢气和氧气:2H₂O 通电 2H₂↑ + O₂↑3、置换反应一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。
例如,铁与硫酸铜溶液反应生成铜和硫酸亚铁:Fe + CuSO₄=FeSO₄+ Cu4、复分解反应两种化合物相互交换成分,生成另外两种化合物的反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氢气和氧气之间发生化学反应的过 程,可用下列图示微观描述。 ( 表示氧原子 表示氢原子 )
点燃 (反应前 ) (反应后)
1写出该反应的化学方程式。 2除化学方程式本身表示的意义外, 从上图中你还能得到哪些信息?
相对原子质量
相对分子质量
化学式
化学方程式 电离方程式
元 素 符 号
化合价 原子结构示意图 离子结构示意图 离子符号
+1
D. 2H
元素符号
含义:代表一种元素、元素的一个原子、 (物质的化学式)(H,Fe)
想一想下列元素能否用元素符 号来代表该元素形成单质的化 学式:H O N Cl 碳、硫、磷、稀有气体、金属元 素的元素符号均可表示该物质
以CO2为例,叙述 化学式的含义。
下列物质化学式你记好了么?
单质:
非金属:氧气、氮气、氢气、碳、硫、磷 稀有气体:氦气、氖气、氩气 金属:铁、汞、金、银、铜、钛、铝(氯气) 化合物: 氧化物:二氧化硫、四氧化三铁、氧化铁、生石灰 有机物:甲烷、乙醇、甲醇、醋酸 其它:氯酸钾、高锰酸钾、碳酸钙、氯化钠、盐酸 硫酸、氢氧化钙、氢氧化钠、氨气、硫化氢、氯化 亚铁、硫酸亚铁、
铁元素的化合价为
。 +6
2酸根阴离子R2O72-中,R的化合价 +6 。
判断下列符号中“3”表示的意义, 用序号填空。 +3 3+ ⑴3CO ⑵SO3 ⑶Fe ⑷NaAlO2 表示分子个数的是 。 (1) 表示一个离子所带电荷数是 (3) 。 (4) 表示化合价数值的是 。
表示一个分子中所含原子个数的 是 (2) 。
写出常见原子团的根价符号 酸根 铵 根 磷酸根
化合价符号
-2
离子符号
CO32-
CO3
讨论题
离子符号与化合价符号在书写上有 什么异同点? 相同点:(1)元素符号相同 (2)数值、正负相同 不同点:(1)书写位置不同 (2)数值与正负顺序不同 (3)“1”的省留不同
两图练习题
写出下列图式表示的粒子符号。
Ne ————
———— ————
O2-
+ 2 Mg
其中 +10 表示 原子核内质子数为 , 10
2 2表示 第一电子层上的电子数为 。
下图是某些粒子的结构示意图:
1,其中属于稳定结构的是:____ 2,写出上图中属于原子的符号___,属于 阳离子的符号____,阴离子的符号___
反应前
反应后
A 4 ∶1 ∶ 3
B
3∶1∶2
C4∶1∶2
D 3∶1∶3
下列化学方程式错在哪里?
A.2Fe+6HCl 2FeCl3+3H2
B.CaCO3+HCl
C.H2+CuO D.CO+CuO
CaCl2+H2O+CO2
Cu+H2O Cu+CO2
写出通电分解水的 化学方程式,并叙述其 含义。
小明在做化学实验时发现:长期存 放硝酸银溶液的试剂瓶壁上出现了黑色 斑点,瓶内还有部分红棕色气体。这是 因为硝酸银见光分解生成一种金属、一 种对空气有污染的红棕色二氧化氮气体 和一种能供给呼吸的气体。请写出此反 应的化学方程式。
下列离子符号你记好了么? 阳离子:钠离子、镁离子、铝离子、氢离子、 铵根离子、钙离子、铜离子、亚铁离子、铁 离子、 阴离子:氧离子、氯离子、硫离子、及上面 的酸根离子
一、下列化学式按氯元素化合价 由低到高排列的 顺序是 2.3.4.1.5 。
1.KClO3 2. NaCl 3. Cl2 4. NaClO 5 .HClO4 二 1.新型净水剂铁酸钠Na2FeO4中,
化学符号周围数字表示的意义。
表示化合价的 数值、正负
表示粒子 个数
R
+ m -
n+ -
一个离子所 带电荷的数 值、正负
b 一个分子中
所含原子的 个数
用化学式填空
1.最常见的金属 Fe ,氩气 Ar .
自然界中最硬的物质 C H2 最轻的气体 空气中含量最多的气体
.
.
N2 .
2.地壳中含量最多的金属元素 与含量最多的非金属元素组成的 化合物 Al2O3 .
原子团
专题复习
化学用语
化学用语知识要点:
元素符号 化学式 三 离子符号 三 化学方程式 号 式 电离方程式 化合价符号 两 量 量 图 离子结构示意图 相对分子质量
原子结构示意图
两 相对原子质
1. 现有大写字母N、H和小写字母 a、 e、g,你能写出哪些元素符号. 2 .下列化学用语中,通常只表示微 观意义,不表示宏观意义的是( D ) A. H2 B.H C. H
3最简单的有机物
CH 。 4
4.1998年中国十大科技成果之一是 合成纳米氮化镓。已知镓(Ga)原子
和氮原子的结构示意图分别为
则氮化镓的化学式是
GaN 。
找规律
从上面的练习中,你能 总结出书写化学式时有哪些 规律
。
下图形象地表示某反应前后反应物与生成 物分子及其数目的变化, 、 、、 分别 表示A、B、C三种不同的分子。该反应的化 学方程式中A、B、C前的化学计量数之比为 ( ) B
3,画出其中属于金属元素的原子结构示 意图_____ 4,写出其中属于阴离子形成相对分子 质量最小的物质的化学式___
化 学 用 语
元素符号 物质的组成用语 化合价符号 离子符号 化学式 化学方程式 物质变化用语 电离方程式 原子结构示意图 物质结构用语 离子结构示意图 相对原子质量 化学量用语 相对分子质量
