初中化学用语全61571
初中化学用语全

初中化学用语总结一、单质1、由原子直接构成的单质:2、由分子构成的物质(1)金属单质,如: Na 钠 Cu 铜Mg 镁 Zn 锌Al 铝 Ag 银K 钾 Ba 钡Ca 钙 Pt 铂 Mn 锰 Hg 汞Fe 铁 Au 金(2)非金属固体:C 碳S 硫P 磷(3)稀有气体:He 氦气Ne 氖气Ar 氩气H2氢气N2氮气O2氧气O3臭氧Cl2氯气一、(1)3个碳原子;(2)2个硫酸根离子;(3)臭氧分子;(4)人体中含量最多的物质;(5)氧化铝中铝元素的化合价;(6)空气中含量最多的元素;(7)氯离子;(8)氧化镁;(9)2个氮原子;(10)碳酸根离子。
(11)n个水分子_______二、①2N2;②5Na ;③3个铝离子 ;④氧化钙中钙元素为+2价 ⑤盐酸 ⑥三个磷原子 ⑦ 二个亚铁离子 ⑧ 铁锈的主要成分 ⑨ 天然气的主要成分是(1)2个汞原子 ; (2) 氧化铝中铝元素显+3价 ;(3)2个硝酸根离子 ; (4) 4个镁离子 ; (5)石灰浆的主要成分 ; (6)铁在氧气中燃烧的产物 ;(7)地壳中含量第二位的元素是 ; (8)导致温室效应的气体主要是 。
三、(1)氧元素 ;(2)四氧化三铁 ; (3)氢氧化钾 ;(4)3N ;(5)CO 32-;(6)氯化钡的化学式_______; 四、写化学式(1) 最轻的气体是 ;(2) 在空气中体积分数最大的气体是_______;(3)绿色植物进行光合作用吸收的气体是_______;放出的气体是_______; (4)2个磷原子 ;(5)氢氧根离子 ;(6)生活中常做调味品的盐 ; (7)最简单的有机物 。
(一)、化合反应:“多变一”1、氯化氢和氨气反应:氯化铵氨气氯化氢−→−+ Cl NH NH HCl 43===+2、红磷燃烧 :五氧化二磷氧气磷点燃−−→−+ 522O P 2O 5P 4点燃+ 3、硫的燃烧:二氧化硫氧气硫点燃−−→−+ 22SO O S 点燃+ 4、铁在氧气中燃烧:四氧化三铁点燃氧气铁−−→−+ 432O e F O 2e F 3点燃+5、镁的燃烧: 氧化镁氧气镁点燃−−→−+ O Mg 2O 2Mg 2点燃+ 6、铝的燃烧: 氧化铝氧气铝点燃−−→−+ 322O Al 2O 34Al 点燃+ 7、铜在空气中加热:氧化铜氧气铜加热−−→−+ O Cu 2O Cu 22△+ 8、氢气的燃烧: 水氧气氢气点燃−−→−+ O H 2O 2H 222点燃+ 9、木炭燃烧: 二氧化碳氧气碳点燃−−→−+ 22CO O C 点燃+ 10、碳在不足量氧气中燃烧:一氧化碳氧气碳点燃−−→−+ CO 2O C 22点燃+ 11、一氧化碳的燃烧:二氧化碳氧气一氧化碳点燃−−→−+ 22CO 2O CO 2点燃+ 12、二氧化碳溶于水:碳酸水二氧化碳→+ 13、生石灰遇水反应:氢氧化钙水氧化钙→+ (二)、分解反应:“一变多”1、氧化汞加热分解: 氧气汞氧化汞加热+−−→− ↑+2O Hg 2O g H 2△2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−−−→− ↑+22O Mn 22O O H 2O 2H 2 3、高锰酸钾加热分解:4、氯酸钾与二氧化锰混合加热:5、电解水: 氢气氧气水通电+−−→− ↑+↑222O H 2O 2H 通电6、碳酸分解: 二氧化碳水碳酸+→7、碱式碳酸铜(孔雀石)热分解:8、电解熔融氧化铝制铝:氧气铝氧化铝通电+−−→− ↑+232O 3Al 4O l A 2通电9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温+−−→− ↑+23CO O a C aCO C 高温(三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ”1、氢气还原氧化铜:铜水氧化铜氢气加热+−−→−+ 2、碳还原氧化铜:铜二氧化碳氧化铜碳高温+−−→−+金属活动顺序:3、镁与稀盐酸反应:氢气氯化镁盐酸镁+→+4、铝与稀盐酸反应:氢气氯化铝盐酸铝+→+5、锌与稀盐酸反应:氢气氯化锌盐酸锌+→+6、铁与稀盐酸反应:氢气氯化亚铁盐酸铁+→+7、镁与稀硫酸反应:氢气硫酸镁稀硫酸镁+→+8、锌与稀硫酸反应:氢气硫酸锌稀硫酸锌+→+9、铝与稀硫酸反应:氢气硫酸铝稀硫酸铝+→+10、铁与稀硫酸反应:氢气硫酸亚铁稀硫酸铁+→+ 11、铝与硫酸铜反应:铜硫酸铝硫酸铜铝+→+ 12、铁与硫酸铜反应:铜硫酸亚铁硫酸铜铁+→+ 13、铁与氯化铜反应:铜氯化亚铁氯化铜铁+→+ (四)、复分解反应:1、氯化钾与硝酸银反应:氯化银硝酸钾硝酸银氯化钾+→+2、盐酸与硝酸银反应:氯化银硝酸硝酸银盐酸+→+3、氧化铜与硫酸反应:水硫酸铜硫酸氧化铜+→+4、氧化镁与硫酸反应:水硫酸镁硫酸氧化镁+→+5、氧化铁与盐酸反应:水+氧化铁+→盐酸氯化铁6、盐酸与氢氧化钠反应:水+→氯化钠氢氧化钠盐酸+7、硫酸与氢氧化钠反应:水→硫酸++硫酸钠氢氧化钠8、硝酸与氢氧化铜反应:9、氯化钡与硫酸反应:水+→硫酸钡硫酸氯化钡+9、氯化钡与碳酸钠反应:10、氢氧化钠硫酸铜反应:硫酸铜+氢氧化钠+→氢氧化铜硫酸铜11、氢氧化钙与氯化铁反应:氯化钙→+氢氧化钙+氯化铁氢氧化铁(五)、其他反应:1、汽车尾气催化转换:2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):3、大理石与盐酸反应:4、甲烷(天然气的主要成分)燃烧:5、一氧化碳还原氧化铁:6、一氧化碳还原氧化铜:10、碳酸氢铵与氢氧化钙混合:氨气→++氢氧化钙水碳酸钙碳酸氢铵+11、硫酸铵与氢氧化钠溶液混合加热:氨气−→−++硫酸铵△+硫酸钠氢氧化钠水(NH4)2SO4+2NaOH Na2SO4+H2O+ NH3·H2O7、葡萄糖在酶作用下的反应:水−+−→葡萄糖酶+氧气二氧化碳一、物质的学名、俗名及化学式⑴金刚石、石墨:C⑵水银、汞:Hg(3)生石灰、氧化钙:CaO(4)干冰(固体二氧化碳):CO2(5)盐酸、氢氯酸:HCl(6)亚硫酸:H2SO3(7)氢硫酸:H2S(8)熟石灰、消石灰:Ca(OH)2(9)苛性钠、火碱、烧碱:NaOH(10)纯碱:Na2CO3碳酸钠晶体、纯碱晶体:Na2CO3⋅10H2O(11)碳酸氢钠、酸式碳酸钠:NaHCO3 (也叫小苏打)(12)胆矾、蓝矾、硫酸铜晶体:CuSO4⋅5H2O(13)铜绿、孔雀石:Cu2(OH)2CO3(分解生成三种氧化物的物质)(14)甲醇:CH3OH 有毒、失明、死亡(15)酒精、乙醇:C2H5OH(16)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子)具有酸的通性(17)氨气:NH3(碱性气体)(18)氨水、一水合氨:NH3⋅H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱)(19)亚硝酸钠:NaNO2(工业用盐、有毒)二、常见物质的颜色的状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+ 的溶液呈棕黄色,其余溶液一般不无色。
化学用语- Microsoft Word 文档

初中化学中考需要记忆和背诵的化学用语: 必须熟练记忆的化学基本用语, 否则无法学习:(一)熟练记忆下列最常见元素和原子团的符号和化合价:1.记忆下列最常见元素的化合价韵语,并记忆括号中的元素符号: 正一氢钾钠和银, (正一 H K Na 和Ag );正二钙镁钡和锌; (正二Ca Mg Ba 和Zn;) 正三铁和铝;(正三Fe 和Al),正二亚铁和铜;氧为负二氯负一;单质规定价为零。
2.熟练记忆下列最常见原子团的化合价韵语并记忆括号中的原子团符号一价铵、硝、氢氧根,二价硫和碳酸根;[一价NH 4 、NO 3 、OH , 二价SO 4 、SO 3 (亚硫酸根)和CO 3 ] 三价常见磷酸根,通常负价除铵根(只有铵根为正价). (三价常见PO 4 , 通常负价除NH 4 ) 附:熟练记忆:最常见原子团的符号,名称及形成离子的符号,名称: NH 4 ; 铵根NO 3 :硝酸根OH :氢氧根 SO 4 :硫酸根 SO 3 :亚硫酸根CO 3 :碳酸根NH 4 +; 铵根离子 NO 3 —:硝酸根离子OH —:氢氧根离子SO 4 2—:硫酸根离子SO 3 2—:亚硫酸根离子 CO 3 2—:碳酸根离子(二)熟练记忆下列最常见物质的化学式: Ⅰ.单质:(由一种元素组成的纯净物叫单质) 名称 氢气 氧气 氮气 (活性)铁粉 氦气 化学式 H 2 O 2 N 2 Fe He 2.非金属氧化物(由非金属元素和氧元素的组成的氧化物叫非金属氧化物)名称 水 过氧化氢 二氧化碳 一氧化碳 二氧化硫 化学式 H 2OH 2O 2CO 2COSO 2 3.金属氧化物(由金属元素和氧元素的组成的氧化物叫金属氧化物)名称 二氧化锰 氧化铁(三氧化二铁) 氧化铝 氧化钙 化学式 MnO 2Fe 2O 3 Al 2O 3CaO4.酸[由氢元素和另一种显负价的元素或原子团(即酸根)组成的化合物.5.碱(由金属离子和氢氧根离子组成的化合物,一般根据化学式,从右向左读作“氢氧化某”。
初中化学用语汇总

初中化学用语汇总1. 原子:构成分子的最小粒子。
2. 元素:由同种原子组成的物质。
4. 分子:由两个及以上原子组成的不带电荷的粒子。
6. 原子量:一个原子质量单位。
8. 周期表:元素根据其原子核结构的排列方式排列的表格。
9. 金属:具有良好的导电性和热传导性质的物质。
11. 金属元素:处于周期表左侧的元素。
16. 原子核:由质子和中子组成的原子中心部分。
17. 共价键:由电子对共享形成的键。
18. 离子键:带正电荷和负电荷之间的相互作用。
21. 化学键:元素通过共享或转移电子形成的化学物质的力。
22. 化学式:用元素符号表示化合物的组成。
23. 反应物:在化学反应中参与反应的物质。
25. 化学反应:物质之间的化学相互作用。
26. 酸:会释放出氢离子的物质。
28. 盐:由阳离子和阴离子组成的离子化合物。
30. 溶解:由固体或气体转变为液体。
31. 溶质:溶解在溶剂中的物质。
34. 沉淀:在溶液中形成的固体颗粒。
36. 电离:在溶液中将电解质分解为离子。
39. 化学平衡:反应物和生成物在化学反应中达到平衡状态。
40. 配位化合物:由中心金属离子和其它分子和离子中的原子和分子共价结合而成的化合物。
41. 化学式计算:根据化学式计算元素的质量。
42. 摩尔质量:化学式中一个摩尔的质量。
43. 密度:单位体积内的物质质量。
44. 燃烧:化合物与氧气彻底反应的化学反应。
46. 温度:温度代表了物体内部分子的平均运动速度。
47. 热力学系统:研究热和压力与化学反应之间的关系。
48. 热能:热能是物体或系统储存的能量。
49. 热动力学:热的能量学,研究物质内部热运动的规律。
50. 热量:由于温度差异而流动的能量。
51. 热容:物质单位质量的温度变化时吸收或释放的热量。
52. 热传导:热能通过物质的传递。
53. 热平衡:两个物体之间热能的交换达到相同的温度。
54. 热力学第一性原理:能量守恒。
55. 内能:热力学系统内分子内部相互作用引起的能量总和。
九年化学用语汇总
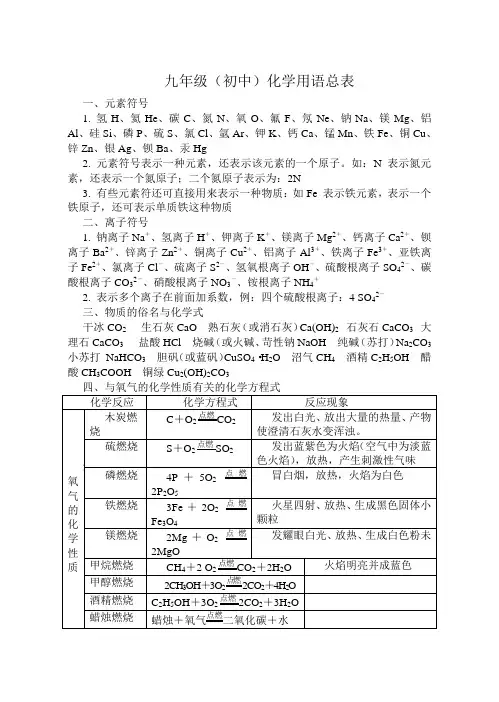
九年级(初中)化学用语总表一、元素符号1. 氢H、氦He、碳C、氮N、氧O、氟F、氖Ne、钠Na、镁Mg、铝Al、硅Si、磷P、硫S、氯Cl、氩Ar、钾K、钙Ca、锰Mn、铁Fe、铜Cu、锌Zn、银Ag、钡Ba、汞Hg2. 元素符号表示一种元素,还表示该元素的一个原子。
如:N表示氮元素,还表示一个氮原子;二个氮原子表示为:2N3. 有些元素符还可直接用来表示一种物质:如Fe 表示铁元素,表示一个铁原子,还可表示单质铁这种物质二、离子符号1. 钠离子Na+、氢离子H+、钾离子K+、镁离子Mg2+、钙离子Ca2+、钡离子Ba2+、锌离子Zn2+、铜离子Cu2+、铝离子Al3+、铁离子Fe3+、亚铁离子Fe2+、氯离子Cl-、硫离子S2-、氢氧根离子OH-、硫酸根离子SO42-、碳酸根离子CO32-、硝酸根离子NO3-、铵根离子NH4+2. 表示多个离子在前面加系数,例:四个硫酸根离子:4 SO42-三、物质的俗名与化学式干冰CO2 生石灰CaO 熟石灰(或消石灰)Ca(OH)2 石灰石CaCO3 大理石CaCO3 盐酸HCl 烧碱(或火碱、苛性钠NaOH 纯碱(苏打)Na2CO3 小苏打NaHCO3胆矾(或蓝矾)CuSO4·H2O 沼气CH4酒精C2H5OH 醋酸CH3COOH 铜绿Cu2(OH)2CO3四、与氧气的化学性质有关的化学方程式化学反应化学方程式反应现象氧氧气的化学性质木炭燃烧C+O2点燃CO2发出白光、放出大量的热量、产物使澄清石灰水变浑浊。
硫燃烧S+O2点燃SO2发出蓝紫色为火焰(空气中为淡蓝色火焰),放热,产生刺激性气味磷燃烧4P+5O2点燃2P2O5冒白烟,放热,火焰为白色铁燃烧3Fe+2O2点燃Fe3O4火星四射、放热、生成黑色固体小颗粒镁燃烧2Mg+O2点燃2MgO发耀眼白光、放热、生成白色粉未甲烷燃烧CH4+2 O2点燃CO2+2H2O 火焰明亮并成蓝色甲醇燃烧2CH3OH+3O2点燃2CO2+4H2O酒精燃烧C2H5OH+3O2点燃2CO2+3H2O蜡烛燃烧蜡烛+氧气点燃二氧化碳+水五、氢气、一氧化碳、碳的化学性质比较(可燃性和还原性,是还原剂)物质可燃性还原性氢气2H2+O2点燃2H2O淡蓝色火焰H2+CuO △Cu+H2O试管壁上出现水珠,黑粉变红碳(以木炭为例)C+O2点燃CO2(充分燃烧)2C+O2点燃2CO(不充分燃烧)C+2CuO 高温2Cu+CO 2↑C+CO2高温2CO(吸热反应)一氧化碳2CO+O2点燃2 CO2蓝色火焰CO+CuO △Cu+CO23CO+Fe2O3高温2Fe+3 CO2六、二氧化碳的化学性质(没有可燃性和还原性,但具有下列性质)化学反应化学方程式应用与水反应CO2+H2O=H2CO3(碳酸)碳酸能使石蕊试液变红使石灰水变浑浊CO2+Ca(OH)2=CaCO3↓+H2O石灰水在空气中变质的反应此反应用于鉴定CO2的存在七、铁的化学性质及酸与金属的反应化学反应化学方程式现象与氧的反应3Fe+2O2点燃Fe3O4火星四射,生成黑色固体与盐酸反应Fe+2HCl=FeCl2+H2↑冒气泡,溶液由无色变为浅绿色与硫酸反应Fe+H2SO4=FeSO4+H2↑湿法冶铜Fe +CuSO4=FeSO4+Cu此反应被看作湿法冶金的先驱铁表面变为红色,溶液由蓝色变为浅绿色八、一些常见物质的分解反应化学反应化学方程式现象或其它氧化汞分解2HgO△2Hg+O2↑红粉未变为银白色液体煅烧石灰石CaCO3高温CaO+CO2↑工业制CO2与生石灰碱式碳酸铜分解Cu2(OH)2CO3△2CuO+H2O+CO2↑绿粉未变黑,水,浑浊电解水2H2O通电2H2↑+O2↑阳氧阴氢,体积1:2九、氧气、氢气、二氧化碳的实验室制法制取气体药品化学方程式气体的检验氧气氯酸钾和二氧化锰或高锰酸钾过氧化氢和二氧化锰2KClO3 MnO22KCl+3O2↑2KMnO4△K2MnO4+MnO2+O2↑2H2O2 MnO22H2O+O2↑用带火星的木条伸入集气瓶,木条复燃氢气锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑或Zn+2HCl=ZnCl2+H2↑可点燃,发出淡蓝色火焰,生成物只有水。
化学用语总结(初中)

化学用语总结1、初中常见的元素符号氢碳钠氯氦铜氧硫镁银硅钙钾铁氮钡锌氖锰磷铝氩汞2、常见元素和原子团的化合价Cl Al Ba Ag H Ca O Na Mg Zn K Cu Fe(铁)Fe(亚铁)NH4NO3OH CO3SO43、常见离子符号氯离子铝离子钡离子银离子氢离子钙离子亚铁离子氧离子钠离子镁离子锌离子钾离子铜离子铁离子铵根离子硫酸根离子碳酸根离子硝酸根离子氢氧根离子4、常见物质的化学式氧气碳镁氢气氦气氮气红磷氧化镁一氧化碳二氧化碳水二氧化硫五氧化二磷四氧化三铁氧化亚铁氧化铁氧化铝二氧化锰过氧化氢氨气氯化氢氯化钾氯化钠氯化钙氯化亚铁盐酸碳酸氯酸钾高锰酸钾锰酸钾氢氧化钠氢氧化钙氢氧化铜碳酸钙碳酸钡碳酸钠硫酸钠硫酸铁硫酸亚铁硝酸银硝酸铵碳酸氢铵硫酸硝酸氢氧化铁氢氧化镁甲烷乙炔5、用化学符号填空两个氮原子;铜单质;五氧化二磷;钡的氧化物________;带三个单位正电荷的铝离子;两个氢氧根离子;氖气______;正六价的硫元素;两个氮分子;三个镁离子;保持水的化学性质的最小微粒________ ;氧化亚铁中铁元素显+2价;氮元素______,单质氧______,两个二氧化碳分子______,氦气______,单质硫______,四氧化三铁______,氧化镁______。
2个氢原子_______、正二价的镁元素_________、3个二氧化硫分子________、4个铁原子________、1个氮分子_________、2个钠离子_________、氧元素1个氧原子钾元素6、化学方程式一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43. 铜在空气中受热:2Cu + O2△2CuO4. 铝在空气中燃烧:4Al + 3O2点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2点燃2H2O6. 红磷在空气中燃烧:4P + 5O2点燃2P2O57. 硫粉在空气中燃烧:S + O2点燃SO28. 碳在氧气中充分燃烧:C + O2点燃CO29. 碳在氧气中不充分燃烧:2C + O2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O13. 乙炔在空气中燃烧:2C2H2 + 5O2点燃4CO2 + 2H2O二.几个分解反应:14. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑MnO215. 过氧化氢分解制氧气:2H2O2======2H2O↑+ O2 ↑16. 加热氯酸钾(有少量二氧化锰):2KClO3MnO22KCl + 3O2 ↑△17. 加热高锰酸钾:2KMnO4△K2MnO4 + MnO2 + O2↑18. 碳酸不稳定而分解:H2CO3 ==H2O + CO2↑19. 高温煅烧石灰石:CaCO3高温CaO + CO2↑三.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)(条件:a、金属为金属活动性顺序表中排在H前面的金属; b、酸为盐酸、稀硫酸)20. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑21. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑22. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑23. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑24. 锌和稀盐酸Zn + 2HCl=== ZnCl2 + H2↑25. 铁和稀盐酸Fe + 2HCl=== FeCl2 + H2↑26. 镁和稀盐酸Mg+ 2HCl=== MgCl2 + H2↑27. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属氧化物 +酸 -------- 盐 + 水(复分解反应)28. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O29. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O30. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O31. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O32. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O33. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(3)非金属氧化物 +碱 --- 盐 + 水(不属于基本反应类型)34.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O35.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3↓+ H2O(4)酸 + 碱 -------- 盐 + 水(复分解反应,中和反应)36.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O37. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O38.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O39. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O40. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O41.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O42.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O43.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O44.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O45. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O46. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(5)酸 + 盐 -------- 另一种酸 + 另一种盐(复分解反应)(条件:a、盐必须溶于水(碳酸盐除外);b、生成物中必须有沉淀、气体或水)47.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑48.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑49.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑50.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓+ HNO351.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑52.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl(6)碱 + 盐 -------- 另一种碱 + 另一种盐(复分解反应)(条件:a、反应物必须都溶于水; b、生成物中必须有沉淀、气体或水)53.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓+ Na2SO454.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓+ 3NaCl55.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓+ 2NaCl56. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓+ 2NaCl57. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH四.其它反应:58.生石灰溶于水:CaO + H2O === Ca(OH)259.二氧化碳溶解于水:CO2 + H2O === H2CO3初中化学常见物质俗称1、氯化钠(NaCl):食盐2、碳酸钠(Na2CO3) :纯碱,苏打3、氧化钙(CaO):生石灰3、氢氧化钠(NaOH):火碱,烧碱,苛性钠5、氢氧化钙(Ca(OH)2):熟石灰,消石灰6、二氧化碳固体(CO2):干冰7、甲烷 (CH4):沼气、瓦斯气8、乙醇(C2H5OH):酒精9、过氧化氢(H2O2)溶液:双氧水10、碳酸氢钠(NaHCO3):小苏打,酸式碳酸钠溶液颜色:蓝色溶液—— CuSO4、CuCl2、Cu(NO3)2等含Cu2+的溶液浅绿色溶液——FeSO4、FeCl2等含Fe2+的溶液黄色溶液——FeCl3、Fe2(SO4)3、Fe(NO3)3等Fe3+的溶液沉淀:红褐色沉淀:Fe(OH)3,蓝色沉淀:Cu(OH)2,白色沉淀:BaSO4、AgCl 、BaCO3、CaCO3、Mg(OH)2其中:BaSO4、AgCl是不溶于HNO3的白色沉淀CaCO3BaCO3是溶于酸的白色沉淀。
化学用语背全

⑴元素符号(全)氢 H 氦 He 锂 Li 铍 Be 硼 B 碳C 氮 N 氧 O 氟 F 氖 Ne 钠 Na 镁 Mg 铝 Al 硅 Si 磷 P 硫 S 氯 Cl 氩 Ar 钾 K 钙 Ca 铜 Cu 银 Ag 金 Au 钡 Ba 锰 Mn 铁Fe 锌 Zn 铂 Pt 碘I 汞 Hg ⑵离子符号(全):氢离子H +、氧离子O 2-、氟离子F -、钠离子Na +、镁离子Mg 2+、铝离子Al 3+、硫离子S 2-、氯离子Cl -、钾离子K +、亚铁离子Fe 2+、铁离子Fe 3+、铜离子Cu 2+、锌离子Zn 2+、银离子Ag +、铵根离子NH 4+、硫酸根离子SO 42-、碳酸根离子CO 32-、硝酸根离子NO 3-、氢氧根离子OH -、(钙离子Ca 2+、钡离子Ba 2+)。
⑶化合价(全): +1-2 +1-1 +2 +2 +3 +2 +4 +5 +2 H 2O 、H 2O 2、CaO 、MgO 、Al 2O 3、CuO 、SiO 2、P 2O 5、FeO 、 +3 +2 +4 +4 -2 +4 +6 +4 Fe 2O 3、CO 、CO 2、H 2CO 3、H 2S 、SO 2、SO 3、H 2SO 3、 +6 +7 +6 -1 +5 -1 +1 +4 H 2SO 4、KMnO 4、K 2MnO 4、KCl 、KClO 3、HCl 、HClO 、ClO 2、 +5 -3 +5 0 +2 +4 +3 -3 +5 KClO 3、NH 3、HNO 3、N 2、NO 、NO 2、NaNO 2 、NH 4NO 3、 +1 -1 -2 -2 -1 (NH 4)2SO 4 、HNO 3 、H 2SO 4 、CaCO 3 、Ca (OH )2。
⑷化学式(全): 单质: 气态非金属单质:氢气 H 2 、氧气 O 2 、氮气 N 2 、氯气 Cl 2 、 稀有气体单质:氦气 He 、氖气 Ne 、氩气 Ar 、固态非金属单质:碳 C 、磷 P 、硫 S 、(碘 I 2 )。
人教版九年级化学常用的化学用语大全
初中必背的化学用语
一、元素符号必记
1、1至20
2
+1 +1 -1 +1 +1
k Na Cl H Ag -2 +2 +2 +2 +2
O Ca Ba Mg Zn +2 +3 +2 +4 Fe F e C C
+3 +4 +5
Al Si P +2 +4 +6 S S S +2 +2 Cu Hg 0 0 H 2 O 2
负一氢氧硝酸根,负二硫酸碳酸根,负三记住磷酸根,唯有正一是铵根。
1 -1 -
2 OH - NO 3- SO 42- (三)离子和原子团
(1)常见的离子
氢离子一H + 钠离子一Na + 钾离子一K + 镁离子一Mg 2+钙离子一Ca 2+ 钡离子一Ba 2+ 锌离子一Zn 2+
铝离子一AI 3+银离子-Ag + 氧离子一O 2-
氯离子一Cl -
亚铁离子一562+(浅绿色) 铜离子一Cu 2+(蓝色) 铁离子一563+(黄色)
二、元素的化合价
(一)常见元素的化合价口诀
一价钾钠氯氢银 二价氧钙钡镁锌 二三铁 二四碳 三铝四硅五价磷 二四六硫都齐全 铜汞二价最常见 莫忘单质都为零
(二)常见原子团的化合价 -2
-3
+1 CO 32- P043-
NH 4+
⑵常见的原子团
氢氧根——OH- 碳酸根——CO32- 硫酸根SO42-
硝酸根——NO3-磷酸根PO43-铵根——NH4+三、常见的化学式
(一)、常见的单质
(二)、化合物
5、常见有机化合物
6、其他化合物
四、化学反应方程式。
初中化学用语(全)
初中化学用语总结
一、单质
1、由原子直接构成的单质:
2、由分子构成的物质
(1)金属单质,如:Na 钠Cu 铜Mg 镁Zn 锌Al 铝Ag 银
K 钾Ba 钡Ca 钙Pt 铂Mn 锰Hg 汞Fe 铁Au 金(2)非金属固体:
C 碳
S 硫
P 磷
(3)稀有气体:
He 氦气
Ne 氖气
Ar 氩气
H2氢气
N2氮气
O2 氧气
O3臭氧
Cl2氯气
(一)、化合反应:“多变一”
1磷燃烧: 五氧化二磷氧气磷点燃
−−→−+ 522O P 2O 5P 4点燃+ 2硫的燃烧: 二氧化硫氧气硫点燃−−→−+ 22SO O S 点燃+
3铁在氧气中燃烧:四氧化三铁点燃氧气铁−−→−+ 432O e F O 2e F 3点燃+ 4镁的燃烧: 氧化镁氧气镁点燃
−−→−+ O Mg 2O 2Mg 2点燃+ 5铝的燃烧: 氧化铝氧气铝点燃−−→−+ 322O Al 2O 34Al 点燃+
6铜在空气中加热:氧化铜氧气铜加热−−→−+ O Cu 2O Cu 22△+ 7氢气的燃烧: 水氧气氢气点燃−−→−+ O H 2O 2H 222点燃+ 8木炭燃烧: 二氧化碳氧气碳点燃−−→−+ 22CO O C 点燃+
(二)、分解反应:“一变多”
1、氧化汞加热分解: 氧气汞氧化汞加热+−−→− ↑+2O Hg 2O
g H 2△ 2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−−−→− ↑+22O Mn 22O O H 2O 2H 2
3、高锰酸钾加热分解:氧气二氧化锰锰酸钾高锰酸钾加热
++−−→−
4、氯酸钾与二氧化锰混合加热:。
初中化学用语全
初中化学用语全WTD standardization office【WTD 5AB- WTDK 08- WTD 2C】初中化学用语总结一、单质1、由原子直接构成的单质: 2、由分子构成的物质(1)金属单质,如:Na 钠 Cu 铜Mg 镁 Zn 锌Al 铝 Ag 银K 钾 Ba 钡Ca 钙 Pt 铂Mn 锰 Hg 汞Fe 铁 Au 金(2)非金属固体:C 碳S 硫P 磷(3)稀有气体:He 氦气Ne 氖气Ar 氩气H2氢气N2氮气O2 氧气O3臭氧Cl2氯气二、化合物三、化学反应一、(1)3个碳原子;(2)2个硫酸根离子;(3)臭氧分子;(4)人体中含量最多的物质;(5)氧化铝中铝元素的化合价;(6)空气中含量最多的元素;(7)氯离子;(8)氧化镁;(9)2个氮原子;(10)碳酸根离子。
(11)n个水分子_______二、①2N2;②5Na ;③3个铝离子;④氧化钙中钙元素为+2价⑤盐酸⑥三个磷原子⑦二个亚铁离子⑧铁锈的主要成分⑨天然气的主要成分是(1)2个汞原子; (2) 氧化铝中铝元素显+3价;(3)2个硝酸根离子; (4) 4个镁离子;(5)石灰浆的主要成分;(6)铁在氧气中燃烧的产物;(7)地壳中含量第二位的元素是;(8)导致温室效应的气体主要是。
三、(1)氧元素;(2)四氧化三铁; (3)氢氧化钾;(4)3N ;(5)CO 32- ;(6)氯化钡的化学式_______;四、写化学式(1) 最轻的气体是 ;(2) 在空气中体积分数最大的气体是_______;(3)绿色植物进行光合作用吸收的气体是_______;放出的气体是_______;(4)2个磷原子 ;(5)氢氧根离子 ;(6)生活中常做调味品的盐 ; (7)最简单的有机物 。
(一)、化合反应:“多变一”1、氯化氢和氨气反应:氯化铵氨气氯化氢−→−+ Cl NH NH HCl 43===+ 2、红磷燃烧 :五氧化二磷氧气磷点燃−−→−+ 522O P 2O 5P 4点燃+ 3、硫的燃烧:二氧化硫氧气硫点燃−−→−+ 22SO O S 点燃+ 4、铁在氧气中燃烧:四氧化三铁点燃氧气铁−−→−+ 432O e F O 2e F 3点燃+5、镁的燃烧: 氧化镁氧气镁点燃−−→−+ O Mg 2O 2Mg 2点燃+ 6、铝的燃烧: 氧化铝氧气铝点燃−−→−+ 322O Al 2O 34Al 点燃+ 7、铜在空气中加热:氧化铜氧气铜加热−−→−+ O Cu 2O Cu 22△+ 8、氢气的燃烧: 水氧气氢气点燃−−→−+ O H 2O 2H 222点燃+ 9、木炭燃烧: 二氧化碳氧气碳点燃−−→−+ 22CO O C 点燃+ 10、碳在不足量氧气中燃烧:一氧化碳氧气碳点燃−−→−+ CO 2O C 22点燃+ 11、一氧化碳的燃烧:二氧化碳氧气一氧化碳点燃−−→−+ 22CO 2O CO 2点燃+12、二氧化碳溶于水:碳酸水二氧化碳→+ 13、生石灰遇水反应:氢氧化钙水氧化钙→+ (二)、分解反应:“一变多”1、氧化汞加热分解: 氧气汞氧化汞加热+−−→− ↑+2O Hg 2O g H 2△2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−−−→− ↑+22O Mn 22O O H 2O 2H 2 3、高锰酸钾加热分解: 4、氯酸钾与二氧化锰混合加热:5、电解水: 氢气氧气水通电+−−→− ↑+↑222O H 2O 2H 通电6、碳酸分解: 二氧化碳水碳酸+→7、碱式碳酸铜(孔雀石)热分解:8、电解熔融氧化铝制铝:氧气铝氧化铝通电+−−→− ↑+232O 3Al 4O l A 2通电9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温+−−→− ↑+23CO O a C aCO C 高温(三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ”1、氢气还原氧化铜:铜水氧化铜氢气加热+−−→−+ 2、碳还原氧化铜:铜二氧化碳氧化铜碳高温+−−→−+ 金属活动顺序:3、镁与稀盐酸反应:氢气氯化镁盐酸镁+→+4、铝与稀盐酸反应:氢气氯化铝盐酸铝+→+5、锌与稀盐酸反应:氢气氯化锌盐酸锌+→+6、铁与稀盐酸反应:氢气氯化亚铁盐酸铁+→+7、镁与稀硫酸反应:氢气硫酸镁稀硫酸镁+→+ 8、锌与稀硫酸反应:氢气硫酸锌稀硫酸锌+→+ 9、铝与稀硫酸反应:氢气硫酸铝稀硫酸铝+→+ 10、铁与稀硫酸反应:氢气硫酸亚铁稀硫酸铁+→+ 11、铝与硫酸铜反应:铜硫酸铝硫酸铜铝+→+ 12、铁与硫酸铜反应:铜硫酸亚铁硫酸铜铁+→+ 13、铁与氯化铜反应:铜氯化亚铁氯化铜铁+→+ (四)、复分解反应:1、氯化钾与硝酸银反应:氯化银硝酸钾硝酸银氯化钾+→+2、盐酸与硝酸银反应:氯化银硝酸硝酸银盐酸+→+3、氧化铜与硫酸反应:水硫酸铜硫酸氧化铜+→+4、氧化镁与硫酸反应:水硫酸镁硫酸氧化镁+→+5、氧化铁与盐酸反应:水氯化铁盐酸氧化铁+→+6、盐酸与氢氧化钠反应:水氯化钠氢氧化钠盐酸+→+7、硫酸与氢氧化钠反应:水硫酸钠氢氧化钠硫酸+→+8、硝酸与氢氧化铜反应:9、氯化钡与硫酸反应:水硫酸钡硫酸氯化钡+→+ 9、氯化钡与碳酸钠反应:10、氢氧化钠硫酸铜反应:硫酸铜氢氧化铜硫酸铜氢氧化钠+→+ 11、氢氧化钙与氯化铁反应:氯化钙氢氧化铁氯化铁氢氧化钙+→+(五)、其他反应:1、汽车尾气催化转换:2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):3、大理石与盐酸反应:4、甲烷(天然气的主要成分)燃烧:5、一氧化碳还原氧化铁:6、一氧化碳还原氧化铜:10、碳酸氢铵与氢氧化钙混合:氨气→++碳酸钙水氢氧化钙碳酸氢铵+11、硫酸铵与氢氧化钠溶液混合加热:氨气−→−++水硫酸钠氢氧化钠硫酸铵△+(NH4)2SO4+2NaOH Na2SO4+ H2O+ NH3·H2O7、葡萄糖在酶作用下的反应:水−+−→葡萄糖酶+二氧化碳氧气一、物质的学名、俗名及化学式⑴金刚石、石墨:C⑵水银、汞:Hg(3)生石灰、氧化钙:CaO(4)干冰(固体二氧化碳):CO2(5)盐酸、氢氯酸:HCl(6)亚硫酸:H2SO3(7)氢硫酸:H2S(8)熟石灰、消石灰:Ca(OH)2(9)苛性钠、火碱、烧碱:NaOH(10)纯碱:Na2CO3碳酸钠晶体、纯碱晶体:Na2CO3⋅10H2O(11)碳酸氢钠、酸式碳酸钠:NaHCO3 (也叫小苏打)(12)胆矾、蓝矾、硫酸铜晶体:CuSO4⋅5H2O(13)铜绿、孔雀石:Cu2(OH)2CO3(分解生成三种氧化物的物质)(14)甲醇:CH3OH 有毒、失明、死亡(15)酒精、乙醇:C2H5OH(16)醋酸、乙酸(℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子)具有酸的通性(17)氨气:NH3(碱性气体)(18)氨水、一水合氨:NH3⋅H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱) (19)亚硝酸钠:NaNO2(工业用盐、有毒)二、常见物质的颜色的状态1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+ 的溶液呈棕黄色,其余溶液一般不无色。
初三新学期化学用语
化学用语
1-20号元素名称和元素符号
氢氦锂铍硼碳氮氧氟氖
H He Li Be B C N O F Ne
钠镁铝硅磷硫氯氩钾钙
Na Mg Al Si P S Cl Ar K Ca
常见金属活动性顺序表
钾钙钠镁铝
K Ca Na Mg Al
锌铁锡铅(氢)
Zn Fe Sn Pb H
铜汞银铂金
Cu Hg Ag Pt Au
常见元素化合价韵语
一价氢、锂、钠、钾、银+1 H、Li、Na、K、Ag
二价铜、钙、钡、镁、锌+2 Cu、Ca、Ba、Mg、Zn 铜、汞一、二铁二、三Cu、Hg+1、+2 Fe+2、+3 铝三硅四五氮、磷Al+3 Si+4 +5N、P 氟、氯、溴、碘负一价F、Cl、Br、I -1价
氧、硫负二用得勤O、S -2用得勤
原子团正一是铵根原子团+1是NH4
负一氢氧、硝酸根-1 OH-、NO-3
负二硫酸、碳酸根-2 SO42-、CO32-
负三只有磷酸根-3只有PO43-
可变价数合理用可变价数合理用
单质零价要记清单质零价要记清
化学式要写正确化学式要写正确
正负价和必等零正负价和必等零。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学用语总结
一、单质
1、由原子直接构成的单质:
2、由分子构成的物质
(1)金属单质,如:
Na 钠Cu 铜
Mg 镁Zn 锌
Al 铝Ag 银
K 钾Ba 钡
Ca 钙Pt 铂Mn 锰Hg 汞
Fe 铁Au 金……(2)非金属固体:
C 碳
S 硫
P 磷
(3)稀有气体:
He 氦气
Ne 氖气
Ar 氩气
H2氢气
N2氮气
O2 氧气
O3臭氧
Cl2氯气
(一)、化合反应:“多变一”
1、氯化氢与氨气反应:氯化铵氨气氯化氢−→−
+ Cl NH NH HCl 43===+ 2、红磷燃烧: 五氧化二磷氧气磷点燃
−−→−+ 522O P 2O 5P 4点燃+ 3、硫的燃烧: 二氧化硫氧气硫点燃
−−→−+ 22SO O S 点燃+ 4、铁在氧气中燃烧:四氧化三铁点燃
氧气铁−−→−+ 432O e F O 2e F 3点燃+
5、镁的燃烧: 氧化镁氧气镁点燃
−−→−+ O Mg 2O 2Mg 2点燃+ 6、铝的燃烧: 氧化铝氧气铝点燃
−−→−+ 322O Al 2O 34Al 点燃+
7、铜在空气中加热:氧化铜氧气铜加热
−−→−+ O Cu 2O Cu 22△+
8、氢气的燃烧: 水氧气氢气点燃
−−→−+ O H 2O 2H 222点燃+ 9、木炭燃烧: 二氧化碳氧气碳点燃
−−→−+ 22CO O C 点燃+ 10、碳在不足量氧气中燃烧:一氧化碳氧气碳点燃
−−→−+ CO 2O C 22点燃+ 11、一氧化碳的燃烧:二氧化碳氧气一氧化碳点燃
−−→−+ 22CO 2O CO 2点燃+ 12、二氧化碳溶于水:碳酸水二氧化碳→+ 13、生石灰遇水反应:氢氧化钙水氧化钙→+
(二)、分解反应:“一变多”
1、氧化汞加热分解: 氧气汞氧化汞加热
+−−→− ↑+2O Hg 2O
g H 2△
2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−
−−→− ↑+22O Mn 22O O H 2O 2H 2 3、高锰酸钾加热分解:
氧气二氧化锰锰酸钾高锰酸钾加热
++−−→−
4、氯酸钾与二氧化锰混合加热:
5、电解水: 氢气氧气水通电
+−−→− ↑+↑222O H 2O 2H 通电
6、碳酸分解: 二氧化碳水碳酸+→
7、碱式碳酸铜(孔雀石)热分解:
水二氧化碳氧化铜碱式碳酸铜加热
++−−→−
8、电解熔融氧化铝制铝:氧气铝氧化铝通电
+−−→− ↑+232O 3Al 4O l A 2通电 9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温
+−−→− ↑+23CO O a C aCO C 高温 (三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ” 1、 氢气还原氧化铜:铜水氧化铜氢气加热
+−−→−+ 2、 碳还原氧化铜:铜二氧化碳氧化铜碳高温
+−−→−+ 金属活动顺序:
3、 镁与稀盐酸反应:氢气氯化镁盐酸镁+→+
4、 铝与稀盐酸反应:氢气氯化铝盐酸铝+→+
5、 锌与稀盐酸反应:氢气氯化锌盐酸锌+→+
6、 铁与稀盐酸反应:氢气氯化亚铁盐酸铁+→+
7、 镁与稀硫酸反应:氢气硫酸镁稀硫酸镁+→+
8、 锌与稀硫酸反应:氢气硫酸锌稀硫酸锌+→+
9、 铝与稀硫酸反应:氢气硫酸铝稀硫酸铝+→+ 10、铁与稀硫酸反应:氢气硫酸亚铁稀硫酸铁+→+ 11、铝与硫酸铜反应:铜硫酸铝硫酸铜铝+→+ 12、铁与硫酸铜反应:铜硫酸亚铁硫酸铜铁+→+ 13、铁与氯化铜反应:铜氯化亚铁氯化铜铁+→+
(四)、复分解反应:
1、氯化钾与硝酸银反应:氯化银硝酸钾硝酸银氯化钾+→+
2、盐酸与硝酸银反应:氯化银硝酸硝酸银盐酸+→+
3、氧化铜与硫酸反应:水硫酸铜硫酸氧化铜+→+
4、氧化镁与硫酸反应:水硫酸镁硫酸氧化镁+→+
5、氧化铁与盐酸反应:水氯化铁盐酸氧化铁+→+
6、盐酸与氢氧化钠反应:水氯化钠氢氧化钠盐酸+→+
7、硫酸与氢氧化钠反应:水硫酸钠氢氧化钠硫酸+→+
8、硝酸与氢氧化铜反应:
水硝酸铜氢氧化铜硝酸+→+
9、氯化钡与硫酸反应:水硫酸钡硫酸氯化钡+→+ 9、氯化钡与碳酸钠反应:
氯化钠碳酸钡碳酸钠氯化钡+→+
10、氢氧化钠硫酸铜反应:硫酸铜氢氧化铜硫酸铜氢氧化钠+→+
11、氢氧化钙与氯化铁反应:氯化钙氢氧化铁氯化铁氢氧化钙+→+
(五)、其她反应:
1、汽车尾气催化转换:
氮气二氧化碳一氧化氮一氧化碳+−−→−+铂、钯
22d
P t P N CO 2NO
2CO 2++,
2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):
水碳酸钙氢氧化钙二氧化碳+→+
3、大理石与盐酸反应:
二氧化碳水氯化钙盐酸碳酸钙++→+
4、甲烷(天然气的主要成分)燃烧:
水二氧化碳氧气甲烷点燃
+−→−+
O H 2CO O 2CH 2224++点燃
5、一氧化碳还原氧化铁:
二氧化碳铁一氧化碳氧化铁高温
+−−→−+ 232CO 32Fe CO
O e F ++高温
6、一氧化碳还原氧化铜:
二氧化碳铜一氧化碳氧化铜加热
+−−→−+ 2CO u C CO
CuO ++加热
10、碳酸氢铵与氢氧化钙混合:氨气水碳酸钙氢氧化钙碳酸氢铵++→+
11、硫酸铵与氢氧化钠溶液混合加热:氨气水硫酸钠氢氧化钠硫酸铵△
++−→−+
(NH 4)2SO 4+2NaOH Na 2SO 4+ H 2O + NH 3·H 2O
7、葡萄糖在酶作用下的反应:水二氧化碳氧气葡萄糖酶
+−→−+。
