(浙江选考)最新2020版高考化学 考前提升训练28 化学计算(第29题)
2020版(2020年4月)浙江选考高考化学:特训4第29题化学计算题专练 Word版含答案
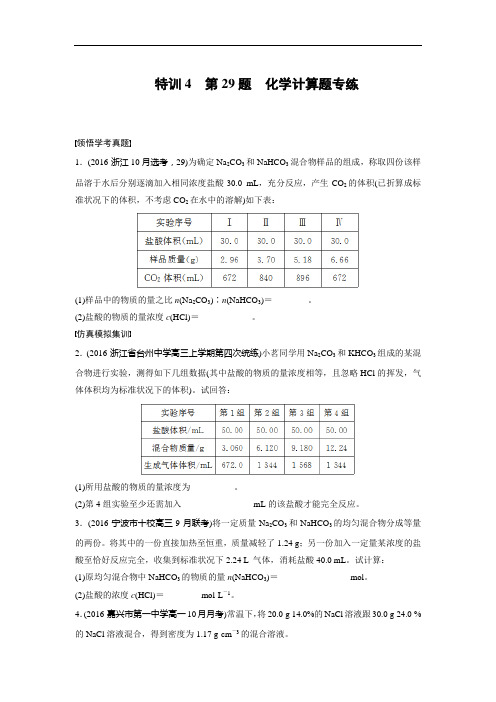
特训4第29题化学计算题专练领悟学考真题1.(2016·浙江10月选考,29)为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:(1)样品中的物质的量之比n(Na2CO3)∶n(NaHCO3)=________。
(2)盐酸的物质的量浓度c(HCl)=____________。
仿真模拟集训2.(2016·浙江省台州中学高三上学期第四次统练)小茗同学用Na2CO3和KHCO3组成的某混合物进行实验,测得如下几组数据(其中盐酸的物质的量浓度相等,且忽略HCl的挥发,气体体积均为标准状况下的体积)。
试回答:(1)所用盐酸的物质的量浓度为__________。
(2)第4组实验至少还需加入________________ mL的该盐酸才能完全反应。
3.(2016·宁波市十校高三9月联考)将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份。
将其中的一份直接加热至恒重,质量减轻了1.24 g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24 L 气体,消耗盐酸40.0 mL。
试计算:(1)原均匀混合物中NaHCO3的物质的量n(NaHCO3)=________________ mol。
(2)盐酸的浓度c(HCl)=________ mol·L-1。
4.(2016·嘉兴市第一中学高一10月月考)常温下,将20.0 g 14.0%的NaCl溶液跟30.0 g 24.0 %的NaCl溶液混合,得到密度为1.17 g·cm-3的混合溶液。
(1)该混合溶液的质量分数为__________。
(2)该混合溶液的物质的量浓度是_______mol·L -1。
(3)在1 000 g 水中溶解__________ mol NaCl 才能使其浓度与上述混合溶液的浓度相等。
(浙江选考)近年高考化学考前提升训练27化学基础实验(第28题)(2021年整理)

(浙江选考)2019版高考化学考前提升训练27 化学基础实验(第28题) 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((浙江选考)2019版高考化学考前提升训练27 化学基础实验(第28题))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(浙江选考)2019版高考化学考前提升训练27 化学基础实验(第28题)的全部内容。
提升训练27 化学基础实验(第28题)1。
(2018·学军中学模拟)一定条件下,草酸铜晶体(CuC2O4· x H2O)受热分解的化学方程式为CuC2O4·x H2O·CuO+CO↑ +CO2↑ +x H2O↑.某化学兴趣小组设计如图装置,探究草酸铜晶体分解的气体产物:请回答:(1)该套实验装置的明显缺陷是。
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中(填实验现象),则可证明草酸铜晶体热分解的气体产物是H2O、CO、CO2。
(3)该兴趣小组改变热分解的反应条件,完全反应后发现C中白色沉淀量明显较先前实验多,而E、F中未见明显现象,请推测A装置中固体产物成分并设计一个实验方案,用化学方法验证固体产物:(不考虑操作和药品的问题)。
2.钠与水反应的改进实验操作如下:取一张滤纸,用酚酞试液浸润并晾干,裁剪并折叠成信封状,滤纸内放一小块金属钠(约绿豆粒般大小),把含钠的滤纸信封放入水中,装置如下图所示.请回答:(1)写出金属钠与水反应的离子方程式:。
(2)实验过程中取用金属钠的操作方法是. (3)有关此实验的说法正确的是。
A.实验过程中,可能听到爆鸣声B。
2020年7月浙江省普通高校招生选考科目考试化学试题与答案

2020.7化学试题可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Cu 64 Zn 65 Ag 108 I 127 Ba 137一、选择题(本大题共25小题,每小题2分,共50分。
每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分) 1.水溶液呈酸性的是A .NaClB .NaHSO 4C .HCOONaD .NaHCO 3 2.固液分离操作中,需要用到的仪器是A .B .C .D .3.下列物质在熔融状态下不导电...的是 A .NaOH B .CaCl 2 C .HClD .K 2SO 44.下列物质对应的组成不正确...的是 A .干冰:CO 2B .熟石灰:CaSO 4·2H 2OC .胆矾:CuSO 4·5H 2OD .小苏打:NaHCO 35.下列表示不正确...的是 A .乙烯的结构式:C CHHHHB .甲酸甲酯的结构简式:C 2H 4O 2 C .2−甲基丁烷的键线式:D .甲基的电子式:H ••C ••H ••H• 6.下列说法不正确...的是 A .天然气是不可再生能源B .用水煤气可合成液态碳氢化合物和含氧有机物C .煤的液化属于物理变化D .火棉是含氮量高的硝化纤维 7.下列说法正确的是A .35Cl 和37Cl 是两种不同的元素B .单晶硅和石英互为同素异形体C .HCOOH 和HOCH 2CHO 互为同系物D .H 与Na 在元素周期表中处于同一主族 8.下列说法不正确...的是 A .Cl −会破坏铝表面的氧化膜B .NaHCO 3的热稳定性比Na 2CO 3强C .KMnO 4具有氧化性,其稀溶液可用于消毒D .钢铁在潮湿空气中生锈主要是发生了电化学腐蚀 9.下列说法不正确...的是 A .高压钠灯可用于道路照明B .SiO 2可用来制造光导纤维C .工业上可采用高温冶炼黄铜矿的方法获得粗铜D .BaCO 3不溶于水,可用作医疗上检查肠胃的钡餐10.反应MnO 2+4HCl (浓)MnCl 2+Cl 2↑+2H 2O 中,氧化产物与还原产物的物质的量之比是A .1∶2B .1∶1C .2∶1D .4∶111.下列有关实验说法不正确...的是 A .萃取Br 2时,向盛有溴水的分液漏斗中加入CCl 4,振荡、静置分层后,打开旋塞,先将水层放出B .做焰色反应前,铂丝用稀盐酸清洗并灼烧至火焰呈无色C .乙醇、苯等有机溶剂易被引燃,使用时须远离明火,用毕立即塞紧瓶塞D .可用AgNO 3溶液和稀HNO 3区分NaCl 、NaNO 2和NaNO 3 12.下列说法正确的是A .Na 2O 在空气中加热可得固体Na 2O 2B .Mg 加入到过量FeCl 3溶液中可得FeC .FeS 2在沸腾炉中与O 2反应主要生成SO 3D .H 2O 2溶液中加入少量MnO 2粉末生成H 2和O 2 13.能正确表示下列反应的离子方程式是A .(NH 4)2Fe (SO 4)2溶液与少量Ba (OH )2溶液反应:SO 2−4+Ba 2+===BaSO 4↓B .电解MgCl 2水溶液:2Cl −+2H 2O2OH −+Cl 2↑+H 2↑C .乙酸乙酯与NaOH 溶液共热:CH 3COOCH 2CH 3+OH − △ CH 3COO −+CH 3CH 2OHD .CuSO 4溶液中滴加稀氨水:Cu 2+2OH −===Cu (OH )2↓ 14.下列说法不正确...的是 A .相同条件下等质量的甲烷、汽油、氢气完全燃烧,放出的热量依次增加B .油脂在碱性条件下水解生成的高级脂肪酸盐是肥皂的主要成分C .根据纤维在火焰上燃烧产生的气味,可以鉴别蚕丝与棉花D .淀粉、纤维素、蛋白质都属于高分子化合物15.有关O OCH 2OH 的说法正确的是A .可以与氢气发生加成反应B .不会使溴水褪色C .只含二种官能团D .1 mol 该物质与足量NaOH 溶液反应,最多可消耗1 mol NaOH16.X 、Y 、Z 、M 、Q 五种短周期元素,原子序数依次增大。
(浙江选考)新2020版高考化学 考前提升训练30 化学实验综合(第31题)【下载】

提升训练30 化学实验综合(第31题)1.(2018·浙江名校新高考联考)二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]·2H2O}(其相对分子质量为354),是一种工业用化工原料。
微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。
现以胆矾和草酸为原料制备二草酸合铜(Ⅱ)酸钾晶体流程如下:(已知:H2C2O4CO↑+CO2↑+H2O)请回答:(1)第①步操作要微热溶解,其原因是加快溶解速率和。
(2)为了将滤纸上的黑色固体充分转移到热的KHC2O4溶液中,以下操作方案中最合理的是。
A.用水溶解滤纸上的黑色固体,然后将溶液转入热的KHC2O4溶液中B.用硫酸溶液溶解滤纸上的氧化铜,然后转入热的KHC2O4溶液中C.黑色固体连同滤纸一起加入到热的KHC2O4溶液中,待充分反应后趁热过滤D.先将黑色固体转入溶液中,再在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液中(3)50 ℃水浴加热至反应充分,写出该反应的化学方程式:。
(4)步骤③所用的洗涤剂最合适的是。
(5)二草酸合铜(Ⅱ)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。
从硫酸铜溶液中获得硫酸铜晶体的实验步骤为加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:a.缩短加热的时间,降低能耗;b.。
②在蒸发浓缩的初始阶段可通过(填操作名称)回收乙醇。
(6)准确称取制取的晶体试样1.000 g溶于NH3·H2O中,并加水定容至250 mL,取试样溶液25.00 mL于锥形瓶中,再加入10 mL 3.000 mol·L-1的H2SO4溶液,用0.010 00 mol·L-1的KMnO4溶液滴定,消耗KMnO4标准液20.00 mL,则该产品的纯度是。
2.(2018·绍兴模拟)锌灰是炼锌厂的烟道灰,含ZnO 35%以上,还含有少量的氧化锰(MnO)、氧化铜、铁的氧化物和不溶于酸的杂质,工业上常用酸浸法回收 ZnSO4·7H2O。
浙江新高考29题化学计算题试题练习

浙江新高考 29 题——化学计算1. 将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的 CO2体积(标准状况)与加入的盐酸体积有如图关系(不考虑CO在水中的溶解)。
2试计算:(无需书写计算步骤)(1) 盐酸的物质的量浓度为mol/L 。
(2) 该样品中 NaOH与 Na CO物质的量之比为。
2 32.取 1.19gK 2 CO3和 KHCO3的混合物溶于水配成 25mL溶液,往溶液中加入 25mLBa(OH) 溶液恰好使生成的白色沉淀的量最多。
反应后溶液的c(OH-(混合溶液体积为 50mL)。
试计算:(1) 反应后溶液中 n(OH- )= mol 。
(2) 原混合物中 n(K CO):n(KHCO )= 。
2 3 33.取 2.74gNa 2CO3和 NaHCO3的混合物溶于水配成 25mL溶液,往溶液中加入 25mLHCl溶液恰好完全反应生成标准状况下 672mL气体。
反应后溶液的c(Cl - )=0.8mol/L( 混合溶液体积为50mL)。
试计算:(1)-)= mol 。
反应后溶液中 n(Cl(2) 原混合物中 n(Na CO):n(NaHCO )= 。
2 3 35.取 14.3g Na2CO3· xH 2O 溶于水配成 100mL 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 20.0mL ,并收集到 1.12LCO 2 (标准状况 )。
试计算:(1) 稀盐酸物质的量的浓度为mol/L 。
(2) x 值是。
6. 取 NaHCO和 Na CO的混合物 8.22g ,加热到质量不再发生变化,冷却后测得其质量为 6.36g 。
3 2 3(1) 取等质量的原混合物溶于水,配成80mL溶液,则 c(Na +)=mol/L(2)向 (1) 所配的溶液中逐滴加入 1mol/L 的稀盐酸至过量,生成 CO2的体积 ( 标准状况 ) 与加入盐酸的体积有如右图所示的关系(不考虑CO2的溶解),则 a 点消耗盐酸的体积为mL。
2020【考前冲刺】浙江学考选考29题化学计算题型方法总结

2020【考前冲刺】浙江学考选考29题化学计算题型方法总结一、考纲解读(1)全文结束》》年浙江学考(化学)考试说明中的第二部分考核目标指出:(二)能力考核目标中第4点明确说明:化学计量及计算能力:运用化学知识和常用的数学方法解决化学问题的能力。
例如:根据化学式及化学方程式进行计算,进行物质的量、物质的量浓度的计算,进行有机物相对分子质量、分子式的初步计算;(2)全文结束》》年浙江学考(化学)考试说明中的第三部分考试要求指出:将化学计算列入b-理解中的第4点,,理解化学学计算的原理和方法、常考题型:学考试卷中第四大题计算题即为理综试卷中第29题计算题,一般为两个填空小题、占分比重:通常两空分值合为4分、二、考点梳理(命题特点)&考试趋势2、1、命题特点:29题是选考(学考)的第4个填空题,以元素化合物为载体,考查的是化学计算,题目短小精悍,固定格式,以元素化合物为载体,定量考查常见化学反应,并伴以图像、图表等包装形式,考查学生比较、判断、推理能力。
解题方法中除了依据化学方程式进行计算,还用到了一些解题技巧和数学思维方法,如守恒法、关系式法等。
该题难度中等、2、2、该题将继续延续xx年学考考试趋势,以两个填空题为主,且以图表图像为主解题、、2、3、解题策略:1、在审题中应当充分利用坐标图、表格中信息以及题干信息,读题时抓住坐标图的横纵坐标的化学意义、表格中数值变化规律等;2、利用坐标图中横坐标数据的变化、表格中数据的变化与中学教材中相关物质及化学性质相联系,在计算中可结合质量守恒、电荷守恒、电子守恒、关系式法、差量法等来进行综合计算;3、在作答时,应当准确计算物质的物质的量、物质的量的浓度等(注意有效数字),正确书写各物理量的单位(注意单位统一)、三、题型讲解3、1解题技巧归纳(提分秘笈)3、1、1归纳1“守恒法”“守恒法”:当物质之间发生化学反应时,其实质就是原子之间的化分解和化合。
一般涵盖质量守恒、电荷守恒、电子守恒以及化合价守恒等。
(浙江选考)新2020版高考化学 考前提升训练28 化学计算(第29题)【下载】

提升训练28 化学计算(第29题)1.(2018·上虞中学模拟)铜有两种常见的氧化物CuO和Cu2O。
某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体,将其加热有铜的氧化物生成,其质量随温度变化的曲线如图所示。
(1)图中A点的固体成分为,B点的固体成分为。
(2)整个过程中质量减轻包括(指出具体的物质和质量)。
2.用11.92 g NaClO配成100 mL溶液,向其中加入0.01 mol Na2S x恰好完全反应,生成Na2SO4和NaCl。
(1)NaClO溶液的物质的量浓度为mol·L-1。
(2)化学式Na2S x中的x=。
3.向一定质量CaCl2和HCl的混合溶液中逐滴加入浓度为1.000 mol·L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
(1)混合溶液中CaCl2和HCl物质的量之比n(CaCl2)∶n(HCl)=。
(2)V2=L。
4.铁、铜混合粉末20.0 g加入到100 mL5.0 mol·L-1 FeCl3溶液中,剩余固体质量为5.2g(忽略反应前后溶液体积变化)。
求:(1)反应后溶液中FeCl2的物质的量浓度为mol·L-1。
(2)原固体混合物中铜的质量分数是。
5.Na与Al混合物共1 mol与足量的水充分反应。
(已知:2Al+2NaOH+2H2O2NaAlO2+3H2↑)(1)当Na与Al的物质的量之比为时,混合物与水反应产生的H2最多。
(2)当Na与Al的物质的量之比为时,混合物与水反应产生的H2的体积为13.44 L(标准状况下)。
6.用沉淀法测定KHCO3和Na2CO3固体混合物的组成,每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应,反应前后溶液体积变化忽略不计,实验记录见下表:实验序号ⅠⅡⅢⅣⅤ样品质量/g 3.06 6.12 9.18 12.24 15.30Ba(OH)2溶液体积/mL 300 300 300 300 300生成沉淀的质量/g 5.91 11.82 17.73 23.64 23.64回答下列问题:(1)样品中KHCO3和Na2CO3的物质的量之比为。
2020年浙江省高考化学(选考)物质的量和量浓度的计算训练提升(含答案)

选考化学计算专题1.将13.6g Fe、Fe2O3和CuO的混合粉末加入到100mL一定物质的量浓度的盐酸中,充分反应,生成标准状况下的氢气896mL,过滤,滤渣经洗涤、干燥后得到1.28g固体纯净物,经检验滤液中只含有一种溶质。
请回答:(1)固体混合物中CuO的质量。
(2)盐酸的浓度为。
答案:(1)1.60 g(2)3.60 mol·Lˉ12.侯氏制碱法制得的NaHCO3固体中含有部分Na2CO3·nH2O(n<10)。
取该固体8.50g充分加热,产生的气体依次通过浓硫酸(增重1.44 g)和碱石灰(增重1.76 g)。
请计算:(1)固体中NaHCO3的质量为_________g。
(2)固体中Na2CO3·nH2O的n值为 ___________。
答案:(1)6.72 (2)43.常温下,取0.592 g Na2CO3和NaHCO3的固体混合物溶于水配成50.0 mL溶液,往溶液中加入50.0 mL Ba(OH)2溶液恰好使生成的沉淀量最多,测得反应后溶液的pH=13 (混合溶液体积改变忽略不计)。
试计算:(1)反应后溶液中n(OH-)=____。
(2)原混合物中n(Na2CO3)∶n(NaHCO3)=____。
答案:(1)0.010mol (2)2:14.3.84g Fe和Fe2O3的混合物溶于100mL某浓度的盐酸中,恰好使混合物溶解,生成0.03mol H2,向反应后的溶液中加入KSCN检验,溶液无明显现象,设HCl无挥发,反应后溶液的体积不变.(已知:氧化性Fe3+>H+,还原性Fe>Cl﹣)答案:(1)0.672L (2) 1.2mol.L-15.NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。
取没有妥善保管已部分变质的一定质量的NaHCO3样品溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
提升训练28 化学计算(第29题)1.(2018·上虞中学模拟)铜有两种常见的氧化物CuO和Cu2O。
某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体,将其加热有铜的氧化物生成,其质量随温度变化的曲线如图所示。
(1)图中A点的固体成分为,B点的固体成分为。
(2)整个过程中质量减轻包括(指出具体的物质和质量)。
2.用11.92 g NaClO配成100 mL溶液,向其中加入0.01 mol Na2S x恰好完全反应,生成Na2SO4和NaCl。
(1)NaClO溶液的物质的量浓度为mol·L-1。
(2)化学式Na2S x中的x=。
3.向一定质量CaCl2和HCl的混合溶液中逐滴加入浓度为1.000 mol·L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
(1)混合溶液中CaCl2和HCl物质的量之比n(CaCl2)∶n(HCl)=。
(2)V2=L。
4.铁、铜混合粉末20.0 g加入到100 mL5.0 mol·L-1 FeCl3溶液中,剩余固体质量为5.2g(忽略反应前后溶液体积变化)。
求:(1)反应后溶液中FeCl2的物质的量浓度为mol·L-1。
(2)原固体混合物中铜的质量分数是。
5.Na与Al混合物共1 mol与足量的水充分反应。
(已知:2Al+2NaOH+2H2O2NaAlO2+3H2↑)(1)当Na与Al的物质的量之比为时,混合物与水反应产生的H2最多。
(2)当Na与Al的物质的量之比为时,混合物与水反应产生的H2的体积为13.44 L(标准状况下)。
6.用沉淀法测定KHCO3和Na2CO3固体混合物的组成,每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应,反应前后溶液体积变化忽略不计,实验记录见下表:实验序号ⅠⅡⅢⅣⅤ样品质量/g 3.06 6.12 9.18 12.24 15.30 Ba(OH)2溶液体积/mL 300 300 300 300 300生成沉淀的质量/g 5.91 11.82 17.73 23.64 23.64回答下列问题:(1)样品中KHCO3和Na2CO3的物质的量之比为。
(2)室温下第Ⅲ组实验所得溶液中的OH-物质的量浓度为。
7.实验室用100 mL 0.500 mol·L-1的NaOH溶液捕获CO2,一定时间后,测定CO2的吸收量,方法是用盐酸逐滴加入到吸收CO2后的溶液中,产生的CO2气体的物质的量与加入盐酸的体积示意图如下:求:(1)吸收的CO2在标准状况下的体积是mL。
(2)盐酸的物质的量浓度是mol·L-1。
8.高温时,Cu2S和O2在密闭容器中实际发生的反应为以下两步:①2Cu2S+3O22Cu2O+2SO2;②2Cu2O+Cu2S6Cu+SO2↑。
取a mol Cu2S和b mol空气(设氧气占空气体积的20%)在高温下充分反应。
根据下列几种情况回答问题(反应前后温度、容器体积不变):(1)若反应后剩余固体只有Cu,则a和b的关系是。
(2)若反应后容器内的压强小于反应前,通过分析,确定反应后容器内固体的成分:。
参考答案提升训练28化学计算(第29题)1.答案: (1)CuO Cu2O (2)水0.18 g、氧气0.08 g解析: (1)根据题意分析图像,n[Cu(OH)2]==0.01 mol,由于可能发生Cu(OH)2CuO+H2O和4Cu(OH)22Cu2O+4H2O+O2↑,根据质量变化计算得出在A点生成CuO,B 点生成Cu2O,所以A处的固体成分为CuO,B点的固体成分为Cu2O。
(2)整个过程中固体质量减轻的不仅仅是H2O还有O2,根据Cu(OH)2CuO+H2O可计算出水的质量是0.18 g,然后计算出氧气的质量是0.08 g。
2.答案: (1)1.6 (2)5解析: (1)11.92 g NaClO的物质的量为=0.16 mol,则NaClO溶液的物质的量浓度为=1.6 mol·L-1;(2)Na2S x在碱性溶液中可被NaClO氧化为Na2SO4,硫元素化合价由-价升高为+6价,而NaClO被还原为NaCl,氯元素化合价由+1价降低为-1价,反应中Na2S x与NaClO的物质的量之比为0.01 mol∶0.16 mol=1∶16,根据电子转移守恒,则x×[6- ()]=16×[1-(-1)],解得:x=5。
3.答案: (1)1∶2 (2)0.100解析: (1)由图示可知碳酸钠与盐酸反应生成气体2.2g,n(HCl)=2n(CO2)=2×=2×=0.1 mol,碳酸钠与氯化钙反应,生成沉淀5.0 g,n(CaCl2)=n(CaCO3)==0.05 mol,n(CaCl2)∶n(HCl)=0.05 mol∶0.1 mol=1∶2;(2)根据C原子守恒可知:n(Na2CO3)=n(CO2)+n(CaCO3)=0.1mol,V2==0.100 L。
4.答案: (1)6.5 (2)58%解析: (1)固体剩余,则氯化铁全部反应。
如果铜不参与反应,根据氯离子守恒可知氯化亚铁的物质的量是0.1 L×5 mol·L-1×=0.75 mol,因此消耗铁的物质的量是0.75 mol-0.5 mol=0.25 mol,质量是14 g,而固体实际减少质量是14.8 g,所以铜部分反应。
设混合溶液中氯化亚铁和氯化铜的物质的量分别是x mol、y mol,则x+y=0.75、(x-0.5)×56+64y=20-5.2,解得x=0.65、y=0.1,因此反应后溶液中FeCl2的物质的量浓度0.65 mol÷0.1 L=6.5 mol·L-1。
(2)原固体混合物中铜的质量分数是×100%=58%。
5.答案: (1)1∶1(2)9∶1或3∶7解析: (1)当Na与Al恰好反应时,混合物与水反应产生的氢气最多,根据化学反应2Na+2H2O2NaOH+H2↑、2Al+2NaOH+2H2O2NaAlO2+3H2↑,所以当Na与Al的物质的量之比为1∶1时,混合物与水反应产生的氢气最多。
(2)情况一:13.44 L氢气的物质的量为0.6 mol,设Na与Al以物质的量之比1∶1发生反应生成氢气,根据化学方程式2Na+2H2O2NaOH+H2↑、2Al+2NaOH+2H2O2NaAlO2+3H2↑,得总反应化学方程式为2Na+2Al+4H2O2NaAlO2+4H2↑,则参加反应的Na的物质的量为0.3 mol,参加反应的Al的物质的量为0.3 mol,还有0.4 mol Al没有反应,则Na与Al的物质的量之比为3∶7;情况二:1 mol Na完全反应生成0.5 mol氢气,实际上生成氢气0.6 mol,则Al一定参加反应,设参加反应的Na的物质的量为x mol,参加反应的Al的物质的量为y mol,根据反应2Na+2H2O2NaOH+H2↑、2Al+2NaOH+2H2O2NaAlO2+3H2↑,0.5x+1.5y=0.6,x+y=1,解得x=0.9 mol,y=0.1 mol,所以Na与Al的物质的量之比为9∶1。
6.答案: (1)2∶1(2)0.60 mol·L-1解析: 第Ⅳ组、第Ⅴ组实验生成沉淀碳酸钡质量都为23.64 g,说明样品质量为12.24 g 时,氢氧化钡已经完全反应,第Ⅰ组、第Ⅳ组实验中样品的质量分别为3.06 g、12.24 g,生成沉淀碳酸钡质量分别为5.91 g、23.64 g,样品的质量之比等于生成的沉淀质量之比为1∶4,说明第4次恰好完全反应。
(1)第4次实验中样品完全反应,令碳酸氢钾与碳酸钠的物质的量分别为x mol、y mol,则:100x+106y=12.24、197x+197y=23.64,解得:x=0.08、y=0.04,故n(KHCO3)∶n(Na2CO3)=0.08 mol∶0.04 mol=2∶1;300 mL Ba(OH)2溶液中Ba2+的物质的量为0.08 mol+0.04 mol=0.12 mol;(2)原固体混合物的组成不变,由(4)可知9.18 g该固体样品中KHCO3的物质的量为0.06 mol,Na2CO3的物质的量为0.03 mol,300 mL Ba(OH)2溶液中Ba2+的物质的量为0.12 mol,OH-的物质的量为0.24 mol;故第Ⅲ组实验所得溶液中的OH-物质的量为0.24 mol-0.06 mol=0.18 mol,其物质的量浓度为0.18 mol÷0.3 L=0.60 mol·L-1。
7.答案: (1)672(2)1解析: NaOH溶液捕获CO2后,随着捕获的CO2的量的增加,得到的溶液中溶质可能存在四种情况:①Na2CO3和NaOH、②Na2CO3、③Na2CO3和NaHCO3、④NaHCO3。
涉及的三种溶质与盐酸反应的顺序依次为NaOH Na2CO3(反应生成NaHCO3)NaHCO3。
反应原理分别为NaOH+HCl NaOH+H2O、Na2CO3+HCl NaHCO3+NaCl、NaHCO3+HCl NaCl+H2O+CO2↑,因此,如果仅有Na2CO3参加反应时,图像中无CO2生成段与生成CO2段盐酸的消耗量相等;若同时存在NaOH,无CO2生成段消耗的盐酸量会增加,导致此段盐酸消耗量大于生成CO2段。
当仅含NaOH时,生成CO2段盐酸消耗量为0。
若存在NaHCO3和Na2CO3时,生成CO2段消耗的盐酸量大于无CO2生成段,当仅含NaHCO3时,则无CO2生成段盐酸消耗量为0。
结合图像,加入20 mL 盐酸过程中无CO2生成,再加入30 mL 盐酸时,CO2完全释放出来,可以判断用NaOH溶液吸收CO2后所得产物为Na2CO3、NaHCO3。
设Na2CO3的物质的量为x mol、NaHCO3的物质的量为y mol,则2x+y=0.100×0.500,,解得x=0.02,y=0.01,吸收的CO2的物质的量为0.01 mol+0.02mol=0.03 mol,标准状况时体积为0.03 mol×22.4 L·mol-1=0.672 L。
反应消耗盐酸中HCl的物质的量为2×0.02 mol+0.01 mol=0.05 mol,物质的量浓度为=1 mol·L-1。
8.答案: (1)b=5a(2)Cu2O或Cu和Cu2O解析: (1)反应后固体全部是Cu,则:2Cu2S+3O22Cu2O+2SO2、2Cu2O+Cu2S6Cu+SO2↑,两方程式相加得:Cu2S + O22Cu+SO21 1a mol 0.2b mol,解得b=5a。
