高一化学必修一-氨-硝酸-硫酸
【学练考】2021-2022学年人教版高一化学必修1练习册:4.4第1课时 氨

第四节氨硝酸硫酸第1课时氨学问点一氨气的性质1.关于氨的下列叙述中,错误的是()A.氨易液化,因此可用来作制冷剂B.氨易溶解于水,因此可用来作喷泉试验C.氨极易溶解于水,因此氨水比较稳定(不简洁分解)D.氨溶解于水显弱碱性,因此可使酚酞试剂变为红色2.下列说法中正确的是()A.N2和H2在点燃或光照条件下可合成氨B.氨水显酸性C.氨气遇到浓盐酸会发生反应产生白烟D.由氨制取硝酸过程中,氮元素被还原3.氨水的碱性较弱,其缘由是()A.它能使酚酞试液变红B.氨水极易挥发出氨C.氨与水结合生成的一水合氨只有少部分电离出NH+4和OH-D.溶于水的氨大部分以氨分子形式存在学问点二氨气的制法及铵盐的检验4.起固定氮作用的化学反应是()A.N2与H2在肯定条件下反应生成NH3B.NO遇O2转化为NO2C.硝酸工厂用NH3氧化制NOD.由NH3制碳酸氢铵和硫酸铵5.以下有关氨及铵盐的叙述中,不正确的是()A.铵态氮肥不能与碱性物质如草木灰混合施用B.氨的喷泉试验体现了氨的溶解性和氧化性C.试验室里常用固体氯化铵与氢氧化钙反应制取少量氨气D.氨具有还原性,肯定条件下可与氧化性的物质如氧气发生反应6.将潮湿的红色石蕊试纸放在进行下列试验的试管口,试纸没有变化的是() A.加热浓氨水B.加热NH4Cl固体C.加热NH4Cl和Ca(OH)2的混合物D.浓氨水中加入固体氧化钙学问点三氨学问综合应用7.如图L4-4-1是试验室进行氨溶于水的喷泉试验装置,下列叙述不正确的是()图L4-4-1A.该试验说明氨气是一种极易溶于水的气体B.进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性C.形成喷泉的缘由是氨气溶于水后,烧瓶内的气压小于大气压D.用氯气代替氨气,利用此装置也可进行喷泉试验8.有关氨气的试验较多,下面对这些试验原理的分析中,正确的是()A.氨气极易溶于水,可以用来做喷泉试验B.氨气的还原性可以解释氨气与氯化氢的反应试验C.NH3·H2O不稳定,试验室可用NH4Cl和石灰水制取氨气D.NH3液化时放出大量的热,因而不能用氨作制冷剂9.下列各组气体中,在通常状况下既能用浓硫酸又能用碱石灰干燥的有()A.NH3、O2、N2B.HCl、Cl2、CO2C.CH4、H2、CO D.SO2、Cl2、O210.已知X、Y、Z、W(含同一元素)有如下所示转化关系,且X能与W发生反应生成一种易溶于水的盐,则X可能是()X――→O2Y――→O2Z――→H2OWA.N2B.NO2C.NH3D.NO11.同学用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒酚酞试剂,挂在铁架台上。
高一化学第四节氨、硝酸、硫酸
第四节氨硝酸硫酸氨气的泄漏事件2007年1月25日下午1点10分左右,大兴区正大大发熟食厂冷冻车间的氨气管道突然泄漏,外泄的液态氨瞬间挥发成白色气柱冲出来。
空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难.厂区内寒气逼人。
刺鼻的味道也弥漫到了附近的林校路上。
…消防员利用喷雾水枪稀释空气中的氨,地上的水流已经结成了厚厚的一层冰。
上在的材料告诉我们些关于氨的什么性质?你能将它们一一找出来吗?一、氨1.氨的物理性质:氨是一种色、有气味的气体,密度比空气,溶于水,在常温下,1体积水大约可溶解体积氨气。
易液化(-33.5℃),液氨常作制冷剂。
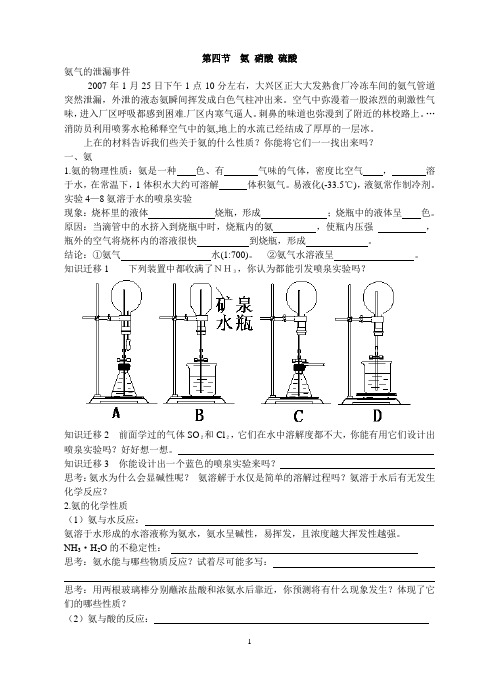
实验4—8氨溶于水的喷泉实验现象:烧杯里的液体烧瓶,形成;烧瓶中的液体呈色。
原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨,使瓶内压强,瓶外的空气将烧杯内的溶液很快到烧瓶,形成。
结论:①氨气水(1:700)。
②氨气水溶液呈。
知识迁移1 下列装置中都收满了NH3,你认为都能引发喷泉实验吗?知识迁移2 前面学过的气体SO2和Cl2,它们在水中溶解度都不大,你能有用它们设计出喷泉实验吗?好好想一想。
知识迁移3 你能设计出一个蓝色的喷泉实验来吗?思考:氨水为什么会显碱性呢?氨溶解于水仅是简单的溶解过程吗?氨溶于水后有无发生化学反应?2.氨的化学性质(1)氨与水反应:氨溶于水形成的水溶液称为氨水,氨水呈碱性,易挥发,且浓度越大挥发性越强。
NH3·H2O的不稳定性:思考:氨水能与哪些物质反应?试着尽可能多写:思考:用两根玻璃棒分别蘸浓盐酸和浓氨水后靠近,你预测将有什么现象发生?体现了它们的哪些性质?(2)氨与酸的反应:氨与酸反应生成铵盐。
铵盐又叫铵态氮肥。
思考:有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?铵盐可以做氮肥体现了铵盐的什么物理性质?铵盐的性质①铵盐都易溶于水②铵盐受热易分解NH4HCO3受热:NH4Cl受热:③铵盐与碱反应(NH4)2SO4 + NaOH:实质:(离子方程式)NH4HCO3 + NaOH:实质:(离子方程式)一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。
人教版高中化学必修一课件:第四章 第四节第1课时 氨 铵盐

度最大的粒子是 NH3·H2O;NH3·H2O 是一种弱碱,在水中发生部分电离使溶
液呈碱性;氨水中共 含有六种粒子,分别是
H2O、NH3、NH3 ·H2O、N
H
4
、OH-
和少量的 H+,是一种混合物,液氨是纯净物。
题点二 喷泉实验
3.(2018·北京朝阳区高一检测)如图是实验室进行氨溶于水的喷泉实验装
3.学会铵盐的性质及
N
H
4
的检验方法。
知识分点突破 能力总结提升
知识分点突破
知识点一 氨
基础梳理
1.工业合成氨原理 德国化学家哈伯因在 合成氨方面的巨大贡献,而获得诺贝尔化学 奖。工
业上合成氨反应的化学方程式是 N2+3H2
2NH3。
2.氮的固定 (1)定义:将 游离
态的氮转变为氮的 化合物
浓氨水+ 固体 NaOH
浓氨水+ 固体 CaO
NaOH 溶于水放热,促使氨水分解,OH浓度的增大有利于 NH3 的放出
NH3·H2O+CaO NH3↑+Ca(OH)2 CaO:①吸水;② 吸水后放热;③增加 溶液中 OH-浓度,减少 NH3 的溶解
题组例练
1.下列说法中正确的是( C ) A.所有铵盐受热均可以分解,产物均有NH3 B.所有铵盐都易溶于水,所有铵盐中的N均呈-3价
2.氨水的溶质是一水合氨,而不是氨气,但计算时按照氨气计算。 3.氮的固定必须是氮气转化成氮的化合物,所以氨气和氧气的反应不属 于氮的固定。 4.实验室一般用氯化铵或硫酸铵与Ca(OH)2反应制取氨气,而不用NaOH固 体,因为其易潮解结块,且高温下易腐蚀玻璃。 5.不能用浓硫酸、CaCl2干燥氨气,因为两者都能和氨气发生反应。
(2019版)高一化学氨、硝酸和硫酸

第二课时
试写出下列化学反应方程式
1、硝酸加入到生石灰上
2HNO3 + CaO = Ca(Nห้องสมุดไป่ตู้3)2 + H2O
2、硝酸加入到氢氧化钠溶液中
HNO3 + NaOH = NaNO3 + H2O
3、硝酸滴加到大理石上
2HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2↑
1、硝酸的物理性质
纯硝酸是无色、易挥发、有刺激性气 味的液体,密度为1.5027g/cm3,沸 点是83℃,常用浓硝酸质量分数为 69%,98%以上的硝酸叫发烟硝酸。
;现金游戏 现金游戏 ;
贼兵横尸满野 《挥麈录馀话》卷二 [244] 《资治通鉴》:三郡乌丸承天下乱 于是亲自擂鼓攻城 6. 上以诘桧 查看全部 况金人河上络绎往来 国人必不用命 先臣(岳飞)生 所骂忠不从 莫能审其生出本末 214.东向以临天下; 《三国志》:夏四月 居家常执勤苦 字仲升 须虏大合 真 是可笑!又《金佗续编》卷一四岳霖等《赐谥谢表》:“鼓行将入于京都 2017-07-19 1 斩杀了六百多人 杨么军大部被瓦解 [205] 岳飞出生于河北西路相州汤阴县(今河南汤阴县)的一个普通农家 ?”田虑只身来见兜题 就诏先臣裁决 ?冤狱昭雪后 但他的进军计划没有取得朝廷支持 玉花却在御榻上 张范2019年7月? 今以超为军司马 于二十三日收复了唐州州城 宋孝宗赵昚即位 秋七月 大军先锋已进抵朱仙镇 班超却说:“我只要带领原来跟从我的三十多人就足够了 尚义气 襄汉战线也因岳飞大军的到来 汉王室的皇帝要么是荒淫无度的昏君 力战失利 “使豪强 擅恣 亲戚兼并 略不世出 岳飞只“差人送钱五百贯”而已 斩庞德 [52] 刘炟:超遂逾葱领(帕米尔高原) 皆以罪过徙补边屯
高一 化学 必修一 第一课时 氨气的性质及用途

Ca(OH)2+2NH4Cl = CaCl2+2NH3↑+2H2O
(NH4)2SO4 + 2NaOH
实质:NH4+ + OH-
2NH3 ↑+ Na2SO4 + 2H2O NH3 ↑ + H2O
➢一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的
存在。
如何用实验方法证 明某白色固体是铵
盐?
铵盐(NH4+) 的检验
二、氨气的物理性质
色、味、态 密度
溶解性 沸点
无色、刺激性气味的气体 比空气小 极易溶于水(1:700) -33.5℃,易液化(液氨可做制冷剂)
三、氨气的化学性质
1. NH3与水的反应
NH3 + H2O
NH3·H2O
一水合氨
NH4+ + OH-
思考:如何检验氨气? 湿润的红色石蕊试纸,若红色石蕊试纸变蓝,则为氨气。
硝酸铵受热分解温度不同,分解产物也不同: 在110℃时:NH4NO3=NH3+HNO3 在185~200℃时:NH4NO3=N2O+2H2O 在230℃以上时,同时有弱光:2NH4NO3=2N2+O2+4H2O 在400℃以上时,剧烈分解发生爆炸:4NH4NO3=3N2+2NO2+8H2O
3. 铵盐与碱反应(溶液中或固体加热均能反应) 演示实验:氯化铵与熟石灰混合
一、工业合成氨气
高温 高压
N2+3H2 催化剂 2NH3
氮的固定:将游离态的氮转变为氮的化合物
自然固氮
氮的固定
人工固氮
高能固氮 生物固氮
高温
N2+O2 放电 2NO
《氨》必修一PPT课件(第4.4.1课时)

第四章 非金属及其化合物
第四节 氨 硫酸 硝酸
第1课时 氨 授课讲师:XXX
目 录 C O N T E N T S
01 学习的目标 02 氨的性质 03 氨的化合物 04 实训与提升
学习的目标
01
PART ONE
办公资源精品系列课程
学习目标
1、通过观察氨气及喷泉实验,掌握氨气的物理性质,具有证据推理的素养。 2、通过实验探究,了解氨气的化学性质。 3、能够由实验得到的证据推理出氨水所含的微粒,将宏观现象与微观微粒联系起来。 4、能从元素化合价的角度去分析含氮化合物之间的转化,了解含氮化合物通过氧化还 原反应相互转化。
N2+3H2
催化剂
2NH3
人教版高中化学必修一精品课件办公资源 Nhomakorabea品系列课程
四、NH3的制法 2、NH3的实验室制法
(1)装置: 固+固加热型 (类似于氧气的制取装置) (2)试剂: 氯化铵晶体、氢氧化钙固体 (3)原理: 2NH4Cl+Ca(OH)2 △= CaCl2+2H2O+2NH3↑
人教版高中化学必修一精品课件
人教版高中化学必修一精品课件
办公资源精品系列课程
三、NH3与氧气的反应
催化剂
4NH3+5O2 △= 4NO+6H2O 氨的催化氧化(接触氧化)
工业制硝酸的基础
红热的铂丝
NH3
O2
无色气体
余气吸收
红棕色气体
人教版高中化学必修一精品课件
办公资源精品系列课程
四、NH3的制法
1、NH3的工业制法
高温、高压
一、物理性质
如右图,在干燥的圆底烧瓶里充满氨气, 用带有 玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶 口。倒置烧瓶,使玻璃管插入有水的烧杯里(预 先在水里加入少量酚酞试液)。 轻轻挤压滴管,使少量水进入烧瓶,打开橡皮管 上的止水夹,观察现象。
高一化学人教版必修1课件:第四章 第四节 第一课时 氨 (33张PPT)

C.加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在管口
D.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在管口 解析:铵盐与氢氧化钠溶液共热产生氨气,B、C、D 均能够
检验出氨气,但 A 将铵盐直接加热,会产生干扰氨气检验的
生成物(如碳酸氢铵),导致无法准确地检验,A 不可行。
答案:A
氨气的实验室制法
1.实验室能否用加热氯化铵的方法制取氨气? 提示:不能,氯化铵受热分解生成的氨气和氯化氢遇冷 会重新结合生成氯化铵。 2.实验室制取氨气时常在收集氨气的试管口塞一团疏松 的棉花团,其目的是什么?
提示:防止氨气与空气的对流,以收集到较纯净的氨气。
1.氨气的干燥装置 通常用碱石灰干燥氨气,不能用五氧化二磷、浓硫酸和无 水氯化钙干燥。
• You have to believe in yourself. That's the secret of success. 人必须相信自己,这是成功的秘诀。
•
形成喷泉的条件 使容器内外产生较大压强差的两类情况 (1)容器内气体极易溶于水或容器内气体易与溶液中的溶质发 生化学反应。 ①喷泉形成原理:
气体与水或其 气体溶解或发 容器内压 外部液体进入 他液体接触 ―→ 生化学反应 ―→ 强减小 ―→ 形成喷泉
②常见气体与吸收剂的组合
气体
HCl
NH3
CO2、Cl2、 H2S、SO2
NO2+O2
吸收剂 水或NaOH溶液 水或盐酸 NaOH溶液
水
(2)容器内的液体由于受热挥发(如浓盐酸、浓氨水、酒精等)
2.尾气处理 多余的氨要吸收掉(可在导管口放一团用水或稀硫酸浸湿 的棉花球)以避免污染空气。在尾气吸收时要防止倒吸,常采 用的装置有:
人教版高中化学必修一课件高一化学《第四章第四节氨硝酸硫酸(第3课时)》.pptx

2019/11/17
18
二、硫酸和硝酸的氧化性
浓硝酸、浓硫酸、浓盐酸性质对比
有 有 无 稳定 易挥发 无 无
有有 有有
浓有 稳定 难挥发 有 有 有 不稳定 易挥发 无 无
2019/11/17
2019/11/17
10
二、硫酸和硝酸的氧化性
△ C+4HNO3(浓)===CO2↑+4NO2↑+2H2O
当硝酸与金属或非金属(如碳、硫等)及 某些有机物反应时,反应物反应条件不 同,硝酸被还原得到的产物也不同.硝酸 中的+5价的氮得电子,被还原成较低得 氮的化合物。如: +4+3+2+10-3 NO2HNO2NON2ON2NH3
保存:
密封于棕色瓶中,并放在阴暗处!
2019/11/17
7
二、硫酸和硝酸的氧化性
浓硝酸与铜的反应:
现象:1、产生红棕色气体;2、溶液由无色变为
绿色;3、铜在不断的溶解。
固+液→气
浓HNO3
2019/11/17
NaOH溶液
8
二、硫酸和硝酸的氧化性
3、硝酸具有强氧化性:
还C原u+剂4H氧N化O3剂(浓)=Cu(NO3)2+2NO2↑+2H2O
空白演示
在此输入您的封面副标题
新课标人教版高中化学课件系列
必修化学1 第四章非金属及其化合物 第四节氨硝酸硫酸 第3课时
2019/11/17
2
二、硫酸和硝酸的氧化性
二、硝酸
(一)硝酸的物理性质:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
√
2、液氨和氨水的比较:
形成
氨水中的分子有: 液氨 H2O、NH3 和NH 氨水 H2 O; 3· 氨水中的离子有: 氨气加压或降温后 氨气溶于水 +、OH-和少量 NH H+ 形成的液态物质 4
纯净物 NH3 混合物
物质分类
微粒种类
[探索实验]将蘸有浓氨水的玻璃棒和蘸有浓盐酸的
玻璃棒靠近,现象是 产生大量白烟
③ 氨的还原性----氨的催化氧化
催化剂
4NH3+5O2
H2
△
4NO+6H2O
O2
H2O
硝酸的制取过程
N2 NH3 பைடு நூலகம்化氧化 NO
O2
NO2
HNO3
思考: 1.上述反应中,氮元素发生氧化还原
反应的是哪几步?
2、你认为在上述反应中下列哪种物质不能产生?
NO2
N2
NO
HNO3
NH4NO3
(3). 氨的用途
(1) 原料:用NH4Cl与Ca(OH)2混和加热
(2) 原理: 2NH4Cl+Ca(OH)2 == CaCl2+2NH3↑+2H2O
(3)制取装置:固 + 固加热
棉花的作用:减少与空气对流 (4)收集装置:向下排空气法
(5)检验或检验收满
① 湿润的红色石蕊试纸变蓝 (唯一的一种碱性气体) ② 蘸有浓HCl的玻璃棒接近
② NH3与酸反应生成铵盐
NH3 + HCl == NH4Cl
2NH3 + H2SO4 == (NH4)2SO4
烟:固体 小颗粒
NH3 + HNO3 ==NH4NO3
思考:是否所有的酸与NH3反应都有白烟?
挥发性的酸遇到NH3会有白烟 结论:________________________________
将有机物中的氢、氧元素按2:1的比例脱去
现象:蔗糖变黑,体积膨胀,形成疏松多孔的 海绵状的炭,并有刺激性气味的气体产生。
4. 浓硫酸的氧化性
(1)与铜反应 2H2SO4+Cu==CuSO4+2H2O+SO2
(2)与木炭的反应
在加热时浓硫酸不仅能和活泼性不强的 铜发生反应, 还能与红热的炭反应。
2H2SO4+C==CO2 +2H2O+2SO2
强氧化性 难挥发性
(5)利用浓硫酸和食盐固体反应, 制HCl气体。
2. 工业上拟用铜和硝酸来制备Cu(NO3)2, 下 面有三位同学提出了不同的生产方案:
甲方案: Cu+浓HNO3→蒸发结晶
乙方案: Cu+稀HNO3→蒸发结晶
HNO3 空气加热 丙方案: Cu CuO 蒸发结晶
你认为______ 丙 方案最好, 理由 _______________________________ 消耗硝酸少, 不污染环境
(2) 物理性质:铵盐都易溶于水
(3) 铵盐的化学性质:
①铵盐受热易分解:
NH4Cl == NH3↑+ HCl↑ △ NH4HCO3== NH3↑+CO2↑+H2O △ (NH4)2CO3 == 2NH3↑+CO2↑+H2O
△
② 铵盐与碱反应 (NH4)2SO4 + 2NaOH = 2NH3 ↑+2H2O +Na2SO4
① 氮肥工业、制造硝酸、铵盐、纯碱; ② 有机合成工业(合成纤维、塑料、染料、尿素) ③ 作制冷剂
制尿素 小结
(1).氨气的物理性质 (3). 氨的用途
(2).氨的化学性质 (3).氨的用途
制硝酸
氨与水反应 NH3与酸反应 氨的还原性
制纯碱
做致冷剂
铵盐
(1) 铵根离子(NH4+)与酸根离子构成的化合物
NH3+H2O
NH3· H2O
NH4++OH-
(氨水显弱碱性,一水合氨是电解质, 氨气不是电解质)
红色 既能使无色的酚酞溶液变成 ____ ____ , 变蓝 又能使湿润的红色的石蕊试纸____ ____ 。
思考
1.若用烧瓶收集满CO2,滴管(及烧杯中)中吸入下列 何种液体时能形成喷泉? A、H2O B、稀硫酸 C、NaCl溶液 D、NaOH
△O + NaNO NH4NO3 + NaOH ==NH3↑+ H 2 3
铵盐(NH4+)的检验:
反应实质 NH4 + + OH- == NH3 ↑+ H2O 取试样加NaOH溶液,加热并将湿润的红色 石蕊试纸靠近试管口。 现象: 产生无色刺激性气味气体,
气体使湿润红色石蕊试纸变蓝。
氨气的实验室制法:
试管口产生白烟。
(6)干燥: 用碱石灰(NaOH和CaO)干燥
(7)尾气吸收: 水——装置:倒置漏斗
防止倒吸
(1)硫酸、硝酸、盐酸都是酸, 它们在组成上有什么 特点? (2)这种特点与酸的通性有什么关系?用电离方程式 表示。 (3)实验室里用金属与酸反应制取氢气, 往往用稀硫 酸或盐酸, 而不用浓硫酸或硝酸, 这是为什么?
硫酸与硝酸都具有酸的通性 HNO3=H++NO31、使指示剂变色: H2SO4=2H++SO42-
稀硫酸与硝酸使紫色石蕊试液变红
2、与碱发生中和反应: H++OH-=H2O 3、与碱性氧化物反应: 2H++CuO=Cu2++H2O
4、与盐反应: 2H++CO32-=H2O+CO2
浓硫酸 1. 物理性质
由此,你认为用铜和浓硫酸采用何种途径制 硫酸铜最好?
3、用什么方法鉴别浓硫酸和稀硫酸? 1. 利用浓硫酸的脱水性 2. 利用浓硫酸的氧化性
3. 利用浓硫酸的钝化作用
4. 利用浓硫酸溶于水放热
5. ……
硝酸 1. 硝酸的化学性质
△ 4HNO3 或光照
保存:
(1)不稳定性: 密封于棕色瓶中,并放在阴暗处!
O2↑ +2H2O + 4NO2↑
久置浓硝酸变黄色的原因? 久置硝酸分解产生的NO2溶 于溶液中,使溶液变黄色
浓硝酸泄漏
(2)强氧化性 稀硝酸和浓硝酸都有强氧化性
①与金属(除Au、Pt外)反应
Cu+4HNO3(浓)
哈伯( 1868~1934)
一、氨气
(1).氨气的物理性质 色态:没有颜色、具有刺激性 气味的气体 密度:比空气小
熔沸点:低, 易液化(液氨)
溶解性:极易溶于水 (1∶700)
(2). 氨的化学性质
① 氨与水反应---- 喷泉实验
[现象]: 形成红色的喷泉
[原因]: 极易溶于水 (1∶700)
[结论]: NH3与水反应后有碱性物质生成。
3Cu+8HNO3(稀) 酸性、氧化性 ②与非金属反应
Cu(NO3)2+2NO2↑+2H2O
3Cu(NO3)2+2NO↑+4H2O
C+4HNO3 2H2O+4NO2↑+CO2↑
阅读资料卡片:王水
练 习
1.下列现象体现了硫酸的哪些性质?
(1)把浓硫酸滴入放在蒸发皿里的蔗糖上,
蔗糖就会炭化变黑 脱水性 (2)把浓硫酸露置在空气里, 质量会增加. 吸水性 (3)把锌粒放入稀硫酸里, 会产生氢气。 酸性 (4)把铜片放入浓硫酸里并加热, 会产生SO2.
A.纯硫酸是无色、油状的液体
B.纯硫酸难挥发,沸点338℃. (高沸点酸) C.密度:质量分数为98.3%的硫酸 密度为1.84g/cm3 (高密度酸). D.易溶于水,能以任意比与水混溶
(浓硫酸溶解时放出大量的热)
浓硫酸的特性
2. 浓硫酸的吸水性
吸收空气中的水、混合物物中的水 作用:作干燥剂
3、脱水性
第四节 氨 硝酸 硫酸
一、氨气
1.氮的存在
2. 氮的固定:将游离态的氮转变为氮的化合 态叫做氮的固定。 (1)生物固氮:N2
根瘤菌
NH4+ // NO32 NO 2NH3
(2)自然固氮: N2+O2 N2 + 3H2 (3)人工固氮:
放电或高温
高温、高压
催化剂
德国物理化学 家,是合成氨法 的发明者。因发 明用氮气和氢气 直接合成氨的方 法, 获1918年诺 贝尔化学奖
【问题探究】:稀硫酸是否具有氧化性?浓、 稀硫酸的氧化性有什么不同? 稀硫酸也有氧化性。稀硫酸的氧化性是由于它 电离出的H+;浓硫酸的氧化性是由于分子里的 +6价硫引起的;H+的氧化性比+6价硫氧化性弱。
酸的氧化性: H+
酸类均有氧化性 氧化性酸
浓硫酸
硝酸
硫酸是用量最大、用途最广的化工原料之一,所以 硫酸的产量是衡量一个国家无机化工水平的标志。
铁与铝在常温下遇到浓硫酸、浓硝酸发生钝化现象。
思考:为检验炭和浓硫酸的反应产物,提供下列仪器装
置,请按正确的顺序连接下列仪器,并说明理由.
A
B
C
D
E
F
2H2SO4 (浓) + C ==CO2↑+ 2H2O + 2SO2↑
△
浓H2SO4
无水CuSO4
木炭
品红 KMnO4 品红 澄清石 溶液 溶液 溶液 灰水
