高一化学硝酸和硫酸
化学高一硝酸知识点总结

化学高一硝酸知识点总结一、硝酸的化学性质硝酸通常是指HNO3,是一种无机酸。
硝酸是一种强氧化性酸,它能和许多金属和非金属反应。
硝酸和硫酸一样都属于强酸,当与水混合时,它发生很强的放热反应。
同时,硝酸也是一种强腐蚀性酸,接触皮肤和黏膜会引起烧伤。
硝酸的溶解度是对其具有很重要的意义。
硝酸在水中是容易溶解的,而且生成的溶液具有特别的氧化性。
硝酸还可以与许多物质发生反应,例如硝化甘油就是硝酸和甘油发生反应的产物。
二、硝酸盐的制备与性质硝酸盐是硝酸的盐类化合物,通常的通式为: R-ONO2。
硝酸盐可以由硝酸和金属氧化物(或碱)反应生成。
硝酸盐一般都是白色晶体,常常在空气中变化25℃以上则失水变质。
硝酸盐的性质由它们的阳离子和硝酸根离子(NO3-)决定。
一般来说,硝酸盐都具有高毒、易燃和爆炸的性质。
硝酸铵(NH4NO3)和硝酸钾(KNO3)在工业上是重要的炸药和火药成分。
三、硝酸与环境保护硝酸被使用在肥料生产中,特别是硝态氮肥。
但大量使用硝酸使土壤中的硝态氮浓度升高,从而造成土壤的环境问题。
过多的硝态氮会导致土壤和水体的污染,使河湖水体富营养化,生态系统遭受破坏,甚至危及人类健康。
因此,环保领域对硝酸和其盐的排放进行了严格的限制。
化肥制造商也加强了相关技术的研发,使硝酸肥料的使用更加科学和环保。
四、金属的硝酸溶液反应硝酸可以溶解大多数金属,产生相应的硝酸盐和氧化物或氢气。
通常,硝酸和活泼金属发生反应尤为激烈。
金属的硝酸溶液反应以铜为例:Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O硝酸还与还原性较强的金属反应时生成亚硝酸盐,如:3Cu + 8HNO3 → 3Cu(NO3)2 +2NO↑+ 4H2O。
五、硝酸与有机化合物的反应硝酸能与许多有机化合物发生反应,主要有硝化反应和硝基化反应。
硝基化合物是亚硝酸盐和含硝基团的有机物,是非常活泼的化合物,有时是爆炸性的。
硝化反应:是指含有活泼氢原子或者含有同位素甲烷,乙烷时,在浓硫酸中加入硝酸,这种反应称为硝化反应。
高一化学第四节氨、硝酸、硫酸
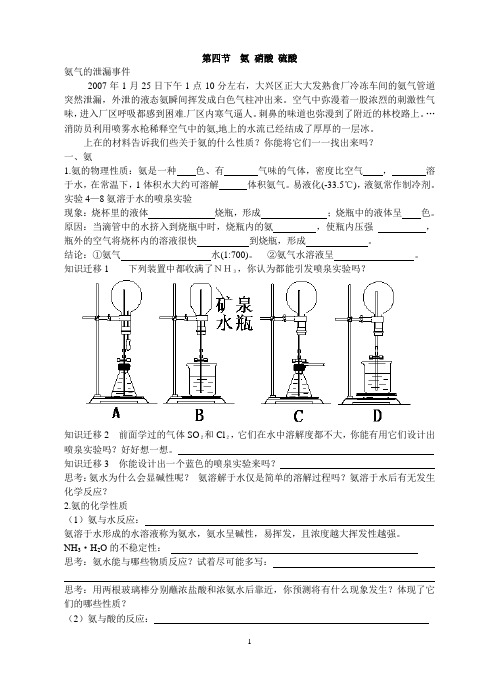
第四节氨硝酸硫酸氨气的泄漏事件2007年1月25日下午1点10分左右,大兴区正大大发熟食厂冷冻车间的氨气管道突然泄漏,外泄的液态氨瞬间挥发成白色气柱冲出来。
空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难.厂区内寒气逼人。
刺鼻的味道也弥漫到了附近的林校路上。
…消防员利用喷雾水枪稀释空气中的氨,地上的水流已经结成了厚厚的一层冰。
上在的材料告诉我们些关于氨的什么性质?你能将它们一一找出来吗?一、氨1.氨的物理性质:氨是一种色、有气味的气体,密度比空气,溶于水,在常温下,1体积水大约可溶解体积氨气。
易液化(-33.5℃),液氨常作制冷剂。
实验4—8氨溶于水的喷泉实验现象:烧杯里的液体烧瓶,形成;烧瓶中的液体呈色。
原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨,使瓶内压强,瓶外的空气将烧杯内的溶液很快到烧瓶,形成。
结论:①氨气水(1:700)。
②氨气水溶液呈。
知识迁移1 下列装置中都收满了NH3,你认为都能引发喷泉实验吗?知识迁移2 前面学过的气体SO2和Cl2,它们在水中溶解度都不大,你能有用它们设计出喷泉实验吗?好好想一想。
知识迁移3 你能设计出一个蓝色的喷泉实验来吗?思考:氨水为什么会显碱性呢?氨溶解于水仅是简单的溶解过程吗?氨溶于水后有无发生化学反应?2.氨的化学性质(1)氨与水反应:氨溶于水形成的水溶液称为氨水,氨水呈碱性,易挥发,且浓度越大挥发性越强。
NH3·H2O的不稳定性:思考:氨水能与哪些物质反应?试着尽可能多写:思考:用两根玻璃棒分别蘸浓盐酸和浓氨水后靠近,你预测将有什么现象发生?体现了它们的哪些性质?(2)氨与酸的反应:氨与酸反应生成铵盐。
铵盐又叫铵态氮肥。
思考:有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?铵盐可以做氮肥体现了铵盐的什么物理性质?铵盐的性质①铵盐都易溶于水②铵盐受热易分解NH4HCO3受热:NH4Cl受热:③铵盐与碱反应(NH4)2SO4 + NaOH:实质:(离子方程式)NH4HCO3 + NaOH:实质:(离子方程式)一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。
高一化学电离方程式大全

高一化学电离方程式大全以下是一些常见的化学电离方程式,按照不同的酸、碱和盐分类。
一、强酸的电离方程式:1.盐酸(HCl)的电离方程式:HCl → H+ + Cl-2.硝酸(HNO3)的电离方程式:HNO3 → H+ + NO3-3.硫酸(H2SO4)的二次电离方程式:H2SO4 → 2H+ + SO4^2-4.氢碘酸(HI)的电离方程式:HI → H+ + I-5.高氯酸(HClO4)的电离方程式:HClO4 → H+ + ClO4-二、强碱的电离方程式:1.氢氧化钠(NaOH)的电离方程式:NaOH → Na+ + OH-2.氢氧化钾(KOH)的电离方程式:KOH → K+ + OH-3.钙氢氧化物(Ca(OH)2)的电离方程式:Ca(OH)2 → Ca^2+ + 2OH-4.氨水(NH3·H2O)的电离方程式:NH3·H2O → NH4+ + OH-三、盐的电离方程式:1.氯化钠(NaCl)的电离方程式:NaCl → Na+ + Cl-2.硝酸铵(NH4NO3)的电离方程式:NH4NO3 → NH4+ + NO3-3.硫酸铜(CuSO4)的电离方程式:CuSO4 → Cu^2+ + SO4^2-4.碳酸钠(Na2CO3)的电离方程式:Na2CO3 → 2Na+ + CO3^2-5.硫酸铵(NH4)2SO4)的电离方程式:(NH4)2SO4 → 2NH4+ + SO4^2-四、其他电离方程式:1.纯水的电离方程式:H2O → H+ + OH-2.氨(NH3)的电离方程式:NH3 → NH4+ + OH-3.三氯化磷(PCl3)的电离方程式:PCl3 + 3H2O → H3PO3 + 3HCl4.二氧化硫(SO2)的电离方程式:SO2 + H2O → H2SO3这些是常见的化学电离方程式的例子。
需要注意的是,这只是一部分的化学电离方程式,还有很多其他的物质的电离方程式,并且在特定的条件下,一些物质可能会有不同的电离方程式。
第五章第二节第3课时硝酸(人教版2019高一化学第二册)

硝酸能与许多还原性化合物反应:
如:SO2、Na2SO3(SO32—)、KI(I—)、FeCl2 (Fe2+)等。
【小结】浓硫酸、稀硝酸、浓硝酸都是强氧化剂,这种氧 化性都不成 SO2 ,浓硝酸一般生成 NO2 , 稀硝酸生成 NO ,像 这样的酸称为氧化性酸。(谁的氧化性更强?)
3体积浓盐酸与1体积浓硝酸的混合物叫做王 水,它的氧化能力更强,可以把不溶于硝酸的金 (Au )和 铂(Pt )溶解。
V : V = 3 : 1 浓HCl
浓HNO3
帮你记忆
【学习任务三】酸雨及防治 1.SO2和NO2的主要来源、危害和防治
2.酸雨
【评价任务一】
久置的硝酸呈黄色的原因是 ( ) A.硝酸露置在空气中被氧气氧化了 B.硝酸露置在空气中被氮气还原了 C.硝酸见光或受热分解产生的NO2再溶于硝酸中 D.硝酸是强氧化性酸 【解析】选C。硝酸不稳定,见光或受热分解产生的NO2再溶于硝 酸中使溶液呈现黄色。
2、硝酸的化学性质 已知硝酸能以任意比溶于水,写出硝酸溶于水的
电离方程式,并从物质的类别角度预测硝酸可能会有 哪些化学性质。
(1)酸性:HNO3 = H+ + NO3—
运输浓硝酸的铝槽车泄露
运输硝酸的铝槽车发生泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻 的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。 思考2:为什么现场有大量红棕色的烟雾?
气体。
①铜与浓硝酸反应的化学方程式为
。
②某同学推测反应后溶液呈绿色的原因是NO2在溶液中达到饱和,NO2的饱和溶液呈黄色, 硝酸铜溶液呈蓝色,两者混合后呈绿色。他取少量该绿色溶液,向其中加入适量水后溶
高一化学第一章 第三节硝酸教案

高一化学第一章第三节硝酸教案一、教学目的1、掌握硝酸的化学性质。
2、了解实验室制NO2、NO的反应原理3、使学生了解硝酸的用途。
二、重点、难点重点:硝酸的氧化性难点:硝酸的氧化性。
三、教学过程设计探究问题框架:1、硝酸的物理性质:(直接给出)反应呢?并与稀硫酸与铜反应进行比较。
【指导学生实验】【总结并板书】3Cu+8HNO3(稀)=3Cu(NO3)2+2NO2↑+4H2O【引导总结】浓硝酸与稀硝酸与铜的作用有何不同;硝酸与硫酸氧化性哪一个较强,从哪几个方面表现。
现象:产生无色气体。
溶液由无色变为蓝色。
铜在不断的溶解。
无色气体遇空气变红棕色。
结论:此无色气体是NO。
因为:此气体遇空气变为了红棕色。
【推导】3Cu+8HNO3(稀)=3Cu(NO3)2+2NO2↑+4H2O【总结】浓硝酸生成NO2、稀硝酸生成NO 气体。
浓硝酸反应速率快,不需加热,稀硝酸反应速率慢,有时需要加热。
浓硫酸与铜反应需要加热,浓硝酸不需加热。
稀硫酸与铜不反应,稀硝酸可以反应。
可见,硝酸的氧化性比硫酸强。
【引导探究】冷浓硝酸与铝、铁活泼金属反应的情况怎样呢?【引导探究】大家回忆,实验室能否用稀硝酸制取氢气?为什么呢?【板书总结】(2)与活泼金属反应在不生成稀硝酸中不生成H2、在浓硝酸中铝、铁钝化。
【讲述】除金、铂以外,其余金属全可被其氧化而溶解。
【介绍】王水的成分:浓硝酸与浓盐酸的混合物,其体积比为1:3。
氧化能力极强,可溶解金和铂。
【实验探究】与浓硫酸一样,铝和铁都浓硝酸中钝化,即浓硝酸把它们的表面氧化成一层薄而致密的氧化膜,常温下可以用铝槽车装运浓硝酸。
【回答】不能,因为硝酸的氧化性很强,NO3-起氧化作用。
而不是H+起氧化作用。
【倾听理解】【引入】请大家用已学知识,推测浓硝酸能否与碳、硫、磷等非金属单质反应?【引导】推测碳与浓硝酸反应的产物,试写反应的化学方程式。
【板书】2、与非金属反应【总结】规律:一般生成最高价酸或氧化物、NO2和H2O。
人教高一化学第五章 化工生产中的重要非金属元素 知识点总结含答案解析

人教高一化学第五章化工生产中的重要非金属元素知识点总结含答案解析一、选择题1.某稀硫酸和稀硝酸混合溶液100 mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示。
下列说法错误的是()A.H2SO4浓度为4 mol/LB.溶液中最终溶质为FeSO4C.原混合酸中NO3-浓度为0.2 mol/LD.AB段反应为:Fe+2Fe3+=3Fe2+【答案】C【分析】由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为Fe+2H+=Fe2++H2↑.最终消耗Fe为22.4g,此时溶液中溶质为 FeSO4,则n( FeSO4)=n(Fe),由硫酸根守恒n(H2SO4)=n( FeSO4),根据OA段离子方程式计算原混合酸中NO3-物质的量,再根据c=nV计算c(H2SO4)、c(NO3-)。
【详解】A、反应消耗22.4g铁,也就是22.4g÷56g/mol=0.4mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所以硫酸的浓度是4mol/L,A正确;B、硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,B正确;C、OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以n (NO3-)=n(Fe)=0.2mol,NO3-浓度为2mol/L,C错误;D、由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,D正确。
答案选C。
【点晴】该题难度较大,解答的关键是根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用。
在做此类题目时,应当先分析反应的过程,即先发生的是哪一步反应,后发生的是哪一步。
人教版高中化学必修一课件高一化学《第四章第四节氨硝酸硫酸(第3课时)》.pptx

2019/11/17
18
二、硫酸和硝酸的氧化性
浓硝酸、浓硫酸、浓盐酸性质对比
有 有 无 稳定 易挥发 无 无
有有 有有
浓有 稳定 难挥发 有 有 有 不稳定 易挥发 无 无
2019/11/17
2019/11/17
10
二、硫酸和硝酸的氧化性
△ C+4HNO3(浓)===CO2↑+4NO2↑+2H2O
当硝酸与金属或非金属(如碳、硫等)及 某些有机物反应时,反应物反应条件不 同,硝酸被还原得到的产物也不同.硝酸 中的+5价的氮得电子,被还原成较低得 氮的化合物。如: +4+3+2+10-3 NO2HNO2NON2ON2NH3
保存:
密封于棕色瓶中,并放在阴暗处!
2019/11/17
7
二、硫酸和硝酸的氧化性
浓硝酸与铜的反应:
现象:1、产生红棕色气体;2、溶液由无色变为
绿色;3、铜在不断的溶解。
固+液→气
浓HNO3
2019/11/17
NaOH溶液
8
二、硫酸和硝酸的氧化性
3、硝酸具有强氧化性:
还C原u+剂4H氧N化O3剂(浓)=Cu(NO3)2+2NO2↑+2H2O
空白演示
在此输入您的封面副标题
新课标人教版高中化学课件系列
必修化学1 第四章非金属及其化合物 第四节氨硝酸硫酸 第3课时
2019/11/17
2
二、硫酸和硝酸的氧化性
二、硝酸
(一)硝酸的物理性质:
2014届高一化学每日一练——氨、硝酸、硫酸

高一化学每日一练——第四章第四节氨、硝酸、硫酸(1)班级姓名1.下列气体不能用H2SO4干燥的是()A.CO2B.NH3C.SO2D.HC12.关于氨的下列叙述中,错误的是()A.氨易液化,因此可用来作制冷剂B.氨易溶解于水,因此可用来作喷泉实验C.氨极易溶解于水,因此氨水比较稳定(不容易分解)D.氨溶解于水显弱碱性,因此可使酚酞试剂变为红色3.下列物质不能用于检验NH3的是A.湿润的红色石蕊试纸B.无色的酚酞溶液C.蘸有浓盐酸的玻璃棒D.湿润的蓝色石蕊试纸4.下列反应属于氮的固定的是()A.空气在雷电作用下所产生NO B.NO和O2生成NO2C.铜与浓硝酸反应产生NO2D.NH4Cl与Ca(OH)2反应生成NH35.关于反应的说法中正确的是()A.NH3做还原剂,体现氧化性B.O2做氧化剂,体现氧化性C.参加反应的O2中只有一部分做氧化剂,其中做氧化剂的和不做氧化剂的物质的量之比是4:6D.该反应中氧化剂和还原剂的质量之比是5:46.下列实验现象与氧化还原反应有关的是A.NH3使湿润的红色石蕊试纸变蓝B.向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成C.NO2通入水中,气体由红棕色逐渐转变为无色D.向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀7.在下列变化①N2和H2合成氨,②NO与O2化合,③NH4Cl受热分解中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是A.①②③B.②①③C.③②①D.③①②8.有关氨气的实验较多,下面对这些实验的实验原理的分析中,正确的是 ( )A .氨气极易溶解于水的性质可以解释氨气的喷泉实验B .氨气的还原性可以解释氨气与氯化氢的反应实验C .铵盐的水溶性大是实验室中用NH 4Cl 和Ca(OH)2的混合物制取氨气的原因D .NH 3·H 2O 的热不稳定性可以解释实验室中用加热氨水的方法制取氨气9.将湿润的红色石蕊试纸放在进行下列实验的试管口,试纸变蓝色的有 ( )A .加热浓氨水B .加热NH 4Cl 固体C .加热NH 4Cl 和Ca(OH)2的混合物D .加热饱和NH 4Cl 溶液 10.如图所示,室温下A 、B 两个容积相等的烧瓶中分别集满了两种气体(同温、同压),( )A .①②③B .②③①C .③①②D .③②①11.右图是实验室制取氨气的装置图。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
幼儿教育品牌商
Байду номын сангаас
