第十章 醇和醚
有机化学醇和醚
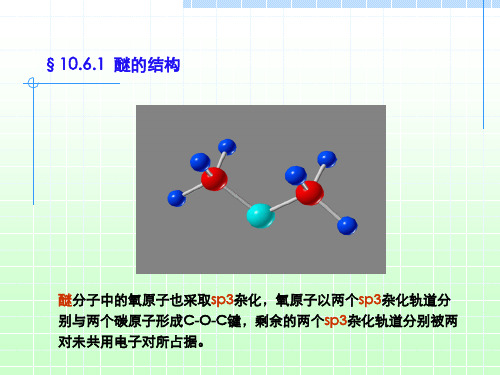
3. 溶解性 醚一般微溶于水,能与水分子形成氢键;易溶于有机溶剂。 由于 醚的化学性质不活泼,是良好的溶剂。
§10.9 醚的化学性质
醚键(C-O-C)的极性很小,比较稳定。
对碱、氧化剂、还原剂都很稳定; 在常温下醚也不与金属钠作用; 但是在一定条件下,醚也能发生某些化学反应。
§10.9 醚的化学性质
+ CH3CH2I
CH 3CH 2I
+ H2O
混醚与氢碘酸作用时,一般是较小的烃基生成碘代烷,较大的烃基
生成醇或酚。
CH 57%HI O C H 2 5 3 △ O C H 2 5 HI △ C H OH 2 5 OH + C H I 2 5 +
CH I 3
§10.9.2 络合物的生成 醚可以将氧上的未共用电子对与缺电子的试剂(如BF3、AlCl3、 RMgX等)形成相应的络合物。
HOCl
HOCH2 CH2 Cl
§10.10 重要的醚
环氧乙烷
b. 化学反应
在酸或碱催化下可以与许多含活泼氢的试剂(如水、氢卤酸、醇、氨
等)发生化学反应。
CH2 O
CH2
+
HA
CH2 OH
CH2 A
式中:A代表-OH,-X,-OR,-NH2等。
§10.10 重要的醚
环氧乙烷
b. 化学反应
① 与水反应
用,形成佯盐,而溶于强酸体系(如浓硫酸、浓盐酸)。
金 羊盐不稳定,遇水很快分解为原来的醚。
§10.9.1 佯盐的形成和醚键的断裂
醚键的断裂
醚与浓氢卤酸(一般用氢碘酸)共热,醚键可以断裂生成卤代烷 和醇。如果氢卤酸过量,生成的醇进一步反应生成卤代烷。
第十章醇和醚

Br -
CH3 CH3 C CH2CH3
Br
三卤化磷或亚硫酰氯(SOCl2)也可与醇反应 制卤代烃,且不发生重排,因此是实验室制卤代
烃的一种重要方法。
CH3CH2CH2OH
P+I2(PI3) 85~90℃
CH3CH2CH2I
CH3CH2CH2CH2OH + SOCl2
CH3CH2CH2CH2Cl + SO2 + HCl
③写出全称 “某醇”。
3CH3 H2C3CH3 3CH3
CH3
CH3CHCH2CH2CCH3
OH
CH3
5,C5H-二3C甲HC基H-22C-H己2醇CHCH2CH3
OH
OH
CHC3CHH3CCHHC2HC2HC2HC2HCHCCHH2C2CHH33
OHOH
OHOH
2,5-庚二醇
CCHH2O2OHH
3. 酯的形成
CH3 OH +H OSO3H
CH3OSO3H +H2O
硫酸氢甲酯
CH2 OH
H2SO4(浓) CH2 ONO2
CH OH + 3HONO2 10~20℃ CH ONO2 + 3H2O
CH2 OH
CH2 ONO2
三硝酸甘油酯(硝化甘油)
硝化甘油是一种烈性炸药;在医疗上可扩张血管,做心 血管的急救药。
不同的醇与同一种氢卤酸反应的活性: 烯丙醇、苄醇>叔醇>仲醇>伯醇>甲醇
卢卡斯(Lucas)试剂:无水氯化锌的浓盐酸溶液
CH3 CH3 C OH
CH3
+ HCl
ZnCl2 20℃
CH3
CH3 C Cl + H2O
有机化学第10章

• 重排: 有一些醇(除大多数伯醇外)与氢卤酸反应, 时常有重排产物生成,如: 例1:
CH3 CH3 H HCl CH3-C-CH2-CH3 CH3-C— C-CH3 Cl OH H
重排反应历程:
CH3 CH3 CH3
Why?
CH3 CH3C-CH2CH3
+
+ CH3C-CHCH3 HCl CH3C-CHCH3 -H 2O CH C-CHCH 重排 3 3 H OH H +OH2 H Cl-
构造式
习惯命名法
衍生物命名法
系统
(4) 不饱和醇的系统命名:应选择连有羟基同时含有重 键(双键和三键)碳原子在内的碳链作为主链,编号时尽 可能使羟基的位号最小:
4-(正)丙基-5-己烯-1-醇
(5) 芳醇的命名,可把芳基作为取代基:
2
1-苯乙醇 (-苯乙醇)
1
CH2 -CH3 OH
3-苯基-2-丙烯-1-醇 (肉桂醇)
H+, 25℃
(CH3)3C-OH
该反应历程:
(CH3)2C=CH2 + H+ (CH3)3 C+
H2 O
(CH3)3C-OH2 (CH3)3C-OH + H+
+
• 不对称烯烃, 在酸催化下水合,往往中间体碳正离子 可发生重排:
H+的加成符合马氏规律
(CH3)3CCH=CH2
H+
重排
①H2O ②-H+
RCH2-OH + HBr H SO RCH2Br + H2O 2 4 RCH2-OH + HCl ZnCl RCH2Cl + H2O 2
高教第二版(徐寿昌)有机化学课后习题答案第10章
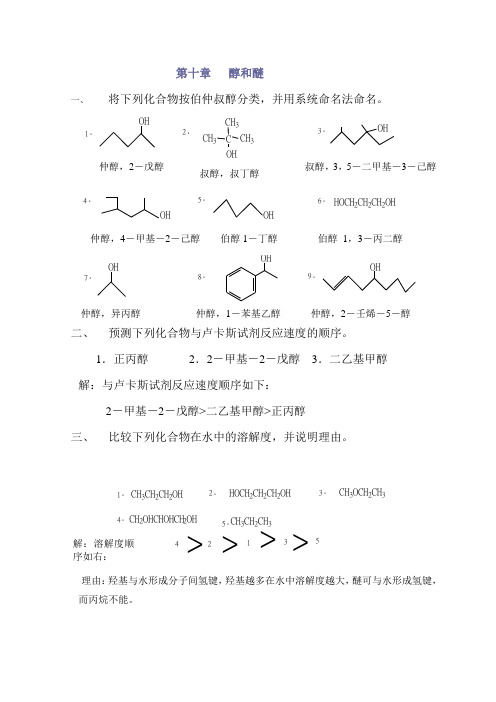
第十章 醇和醚一、将下列化合物按伯仲叔醇分类,并用系统命名法命名。
1.2.CH 3CH 3CH 3C OH 3.OH4.OH 5.OH6.HOCH 2CH 2CH 2OH7.OHOH8.9.OHOH仲醇,异丙醇仲醇,1-苯基乙醇 仲醇,2-壬烯-5-醇二、 预测下列化合物与卢卡斯试剂反应速度的顺序。
1.正丙醇 2.2-甲基-2-戊醇 3.二乙基甲醇 解:与卢卡斯试剂反应速度顺序如下:2-甲基-2-戊醇>二乙基甲醇>正丙醇三、 比较下列化合物在水中的溶解度,并说明理由。
1.CH 3CH 2CH 2OH2.HOCH 2CH 2CH 2OH3.CH 3OCH 2CH 34.CH 2OHCHOHCH 2OH5.CH 3CH 2CH 342135>>>>理由:羟基与水形成分子间氢键,羟基越多在水中溶解度越大,醚可与水形成氢键,而丙烷不能。
四、 区别下列化合物。
1.CH 2=CHCH 2OH 2.CH 3CH 2CH 2OH3.CH 3CH 2CH 2Cl解:烯丙醇 丙醇 1-氯丙烷2.CH 3CH 2CHOHCH 3CH 3CH 2CH 2CH 2OH (CH 3)3COH3.α-苯乙醇 β-苯乙醇解:与卢卡斯试剂反应,α-苯乙醇立即变浑, β-苯乙醇加热才变浑。
五、顺-2-苯基-2-丁烯和2-甲基-1-戊烯经硼氢化-氧化反应后,生成何种产物? 解:CH 3C=CCH 3HC 6H 5B 2H 6NaOH,H 2O 2C 6H 5CHCHOHCH 3CH 3CH 3CH 2=C CH 2CH 2CH 3B 2H 6NaOH,H 2O 2CH 3HOCH 2CHCH 2CH 2CH 3六、 写出下列化合物的脱水产物。
1.CH 3CH 2C(CH 3)2OHCH 3CH=C(CH 3)22.(CH 3)2CCH 2CH 2OHH 2SO 41moleH 2O(CH 3)2C=CHCH 2OH3.CH 2CHCH 3OHH +CH=CHCH 34.CH 2CHCH(CH 3)2OH+CH=CHCH(CH 3)25.CH 3CH=C CH 3CH 2C(CH 3)C(CH 3)CH 2CH 3CH 3C CH 3=CHCH 3OHOH七、 比较下列各组醇和溴化氢反应的相对速度。
Ch10 醇和醚

5-羟基己醛 5,5-二甲基-2-己醇
CH2OH HOCH2CH2CHCH2CH2CH2CH2OH
Cl OH COOH
3-羟甲基-1,7-庚二醇
3-羟基-4-氯环己甲酸
第三节 醇的结构特点
1 醇羟基中的氧是 sp3杂化,两个孤对电子分别占据两 个sp3杂化轨道,另外两个sp3杂化轨道分别与碳、 氢形成两个σ键。 2 大部分醇的羟基与sp3杂化的碳原子相连。烯醇中的 羟基与sp2杂化的碳原子相连。 3 醇的偶极矩在2D左右。甲醇的偶极矩为u=1.71D。 4 一般地说,相邻两个碳上最大的两个基团处于对交叉 最稳定,但当这两个基团可能以氢键缔合时,则这 两个基团处于邻交叉成为优势构象。
CH3CH2OH
乙醇
脂肪醇
CH 2OH
OH
环己醇
脂环醇
CH 2OH
环己甲醇
脂环醇
OH
苯酚 酚
苯甲醇 芳香醇
二 分类
一 元 醇
CH3CH2CH2CH2OH 一级醇(伯醇) CH2=CH-OH CH3CHO
O RCH2-C-R'
CH3CH2CHOH CH3 CH3
CH3COH CH3
二级醇(仲醇)
烯醇
CH2–O –NO2
甘油三硝酸酯 (硝化甘油)
CH2–O –NO2
CH2–O –NO2
乙二醇二硝酸酯
2 磷酸酯的制备
3C4H9OH +
Cl Cl Cl P=O
C4H9O C4H9O C4H9O
P=O
+ 3HCl
O
CH2OH CHOH CH2OH + HO
O P OH OH
CH2O CHOH CH2OH
第10章_第一节 醇 (1)
O
CrO3 N 2 CH2Cl2
b. MnO2(选择性氧化烯丙位羟基, 对双键无影响。 )
HO CH2CH2CH
CHCH2OH
MnO2
HO CH2CH2CH
CHCHO
⑵脱氢剂
Cu C H OH 325℃ C O
+
H2
R CH2 OH
Cu,325oC
R CH
O 醛
1°醇
R R
2°醇 Cu,325oC CH OHຫໍສະໝຸດ H2C CH2 浓 H2SO4
β H OH
H2C CH2
① 反应历程:生成碳正离子的历程
(1) C C
H OH H +
慢 C C -H2O + H OH2
C
C C + H
(2)
C C C + 电子对转移 H
- H+
② 脱水反应活性: 叔醇 > 仲醇 > 伯醇 碳正离子稳定性: 3°C+> 2°C+ >1°C+
②
CH3
Cl
-
③
CH3CCH2CH3 +
三种重排可能
更稳定
+ CH3CHCHCH3 CH3
重排产物 相同
练习:335-25(2)
3. 制备卤代烃的反应
3 ROH + PX3
常用方法
3 RX + P(OH)3 X=Br, I
特点:不发生重排反应。
PBr3 R OH + PI3 or P, I2 R Br
OH
6. 氧化反应 具有α-H的醇,容易被氧化。 α
C OH [O] C O
或 脱氢
徐寿昌《有机化学》 课件 第十章 醇、醚

R CH CH R' OH OH
+
Pb(OAc)4
RCHO
+
R'CHO
+ Pb(OAc)2 +
HOAc
这个反应常定量完成,因此可用于乙二醇的定量测定,并可根 据氧化产物推断原醇的结构。 7、邻二醇的重排反应—频哪醇重排
CH3 CH 3 H3C C C CH3
H2SO4 (HCI)
△
CH3 H3C C O C CH3 CH3
M= b.p=
74 117.2
OH OH
频哪醇
频哪酮
CH3 CH3 H3C C C CH3
H2SO4
CH3 CH3 H3C C C CH3
+
OH OH CH3 CH 3 H3C C OH C
OH OH2
CH3 H3C C C CH3
-H
+
CH3 H3C C O C CH3 CH3
+CH3O Nhomakorabea CH3
第二节 醚(ethers)
325℃
5、与酸反应——酯化
醇可与有机酸、无机酸作用生成酯。
O H3C C OH + H
O
O CH2
H+ CH3
△
CH3 C O CH2 CH3
发生酯化反应时,羧酸的C – O键断裂,醇的O – H键断 裂。 CH3 – OH + H2SO4 (CH3)2SO4(硫酸二甲酯)
硫酸二甲酯剧毒,对皮肤的阀限值1ppm,空气中最 高限量5mg/m3。
CH3CH2Cl + H2O
通常用无水氯化锌与浓盐酸按1:1的比例配成溶液与醇反 应, 代替不易操作的氯化氢气体,这样的溶液称为卢卡斯 (Lucas)试剂。结构不同的醇与卢卡斯试剂反应的活性顺序 为:
有机化学第10章 醇、酚、醚

①醇可依分子中所含羟基数目分为一元醇、二元醇及三元醇等,二
元及二元以上的醇称为多元醇。例如:
CH3CH2OH CH2CH2 OH OH
乙醇(一元醇) 乙二醇(二元醇)
CH2CH CH2 OH OH OH
丙三醇(三元醇)
3
②醇也可依分子中烃基的不同而分为脂肪醇(包括饱和醇及不饱和 醇)、脂环醇和芳香醇。 例如:
C(CH3)2或 C(CH3)3
23
在醇的核磁共振谱图中,羟基质子(O—H)由于受
分子间氢键的影响,其化学位移(δ)出现在1~5.5范围 内,在核磁共振谱中产生一个单峰。由于氧的电负性 较大,羟基所连碳原子上的质子的化学位移一般在 3.4~4.0。
24
10.1.4 醇的化学性质
羟基是醇的官能团,作为反应中心羟基决定了醇的化学性质。
2,3-二甲基-3-戊醇
12
不饱和醇的命名,除应选择同时连有羟基和不饱和键的最长碳 链作为主链外,其它原则与饱和醇相同。
CH3CH2CH2CHCH2CH2CH2OH CH CH2
5 6
4
3
2
1
4-丙基-5-己烯-1-醇
CH CHCH3 CH3CH2CHCHCH2CHCH3 CH3 OH
4-甲基-5-乙基-6-辛烯-2-醇
32
醇和氢卤酸反应的速率与醇的结构的关系: 醇的活性顺序是:烯丙型醇、苄基型醇>叔醇>仲醇>伯醇。 例如:
33
利用不同醇与盐酸反应速率的不同,可以区分伯、仲、叔醇。无
水氯化锌与浓盐酸配制的溶液,叫做Lucas试剂。因为水溶性较好的
醇与Lucas试剂反应后,生成与水不互溶的氯代烃,形成乳状的混浊 溶液或分层,所以可利用Lucas试剂鉴别低碳(C6以下)一元伯、仲、叔 醇(C6以上的一元醇水溶性较差,难于用Lucas试剂鉴别)。例如:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2010-11-11
第一节
第二节
第三节
第四节
第五节
第六节
第七节
-2-
四川理工学院
第十章 醇和醚
授课教师:冯建申
第十章 醇和醚
目录: (二)醚 §10.7 醚的构造、分类和命名 §10.8 醚的制法 §10.9 醚的性质 §10.10 乙醚 §10.11 环醚 §10.12 冠醚 §10.13 硫醚
C
1 08 .9 ° H
H
第三节 第四节
O原子为sp3杂化由 于 在 sp3 杂 化 轨 道 上 有未共用电子对,两 对之间产生斥力,使 得 ∠ C-O-H 小 于 109.5°。
第五节 第六节 第七节 -4-
第一节
第二节
四川理工学院
第十章 醇和醚
授课教师:冯建申
二、醇的分类 1、根据羟基所连碳原子种类分 ① 一级醇(伯醇) ② 二级醇(仲醇) ③ 三级醇(叔醇); 2、根据分子中烃基的类别分 ① 脂肪醇 ② 脂环醇 ③ 芳香醇 注:芳香醇指芳环侧链有羟基的化合物,羟基直接连 在芳环上的不是醇而是酚;
2010-11-11 第一节 第二节 第三节 第四节 第五节 第六节 第七节 - 15 -
四川理工学院
第十章 醇和醚
授课教师:冯建申
3、溶解度 ① 甲、乙、丙醇与水以任意比混溶(与水形成氢键的 原因); ② C4以上则随着碳链的增长溶解度减小(烃基增大, 其遮蔽作用增大,阻碍了醇羟基与水形成氢键); ③ 分子中 羟基越多 ,在水中的 溶解度越大 , 沸点越 高; 例如: 乙二醇 (b.p=197 ℃ ) 、 丙三醇 (b.p=290 ℃ ) 可与 水混溶。
C R OMgX H2O H C R OH + Mg X OH
RMgX与甲醛反应得伯醇,与其它醛反应得仲醇, 与酮反应得叔醇。
2010-11-11 第一节 第二节 第三节 第四节 第五节 第六节 第七节 - 12 -
四川理工学院
第十章 醇和醚
授课教师:冯建申
格氏试剂还可与环氧乙烷作用,制得比格氏试剂多 两个碳原子的伯醇。
四川理工学院
第十章 醇和醚
授课教师:冯建申
四、由卤代烃水解
水 + RCH2- X NaO H RCH 2OH + NaX
2010-11-11
第一节
第二节
第三节
第四节
第五节
第六节
第七节
- 14 -
四川理工学院
第十章 醇和醚
授课教师:冯建申
§10.3 醇的物理性质和光谱性质
一、醇的物理性质 1、性状 低级醇 是 易挥发的液体 , 较高级的醇 为 粘稠的液 体,高于11个碳原子的醇在室温下为蜡状固体。 2、沸点 ① 低分子量的醇 ,其沸点 比 分子量相近的 烷烃 高得 多(形成分子间氢键的原因); ② 饱和一元醇 随着碳原子数目的增加而上升 , 碳原 子数目相同的醇,支链越多,沸点越低。
2010-11-11
第一节
第二节
第三节
第四节
第五节
第六节
第七节
- 16 -
四川理工学院
第十章 醇和醚
授课教师:冯建申
④ 结晶醇的形成 低级醇 能和 一些无机盐 (MgCl2 、 CaCl2 、 CuSO4 等 ) 作用形成结晶醇,亦称醇化物。
MgCl2 6CH 3OH
CaC l2
4C 2H5O H
RMgX +
O
RCH2CH2OH
三、含羰基化合物的还原 醛或酮分子中的羰基可催化加氢还原成相应的醇 , 醛还原得伯醇、酮还原得仲醇。常用的催化剂为Ni、 Pt和Pd等。 若使用某些金属氢化物作为还原剂,例如氢化锂铝、 硼氢化钠等,它们只还原羰基,且不还原碳碳双键, 能制备不饱和醇。
2010-11-11 第一节 第二节 第三节 第四节 第五节 第六节 第七节 - 13 -
C H 3C H = C H 2 + H 2O H3PO4
195oC,2Mpa 195 C,2Mpa
CH3CHCH3 OH
② 间接水合法
CH3CH=CH2 + HOSO2OH CH3CHCH3 OSO2OH 硫酸氢异丙酯
2010-11-11 第一节 第二节 第三节 第四节 第五节 第六节 第七节 - 11 -
C H
O
H
O-H键断裂: 与活泼金属的 反应 及酯化反 反应及 应;
2010-11-11
第一节
第二节
第三节
第四节
第五节
第六节
第七节
- 19 -
四川理工学院
第十章 醇和醚
授课教师:冯建申
分子中的C—O键和O—H键都是极性键,因而醇分 子中有 两个反应中心 ;又由于 受 C — O 键 极性的 影 响 ,使得 α — H具有一定的活性 ,所以 醇的反应 可发 生在三个部位上。 一、弱酸弱碱性 1、 弱酸性 醇的酸性表现在能与钠、钾、镁、铝等活泼金属反 应,羟基上的氢被置换,生成氢气和醇金属。
此反应可用于检查醇的含量;例如,检查司机是否 酒后驾车的分析仪 就有根据此反应原理设计的。在 100mL血液中如含有超过80mg乙醇(最大允许量 )时, 呼出的气体所含的乙醇即可使仪器得出正反应。(若用 酸性KMnO4,只要有痕迹量的乙醇存在,溶液颜色即 从紫色变为无色,故仪器中不用KMnO4)。 为了把伯醇的氧化控制在生成醛的阶段,可使用一 些 特殊的氧化剂 ;如 氯化铬酸吡啶 (PCC) ,又称 沙瑞 特 (Sarrett) 试剂 ,通常表示为 CrO3 · (C5H5N)2 或 CrO3吡啶。
CH3CH2OH + H+ H2SO4 + CH3CH2OH (pKa= - 2 ~ - 3) H
② 与金属离子的络合
ROH + Al Cl 3
2010-11-11 第一节 第二节 第三节
RO H
第四节
AlCl3
第五节 第六节 第七节 - 22 -
四川理工学院
第十章 醇和醚
授课教师:冯建申
二、氧化和脱氢 1、氧化 醇分子中由于羟基的影响,使得α-氢较活泼,容易 发生氧化反应;伯醇和仲醇由于有α-氢存在容易被氧 化,而叔醇没有α-氢难氧化;常用的氧化剂为重铬酸 钾和硫酸或高锰酸钾等。不同类型的醇得到不同的氧 化产物。 ① 伯醇被氧化为羧酸
CH- CH3 OH
1-苯基乙醇 (α-苯乙醇)
CH2-CH2O H
2-苯基乙醇 (β-苯乙醇)
CH3 OH OH
顺-1-甲基-1,2-环己二醇
2010-11-11
第一节
第二节
第三节
第四节
第五节
第六节
第七节
- 10 -
四川理工学院
第十章 醇和醚
授课教师:冯建申
§10.2 醇的制法
一、由烯烃制备 1、烯烃的水合 ① 直接水合法
2010-11-11 第一节 第二节 第三节 第四节 第五节 第六节 第七节 -3-
四川理工学院
第十章 醇和醚
授课教师:冯建申
§10.1 醇的结构、分类、异构和命名
一、醇的结构 醇可以看成是烃分子中的氢原子被羟基(OH)取代后 生成的衍生物(R-OH)。
H R sp3
2010-11-11
sp3 O
CH3 还原剂 有机合成中常用的试剂
醇的酸性:CH3OH >伯醇(乙醇)>仲醇>叔醇 Na与醇的反应比与水的反应缓慢的多,反应所生成 的热量不足以使氢气自然,故常利用醇与Na的反应销 毁残余的金属钠,而不发生燃烧和爆炸。 醇的酸性比水小,因此反应所得到的醇钠可 水解得 到原来的醇;
CH 3CH 2ONa + H2O
3、系统命名法 对于 结构复杂的醇 则采用 系统命名法 ,其原则如 下:
2010-11-11 第一节 第二节 第三节 第四节 第五节 第六节 第七节 -7-
四川理工学院
第十章 醇和醚
授课教师:冯建申
① 选择连有羟基的碳原子在内的最长的碳链为主链, 按主链的碳原子数称为“某醇”; ② 从靠近羟基的一端将主链的碳原子依次用阿拉伯数 字编号,使羟基所连的碳原子的位次尽可能小; ③ 命名时把取代基的位次、名称及羟基的位次写在母 体名称“某醇”的前面; ④ 不饱和醇命名时应选择包括连有羟基和含不饱和键 在内的 最长的碳链 做主链,从 靠近羟基 的一端开 始编号; ⑤ 命名芳香醇时,可将芳基作为取代基加以命名;
RCH2O H K 2Cr2O 7 + H2SO 4 R C HO O RCOO H
CH3CH2OH + Cr2O72橙红
2010-11-11 第一节 第二节 第三节
CH3CHO + Cr3+ 绿色
K2Cr2O7
第四节 第五节
CH3COOH
第六节 第七节 - 23 -
四川理工学院
第十章 醇和醚
授课教师:冯建申
H2O
CH3CHCH3 OH
四川理工学院
第十章 醇和醚
授课教师:冯建申
2、硼氢化-氧化反应 B2H6
R CH CH2
(RCH2CH2)3B
H2O2
OH
(RCH2CH2O)3B
H2O
RCH2CH2OH
伯醇
二、醛、酮、环氧乙烷与格氏试剂反应 用格氏试剂与醛酮作用,可制得伯、仲、叔醇。
无水乙醚 C O + R-MgX 或 THF
《有 机 化 学》
(徐寿昌主编 第二版)
授课教师: 冯 建 申 Email:fjsh8177@ Phone:13778570818
四 川 理工 学 院
四川理工学院
第十章 醇和醚
授课教师:冯建申
第十章 醇和醚
目录: (一)醇 §10.1 醇的结构、分类、异构和命名 §10.2 醇的制法 §10.3 醇的物理性质 §10.4 醇的化学性质 §10.5 重要的醇 §10.6 硫醇
