第十章 醇和醚
合集下载
第10章 醇和醚
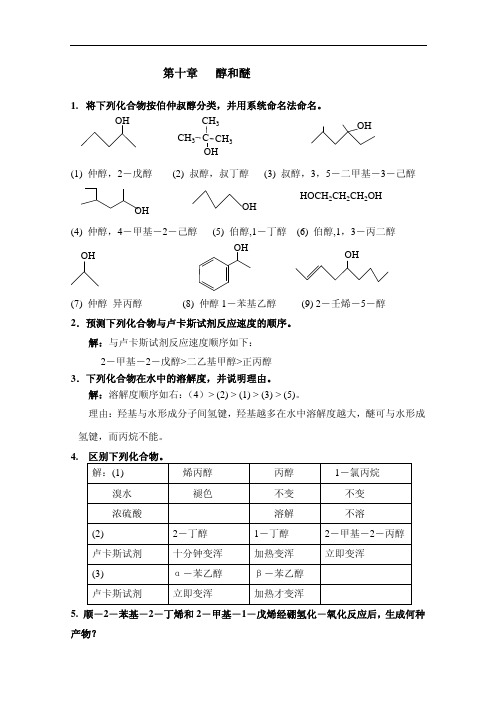
CH3COCH3
H2O,H+
CH3 CH3 CH3 CH3 CH3CHCH2CCH3 H2SO4 CH3CHCH=CCH3 OH
(5)丙烯合成甘油和三硝酸甘油酯
CH3CH=CH2
Cl2 HOCl ClCH2CH=CH2 0 500 C
CH2CHCH2 Cl OH Cl
Ca(OH)2
Cl
CH2CHCH2 O
(CH3)3CCHCH3 OH
H+
(CH3)3CCHCH3
+
H+ (CH ) CCH=CH 3 3 2
CH3
CH3 CHCH3 C
+
CH3 CH3 CHCH3 CH3 C +
+
H+
CH3 (CH3)2CHC=CH2 CH3 (2) 反应历程: CH2OH H
+
(CH3)2C=(CH3)2
CH2OH2+ H2O
+
3
3
3 H H C C C = H C 2 H C 3 H C
HOCH2CH=CHCH3 HBr
BrCH2CH=CHCH3
+
CH2=CHCHCH3 OH
HOCH2CH=CHCH3 H2O
+
H+
H2O CH2CH=CHCH3 CH2=CHCHCH3 BrCH2=CHCHCH3 OH
+
+
CH2CH=CHCH3 Br-
BrCH2CH=CHCH3
9. 应历程解释下列反应事实。 解: (1) 反应历程:
CH3 CH3 C CH2OH CH3 CH3 H
+
CH3 CH3 C CH3
第十章醇和醚

Br -
CH3 CH3 C CH2CH3
Br
三卤化磷或亚硫酰氯(SOCl2)也可与醇反应 制卤代烃,且不发生重排,因此是实验室制卤代
烃的一种重要方法。
CH3CH2CH2OH
P+I2(PI3) 85~90℃
CH3CH2CH2I
CH3CH2CH2CH2OH + SOCl2
CH3CH2CH2CH2Cl + SO2 + HCl
③写出全称 “某醇”。
3CH3 H2C3CH3 3CH3
CH3
CH3CHCH2CH2CCH3
OH
CH3
5,C5H-二3C甲HC基H-22C-H己2醇CHCH2CH3
OH
OH
CHC3CHH3CCHHC2HC2HC2HC2HCHCCHH2C2CHH33
OHOH
OHOH
2,5-庚二醇
CCHH2O2OHH
3. 酯的形成
CH3 OH +H OSO3H
CH3OSO3H +H2O
硫酸氢甲酯
CH2 OH
H2SO4(浓) CH2 ONO2
CH OH + 3HONO2 10~20℃ CH ONO2 + 3H2O
CH2 OH
CH2 ONO2
三硝酸甘油酯(硝化甘油)
硝化甘油是一种烈性炸药;在医疗上可扩张血管,做心 血管的急救药。
不同的醇与同一种氢卤酸反应的活性: 烯丙醇、苄醇>叔醇>仲醇>伯醇>甲醇
卢卡斯(Lucas)试剂:无水氯化锌的浓盐酸溶液
CH3 CH3 C OH
CH3
+ HCl
ZnCl2 20℃
CH3
CH3 C Cl + H2O
有机化学第十章 醇和醚(简单)PPT课件

总目录
本章目录
21
4. 从格氏试剂制备(Grignard)
O R′MgX + R–C–H 干醚
OMgX H-C-R′
OH R-CH-R′
R
此法可制备仲醇或叔醇,尤其是叔醇。
例如:
CH2CH3 CH3CH2CH2-C-CH3
OH
有三种切断
那种原料价廉易得,就采用哪种切断法。
10.08.2020
总目录
+ CH3CH2OH2
H2O
+ CH3CH2
H+ CH2 = CH2
CH3
CH3 H CC
CH3
H+
CH3 OH
CH3
CH3
C
+ CH CH3
重排
CH3 H+
CH3 CH3
CH3
C +
CH CH3
H+
10.08.2020
CH3 CH3 C CH = CH2
CH3 (30%) 总目录
CH3 CH3 CH3 C = C CH3
CH3 (CH3–C–O)3Al
H
+
3 2
H2
异丙醇铝
10.08.2020
总目录
本章目录
29
醇的反应活性: CH2OH >伯醇> 仲醇 > 叔醇
RONa + H2O
强碱 强酸
NaOH + ROH
较弱碱 较弱的酸
注意:因反应可逆,可利用此反应制备醇钠
10.08.2020
总目录
本章目录
30
2. 生成卤代烃(取代) (1)与氢卤酸的反应
20
第十章醇和醚-精品文档227页

33
醇除了可与碱金属作用外,还可与其它活泼金属, 如镁、铝等作用生成醇镁和醇铝。生成醇镁的反应需用 少量碘催化。醇镁与醇钠一样,也很容易水解。
25.09.2019
26
(2)氢键对水溶性的影响
醚和醇都可以分别与水形成氢键,故分子量相 当的醚与醇的水溶性相似,而醚与相当分子量的烃却 大不相同。
例如:1-丁醇与二乙醚在水中的溶解度相同,在 室温下接近8.0g/100ml,而戊烷实际上是不溶于水的。 甲醇、乙醇、丙醇和叔丁醇都可以完全与水混溶,而丁 醇在水中的溶解度为7.9-12.5g/100ml,醇的水溶性 随着烃基部分的碳链增长而减少。根据“相似相溶”原 理,长链醇的极性更多与烷烃相似,而更少与水相似, 它与水羟基的缔合力减弱。
pKa
36 25 15.9 15.7 10.6 10 6.35
醇与水相似,也能与活泼金属(如 Na、K、Mg、Al)作 用,生成相应的醇化物(醇盐)并放出氢气。
例如:
H 3 C C H 2O H+N a
H 3 C C H 2 ON +H 2 a
醇的酸性:伯醇>仲醇>叔醇
25.09.2019
31
在溶液中醇的共轭碱,烷氧基 负离子是溶剂化的,溶剂化使 烷氧基负离子的稳定性增加。
25.09.2019
练习3
28
四、醇的化学性质
醇性质的总分析
25.09.2019
29
醇的化学性质
1. 酸碱性 2. 2. 卤代烷的生
成 3. 3. 脱水反应 4. 酯的生成 5. 氧化 6. 多元醇
25.09.2019
30
1. 酸碱性
a. 酸性
H 3 C C H 2 O HkaH 3 C C H 2 O -+ H + 乙烯 乙炔 乙醇 水 乙硫醇 苯酚 碳酸 硫酚
徐寿昌《有机化学》 课件 第十章 醇、醚

R CH CH R' OH OH
+
Pb(OAc)4
RCHO
+
R'CHO
+ Pb(OAc)2 +
HOAc
这个反应常定量完成,因此可用于乙二醇的定量测定,并可根 据氧化产物推断原醇的结构。 7、邻二醇的重排反应—频哪醇重排
CH3 CH 3 H3C C C CH3
H2SO4 (HCI)
△
CH3 H3C C O C CH3 CH3
M= b.p=
74 117.2
OH OH
频哪醇
频哪酮
CH3 CH3 H3C C C CH3
H2SO4
CH3 CH3 H3C C C CH3
+
OH OH CH3 CH 3 H3C C OH C
OH OH2
CH3 H3C C C CH3
-H
+
CH3 H3C C O C CH3 CH3
+CH3O Nhomakorabea CH3
第二节 醚(ethers)
325℃
5、与酸反应——酯化
醇可与有机酸、无机酸作用生成酯。
O H3C C OH + H
O
O CH2
H+ CH3
△
CH3 C O CH2 CH3
发生酯化反应时,羧酸的C – O键断裂,醇的O – H键断 裂。 CH3 – OH + H2SO4 (CH3)2SO4(硫酸二甲酯)
硫酸二甲酯剧毒,对皮肤的阀限值1ppm,空气中最 高限量5mg/m3。
CH3CH2Cl + H2O
通常用无水氯化锌与浓盐酸按1:1的比例配成溶液与醇反 应, 代替不易操作的氯化氢气体,这样的溶液称为卢卡斯 (Lucas)试剂。结构不同的醇与卢卡斯试剂反应的活性顺序 为:
有机化学第10章 醇、酚、醚

1.醇的分类
①醇可依分子中所含羟基数目分为一元醇、二元醇及三元醇等,二
元及二元以上的醇称为多元醇。例如:
CH3CH2OH CH2CH2 OH OH
乙醇(一元醇) 乙二醇(二元醇)
CH2CH CH2 OH OH OH
丙三醇(三元醇)
3
②醇也可依分子中烃基的不同而分为脂肪醇(包括饱和醇及不饱和 醇)、脂环醇和芳香醇。 例如:
C(CH3)2或 C(CH3)3
23
在醇的核磁共振谱图中,羟基质子(O—H)由于受
分子间氢键的影响,其化学位移(δ)出现在1~5.5范围 内,在核磁共振谱中产生一个单峰。由于氧的电负性 较大,羟基所连碳原子上的质子的化学位移一般在 3.4~4.0。
24
10.1.4 醇的化学性质
羟基是醇的官能团,作为反应中心羟基决定了醇的化学性质。
2,3-二甲基-3-戊醇
12
不饱和醇的命名,除应选择同时连有羟基和不饱和键的最长碳 链作为主链外,其它原则与饱和醇相同。
CH3CH2CH2CHCH2CH2CH2OH CH CH2
5 6
4
3
2
1
4-丙基-5-己烯-1-醇
CH CHCH3 CH3CH2CHCHCH2CHCH3 CH3 OH
4-甲基-5-乙基-6-辛烯-2-醇
32
醇和氢卤酸反应的速率与醇的结构的关系: 醇的活性顺序是:烯丙型醇、苄基型醇>叔醇>仲醇>伯醇。 例如:
33
利用不同醇与盐酸反应速率的不同,可以区分伯、仲、叔醇。无
水氯化锌与浓盐酸配制的溶液,叫做Lucas试剂。因为水溶性较好的
醇与Lucas试剂反应后,生成与水不互溶的氯代烃,形成乳状的混浊 溶液或分层,所以可利用Lucas试剂鉴别低碳(C6以下)一元伯、仲、叔 醇(C6以上的一元醇水溶性较差,难于用Lucas试剂鉴别)。例如:
①醇可依分子中所含羟基数目分为一元醇、二元醇及三元醇等,二
元及二元以上的醇称为多元醇。例如:
CH3CH2OH CH2CH2 OH OH
乙醇(一元醇) 乙二醇(二元醇)
CH2CH CH2 OH OH OH
丙三醇(三元醇)
3
②醇也可依分子中烃基的不同而分为脂肪醇(包括饱和醇及不饱和 醇)、脂环醇和芳香醇。 例如:
C(CH3)2或 C(CH3)3
23
在醇的核磁共振谱图中,羟基质子(O—H)由于受
分子间氢键的影响,其化学位移(δ)出现在1~5.5范围 内,在核磁共振谱中产生一个单峰。由于氧的电负性 较大,羟基所连碳原子上的质子的化学位移一般在 3.4~4.0。
24
10.1.4 醇的化学性质
羟基是醇的官能团,作为反应中心羟基决定了醇的化学性质。
2,3-二甲基-3-戊醇
12
不饱和醇的命名,除应选择同时连有羟基和不饱和键的最长碳 链作为主链外,其它原则与饱和醇相同。
CH3CH2CH2CHCH2CH2CH2OH CH CH2
5 6
4
3
2
1
4-丙基-5-己烯-1-醇
CH CHCH3 CH3CH2CHCHCH2CHCH3 CH3 OH
4-甲基-5-乙基-6-辛烯-2-醇
32
醇和氢卤酸反应的速率与醇的结构的关系: 醇的活性顺序是:烯丙型醇、苄基型醇>叔醇>仲醇>伯醇。 例如:
33
利用不同醇与盐酸反应速率的不同,可以区分伯、仲、叔醇。无
水氯化锌与浓盐酸配制的溶液,叫做Lucas试剂。因为水溶性较好的
醇与Lucas试剂反应后,生成与水不互溶的氯代烃,形成乳状的混浊 溶液或分层,所以可利用Lucas试剂鉴别低碳(C6以下)一元伯、仲、叔 醇(C6以上的一元醇水溶性较差,难于用Lucas试剂鉴别)。例如:
第十章 醇、酚、醚

用CrO3/稀硫酸溶液氧化醇怕反应在有机分析中还可用来将伯醇、仲醇和烯烃、炔烃区别开来,因为后两者不被氧化。这个氧化反应进行时现象很明显,溶液的颜色从清彻的橙色变成浑浊的兰绿色。
伯醇氧化生成醛
仲醇氧化生成酮
叔醇只有在强烈氧化条件下才被氧化-----发生键的断裂
选择性氧化-异丙醇铝-----选择性氧化羟基而保留双键
+|
Cl
伯醇主要按SN2反应机制进行,
快+
RCH2—OH +HX————→RCH2—OH2+ X一
+
RCH2—OH2+ X一———→X…CH2…OH2———→RCH2X + H2O
|
R
不同的醇在与相同的氢卤酸反应时的活性为:烯丙型醇、叔醇>仲醇>伯醇。
无水氯化锌与氯化氢的混合试剂称为卢卡斯(Lucas)试剂。其中无水氯化锌是强的路易斯酸。
3.与无机酸的反应
A.与HX反应得到卤代烃和水ROH+HX——→RX+H2O
大多数的仲醇和叔醇与氢卤酸的反应是按SN1反应机制进行的。仲醇反应时,由于仲碳正离子不如叔碳正离子稳定,某些特殊结构的醇可能容易发生重排。
活性:HX:HI>HBr>HCl;
醇:烯丙醇>3°>2°>1°
烯丙醇、三级醇、二级醇在酸催化下可通过SN1历程进行:
三、光谱性质
IR:醇的C—O吸收峰出现在1000—1200cm-1,其中伯醇约在1060—1030cm-1区域;仲醇约在1100cm-1附近;叔醇约在1140cm-1附近;酚的C—O吸收峰出现在1230cm-1。醇的—OH有两个吸收峰,未缔合的自由—OH在3600—3610cm-1有一外形较锐的吸收带;缔合—OH在3600—3210cm-1有一外形较宽的吸收带
伯醇氧化生成醛
仲醇氧化生成酮
叔醇只有在强烈氧化条件下才被氧化-----发生键的断裂
选择性氧化-异丙醇铝-----选择性氧化羟基而保留双键
+|
Cl
伯醇主要按SN2反应机制进行,
快+
RCH2—OH +HX————→RCH2—OH2+ X一
+
RCH2—OH2+ X一———→X…CH2…OH2———→RCH2X + H2O
|
R
不同的醇在与相同的氢卤酸反应时的活性为:烯丙型醇、叔醇>仲醇>伯醇。
无水氯化锌与氯化氢的混合试剂称为卢卡斯(Lucas)试剂。其中无水氯化锌是强的路易斯酸。
3.与无机酸的反应
A.与HX反应得到卤代烃和水ROH+HX——→RX+H2O
大多数的仲醇和叔醇与氢卤酸的反应是按SN1反应机制进行的。仲醇反应时,由于仲碳正离子不如叔碳正离子稳定,某些特殊结构的醇可能容易发生重排。
活性:HX:HI>HBr>HCl;
醇:烯丙醇>3°>2°>1°
烯丙醇、三级醇、二级醇在酸催化下可通过SN1历程进行:
三、光谱性质
IR:醇的C—O吸收峰出现在1000—1200cm-1,其中伯醇约在1060—1030cm-1区域;仲醇约在1100cm-1附近;叔醇约在1140cm-1附近;酚的C—O吸收峰出现在1230cm-1。醇的—OH有两个吸收峰,未缔合的自由—OH在3600—3610cm-1有一外形较锐的吸收带;缔合—OH在3600—3210cm-1有一外形较宽的吸收带
大学有机化学第十章醇酚醚

② 与金属离子的络合
MgCl2•6ROH CaCl2•4ROH
结晶醇 (溶于水\不溶于有机溶剂)
因此:
不能用无水CaCl2干燥ROH
2. 醇与活泼金属的反应 ——弱酸性
+ CH3CH2OH Na
+ CH3CH2ONa H2
+ (CH3)3COH K
+ (CH3)3COK H2
醇金属: 强碱性试剂和强亲核性试剂
OH
R'
OH
R
30 叔醇( R' C OH ): (CH3)3COH R''
② 按羟基所连的烃基分:
饱和醇:
OH
CH3CH2OH (CH3)3COH
不饱和醇:
OH
CH2=CHCH2OH CH3C≡ CCH2OH
芳香醇:
CH OH 2
CH OH 2
③ 按羟基的数目分类:
一元醇: CH3CH2CH2OH
② RX的制备:10 醇,可采用 HX作卤化剂;
不是10 醇,不采用 HX作卤化剂,否则易得到重排产物。 可采用SOCl2 , PX3 , PX5作卤化剂
i) 与SOCl2反应
ROH SOCl2 RC+l SO2 + HCl
优点:1) 不重排,且产物构型保持
2) 副产物均为气体,易于除去 3) 产率高,产物容易分离
i. 伯醇氧化成醛和羧酸
[O]
[O]
RCH2OH
RCHO
RCOOH
[O]:KMnO4/H+、HNO3、 CrO3/ H2SO4、 K2Cr2O7/H2SO4、Na2Cr2O7/H2SO4 等
e.g.
CrO3 / H2SO4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十章醇和醚
1. 按下列醇在硫酸存在下脱水活性从大到小排序。
解答:D>A>B>E>C。
醇在硫酸作用下脱水反应,属于E1 历程,反应速度快慢由中间体碳正离子稳定性决定。
碳正离子愈稳定,决定反应速度的第一步就容易进行。
桥头碳正离子不能满足sp2平面结构,存在较大的扭转张力,最不稳定。
2. 如何除去1-溴丁烷中少量的正丁醇?
解答:在此混合物中加入冷浓H2SO4
3. 合成:
解答:利用Grignard试剂来进行增碳。
4. 合成:
解答:在进行Grignard反应时,注意保护羟基
5. 用醇为原料合成异丙基叔丁基醚。
解答:产物是混醚,用威廉姆森制醚法。
注意:不能用叔卤代烃与醇钠反应。
不能用两种醇分子之间酸性脱水制备混醚,因为得到的是混合物,难分离,无合成意义。
6. 写出下列反应的机理:
解答:
这是个SN1反应,活性中间体是烯丙基型碳正碳离子,并且可写出其共振式
Ⅱ,所以亲核试剂进攻不同的碳正离子,得到两种产物。
