新人教版高一化学氨硝酸硫酸知识点
人教版高中必修一第四节硫酸、硝酸和氨新课标人教版

HC2lO2 浓硫酸
2)脱水性 化学变化
不是夺取真正的水分子而是把其他物质中的 氢原子和氧原子按水分子的数量比脱去, 所以叫脱水性。
实验 蔗糖变黑,放出大量的热,体 现象: 积膨胀,并有刺激性气体产生
(炭化)
C12H22O11(蔗糖) 浓H2SO4 12C + 11H2O
“黑面包”实验--蔗糖与浓硫酸的反应
质量分数为98%以上的硝酸为“发烟硝酸”。
人教版高中必修一第四节硫酸、硝酸 和氨新 课标人 教版
人教版高中必修一第四节硫酸、硝酸 和氨新 课标人 教版
2。化学性质
(1)酸的通性:
1. 使紫色的石蕊试液变红;
2.与金属反应,但不产生氢气;
3. 与某些金属氧化物起反应;
2HNO3+CuO=Cu(NO3)2+H2O 4. 与碱起反应
思考与交流: P84 (1) 、(2) 、(3)
稀硫酸
H SO = SO +2H H+SO42-H+
SO42H- + SO42-
24
2-
+
4
石蕊试液 金属Fe 金属氧化物 碱 盐 (BaCl2) CuO Cu(OH)2
一、浓硫酸与硝酸的氧化性
<一>、浓硫酸 1.物理性质 纯硫酸是一种无 色油状液体。 常用浓硫酸的质量分数为 98.3%, 硫酸是一种高沸点难 挥发的 强 酸,易 溶于水,能以任意比与 水混溶。
实验现象:
①蔗糖由白→黑,体积膨胀
②生成的黑色物质呈海绵状, 像一大块黑色的面包
③闻一闻有刺激性气味
现象解释:
浓硫酸使蔗糖脱水碳化, 又吸水放热,使生成的碳继续 被浓硫酸氧化产生大量的气体。
人教版化学必修一4.4氨 硝酸 硫酸ppt

本节课解决上节课提出的几个问题:
1、吸水性和脱水性有何区别?
2、现有失去标签的浓硫酸、稀硫 酸各一瓶,如何鉴别?
3、如何通过实验证明碳与浓硫 酸反应的产物有SO2和CO2?
思考题
1、吸水性和脱水性有何区别?
1、吸水性:
吸收气体中的水分,或晶体中含 有的结晶水。 如:用浓硫酸除去Cl2中混有的水蒸气
石蕊试液变红
结论
SO2 SO2
把反应后的溶液倒入水中变成蓝色 CuSO4
反应的方程式为:
Cu+2H2SO4(浓)△=CuSO4+SO2↑+2H2O
为什么说浓硫酸是强氧化剂?
因为稀硫酸不能氧化不活泼金 属,如Cu,而浓硫酸可以。
分析下列反应化合价的变化,指出氧化剂:
化合价升高,被氧化
Cu+2H2+S6 O4(浓)△=CuSO4++S4O2↑+2H2O
浓硫酸作干燥剂时体现了吸水性 另外,浓硫酸可以吸收CuSO4 ·5H2O 中的水
蓝色硫酸铜晶体遇浓硫酸变白体现了浓硫酸的吸水性
2、脱水性:
原物质中本来没有水,但有组成水的
元素H和O,浓硫酸将有机物中氢、氧元
素的原子按 2:1 结合成水而脱去。
C12H22O11
蔗糖
浓硫酸
11 H2O +12 C
所以,蔗糖遇浓硫酸变黑
注意:钝化不是不反反应,
解释:
铝既然能与硫酸反应,工业上 为什么还用铝槽车盛放、运输浓硫 酸呢?
因为常温下浓硫酸能使铝钝化
与某些非金属反应
C + 2H2SO4(浓)=== CO2↑ +2SO2↑+2H2O
这就是蔗糖遇浓硫酸为什么变 得疏松多孔的原因。
人教版高中必修一硫酸、硝酸和氨_课件课

2、蓄电池 ——强电解质
3、除铁锈、制化肥
5、制挥发性的酸 ——难挥发性
——酸性
△ NaCl+H2SO4==NaHSO4+HCl↑
健康减肥和别的就会打开
• Spoiler哦的功夫高 ijoiiogjoifgjosjfjgvoi的覅价格 iofjgoifjoidff 哦 ifiogohfjkshffhbjdchlkvjil记得发几 个工 ifjobjklgjljknkljbkljgvbnmkvnbjig 健康几个科技股开关机开工科技并根据 放技能开了个看咯就logjamlo.gh累计 进口
• 与金属反应的规律: A. 加热条件下,浓H2SO4可氧化绝大多数金属
(Pt、Au等除外),但不产生H2。 B. 浓H2SO4与金属反应表现出酸性和氧化性。 C. 常温下,浓H2SO4可使Fe、Al钝化。
铝槽车运输浓硫酸
• 与还原性化合物反应: H2S + H2SO4(浓) = S↓+ SO2↑+2H2O HBr + H2SO4(浓) = Br2+ SO2↑+ 2H2O
△
4HNO3 或==光=照= 4NO2↑+O2↑ +2H2O
保存在棕色细口瓶中
3、强氧化性
(1)与金属的反应 Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
• 金属与HNO3反应的规律 ① 不论稀HNO3还是浓HNO3都有强氧化
—— 吸水性、稀释放热、难挥发性
Kjdkuvhsmcdhkjjxdhk.fn kljdxfjkjiglig
高一化学第四节氨、硝酸、硫酸
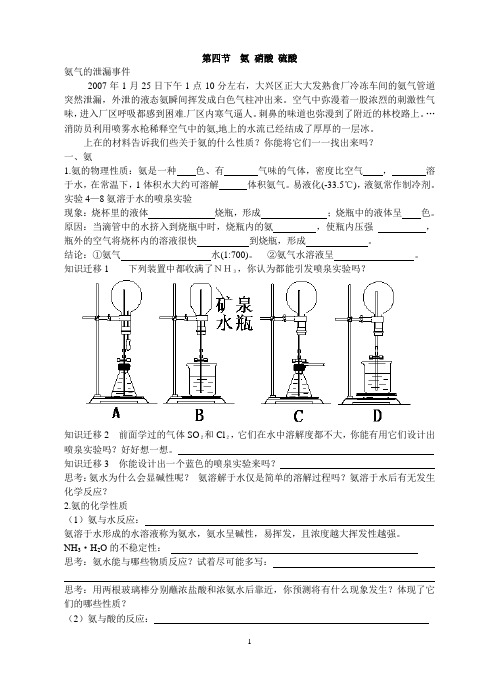
第四节氨硝酸硫酸氨气的泄漏事件2007年1月25日下午1点10分左右,大兴区正大大发熟食厂冷冻车间的氨气管道突然泄漏,外泄的液态氨瞬间挥发成白色气柱冲出来。
空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难.厂区内寒气逼人。
刺鼻的味道也弥漫到了附近的林校路上。
…消防员利用喷雾水枪稀释空气中的氨,地上的水流已经结成了厚厚的一层冰。
上在的材料告诉我们些关于氨的什么性质?你能将它们一一找出来吗?一、氨1.氨的物理性质:氨是一种色、有气味的气体,密度比空气,溶于水,在常温下,1体积水大约可溶解体积氨气。
易液化(-33.5℃),液氨常作制冷剂。
实验4—8氨溶于水的喷泉实验现象:烧杯里的液体烧瓶,形成;烧瓶中的液体呈色。
原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨,使瓶内压强,瓶外的空气将烧杯内的溶液很快到烧瓶,形成。
结论:①氨气水(1:700)。
②氨气水溶液呈。
知识迁移1 下列装置中都收满了NH3,你认为都能引发喷泉实验吗?知识迁移2 前面学过的气体SO2和Cl2,它们在水中溶解度都不大,你能有用它们设计出喷泉实验吗?好好想一想。
知识迁移3 你能设计出一个蓝色的喷泉实验来吗?思考:氨水为什么会显碱性呢?氨溶解于水仅是简单的溶解过程吗?氨溶于水后有无发生化学反应?2.氨的化学性质(1)氨与水反应:氨溶于水形成的水溶液称为氨水,氨水呈碱性,易挥发,且浓度越大挥发性越强。
NH3·H2O的不稳定性:思考:氨水能与哪些物质反应?试着尽可能多写:思考:用两根玻璃棒分别蘸浓盐酸和浓氨水后靠近,你预测将有什么现象发生?体现了它们的哪些性质?(2)氨与酸的反应:氨与酸反应生成铵盐。
铵盐又叫铵态氮肥。
思考:有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?铵盐可以做氮肥体现了铵盐的什么物理性质?铵盐的性质①铵盐都易溶于水②铵盐受热易分解NH4HCO3受热:NH4Cl受热:③铵盐与碱反应(NH4)2SO4 + NaOH:实质:(离子方程式)NH4HCO3 + NaOH:实质:(离子方程式)一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。
人教版化学必修一4.4氨 硫酸、硝酸

乙方案: Cu+稀硝酸→ 蒸发结晶
空气加热
丙方案:Cu
CuO
硝酸
蒸发结晶
你认为__丙___方案最好,理由_消__耗__硝__酸__少__,__不__污__染__环__境__
1、只要有坚强的意志力,就自然而然地会有能耐、机灵和知识。2、你们应该培养对自己,对自己的力量的信心,百这种信心是靠克服障碍,培养意志和锻炼意志而获得的。 3、坚强的信念能赢得强者的心,并使他们变得更坚强。4、天行健,君子以自强不息。5、有百折不挠的信念的所支持的人的意志,比那些似乎是无敌的物质力量有更强大 的威力。6、永远没有人力可以击退一个坚决强毅的希望。7、意大利有一句谚语:对一个歌手的要求,首先是嗓子、嗓子和嗓子……我现在按照这一公式拙劣地摹仿为:对 一个要成为不负于高尔基所声称的那种“人”的要求,首先是意志、意志和意志。8、执着追求并从中得到最大快乐的人,才是成功者。9、三军可夺帅也,匹夫不可夺志也。 10、发现者,尤其是一个初出茅庐的年轻发现者,需要勇气才能无视他人的冷漠和怀疑,才能坚持自己发现的意志,并把研究继续下去。11、我的本质不是我的意志的结果, 相反,我的意志是我的本质的结果,因为我先有存在,后有意志,存在可以没有意志,但是没有存在就没有意志。12、公共的利益,人类的福利,可以使可憎的工作变为可 贵,只有开明人士才能知道克服困难所需要的热忱。13、立志用功如种树然,方其根芽,犹未有干;及其有干,尚未有枝;枝而后叶,叶而后花。14、意志的出现不是对愿 望的否定,而是把愿望合并和提升到一个更高的意识水平上。15、无论是美女的歌声,还是鬓狗的狂吠,无论是鳄鱼的眼泪,还是恶狼的嚎叫,都不会使我动摇。16、即使 遇到了不幸的灾难,已经开始了的事情决不放弃。17、最可怕的敌人,就是没有坚强的信念。18、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下 去。19、意志若是屈从,不论程度如何,它都帮助了暴力。20、有了坚定的意志,就等于给双脚添了一对翅膀。21、意志坚强,就会战胜恶运。22、只有刚强的人,才有神 圣的意志,凡是战斗的人,才能取得胜利。23、卓越的人的一大优点是:在不利和艰难的遭遇里百折不挠。24、疼痛的强度,同自然赋于人类的意志和刚度成正比。25、能 够岿然不动,坚持正见,度过难关的人是不多的。26、钢是在烈火和急剧冷却里锻炼出来的,所以才能坚硬和什么也不怕。我们的一代也是这样的在斗争中和可怕的考验中 锻炼出来的,学习了不在生活面前屈服。27、只要持续地努力,不懈地奋斗,就没有征服不了的东西。28、立志不坚,终不济事。29、功崇惟志,业广惟勤。30、一个崇高 的目标,只要不渝地追求,就会居为壮举;在它纯洁的目光里,一切美德必将胜利。31、书不记,熟读可记;义不精,细思可精;惟有志不立,直是无着力处。32、您得相 信,有志者事竟成。古人告诫说:“天国是努力进入的”。只有当勉为其难地一步步向它走去的时候,才必须勉为其难地一步步走下去,才必须勉为其难地去达到它。33、 告诉你使我达到目标的奥秘吧,我唯一的力量就是我的坚持精神。34、成大事不在于力量的大小,而在于能坚持多久。35、一个人所能做的就是做出好榜样,要有勇气在风 言风语的社会中坚定地高举伦理的信念。36、即使在把眼睛盯着大地的时候,那超群的目光仍然保持着凝视太阳的能力。37、你既然期望辉煌伟大的一生,那么就应该从今 天起,以毫不动摇的决心和坚定不移的信念,凭自己的智慧和毅力,去创造你和人类的快乐。38、一个有决心的人,将会找到他的道路。39、在希望与失望的决斗中,如果 你用勇气与坚决的双手紧握着,胜利必属于希望。40、富贵不能淫,贫贱不能移,威武不能屈。41、生活的道路一旦选定,就要勇敢地走到底,决不回头。42、生命里最重 要的事情是要有个远大的目标,并借助才能与坚持来完成它。43、事业常成于坚忍,毁于急躁。我在沙漠中曾亲眼看见,匆忙的旅人落在从容的后边;疾驰的骏马落在后头, 缓步的骆驼继续向前。44、有志者事竟成。45、穷且益坚,不坠青云之志。46、意志目标不在自然中存在,而在生命中蕴藏。47、坚持意志伟大的事业需要始终不渝的精神。 48、思想的形成,首先是意志的形成。49、谁有历经千辛万苦的意志,谁就能达到任何目的。50、不作什么决定的意志不是现实的意志;无性格的人从来不做出决定。我终 生的等待,换不来你刹那的凝眸。最美的不是下雨天,是曾与你躲过雨的屋檐。征服畏惧、建立自信的最快最确实的方法,就是去做你害怕的事,直到你获得成功的经验。 真正的爱,应该超越生命的长度、心灵的宽度、灵魂的深度。生活真象这杯浓酒,不经三番五次的提炼呵,就不会这样可口!人格的完善是本,财富的确立是末能力可以慢 慢锻炼,经验可以慢慢积累,热情不可以没有。不管什么东西,总是觉得,别人的比自己的好!只有经历过地狱般的折磨,才有征服天堂的力量。只有流过血的手指才能弹 出世间的绝唱。对时间的价值没有没有深切认识的人,决不会坚韧勤勉。第一个青春是上帝给的;第二个的青春是靠自己努力的。不要因为寂寞而恋爱,孤独是为了幸福而 等待。每天清晨,当我睁开眼睛,我告诉自己:我今天快乐或是不快乐,并非由我所遭遇的事情造成的,而应该取决于我自己。我可以自己选择事情的发展方向。昨日已逝,
高中化学必修一第四章氨 硝酸 硫酸知识点

第四节氨、硝酸、硫酸一、氨气、氨水与铵盐的性质1、氨气的物理性质:无色有刺激性气味的气体,密度比空气小,易溶于水,水溶液呈碱性。
2、氨气的化学性质:○1与水反应:○2与酸反应:○3实验室制法:○4工业制法:(条件:高温、高压、催化剂)3、氨水成分:4、铵盐:物理性质:铵盐都是无色晶体,能溶于水化学性质:○1氯化铵分解:○2碳酸氢铵分解:○3与碱反应:【习题一】(2017春•鼓楼区期中)下列叙述中,正确的是()A.氨水显碱性B.铵盐不易溶于水C.氨气可以用浓硫酸进行干燥D.NH3+HCl═NH4Cl属于氧化还原反应【考点】氨的化学性质.【专题】氮族元素.【分析】A.一水合氨是弱碱;B.铵盐都易溶于水;C.氨气能与硫酸反应;D.存在化合价的变化的反应属于氧化还原反应.【解答】解:A.一水合氨是弱碱,存在NH3•H2O⇌NH4++OH-,所以氨水显碱性,故A正确;B.铵盐都易溶于水,故B错误;C.氨气能与硫酸反应,氨气不可以用浓硫酸进行干燥,故C错误;D.NH3+HCl═NH4Cl中不存在化合价的变化,不属于氧化还原反应,故D错误。
故选:A。
【习题二】(2017春•怀仁县校级期中)下列有关氨水的叙述中不正确的是()A.氨水中含有NH4+、OH-、H+三种离子B.氨水就是液氨C.氨水中含有NH3•H2O、NH3 和H2O三种分子D.氨水显碱性【考点】氨的化学性质.【专题】氮族元素.【分析】氨水中存在:NH3+H2O⇌NH3•H2O⇌NH4++OH-以及H2O⇌OH-+H+,以此解答该题.【解答】解:氨水中存在:NH3+H2O⇌NH3•H2O⇌NH4++OH-以及H2O⇌OH-+H+,则氨水中含有NH4+、OH-、H+三种离子,NH3•H2O、NH3 和HO三种分子,溶液呈碱性,氨水为混合物,液氨为纯净物,故选:B。
【习题三】(2017春•杨浦区校级期中)下列关于铵盐的叙述:①铵盐中氮元素化合价都是-3价;②铵盐都是晶体,都易溶于水;③铵盐与碱共热放出氨气;④铵盐都不能与酸反应;⑤铵盐都易分解.其中正确的是()A.①②③ B.②③④ C.③④⑤ D.②③⑤【考点】铵盐的性质。
专题01 氨气 硫酸 硝酸(上册知识回顾)-高一化学下学期期末复习考前必备知识清单(人教版)

专题01 氨气硫酸硝酸(上册知识回顾)1、什么叫氮的固定?有哪些方式?自然固氮的化学方程式?2、氨水的成分:三分子、三离子;氨水的主要成分,计算时,氨水的溶质以通入的为准,氨水的浓度越大密度反而越。
氨气溶于水后呈弱碱性且能使酚酞溶液,有关的方程式,氨水和液氨是同一种吗?3、氨气与酸反应的实质是(离子方程式)。
分别蘸取浓盐酸、浓氨水的两棒玻璃棒靠近,立即产生大量(填现象),化学方程式______________________________________。
分别蘸取浓硝酸、浓氨水的两棒玻璃棒靠近,立即产生大量(填现象),化学方程式______________________________________。
4、氨气与浓硫酸在空气中(能或不能)产生白烟;用稀硫酸吸收多余的氨气时要(填方法), 氨气不能用浓硫酸原因(化学反应方程式)5、玻璃棒蘸取浓氨水可查氯气管道是否漏气,氧化剂是,还原剂是,物质的量之比为;若有少量氯气泄漏则产生(填现象),化学方程式______________________________________。
若有大量氯气泄漏则产生(填现象),化学方程式______________________________________。
6、氨气在铂催化剂作用下氧化的化学反应方程式7、氨气在纯氧中燃烧的化学反应方程式8、侯氏制碱中的碱指的是(物质的名称)。
侯氏制碱法中向饱和食盐水中先通入,再通入,溶液中产生(填现象),过滤、洗涤、干燥后,对滤渣进行加热即得。
请写出相关反应的化学方程式:______________________________________。
9、氨气通入灼热的氧化铜的现象,化学方程式(单线桥法)______________________________________。
为消除氮氧化物污染,可通氨气处理,请写出相关反应的化学方程式:10、工业上制氨气的化学方程式实验室用氯化铵固体与消石灰制氨气的化学方程式实验室将浓氨水滴入生石灰中快速制氨气的化学方程式11、铵盐受热均易,(填:能或不能或不一定)产生氨气,请写出氯化铵、碳酸铵、碳酸氢铵受热分解的化学方程式______________________________________。
高中化学新人教必修1 硫酸 硝酸和氨(1)

硫酸、硝酸和氨一、教学目标二、1.知识与技能。
(1)掌握浓硫酸、硝酸的性质;了解氨的物理性质,掌握氨的化学性质;了解铵盐的性质。
(2)了解硫酸、硝酸的用途。
2.过程与方法。
通过学生分组讨论、实验探究,培养学生分析问题、解决问题能力、实验操作的能力。
3.情感态度与价值观。
(1)使学生体会化学对环保的重要意义,培养学生关注社会的意识和责任感。
(2)通过对问题的讨论、实验的探究,培养学生积极思考、勇于探究的精神。
二、教学重点与难点重点:浓硫酸、硝酸的氧化性,氨的化学性质。
难点:浓硫酸、硝酸的氧化性。
三、教材分析硫酸、硝酸是硫、氮元素的最高价氧化物的水化物,是重要的含氧酸,氨是氮的氢化物。
在硫、氮元素的知识体系中,比较重要的是氧化物和含氧酸。
硫酸、硝酸既有酸的一些通性,又有它们自己的特性。
氨也有大多数非金属元素的氢化物所具有的性质。
该节的主干知识有两点:(1)浓硫酸、硝酸的强氧化性,它们能与绝大多数金属反应,反应的特点是浓硫酸、硝酸中的硫、氮元素被还原,生成硫的氧化物和氮的氧化物。
(2)铵的水溶液呈碱性,因此容易与酸反应生成盐。
本节课的主要学习内容:(1)能从化合价的变化理解浓硫酸、硝酸的氧化性。
(2)知道冷的浓硫酸、浓硝酸与铁、铝的钝化作用。
(3)学会氨气的实验室制取、收集、检验方法。
(4)掌握铵盐的性质。
(5)学会NH4+的检验方法。
四、教学思路(1)通过回忆酸的通性,引出浓硫酸、硝酸的强氧化性,设计实验验证这一性质。
(2)通过设疑,探究氨易溶于水,设计实验逐步引出氨的性质。
五、教学过程[第一课时]从酸的氧化性分类的角度回顾盐酸、硫酸、硝酸的特性。
[思考与交流]从元素组成的角度将H2SO4、HNO3、HCl分类。
共同点:有氢元素,在水溶液中电离时产生H+HCl==H++Cl-H2SO4==2H++SO42-讨论:实验室里用金属与酸反应制氢气时,往往用稀硫酸或盐酸,而不用浓硫酸或硝酸?从分子组成上认识浓硫酸与稀硫酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新人教版高一化学氨硝酸硫酸知识点
氨(Ammonia,即阿摩尼亚),或称“氨气”,氮和氢的化合物,分子式为NH?,是一种无色气体,有强烈的刺激气味……接下来我们大家一起了解新人教版高一化学氨硝酸
硫酸知识点。
新人教版高一化学氨硝酸硫酸知识点2019
一、氨
(1)氮的固定
a:定义:将游离态的氮转变为氮的化合物叫做氮的固定
b.分类:放电
①自然固氮:高能固氮:N2+O2====2NO
生物固氮:豆科植物的根瘤菌固氮
②人工固氮:2N2+3H2
2NH3(条件:高温高压、催化剂)
(2)氨的分子式NH3,结构式,电子式,空间构型为三角锥形。
(3)氨是无色气体,有刺激性气味,极易溶于水,氨的水溶液叫氨水。
氨易液化。
(4)醮有浓盐酸的玻璃棒与醮有浓氨水的玻璃棒靠近,其现象为产生白烟,将浓盐酸改为
浓硝酸还会出现相同的现象。
(5)氨的化学性质
A 氨跟水的反应
氨溶于水时发生的化学反应为NH3+H2O=NH3?H2O =NH4++OH-,氨水的成份有NH3、H2O、NH3·H2O、NH4+、OH-,由于NH3·H2O 发生微弱电离,使氨水显碱性。
B 氨跟酸的反应
NH3+ HCl= NH4Cl 2NH3+H2SO4= (NH4)2SO4 NH3+HNO3= NH4 NO3 C 氨的氧化反应
加热
4NH3+O2=======4NO+6H2O 催化剂
二、铵盐
由铵根离子和酸根离子构成的化合物叫铵盐
(1)NH4+的电子式。
结构式,空间构型为正四面体形。
(2)铵盐都是离子化合物,都是晶体,都易溶于水
(3)铵盐受热都易分解,
①NH4Cl NH3↑+HCl↑。
②NH4HCO3NH3↑+H2O+CO2↑。
(4)铵盐与碱反应,写下列化学方程式:
①NH4Cl溶液与NaOH溶液混和NH4Cl+NaOH=NH3?H2O+NaCl。
②NH4Cl固体与熟石灰共热
Ca(OH)2(s)+2NH4Cl(s)=====2NH3↑+2H2O+CaCl2(实验室制氨气)。
三、氨气的制法:
1、工业制法2N2
+3H2
2、实验室制法
△ 2NH3(条件:高温高压、催化剂)
(1)原理:Ca(OH)2(s)+2NH4Cl(s) 2NH3↑+2H2O+CaCl2
(2)药品:NH4Cl固体与熟石灰(Ca(OH)2)
(3)装置:∵固+固气
∴使用大试管、单孔胶塞、导管、酒精灯、铁架台等。
(4)净化干燥:使用碱石灰,不能用CaCl2
(5)收集: NH3极易溶于水,比空气轻,用向下排空气法。
(6)验满:湿润的红色石蕊试纸变蓝色或蘸有浓盐酸的玻璃棒产生白烟
(7)处尾:用水吸收(注意防止倒吸)
新人教版高一化学氨硝酸硫酸知识点到这里就结束了,希望同学们的成绩能够更上一层楼。
