氯及其重要化合物转化关系方程式的书写
氯气及其重要化合物的性质和相互转化

选项 A B C D
实验现象 a处变蓝,b处变红棕色 c处先变红,后褪色 d处立即褪色 e处变红色
解释或结论 氧化性:Cl2>Br2>I2 氯气与水生成了酸性物质 氯气与水生成了漂白性物质 还原性:Fe2+>Cl-
练习2
某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列 用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液 的pH约为11)
达标
(2021·常州一模)二氧化氯(ClO2)是一种绿色消毒剂,常温常压下为黄绿 色气体,易溶于水。常见的化学合成方法有氧化法和还原法。
(1)过硫酸盐氧化法:用原料亚氯酸钠(NaClO2)和过硫酸钠(Na2S2O8)直接 反应,操作简单,同时可得到副产品Na2SO4。 ①制备时发生反应的离子方程式:_____________________。 ②原料亚氯酸钠的阴离子(ClO2-)中Cl原子的杂化方式为________,副产 品Na2SO4中阴离子的空间构型为__________________。
A.该消毒液可用NaOH溶液吸收Cl2制备: Cl2 +2OH- = Cl-+ ClO- + H2O B.该消毒液的pH约为12: ClO-+ H2O=HClO + OH- C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2: 2H++Cl-+ClO-= Cl2↑+H2O D.该消毒液加白醋生成HClO,可增强漂白作用: CH3COOH+ ClO-= HClO+CH3COO-
族, 区
基态氯原子的价层电。
强氧化性
考点一 氯及其化合物的性质和应用
3.氯气的化学性质
歧化反应
氯气与水或碱反应,氯的化合价既有升高又有降低,因而氯气既表
高一化学必修一化学方程式和离子方程式

1、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑ Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH 2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3 OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3- ※⒂2NaHCO 3△Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O ⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑ CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2O Ca 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2O Ca 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 2、铝及其化合物的转化关系①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2 △2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O 2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4Cl Al 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+ ⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2ONaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂⒃ ⒄ ④ Al Al 2O 3 A l (O H)3 KAl(SO 4)2NaAlO 2AlCl 3 ① ② ③ ④ ⑤ ⑥⑦⑧ ⑨ ⑩⑾ ⑿Al(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3 AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3- ※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H + Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2O 3、铁及其化合物的转化关系①Fe 3O 4+4CO△3Fe +4CO 2 ※② 3Fe +4H 2O(g)高温Fe 3O 4+4H 2③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2 点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑ ④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2O Fe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2O※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓ ⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KCl Fe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3 4、硅及其化合物的转化关系①Si +O 2 △SiO 2 ②SiO 2+2C 高温Si +2CO ↑ ※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃) ④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO 高温 CaSiO 3 ※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O SiO 2+CaCO 3高温CaSiO 3+CO 2↑SiO 2+2OH -= SiO 32-+H 2O ※⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑ SiO 32-+2H += H 2SiO 3↓※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3-Na 2SiO 3 SiF 4Si SiO 2 H 2SiO 3 CaSiO 3① ②③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe 2O 3 ①②③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾⑿ ⒁ ⒀⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O ⑨H 2SiO 3 △H 2O +SiO 2H 2SiO 3+2OH -= SiO 32-+2H 2O 5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 2 2Fe 3++Cu = 2Fe 2++Cu 2+ ④H 2+Cl 2 2HCl ※⑤MnO 2+4HCl(浓) △ MnCl 2+Cl 2↑+2H 2O MnO 2+4H ++2Cl -△Mn 2++Cl 2↑+2H 2O※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑ Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O Cl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClO Ca 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClO ClO -+H 2O +CO 2 = HCO 3-+HClO 6、硫及其化合物的转化关系①S +O 2 点燃SO 2 ②2H 2S +SO 2=3S +2H 2O※③SO 2+O 2 催化剂 加热 2SO 3 ④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2△2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓) △CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl - Cu +2H 2SO 4(浓) △Cu 2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O7、氮及其化合物的转化关系※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2 ※③3NO 2+H 2O = 2HNO 3+NO3NO 2+H 2O =2H ++2NO 3-+NO 以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 34NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OCuCl 2 HClO HCl Cl 2 FeCl 3 NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ① ⑤S SO 2 SO 3 H 2SO 4 CaSO 3 CaSO 4 ② ③ ④ ⑥ ⑦ ⑧氯水 ⑨Cu ⑩C ① ⑨ ⑧⑦⑥ ④ ③⑤ N 2 NH 3 NH 4Cl NO NO 2 HNO 3 ② ③点燃 或光照 光照光照高温或放电光照C +4HNO 3(浓)△CO 2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H + = NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑ 氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH △ NaCl +NH 3↑+H 2O NH 4++OH - △NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
2022年高考化学有机转化关系及反应方程式书写
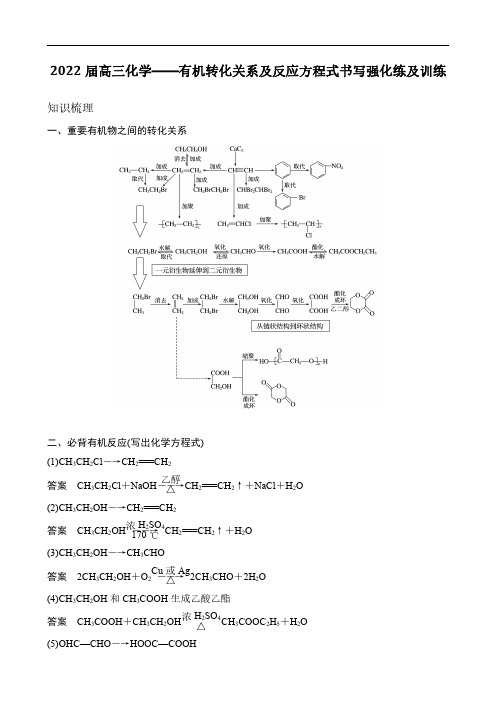
2022届高三化学——有机转化关系及反应方程式书写强化练及训练知识梳理一、重要有机物之间的转化关系二、必背有机反应(写出化学方程式)(1)CH 3CH 2Cl ―→CH 2===CH 2答案CH 3CH 2Cl +NaOH ――→乙醇△CH 2===CH 2↑+NaCl +H 2O(2)CH 3CH 2OH ―→CH 2===CH 2答案CH 3CH 2OH ――→浓H 2SO 4170℃CH 2===CH 2↑+H 2O (3)CH 3CH 2OH ―→CH 3CHO 答案2CH 3CH 2OH +O 2――→Cu 或Ag △2CH 3CHO +2H 2O(4)CH 3CH 2OH 和CH 3COOH 生成乙酸乙酯答案CH 3COOH +CH 3CH 2OH浓H 2SO 4△CH 3COOC 2H 5+H 2O (5)OHC—CHO ―→HOOC—COOH答案OHC—CHO +O 2――→催化剂△HOOC—COOH(6)乙二醇和乙二酸生成聚酯答案n HOCH 2—CH 2OH +n HOOC—COOH――→一定条件+(2n -1)H 2O (7)乙醛和银氨溶液的反应答案CH 3CHO +2Ag(NH 3)2OH ――→△CH 3COONH 4+2Ag ↓+3NH 3+H 2O(8)乙醛和新制Cu(OH)2悬浊液的反应答案CH 3CHO +2Cu(OH)2+NaOH ――→△CH 3COONa +Cu 2O ↓+3H 2O(9)答案(10)答案(11)和饱和溴水的反应答案(12)和溴蒸气(光照)的反应答案(13)和HCHO 的反应答案+(n -1)H 2O(14)酯在碱性条件的水解(以乙酸乙酯在NaOH 溶液中为例)答案CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH (15)和NaOH 的反应三、常考有机物的检验1.卤代烃中卤素的检验取样,滴入NaOH 溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO 3溶液,观察沉淀的颜色,确定是何种卤素。
必修1_物质转化关系图及相应化学方程式

必修1 物质转化关系图及相应化学方程式一、金属钠及其重要化合物的相互转化(括号内写离子方程式)1、4 Na + O 2 === 2 Na 2O2、2 Na +O 2△Na 2O 23、2 Na +2 H 2O===2 NaOH +H 2↑ (2 Na +2 H 2O===2 Na ++2 OH -+H 2↑)4、Na 2O + H 2O===2 NaOH (Na 2O +H 2O===2 Na ++2 OH -) *5、2Na 2O 2 +2H 2O === 4 NaOH +O 2↑ (2Na 2O 2+2 H 2O =4Na ++4OH -+O 2↑) *6、2 Na 2O 2 + 2 CO 2 === 2 Na 2CO 3+O 27、2 NaOH + CO 2 === Na 2CO 3+H 2O (CO 2+ 2 OH - = CO 32-+H 2O ) 8、NaOH + HCl === NaCl +H 2O (OH — + H += H 2O)9、Na 2CO 3+2HCl =2NaCl +CO 2↑+H 2O (CO -23+ 2H + = CO 2↑ + H 2O )10、NaHCO 3+HCl =NaCl +CO 2↑+H 2O (HCO -3+ H + = CO 2↑ + H 2O )11、Na 2CO 3+CO 2+H 2O= 2 NaHCO 3 (CO 32— + CO 2 + H 2O= 2 HCO 3—)12、NaHCO 3+NaOH =Na 2CO 3+H 2O (HCO -3+OH - = CO -23 + H 2O )2 NaHCO 3△Na 2CO 3+CO 2↑+H 2ONa 2O Na ①NaCl NaHCO 3Na 23Na 2O 2 ② ③ ④ ⑤ ⑥⑦ ⑧ ⑨⑩ ⑾ ⑿二、非金属氯及其化合物的相互转化(括号内写离子方程式)1、H 2 + Cl 2点燃2HCl 2、2Na + Cl 2 点燃2NaCl3、Cu + Cl 2 点燃CuCl 24、2Fe + 3Cl 2点燃2FeCl 35、HCl +AgNO 3 = AgCl↓+HNO 3 (Cl -+Ag +=Ag Cl↓)6、NaCl +AgNO 3 = AgCl↓+NaNO 3 (Cl -+Ag +=AgCl↓)7、CuCl 2+2AgNO 3 = 2AgCl↓+Cu(NO 3)2 (Cl -+Ag +=AgCl↓)8、FeCl 3+3AgNO 3 = 3AgCl↓+Fe(NO 3)3 (Cl -+Ag +=AgCl↓)9、Cl 2 + 2NaOH = NaCl + NaClO + H 2O (Cl 2 + 2OH - = Cl - + ClO - + H 2O) 10、2Cl 2 + 2Ca(OH)2 = CaCl 2+ Ca(ClO)2 +2 H 2O(Cl 2 + 2OH - = Cl - + ClO - + H 2O)11、Cl 2 + H 2O = HCl + HClO (Cl 2 + H 2O = H ++Cl -+ HClO) 12、NaClO +HCl = NaCl + HClO (ClO - +H += HClO)2NaClO+H 2O+CO 2= Na 2CO 3+ 2HClO (2ClO -+H 2O+CO 2= CO 32-+ 2HClO) 13、Ca(ClO) 2+2HCl = CaCl 2 + 2HClO (ClO - +H += HClO)Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO (Ca 2++2ClO -+H 2O+CO 2=CaCO+ 2HClO)14、2HClO 2HCl+O 2↑NaCl 23AgCl⑤ ⑥ ⑦ ⑧光照三、金属铝及其重要化合物的相互转化(括号内写离子方程式)1.4Al +3O 2点燃2Al 2O 3 2.2 Al (OH )3△Al 2O 3 +3H 2O3.2Al +6HCl==2AlCl 3+3H 2↑ ( 2Al +6H +==2 Al 3++3H 2↑) 4.2Al +2NaOH +2H 2O==2NaAlO 2+3H 2↑ (2 Al +2OH -+2H 2O =2AlO 2-+3 H 2↑)5.Al 2O 3+6HCl =2AlCl 3+3H 2O ( Al 2O 3+6H +=2Al 3++3H 2O ) 6. Al 2O 3+2NaOH =2Na AlO 2+H 2O (Al 2O 3+2OH -=2 AlO 2-+H 2O )7、Al (OH )3+3HCl =AlCl 3+3H 2O ( Al (OH )3+3H + = Al 3++3H 2O )8、Al (OH )3+NaOH =NaAlO 2+2H 2O ( Al (OH )3+OH - = AlO 2-+2H 2O )9、实验制取Al (OH )3: AlCl 3+3NH 3·H 2O = Al (OH )3↓+3NH 4Cl (Al 3++3 NH 3·H 2O = Al (OH )3 ↓+ 3NH 4+ )AlAl (OH )3NaAlO 2Al 2O 3AlCl 3①②③④ ⑤ ⑥⑦ ⑧四、金属铁及其化合物的相互转化(括号内写离子方程式)1、3Fe +2O2 点燃Fe3O42、Fe+2HCl=FeCl2+H2↑(Fe+2H+=Fe2++H2↑)Fe+CuCl2=FeCl2+Cu (Fe+Cu2+=Fe2++Cu)3、FeO+2HCl=FeCl2+H2O(FeO+2H+=Fe2++H2O)4、Fe2O3+6HCl=2 FeCl3+3H2O (Fe2O3+6H+=2Fe2++3H2O)5、FeCl2+2NaOH =Fe(OH)2↓+2NaCl (Fe2++2OH-=Fe(OH) 2)↓6、Fe(OH)2 + 2HCl=FeCl2+2H2O(Fe(OH)2+2H+=Fe2++2H2O)7、FeCl3+3NaOH =Fe(OH)3↓+3NaCl ( Fe3++3OH-=Fe(OH) 3↓)8、Fe(OH) 3+3HCl=FeCl3+3H2O (Fe(OH) 3+3H+=Fe3++3H2O)9、2FeCl2+Cl2=2FeCl3 (2Fe2++Cl2=2 Fe3++2Cl—)10、属于化合反应的:Fe+2FeCl3 =3FeCl2(Fe +2 Fe3+=3 Fe2+) 印刷腐蚀电路板:Cu+2FeCl3 =CuCl2+2FeCl2 (Cu+2 Fe3+=Cu2++2 Fe2+)11、2 Fe(OH)3△Fe2O3+3H2O12、白色沉淀,然后迅速变为灰绿色,最后变为红褐色4 Fe(OH)2+ O2 + 2 H2O ═ 4 Fe(OH) 3①Fe3O4②23⑾⑿。
卤素及其化合物的化学方程式和离子方程式

卤素及其化合物的化学方程式和离子方程式一、氟气、氯气、溴、碘1、铁在氯气中燃烧:2Fe+3Cl22FeCl32、铁粉和液体溴反应:2Fe+3Br22FeBr33、铁与固体碘加热:Fe+I2FeI24、氟气和水反应:2F2+2H2O4HF+O2↑5、氯气溶于水:Cl2+H2O HCl+HClOCl2+H2O H++Cl-+HClO6、二氧化硫通入氯水:SO2+Cl2+2H2O H2SO4+2HClSO2+Cl2+2H2O4H++SO42-+2Cl-7、二氧化硫通入溴水:SO2+Br2+2H2O H2SO4+2HBrSO2+Br2+2H2O4H++SO42-+2Br-8、二氧化硫通入碘水:SO2+I2+2H2O H2SO4+2HISO2+I2+2H2O4H++SO42-+2I-9、氢硫酸和氯水混合:H2S+Cl22HCl+S↓H2S+Cl22H++2Cl-+S ↓10、氢硫酸和溴水混合:H2S+Br22HBr+S↓H2S+Br22H++2Br-+S↓11、氢硫酸和碘水混合:H2S+I22HI+S↓H2S+I22H++2I-+S↓12、氢碘酸与氯水混合:2HI+Cl22HCl+I22I-+Cl2I2+2Cl-13、氢碘酸与溴水混合:2HI+Br22HBr+I22I-+Br2I2+2Br-14、氢溴酸与氯水混合:2HBr+Cl22HCl+Br22Br-+Cl2Br2+2Cl-15、亚硫酸与氯水混合:H2SO3+Cl2+H2O H2SO4+2HClH2SO3+Cl2+H2O4H++SO42-+2Cl-16、亚硫酸与溴水混合:H2SO3+Br2+H2O H2SO4+2HBrH2SO3+Br2+H2O4H++SO42-+2Br-17、亚硫酸与碘水混合:H2SO3+I2+H2O H2SO4+2HIH2SO3+I2+H2O4H++SO42-+2I-18、氯气溶于氢氧化钠溶液:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O19、溴溶于氢氧化钠溶液:Br2+2NaOH NaBr+NaBrO+H2OBr2+2OH-Br-+BrO-+H2O20、碘溶于氢氧化钠溶液:I2+2NaOH NaI+NaIO+H2OI2+2OH-I-+IO-+H2O21、氯气与热的氢氧化钠溶液反应:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O 22、溴与热的氢氧化钠溶液反应:3Br2+6NaOH5NaBr+NaBrO3+3H2O3Br2+6OH-5Br-+BrO3-+3H2O 23、碘与热的氢氧化钠溶液反应:3I2+6NaOH5NaI+NaIO3+3H2O3I2+6OH-5I-+IO3-+3H2O24、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl32Fe2++Cl22Fe3++2Cl-25、氯化亚铁中加入溴:6FeCl2+3Br24FeCl3+2FeBr32Fe2++Br22Fe3++2Br-26、溴化亚铁中通入少量氯气:6FeBr2+3Cl22FeCl3+2FeBr32Fe2++Cl22Fe3++2Cl-27、溴化亚铁中通入足量氯气:2FeBr2+3Cl22FeCl3+2Br22Fe2++4Br-+3Cl22Fe3++2Br2+6Cl-28、碘化亚铁溶液中通入少量氯气:FeI2+Cl2FeCl2+I22I-+Cl2I2+2Cl-29、碘化亚铁溶液中通入足量氯气:2FeI2+3Cl22FeCl3+2I22Fe2++4I-+3Cl22Fe3++2I2+6Cl-30、溴化钠溶液中通入氯气:2NaBr+Cl22NaCl+Br22Br-+Cl2Br2+2Cl-31、碘化钾溶液中加入溴水:2KI+Br22KBr+I22I-+Br2I2+2Br-32、碘化钾溶液中通入氯气:2KI+Cl22KCl+I22I-+Cl2I2+2Cl-33、硫化钠溶液中加入氯水:Na2S+Cl22NaCl+S↓S2-+Cl22Cl-+S ↓34、硫化钠溶液中加入溴水:Na2S+Br22NaBr+S↓S2-+Br22Br-+S↓35、硫化钠溶液中加入碘水:Na2S+I22NaI+S↓S2-+I22I-+S↓36、亚硫酸钠溶液中加入氯水:Na2SO3+Cl2+H2O Na2SO4+2HClSO32-+Cl2+H2O2H++SO42-+2Cl-37、亚硫酸钠溶液中加入溴水:Na2SO3+Br2+H2O Na2SO4+2HBrSO32-+Br2+H2O2H++SO42-+2Br-38、亚硫酸钠溶液中加入碘水:Na2SO3+I2+H2O Na2SO4+2HISO32-+I2+H2O2H++SO42-+2I-39、氟气和硅反应:Si+2F2SiF440、氯气与硅共热:Si+2Cl2SiCl4二、氟化氢、氯化氢、溴化氢、碘化氢1、钠与稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑2、锌与稀盐酸反应:Zn+2HCl ZnCl2+H2↑Zn+2H+Zn2++H2↑3、铝与稀盐酸反应:2Al+6HCl2AlCl3+3H2↑2Al+6H+2Al3++3H2↑4、铁与稀盐酸反应:Fe+2HCl FeCl2+H2↑Fe+2H+Fe2++H2↑5、硅与氢氟酸反应:Si+4HF SiF4+2H2↑6、氢溴酸与氯水混合:2HBr+Cl22HCl+Br22Br-+Cl2Br2+2Cl-7、氢碘酸与氯水混合:2HI+Cl22HCl+I22I-+Cl2I2+2Cl-8、氢碘酸与溴水混合:2HI+Br22HBr+I22I-+Br2I2+2Br-9、氧化钠与稀盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O10、氧化铜与稀盐酸反应:CuO+2HCl CuCl2+H2OCuO+2H+Cu2++H2O11、氧化铁与稀盐酸反应:Fe2O3+6HCl2FeCl3+3H2OFe2O3+6H+2Fe3++3H2O12、四氧化三铁与稀盐酸反应:Fe3O4+8HCl FeCl2+2FeCl3+4H2OFe3O4+8H+Fe2++2Fe3++4H2O13、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2OFe2O3+6H++2I-2Fe2++I2+3H2O14、四氧化三铁与氢碘酸反应:Fe3O4+8HI3FeI2+I2+4H2OFe3O4+2I-+8H+3Fe2++I2+4H2O15、二氧化锰与浓盐酸共热:MnO2+4HCl MnCl2+Cl2↑+2H2OMnO2+4H++2Cl-Mn2++Cl2↑+2H2O 16、二氧化锰与浓氢溴酸共热:MnO2+4HBr MnBr2+Br2+2H2OMnO2+4H++2Br-Mn2++Br2+2H2O 17、二氧化锰与浓氢碘酸共热:MnO2+4HI MnI2+I2+2H2OMnO2+4H++2I-Mn2++I2+2H2O18、二氧化硅与氢氟酸反应:SiO2+4HF SiF4+2H2O19、氢氧化钠与盐酸反应:HCl+NaOH NaCl+H2OH++OH-H2O20、氢氧化镁与盐酸反应:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H+Mg2++2H2O21、氢氧化铁与盐酸反应:Fe(OH)3+3HCl FeCl3+3H2OFe(OH)3+3H+Fe3++3H2O22、氢氧化铁与氢碘酸反应:2Fe(OH)3+6HI2FeI2+I2+6H2O2Fe(OH)3+6H++2I-2Fe2++I2+6H2O 23、硝酸银溶液与盐酸反应:AgNO3+HCl AgCl↓+HNO3Ag++Cl-AgCl↓24、硝酸银溶液与氢溴酸反应:AgNO3+HBr AgBr↓+HNO3Ag++Br-AgBr↓25、硝酸银溶液与氢碘酸反应:AgNO3+HI AgI↓+HNO3Ag++I-AgI↓26、溴化氢通入浓硫酸中:2HBr+H2SO4Br2+SO2↑+2H2O27、碘化氢通入浓硫酸中:2HI+H2SO4I2+SO2↑+2H2O28、溴化氢通入浓硝酸中:2HBr+2HNO3Br2+2NO2↑+H2O29、碘化氢通入浓硝酸中:2HI+2HNO3I2+2NO2↑+H2O30、氢碘酸与氯化铁溶液混合:2FeCl3+2HI2FeCl2+I2+2HCl2Fe3++2I-2Fe2++I231、氯酸钾与浓盐酸反应:KClO3+6HCl KCl+3Cl2↑+3H2OClO3-+6H++5Cl-3Cl2↑+3H2O32、溴酸钾与浓氢溴酸反应:KBrO3+6HBr KBr+3Br2+3H2OBrO3-+6H++5Br-3Br2+3H2O33、碘酸钾与浓氢碘酸反应:KIO3+6HI KI+3I2+3H2OIO3-+6H++5I-3I2+3H2O34、高锰酸钾与浓盐酸反应:2KMnO4+16HCl 2KCl+5Cl2↑+2MnCl2+8H2O2MnO4-+16H++10Cl-2Mn2++5Cl2↑+8H2O 35、高锰酸钾与浓氢溴酸反应:2KMnO4+16HBr 2KBr+5Br2+2MnBr2+8H2O2MnO4-+16H++10Br-2Mn2++5Br2+8H2O 36、高锰酸钾与浓氢碘酸反应:2KMnO4+16HI 2KI+5I2+2MnI2+8H2O2MnO4-+16H++10I-2Mn2++5I2+8H2O三、氟化钠、氯化钠、溴化钠、碘化钠1、硝酸银溶液与氯化钠溶液反应:AgNO3+NaCl AgCl↓+NaNO3Ag++Cl-AgCl↓2、硝酸银溶液与溴化钠溶液反应:AgNO3+NaBr AgBr↓+NaNO3Ag++Br-AgBr↓3、硝酸银溶液与碘化钠溶液反应:AgNO3+NaI AgI↓+NaNO3Ag++I-AgI↓4、氟化钠溶液与氯化钙溶液混合:2NaF+CaCl2CaF2↓+2NaClCa2++2F-CaF2↓5、氟化钠溶液呈碱性:NaF+H2O HF+NaOHF-+H2O HF+OH-6、氟化钠溶液与稀盐酸反应:NaF+HCl NaCl+HFF-+H+HF7、氟化钠溶液与氯化铁溶液反应:FeCl3+3NaF+3H2O Fe(OH)3↓+3NaCl+3HFFe3++3F-+3H2O Fe(OH)3↓+3HF8、氯化钠固体与浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl9、溴化钠固体与浓硫酸共热:2NaBr+H2SO4Na2SO4+SO2↑+Br2+H2O10、碘化钠固体与浓硫酸共热:2NaI+H2SO4Na2SO4+SO2↑+I2+H2O11、溴化钠固体与浓磷酸共热:NaBr+H3PO4NaH2PO4+HBr↑12、溴化钠固体与浓磷酸共热:NaI+H3PO4NaH2PO4+HI↑13、碘化钠固体溶于浓硝酸:2NaI+4HNO32NaNO3+2NO2↑+I2+2H2O14、溴化钠溶液中通入氯气:2NaBr+Cl22NaCl+Br22Br-+Cl2Br2+2Cl-15、碘化钠溶液加入溴水:2NaI+Br22NaBr+I22I-+Br2I2+2Br-16、碘化钠溶液通入氯气:2NaI+Cl22NaCl+I22I-+Cl2I2+2Cl-17、碘化钠溶液与氯化铁溶液混合:2FeCl3+2NaI2FeCl2+I2+2NaCl2Fe3++2I-2Fe2++I218、氯酸钠、氯化钠的混合液中加稀硫酸:NaClO3+5NaCl+3H2SO4Na2SO4+3Cl2↑+3H2OClO3-+5Cl-+6H+3Cl2↑+3H2O19、溴酸钠、溴化钠的混合液中加稀硫酸:NaBrO3+5NaBr+3H2SO4Na2SO4+3Br2+3H2OBrO3-+5Br-+6H+3Br2+3H2O20、碘酸钠、碘化钠的混合液中加稀硫酸:NaIO3+5KNa+3H2SO4Na2SO4+3I2+3H2OIO3-+5I-+6H+3I2+3H2O四、次氯酸1、二氧化硫通入次氯酸中:SO2+HClO+H2O H2SO4+HClSO2+HClO+H2O3H++SO42-+Cl-2、氢硫酸与次氯酸混合:H2S+HClO S↓+H2O+HClH2S+HClO S↓+H++Cl-+H2O3、亚硫酸与次氯酸混合:H2SO3+HClO H2SO4+HClH2SO3+HClO3H++SO42-+Cl-4、氢碘酸与次氯酸混合:2HI+HClO I2+HCl+H2O2I-+HClO+H +I2+Cl-+H2O6、次氯酸与氢氧化钠溶液反应:HClO+NaOH NaClO+H2OHClO+OH -ClO-+H2O7、氯化亚铁溶液与次氯酸混合:2FeCl2+2HClO2FeCl3+H2O2Fe2++2HClO2Fe3++2Cl-+H2O 8、硫化钠与次氯酸混合:Na2S+2HClO2NaCl+S↓+H2OS2-+2HClO2Cl-+S ↓+H2O9、亚硫酸钠与次氯酸混合:Na2SO3+HClO Na2SO4+HClSO32-+HClO SO42-+H++Cl-10、碘化钾与次氯酸混合:2KI+2HClO2KCl+I2+H2O2I-+2HClO I2+2Cl-+H2O见光或受热11、次氯酸见光分解:2HClO2HCl+O2↑五、次氯酸钠1、二氧化硫通入次氯酸钠溶液中:SO2+NaClO+H2O NaCl+H2SO4SO2+ClO-+H2O Cl-+2H++SO42-2、次氯酸钠溶液呈碱性:NaClO+H2O HClO+NaOHClO-+H2O HClO+OH-3、次氯酸钠与稀硫酸反应:2NaClO+H2SO42HClO+Na2SO4ClO-+H+HClO4、次氯酸钠溶液通入二氧化碳:NaClO+CO2+H2O HClO+NaHCO3ClO-+CO2+H2O HClO+HCO3-5、次氯酸钠溶液与氯化铁溶液混合:FeCl3+3NaClO+3H2O Fe(OH)3↓+3NaCl+3HClOFe3++3ClO-+3H2O Fe(OH)3↓+3HClO6、次氯酸钠与氢硫酸反应:NaClO+H2S NaCl+S↓+H2OClO-+H2S S↓+Cl-+H2O7、次氯酸钠与氢碘酸反应:NaClO+2HI I2+NaCl+H2OClO-+2H++2I-I2+Cl-+H2O8、次氯酸钠与浓盐酸反应:NaClO+2HCl NaCl+Cl2↑+H2OClO-+2H++Cl-Cl2↑+H2O9、次氯酸钠与亚硫酸反应:NaClO+H2SO3NaCl+H2SO4ClO-+H2SO3Cl-+2H++SO42-10、次氯酸钠与硫化钠反应:Na2S+NaClO+H2O NaCl+S↓+2NaOHS2-+ClO-+H2O S↓+Cl-+2OH-11、次氯酸钠与碘化钾反应:2KI+NaClO+H2O I2+NaCl+2KOH2I-+ClO-+H2O I2+Cl-+2OH-12、次氯酸钠与亚硫酸钠反应:NaClO+Na2SO3Na2SO4+NaClClO-+SO32-SO42-+Cl-13、次氯酸钠与氯化亚铁反应:2FeCl2+5NaClO+5H2O2Fe(OH)3↓+5NaCl+4HClO2Fe2++5ClO-+5H2O2Fe(OH)3↓+Cl-+4HClO14、次氯酸钠与氯化钠的混合溶液中加入稀硫酸:NaClO+NaCl+H2SO4Na2SO4+Cl2↑+H2OClO-+Cl-+2H+Cl2↑+H2O六、氯酸钾、溴酸钾、碘酸钾1、氯酸钾与二氧化锰共热:2KClO32KCl+3O2↑2、氯酸钾与浓盐酸反应:KClO3+6HCl KCl+3Cl2↑+3H2OClO3-+6H++5Cl-3Cl2↑+3H2O 3、溴酸钾与浓氢溴酸反应:KBrO3+6HBr KBr+3Br2+3H2OBrO3-+6H++5Br-3Br2+3H2O 4、、碘酸钾与浓氢碘酸反应:KIO3+6HI KI+3I2+3H2OIO3-+6H++5I-3I2+3H2O 5、氯酸钾、氯化钾的混合液中加稀硫酸:KClO3+5KCl+3H2SO4K2SO4+3Cl2↑+3H2OClO3-+5Cl-+6H+3Cl2↑+3H2O6、溴酸钾、溴化钾的混合液中加稀硫酸:KBrO3+5KBr+3H2SO4K2SO4+3Br2+3H2OBrO3-+5Br-+6H+3Br2+3H2O7、碘酸钾、碘化钾的混合液中加稀硫酸:KIO3+5KI+3H2SO4K2SO4+3I2+3H2OIO3-+5I-+6H+3I2+3H2O。
高中化学元素化合物重要方程式

一、钠及其化合物(1)钠1.钠与非金属:O2Cl2S4Na+O2=2Na2O2Na+O2= Na2O22. 钠与水: 浮熔游响红2Na+2H2O=2NaOH+H2↑3.钠与盐溶液:CuSO4溶液2Na+2H2O=2NaOH+H2↑CuSO4+2NaOH=Cu(OH)2↓+ Na2SO44.钠与酸:盐酸2Na+2HCl=2NaCl+H2↑(2)氧化钠过氧化钠2Na2O+ O2 =2Na2O22Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O2(3)氢氧化钠:碱的通性2NaOH+CO2=Na2CO3+ H2ONaOH+CO2=NaHCO3(4)碳酸钠碳酸氢钠1.与酸CO32-+2H+=H2O+CO2↑CO32-+H+=HCO3-HCO3-+H+=H2O+CO2↑2.受热分解2NaHCO3=Na2CO3+H2O+CO2↑3.与盐:CaCl2溶液、BaCl2溶液CO32-+Ca2+=CaCO3↓4.与碱NaHCO3+NaOH=Na2CO3+H2O5.转化Na2CO3+H2O+CO2=2NaHCO3Na2CO3+HCl=NaHCO3+NaCl2NaHCO3=Na2CO3+H2O+CO2↑NaHCO3+NaOH=Na2CO3+H2O 二、铝及其化合物(1)铝1.铝与非金属单质:O2Cl24Al+3O2= 2Al2O32. 铝与酸2Al+6HCl= 2AlCl3+3H2↑3.铝与强碱2Al+2NaOH+2H2O= 2NaAlO2+3H2↑(2)氧化铝:两性氧化物,不溶于水。
Al2O3+6HCl =2AlCl3+3H2OAl2O3+6H+=2Al3++3H2OAl2O3+2NaOH =2NaAlO2+H2OAl2O3+2OH-=2AlO2-+H2O(3)氢氧化铝:两性氢氧化物。
1.两性Al(OH)3+3HCl =AlCl3+3H2OAl(OH)3+NaOH= NaAlO2+2H2O2.不稳定性2Al(OH)3Al2O3+3H2O3. 实验室制取氢氧化铝Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4 Al3++3NH3•H2O =Al(OH)3↓+3NH4+(4)Al3+、Al(OH)3与AlO2—相互转化Al3++3OH-=Al(OH)3↓Al3+ + 4OH—=AlO2—+ 2H2OAl(OH)3+OH-=AlO2-+2H2OAl(OH)3 + H+=Al3+ +3 H2OAlO2—+ H+ + H2O = Al(OH)3↓AlO2—+ 4H+ = Al3+ +2 H2O△△△△△三、铁及其化合物(1)铁1. 铁与非金属:O2、Cl2、S3Fe+2O Fe3O42Fe+3Cl22FeCl3Fe+S FeS2. 铁与水蒸气3Fe+4H2O(g)== Fe3O4 +4H23.铁与酸:盐酸、稀硫酸Fe+2H+=Fe2++H2↑4. 铁与盐溶液Fe+CuSO4=FeSO4+CuFe+2FeCl3=3 FeCl2(2)铁的氧化物:FeO(黑色粉末)、Fe3O4(黑色粉末、具有磁性)、Fe2O3(红棕色粉末)1.与酸FeO+2HCl=FeCl2+H2↑Fe2O3+6HCl=2FeCl3+3H2OFe3O4+8HCl=FeCl2+2FeCl3+4H2O2. 与还原剂反应FeO+H2Fe+H2OFe2O3+3CO2Fe+3CO23.不稳定性6FeO+O2 2 Fe3O4(3)铁的氢氧化物:Fe(OH)2 (白色固体) 、Fe(OH)3 (红褐色固体) 1.与酸Fe(OH)2+2H+ =Fe2++2H2OFe(OH)3+3H+=Fe3++3H2O2.不稳定性4Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3Fe2O3+3H2O(4)Fe2+及Fe3+离子的检验:①Fe2+的检验:(浅绿色)a) 加氢氧化钠溶液,产生白色沉淀,迅速变成灰绿色,最后变红褐色。
专题3.3 氯及其化合物 (解析版)
专题3 氯及其化合物【名师预测】本专题内容与化工生产、日常生活、科学技术等方面有着广泛的联系,如氯碱工业、漂白粉应用、饮用水消毒、环境保护等,往往与氧化还原反应、离子反应、化学实验方案的设计与评价等知识结合出现。
预计今后:1.以氯单质及其重要化合物的性质、用途设计选择题;2.以制取氯气设计有关实验题;3.根据同主族元素性质的相似性设计信息题,考查溴、碘及其重要性质和用途;4.考查用海水制取溴和碘。
【知识精讲】一、氯气及其化合物的转化关系二、氯及其化合物的性质和应用(一)氯气的性质1.氯气的物理性质注意:实验室里闻有毒气体及未知气体气味的方法是:用手在瓶口轻轻扇动,仅使极少量气体飘进鼻孔。
(如图所示)2.从氯的原子结构认识氯气的化学性质——氧化性依据氯气的氧化性完成下列方程式: (1)与金属反应①Fe :2Fe +3Cl 2=====点燃2FeCl 3,棕红色烟。
②Cu :Cu +Cl 2=====点燃CuCl 2,棕黄色烟。
(2)与非金属反应H 2:H 2+Cl 2=====点燃2HCl ,苍白色火焰; H 2和Cl 2的混合气体光照时会发生爆炸。
(3)与还原性无机化合物反应:①与碘化钾溶液反应:Cl 2+2KI===2KCl +I 2。
②与SO 2水溶液反应:Cl 2+SO 2+2H 2O===H 2SO 4+2HCl 。
③与FeCl 2溶液反应:Cl 2+2FeCl 2===2FeCl 3。
3.从化合价的角度认识Cl 2的化学性质——歧化反应氯气与水或碱反应,氯元素的化合价既有升高又有降低,因而氯气既表现氧化性又表现还原性。
(1)与水反应化学方程式:Cl 2+H 2O HCl +HClO , 离子方程式:Cl 2+H 2O H ++Cl -+HClO 。
(2)与碱反应①与烧碱反应:Cl 2+2NaOH===NaCl +NaClO +H 2O 。
②制取漂白粉:2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O 。
氯及其重要化合物的化学方程式(或离子方程式)总结
23.氯气通入溴化钠溶液中:
离子方程式:
24.氯气通入碘化钾溶液中:
离子方程式:
25.向碘化钾溶液中滴:
氯及其重要化合物的化学方程式
(或离子方程式)总结
1.钠在氯气中燃烧:
2.铜在氯气中燃烧:
3.铁在氯气中燃烧:
4.氢气在氯气中燃烧:
5.磷和少量氯气反应:
6.磷和足量氯气反应:
7.氯气与水反应:
8.氯气与氢氧化钠反应:
离子方程式:
9.氯气制漂白粉:
10.二氧化碳通入次氯酸钙溶液中:
11.氯气通入氢硫酸中:
离子方程式
12.氯气通入亚硫酸钠溶液中:
离子方程式:
13.氯气通入碘化钾溶液中:
离子方程式:
14.氯气通入碘化钾溶液中:
离子方程式:
15.将二氧化硫通入氯水中:
离子方程式:
16.次氯酸见光分解:
17.实验室制氯气:
离子方程式:
18.高锰酸钾和浓盐酸反应:
19.工业制氯气:
20.氟与水反应:
21.向溴水中加入镁粉:
氯及其重要化合物的化学方程式(或离子方程式)总结
氯及其重要化合物的化学方程式
(或离子方程式)总结
1.钠在氯气中燃烧:
2.铜在氯气中燃烧:
3.铁在氯气中燃烧:
4.氢气在氯气中燃烧:
5.磷和少量氯气反应:
6.磷和足量氯气反应:
7.氯气与水反应:
17.实验室制氯气:
离子方程式:
18.高锰酸钾和浓盐酸反应:
19.工业制氯气:
20.氟与水反应:
21.向溴水中加入镁粉:
22.溴与水反应:
23.氯气通入溴化钠溶液中:
离子方程式:
24.氯气通入碘化钾溶液中:
离子方程式:
25.向碘化钾溶液中滴加溴水:
离子方程式:
26.溴化银见光分解:
8.氯气与氢氧化钠反应:
离子方程式:
9.氯气制漂白粉:
10.二氧化碳通入次氯酸钙溶液中:
11.氯气通入氢硫酸中:
离子方程式
12.氯气通入亚硫酸钠溶液中:
离子方程式:
13.氯气通入碘化钾溶液中:
离子方程式:
14.氯气通入碘化钾溶液中:
离子方程式:
15.将二氧化硫通入氯水中:离Βιβλιοθήκη 方程式:16.次氯酸见光分解:
氯及其化合物方程式汇总
氯及其化合物方程式汇总1、钠与氯气的反应方程式2、铜与氯气的反应方程式3、铁与氯气的反应方程式4、氢气与氯气反应的化学方程式5、实验室制取氯气反应的离子方程式6、电解饱和食盐水离子方程式7、电解氯化钠8、氯气和水反应的离子方程式9、氯气和氢氧化钙溶液反应的离子方程式10、氯气和氢氧化钠溶液反应的离子方程式11、次氯酸的分解方程式13、氯气与亚硫酸钠溶液反应的离子方程式14、二氧化硫与氯气反应的离子方程式15、氯气与溴化钾溶液的反应方程式16、氯气与碘化钾溶液反应的离子方程式17、溴单质与碘化钾溶液的反应方程式18、氯化铁溶液与碘化钾溶液的反应离子方程式19、磷在少量氯气中的燃烧方程式20、磷在过量氯气中的燃烧方程式其他元素化合物的反应方程式抽测1、钠与水反应的离子方程式2、过氧化钠与水的反应方程式3、铝与氢氧化钠溶液的反应方程式4、铝热反应5、氢氧化铝与氢氧化钠溶液的反应方程式6、硫酸铝与过量氨水反应的离子方程式7、氯化铝与氢氧化钠溶液的反应离子方程式8、氢氧化钙溶液与少量二氧化碳的反应9、氢氧化钙溶液与过量二氧化碳的反应10、镁与二氧化碳的反应11、铁与水蒸气的反应12、铁与过量稀硝酸的反应13、氯化铁溶液与铁反应的离子方程式14、制备氢氧化铁胶体离子方程式15、氯化铁溶液与硫氰化钾溶液反应的离子方程式16、氯化亚铁溶液与氯气的反应方程式17、氢氧化亚铁与氧气的反应方程式18、水煤气的制取方程式19、碳酸氢钙溶液与足量的氢氧化钠溶液反应的离子方程式20、碳酸氢钠的分解21、二氧化硅与氟化氢的反应方程式22、二氧化硅与碳的反应方程式23、二氧化硅与氢氧化钠溶液的反应方程式24、硅酸钠溶液与二氧化碳的反应25、铜与稀硝酸反应的离子方程式26、铜与浓硝酸反应的离子方程式27、偏铝酸钠与盐酸溶液的反应方程式28、氯化铝溶液与碳酸氢钠溶液反应的离子方程式29、碳与浓硝酸溶液的反应方程式30、二氧化硅与氧化钙的反应方程式。
