吸收与解吸课件
(完整版)二氧化碳吸收与解吸实验

二氧化碳汲取与解吸实验一、实验目的1.认识填料汲取塔的构造、性能和特色,练习并掌握填料塔操作方法;经过实验测定数据的办理解析,加深对填料塔流体力学性能基本理论的理解,加深对填料塔传质性能理论的理解。
2.掌握填料汲取塔传质能力和传质效率的测定方法,练习实验数据的办理解析。
二、实验内容1.测定填料层压强降与操作气速的关系,确立在必定液体喷淋量下的液泛气速。
2.固定液相流量和入塔混淆气二氧化碳的浓度,在液泛速度下,取两个相差较大的气相流量,分别丈量塔的传质能力(传质单元数和回收率)和传质效率(传质单元高度和体积汲取总系数)。
3.进行纯水汲取二氧化碳、空气解吸水中二氧化碳的操作练习,同时测定填料塔液侧传质膜系数和总传质系数。
三、实验原理:气体经过填料层的压强降:压强降是塔设计中的重要参数,气体经过填料层压强降的大小决定了塔的动力耗费。
压强降与气、液流量均相关,不同样样液体喷淋量下填料层的压强降 P 与气速u的关系如图一所示:L 3> L 2> L 1aPk,P32L 0 = 01u , m/s图一填料层的P ~u关系当液体喷淋量 L00 时,干填料的P ~u的关系是直线,如图中的直线0。
当有必定的喷淋量时,P ~u的关系变为折线,并存在两个转折点,下转折点称为“载点”,上转折点称为“泛点”。
这两个转折点将P ~u关系分为三个区段:既恒持液量区、载液区及液泛区。
传质性能:汲取系数是决定汲取过程速率高低的重要参数,实验测定可获得汲取系数。
关于同样的物系及必定的设施(填料种类与尺寸),汲取系数跟着操作条件及气液接触状况的不同样样而变化。
1.二氧化碳汲取 - 解吸实验依据双膜模型的基本假定,气侧和液侧的汲取质 A 的传质速率方程可分别表达为气膜G A k g A( p A p Ai ) ( 1)液膜G A k l A(C Ai C A ) (2)式中: G A—A组分的传质速率, kmoI s 1;2A —两相接触面积, m;P A—气侧A组分的均匀分压,Pa;P Ai—相界面上A组分的均匀分压,Pa;C A—液侧A组分的均匀浓度, kmol m 3C Ai—相界面上A组分的浓度kmol m 3k g—以分压表达推进力的气侧传质膜系数,kmol m 2s 1Pa 1;k l—以物质的量浓度表达推进力的液侧传质膜系数,m s 1。
化工单元操作吸收与解析
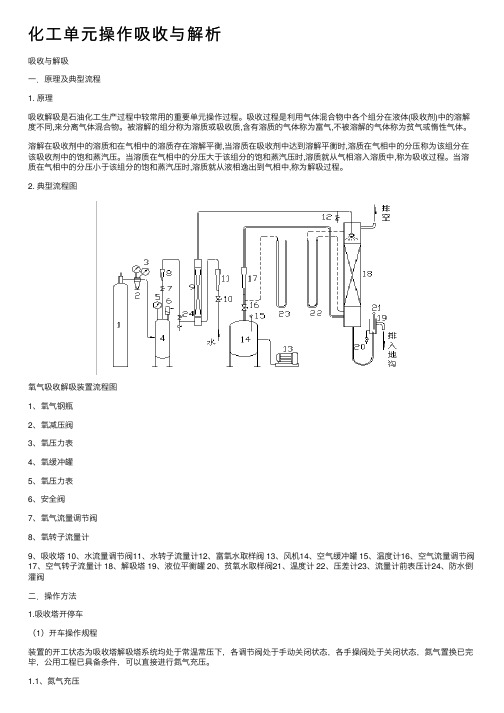
化⼯单元操作吸收与解析吸收与解吸⼀.原理及典型流程1. 原理吸收解吸是⽯油化⼯⽣产过程中较常⽤的重要单元操作过程。
吸收过程是利⽤⽓体混合物中各个组分在液体(吸收剂)中的溶解度不同,来分离⽓体混合物。
被溶解的组分称为溶质或吸收质,含有溶质的⽓体称为富⽓,不被溶解的⽓体称为贫⽓或惰性⽓体。
溶解在吸收剂中的溶质和在⽓相中的溶质存在溶解平衡,当溶质在吸收剂中达到溶解平衡时,溶质在⽓相中的分压称为该组分在该吸收剂中的饱和蒸汽压。
当溶质在⽓相中的分压⼤于该组分的饱和蒸汽压时,溶质就从⽓相溶⼊溶质中,称为吸收过程。
当溶质在⽓相中的分压⼩于该组分的饱和蒸汽压时,溶质就从液相逸出到⽓相中,称为解吸过程。
2. 典型流程图氧⽓吸收解吸装置流程图1、氧⽓钢瓶2、氧减压阀3、氧压⼒表4、氧缓冲罐5、氧压⼒表6、安全阀7、氧⽓流量调节阀8、氧转⼦流量计9、吸收塔 10、⽔流量调节阀11、⽔转⼦流量计12、富氧⽔取样阀 13、风机14、空⽓缓冲罐 15、温度计16、空⽓流量调节阀17、空⽓转⼦流量计 18、解吸塔 19、液位平衡罐 20、贫氧⽔取样阀21、温度计 22、压差计23、流量计前表压计24、防⽔倒灌阀⼆.操作⽅法1.吸收塔开停车(1)开车操作规程装置的开⼯状态为吸收塔解吸塔系统均处于常温常压下,各调节阀处于⼿动关闭状态,各⼿操阀处于关闭状态,氮⽓置换已完毕,公⽤⼯程已具备条件,可以直接进⾏氮⽓充压。
1.1、氮⽓充压(1)确认所有⼿阀处于关状态。
(2)氮⽓充压①打开氮⽓充压阀,给吸收塔系统充压。
②当吸收塔系统压⼒升⾄1.0Mpa(g)左右时,关闭N2充压阀。
③打开氮⽓充压阀,给解吸塔系统充压。
④当吸收塔系统压⼒升⾄0.5Mpa(g)左右时,关闭N2充压阀。
1.2、进吸收油(1)确认①系统充压已结束。
②所有⼿阀处于关状态。
(2)吸收塔系统进吸收油①打开引油阀V9⾄开度50%左右,给C6油贮罐D-101充C6 油⾄液位70%。
吸收与解吸实验

吸收与解吸实验一、实验目的及任务:1、熟悉填料塔的构造与操作。
2、观察填料塔流体力学状况,测定压降与气速的关系曲线。
3、掌握总传质系数K x a的测定方法并分析影响因素。
4、学习气液连续接触式填料塔,利用传质速率方程处理传质问题的方法。
二、基本原理:本装置先用吸收柱将水吸收纯氧形成富氧水后(并流操作),送入解吸塔顶再用空气进行解吸,实验需测定不同液量和气量下的解吸总传质系数K x a,并进行关联,得到K x a=AL a·V b的关联式,同时对四种不同填料的传质效果及流体力学性能进行比较。
本实验引入了计算机在线数据采集技术,加快了数据记录与处理的速度。
1、填料塔流体力学特性:气体通过干填料层时,流体流动引起的压降和湍流流动引起的压降规律相一致。
在双对数坐标系中,此压降对气速作图可得一斜率为1.8~2的直线(图中aa线)。
当有喷淋量时,在低气速下(c点以前)压降也正比于气速的 1.8~2次幂,但大于同一气速下干填料的压降(图中bc段)。
随气速的增加,出现载点(图图1 填料层压降–空1中c点),持液量开始增大,压降气速线向上弯,斜率变陡(图中cd到液泛点(图中d点)后,在几乎不变的气速下,压降急剧上升。
2、传质实验:填料塔与板式塔气液两相接触情况不同。
在填料塔中,两相传质主要是在填料有效湿表面上进行,需要计算完成一定吸收任务所需填料高度,其计算方法有:传质系数法、传质单元法和等板高度法。
本实验是对富氧水进行解吸。
由于富氧水浓度很小,可认为气液两相的平衡关系服从亨利定律,即平衡线为直线,操作线也是直线,因此可以用对数平均浓度差计算填料层传质平均推动力。
整理得到相应的传质速率方式为:m p x A x V a K G ∆∙∙=m p A x x V G a K ∆∙=其中 22112211ln )()(e e e e m x x x x x x x x x -----=∆()21x x L G A -= Ω∙=Z V p相关的填料层高度的基本计算式为:OL OL x x e x N H xx dx a K L Z ∙=-Ω∙=⎰12 即 OL OL N Z H /=其中 m x x e OL x x x x x dx N ∆-=-=⎰2112 , Ω∙=a K L H x OL式中:G A —单位时间内氧的解吸量[Kmol/h] K x a —总体积传质系数[Kmol/m 3•h •Δx]V P —填料层体积[m 3]Δx m —液相对数平均浓度差x 1 —液相进塔时的摩尔分率(塔顶)x e1 —与出塔气相y 1平衡的液相摩尔分率(塔顶) x 2 —液相出塔的摩尔分率(塔底)x e2 —与进塔气相y2平衡的液相摩尔分率(塔底)Z—填料层高度[m]Ω—塔截面积[m2]L—解吸液流量[Kmol/h]H OL—以液相为推动力的传质单元高度N OL—以液相为推动力的传质单元数由于氧气为难溶气体,在水中的溶解度很小,因此传质阻力几乎全部集中于液膜中,即K x=k x, 由于属液膜控制过程,所以要提高总传质系数K x a,应增大液相的湍动程度。
环境工程原理第八章吸附ppt课件

第二节 吸附剂
(2)降低压力
压力高,吸附进行得快,
脱附进行得慢。当压力降低时,脱附现象开始显著。所以操作压力
降低后,被吸附的物质就会脱离吸附剂表面返回气相。有时为了脱
附彻底,甚至采用抽真空的办法。
这种改变压力的再生操作,在变压吸附中广为应用。如吸附
分离高纯度氢,先是在 1.37~4.12 MPa压力下吸附,然后在常压
一、吸附分离操作的分类
• 按作用力性质分类:分物理吸附和化学吸附 • 物理吸附:吸附质分子与吸附剂表面分子间存在的范德华力
所引起的,也称为范德华吸附。 • 吸附热较小(放热过程,吸附热在数值上与冷凝热相当),
可在低温下进行; • 过程是可逆的,易解吸; • 相对没有选择性,可吸附多种吸附质; • 分子量越大,分子引力越大,吸附量越大; • 可形成单分子吸附层或多分子吸附层 。
下脱附,从而可得到高纯度氢,吸附剂也得到再生。
变压吸附 ——根据系统操作压力变化不同,变压吸附循环可
以是常压吸附、真空解吸,加压吸附、常压解吸,加压吸附、真空
解吸等几种方法。
第二节 吸附剂
(3) 通气吹扫 通入吸附剂床层,进行吹扫,以降低吸附剂上的吸附质分 压,从而达到脱附。当吹扫气的量一定时,脱附物质的量 取决于该操作温度和总压下的平衡关系。
第二节 吸附剂
四、吸附剂选择的影响因素
如何选择适宜的吸附剂? ——需要根据被分离对象、分离条件和吸附剂本身的特点 确定 ——需要进行试验研究
第二节 吸附剂
(1)将超细活性炭微粒加入增稠剂后与纤维混纺制成单丝, 或用热熔法将活性炭粘附于有机纤维或玻璃纤维上,也可 以与纸浆混粘制成活性炭纸。
(2)以人造丝或合成纤维为原料,与制备活性炭一样经过炭 化和活化两个阶段,加工成具有一定比表面积和一定孔分 布结构的活性炭纤维。
第四章 吸收及吸附.

•
Ldx B ' GdYA rA adH b
' —宏观反应速度 A
15
• 其中 r
• b—B的反应系数与A的反应系数之比。
Ldx B ' GdYA rA adH b
16
当处理稀溶液时,Pt≈Pu CT≈CU 可得到微分物料平
衡方程
G L dpA — dcA B pt bCT
相,汽→液;液相中的轻组分汽化进入汽相,液→汽; 成立恒摩尔流的假设,使计算过程简化。 而吸收只是气相中的某些组分溶解到不挥发的吸收剂中 去的单相传质过程。一般沿塔从上往下,气体量、液 体量增加。∴除了贫气吸收(吸收质量很小)外不能
传质过程往两个方向进行。如果各组分的ΔHv 相近时,
视为恒摩尔流。
28
塔顶:
塔底:
气相传质控制
21
塔顶: 塔底:
液膜传质控制
22
塔顶: 塔底:
23
化学吸收 • 结论:
• 1.
k AG apA k B1aCB
气相反应速率较慢,由较慢的控制。
• 2.
k AG apA k B1aC B
反应在液相内进行,为液相控制。 化学吸收可以大大降低塔的高度,
而物理吸收塔过高,不能够实现。
4
分类
吸收剂与溶质之间相互作用不同,可分为
物理吸收:吸收过程纯属气体的溶解过程。
a 单组分吸收:
b 多组分吸收:
吸收过程有无热效应,可分为
等温吸收:贫气吸收(吸收微量气体)
非等温吸收:吸收量大时,一般放热,产生吸收热,T↗;
5
吸收过程的气液相平衡关系
气体在液体中的溶解度
气体吸收涉及到相际传质过程。
气体吸收

5.1 概述
2、传质
气体吸收是传质分离过程。 前面提到的传质分离过程中,
重点是要讲述平衡分离过程, 是组分在两相间的分配不同 (平衡)来实现分离。 气体吸收过程包含有组分从一 相到另一相的转移。 过程的推动力为:浓度差C
二. 物理吸收和化学吸收
物理吸收 定义: 溶质气体溶于液相中不发生显著化学 反应的吸收过程,称之为~ 例如: CO2 + H2O= H2 CO3 HCl(g)+H2O = HCl(L) 丙酮(g)+H2O=丙酮(L) 化学吸收 定义: 液相中有某种组分,能够与溶质气体 (溶解于L)进行化学反应的吸收过程,促进 了吸收过程的进行速率; 例如:Na2 CO3 (K2CO3) +CO2 + H2O = Na2HCO3 ( KHCO3 )
X1、X2——分别为吸收塔的塔底和塔顶的液相比摩尔分率; φA——混合气体中溶质A被吸收的百分率,称为吸收率或回收率
现取塔内任一截面m-n与塔底(图中的虚线范围)作溶质
的物料衡算, 即:
V(Y1 - Y) = L(X1 - X)
L L Y X (Y1 X 1 ) V V
同理,可得
L L Y X (Y2 X 2 ) V V
NA=ky(y-yi) ky=PkG NA=kX(xi -X) kX=CkL
NA=Ky(y-ye) Ky=PKG Ky=1/(1/ky+m/kX) 气膜控制时Ky=ky
液膜
NA=kL(Ci-C)
NA=KG(P-Pe)
KG=1/(1/kG+1/HkL)
气相
气膜控制 KG=kG NA=KL(Ce -C)
一、亨利定律
5.2
气液相平衡
当总压不高(<5×105Pa)时,在一定温度下,稀溶液上方 溶质的平衡分压与其在液相中的浓度之间存在着如下的关系:
(完整版)二氧化碳吸收与解吸实验.doc

二氧化碳吸收与解吸实验一、实验目的1.了解填料吸收塔的结构、性能和特点,练习并掌握填料塔操作方法;通过实验测定数据的处理分析,加深对填料塔流体力学性能基本理论的理解,加深对填料塔传质性能理论的理解。
2.掌握填料吸收塔传质能力和传质效率的测定方法,练习实验数据的处理分析。
二、实验内容1.测定填料层压强降与操作气速的关系,确定在一定液体喷淋量下的液泛气速。
2.固定液相流量和入塔混合气二氧化碳的浓度,在液泛速度下,取两个相差较大的气相流量,分别测量塔的传质能力(传质单元数和回收率)和传质效率(传质单元高度和体积吸收总系数)。
3.进行纯水吸收二氧化碳、空气解吸水中二氧化碳的操作练习,同时测定填料塔液侧传质膜系数和总传质系数。
三、实验原理:气体通过填料层的压强降:压强降是塔设计中的重要参数,气体通过填料层压强降的大小决定了塔的动力消耗。
压强降与气、液流量均有关,不同液体喷淋量下填料层的压强降 P 与气速u的关系如图一所示:L 3> L 2> L 1aPk,P32L 0 = 01u , m/s图一填料层的P ~u关系当液体喷淋量 L00 时,干填料的P ~u的关系是直线,如图中的直线0。
当有一定的喷淋量时,P ~u的关系变成折线,并存在两个转折点,下转折点称为“载点”,上转折点称为“泛点”。
这两个转折点将P ~u关系分为三个区段:既恒持液量区、载液区及液泛区。
传质性能:吸收系数是决定吸收过程速率高低的重要参数,实验测定可获取吸收系数。
对于相同的物系及一定的设备(填料类型与尺寸),吸收系数随着操作条件及气液接触状况的不同而变化。
1.二氧化碳吸收 - 解吸实验根据双膜模型的基本假设,气侧和液侧的吸收质 A 的传质速率方程可分别表达为气膜G A k g A( p A p Ai ) ( 1)液膜G A k l A(C Ai C A ) (2)式中: G A—A组分的传质速率, kmoI s 1;2A —两相接触面积, m;P A—气侧A组分的平均分压,Pa;P Ai—相界面上A组分的平均分压,Pa;C A—液侧A组分的平均浓度, kmol m 3C Ai—相界面上A组分的浓度kmol m 3k g—以分压表达推动力的气侧传质膜系数,kmol m 2s 1Pa 1;k l—以物质的量浓度表达推动力的液侧传质膜系数,m s 1。
吸收解吸

一、实训目的1.认识吸收解吸设备结构2.认识吸收解吸装置流程及仪表3.掌握吸收解吸装置的运行操作技能4.学会常见异常现象的判别及处理方法二、吸收与解吸实训装置功能:1开车前准备和正常开停车实训任务1.1工艺文件准备能识记吸收、解吸生产过程工艺文件(能识读吸收岗位的工艺流程图、实训设备示意图、实训设备的平面和立面布置图,能绘制工艺配管简图,能识读仪表联锁图。
熟悉吸收塔、解吸塔、填料及附属设备等主要设备的结构和布置)。
1.1.1吸收与解吸基本原理气体吸收是典型的化工单元操作过程,其原理是根据气体混合物中各组分在选定液体吸收剂中物理溶解度或化学反应活性的不同而实现气体组分分离的传质单元操作。
前者称物理吸收,后者称化学吸收。
吸收操作所用的液体溶剂称为吸收剂,以S表示;混合气体中,能够显著溶解于吸收剂的组分称为吸收物质或溶质,以A表示;而几乎不被溶解的组分统称为惰性组分或载体,以B表示。
吸收操作所得的溶液称为吸收液或溶液,它是溶质A在溶剂S中的溶液;被吸收后排除出的气体称为吸收尾气,其主要成分为惰性气体B,但仍含有少量未被吸收的溶质A。
吸收操作在石油化工、天然气化工以及环境工程中有极其广泛的应用,按工程目的可归纳为:①净化原料气或精制气体产品;②分离气体混合物以获得需要的目的组分;③制取气体溶液作为产品或中间产品;④治理有害气体的污染、保护环境。
与吸收相反的过程,即溶质从液相中分离出来而转移到气相的过程(用惰性气体吹扫溶液或将溶液加热或将其送入减压容器中使溶质放出),称为解吸或提馏。
吸收与解吸的区别仅仅是过程中物质传递的方向相反,它们所依据的原理一样。
⑴. 气体在液体中的溶解度,即气-液平衡关系在一定条件(系统的温度和总压力)下,混合气中某溶质组分的分压若一定,则与之密切接触而达到平衡的溶液中,该溶质的浓度也为一定,反之亦然。
对气相中的溶质来说,液相中的浓度是它的溶解度;对液相中的溶质来说,气相分压是它的平衡蒸汽压。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、基本知识
• (2)减压解吸 若吸收采用加压吸收,解吸可采用减压解吸,
使溶质气体从吸收剂中解吸出来。溶质气体被解 吸的程度取决于最终解吸压力和温度。 • (3)加热解吸
当溶质气体在吸收剂中的溶解度随温度的升高 而降低较大时,可采用加热解吸。 • (4)加热-减压解吸
将吸收液加热升温解吸之后再举行减压解吸, 加热解吸和减压解吸的结合,能显著提高溶质气 体被解吸的程度。
对于给定物系,亨利系数E随温度升高而增大。 在同一溶剂中,易溶气体的E值很小,而难溶气体的 E值很大。常见物系的亨利系数可从手册中查到。
• 5、吸收机理——双膜理论
根据双膜理论,吸收过程的机理如下: • (1)吸收质从气相主体以对流扩散的方式到达气膜
边界, • (2)到达气膜边界吸收质以分子扩散的方式穿过气
一、实训目的
• (1)了解吸收解吸操作基本原理和基本工艺流程 、了解填料塔等主要设备的结构特点、工作原理 和性能参数、了解流量、压力、温度等工艺参数 的测量原理和操作方法。
• (2)能够根据工艺要求进行吸收、解吸生产装置 的间歇或连续操作;能够在操作进行中熟练调控 各个参数,保证生产维持在工艺条件下正常进行 。能实现手动和自动无扰切换操作。能熟练操控 DCS控制系统。
三、基本知识
• 气相和液相达到动态平衡,此时,液相中溶质的浓 度达到最大值。气液平衡时,溶质在液相中的含量
称为气体在液相的平衡溶解度,简称溶解度。气液
平衡时,溶液上方溶质的分压称为平衡分压。
• 4、亨利定律
•
当气、液相处于平衡状态时,溶质气体在两相
中的浓度存在着一定的分布关系,这种关系可以用
亨利定律来表明。
的大小决定了塔的动力消耗。压强降与气、液流量有关 ,不同液体喷淋量下填料层的压强降与气速的关系如图
• 当无液体喷淋即喷淋量 时,干填料的ΔP ~u的关系是 直线,如图中的直线L0。L0 当 0 有一定的喷淋量时, ΔP ~u的关 系变成折线,并存在两个转折点,下转折点称为“载点 ”,上转折点称为“泛点”。这两个转折点将ΔP ~u关 系分为三个区段:恒持液量区、载液区与液泛区。
用,节约操作费用。
三、基本知识
• (1)汽提解吸 • 汽提解吸采用的载气是不含溶质的惰性气体或溶
剂蒸气,提供与吸收液相成平衡的气相,将溶质从 吸收液中吹出。
• 吸收液解吸了大部分被吸收的气体后,为了使气 体进一步解吸完全,有时向解吸塔中通入水蒸气 、空气等气体,降低液面上溶质气体的分压,使 吸收液中溶质气体更完全的解吸出来。这一过程 称为汽提,所用的水蒸气、空气等气体称为汽提 气。
三、基ቤተ መጻሕፍቲ ባይዱ知识
3、相组成的表示方法 吸收是溶质由气相转移到液相的传质过程。随
着吸收过程的进行,组分在气相和液相中的浓度 均发生变化,为了研究吸收过程的基本原理,首 先应掌握物质在气相或液相中浓度的表示方法。 用x(X)表示液相组成,用y(Y)气相组成。 4、平衡溶解度
在一定的温度和压力下,气体和液体两相接触 时,气体中的溶质组分便溶解在液相中,随着吸 收过程的进行,溶质气体在液相中的浓度逐渐增 加;同时,溶解在液相中的气体也不断地返回到 气相中去。在操作初期,过程以吸收为主,但经 过一定时间,溶质从气相进入液相和从液相返回 气相的速率相等,气液两相的组成亦不再变化,
贫气 贫液
富气
富液
三、基本知识
2.解吸:从吸收液中分离岀已被吸收的气体吸收质 的操作称为解吸。 解吸方法:
(1)汽提 (2)减压 (3)加热 (4)加热减压
工程上很少采用单一的解吸方法,往往是先升温 再减压至常压,最后采用汽提法解吸。 显然,解吸与吸收是相反的过程
三、基本知识
生产中解吸的作用有两个: 一个是把吸收液中吸收的气体重新释放出来 ,获得高纯度的吸收质气体; 另一个是使吸收液释放了被吸收的气体,使 吸收剂重新具有吸收作用,再返回吸收塔循环使
• 计算公式为: =Y1-Y2/Y1
• 式分中率:。Y1----表示入塔气体中可吸收组分(CO2)的摩尔
• Y2--表示出塔气体中可吸收组分(CO2)的摩尔分率。
三、基本知识
• 1.吸收:利用气体混合物各组分在液体中溶解度 的差异,用液体吸收剂分离气体混合物的单元操 作。
• 吸收所用的液体称为吸收剂或(贫液)溶剂,气 体混合物(富气)中被吸收的组分称为吸收质或 溶质,不被吸收的组分称为惰性气体(贫气), 吸收后得到的液体称为吸收液(富液)或溶液。
• (3)能根据异常现象分析判断故障种类、产生原 因并排除处理。
• (4)能够完成吸收过程和解吸过程的性能测定。
二、实训的基本原理
• (1)气体吸收是典型的传质过程之一。由于二氧化 碳气体无味、无毒、廉价,所以选择二氧化碳作为 溶质组分,本实训装置采用水吸收二氧化碳组分。 二氧化碳在水中溶解度很小,一般预先将一定的二 氧化碳通入空气中混合,以提高空气中二氧化碳浓 度,但水中的二氧化碳含量依然很低,所以吸收的 计算方法按低浓度处理,此体系吸收过程属液膜控 制。
• (4)传质性能:
•
吸收系数是决定吸收过程速率高低的重要参数,实
验测定是获取吸收系数的根本途径。对于相同的物系及
一定的设备(填料类型与尺寸),吸收系数随着操作条
件及气液接触状况的不同而变化。
•
吸收率是测定吸收操作好坏的一个主要指标,他
表示已被吸收的容质量与气相中与原有的容质量的比,
吸收率越大吸收越完全,气体的净化度越高。
•
在一定温度和总压不超过506.5kpa的情况下,
多数气体溶解后形成的溶液为稀溶液,气液平衡时
,溶质在液相中的溶解度与其在气相中的平衡分压
成正比,这一规律称为亨利定律。
• 亨利定律用数学表达式为
p*=Ex 式中 p*——溶质在气相中的平衡分压,Pa; x—溶质在液相中的摩尔分率; E—亨利系数,Pa。
• (2)解吸或称脱吸是吸收的逆过程,其传质方向与 吸收相反,溶质由液相向气相传递,其目的是为了 分离吸收后的溶液,使溶液再生并得到回收后的溶 质。
• (3)气体通过填料层的压强降:
•
ΔP , kPa
L3>L2>L1 L0=0
•
• • 图填料层的 ΔP ~u关系
3 21 0
u , m/s
• 压强降是塔设计中的重要参数,气体通过填料层压强降
