物质的量PPT下载优秀课件1
课件《物质的量》PPT_完美课件_人教版1

溶液体积
nB: mol V: L
CB: mol/L
第4 页
溶质不是1mol
× 例 判断下列说法是否正确:
1、将1gNaCl溶于水制不成是11LL溶溶液液,则c=1mol/L
2、将1molNaCl溶于1L水中,则c=1mol/L
×
3 、 若从1L 1 mol/L的NaOH溶液中取出20mL,则取出的NaOH溶液
课堂感悟
课堂巩固 1 、 300mL 某 浓 度 的 NaOH 溶 液 中 含 有 60g 溶 质 。 现 要 配 制 1 mol/L
NaOH溶液,应取原溶液与蒸馏水的体积比约为( A ) A. 1∶4 B. 1∶5 C. 2∶1 D. 2∶3 c(NaOH) = (60g÷40g·mol-1)÷0.3 = 5mol·L-1
个数 5mol·L-1×300mL = 1mol·L-1×(300mL+V水)
若由液体配制溶液所需主要仪器
第6 页
二、溶液中微粒的物质的量浓度
第7 页
[练习] 下列各溶液中 1、0.8L 0.4mol/L的NaOH溶液中C(Na+) 2、2L 0.15mol/L的Na3PO4溶液中C(Na+) 3、0.1mol/L Al2(SO4)3中Al3+的物质的量浓度为 4、已知2LAl2(SO4)3溶液中,Al3+为9.03x1023个,则SO42-的物质 的量浓度为
④读数时 ,应平视,使溶液的凹液面正好与刻度相切;不能 作反应容器,不能长期存放溶液,只能用作配制的量具。移 动容量瓶,应手握刻度线以上部分。
三、物质的量在化学实验中的应用
[随堂练习]
容量瓶需标有:
(1)温度
(2)浓度
(3)容积
《物质的量》精品ppt人教

•
1.情节是叙事性文学作品内容构成的 要素之 一,是叙 事作品 中表现 人物之 间相互 关系的 一系列 生活事 件的发 展过程 。
•
2.它由一系列展示人物性格,反映人物 与人物 、人物 与环境 之间相 互关系 的具体 事件构 成。
•
3.把握好故事情节,是欣赏小说的基础,也是整 体感知 小说的 起点。 命题者 在为小 说命题 时,也必 定以情 节为出 发点,从整体 上设置 理解小 说内容 的试题 。通常 从情节 梳理、 情节作 用两方 面设题 考查。
3)95gMgCl2配成500mL溶液,其物质 的量浓度___2___mol/L
4) 200 mL、2 mol/L的Al2(SO4)3溶液中,
Al3+的物质的量浓度为 4 mol/L, SO4 2-物质的量浓度为 6 mol/,L
含Al3+ 的物质的量为 0.8 m,ol
课堂练习三 选择题
1.下列关于0.2mol/LBa(NO3)2溶液正确的说法是
⑧装瓶
容量瓶中不能存放溶液,因此要把配 制好的溶液转移到试剂瓶中,贴好标签, 注明溶液的名称和浓度。
溶液配制步骤:
• 1、计算 • 3、溶解 • 5、转移、洗涤 • 7、摇匀
2、称量 4、冷却 6、定容 8、装瓶、贴标签
课堂练习一 判断题
1)将1molNaCl溶于1L水中,则
x c( NaCl )= 1mol/L ( )
1.体积是指溶液的体积 ,并非溶剂
的体积。
2.从某已知物质的量浓度的溶液中取 出任意体积的溶液, 其物质的量浓
度都相同。(溶液是均一的)
实
实
验
验
仪
步
器
骤
探一探:
物质的量在化学实验中的应用
2.3物质的量 课件(共32张ppt)化学人教版(2023)必修第一册

2.3物质的量课件(共32张ppt)化学人教版(2023)必修第一册(共32张PPT)第二章海水中的重要元素—钠和氯第三节物质的量第三节物质的量怎样才能科学又方便的快速计数呢?水是由水分子构成的,一滴水(约0.05mL)大约含有17万亿亿个水分子,如果一个个去数,即使分秒不停,一个人一生也无法完成这项工作,怎样才能既科学又方便地知道一定量的水中含有多少水分子呢?找到计数原子或分子的方法1包150抽1打12只1包500张找到计数原子或分子的方法能这样数微粒的前提?微粒完全相同要规定每一堆的基准思考要规定:选多少为“一堆”“很大很大”的数目为一堆!大到什么程度才合理?由微观进入宏观要规定:选多少为“一堆”?“很大很大”的数目为一堆!要可称量!一堆H原子一堆O原子一堆C原子一堆Na原子一堆Mg原子一样重吗?谁重谁轻?一堆原子相对原子质量:以任一原子质量与12C原子质量的1/12的比值,即为该原子的相对原子质量。
相对原子质量不是原子真实质量H 1C 12O 16Na 23Mg 24但反映了原子质量的相对大小一堆H原子一堆O原子一堆C原子一堆Na原子一堆Mg原子一堆原子1g12g16g23g24g可称标准就规定这么一大堆,够了。
这样,1堆原子的质量和相对原子质量共用一套数据!选多少为“一堆”?“很大很大”的数目为一堆!要可称量!0.012kg12C中所含的碳原子数1摩尔(mol)物理量单位个数个摩(mol)物质的量(n)第三节物质的量1、物质的量——表示含有一定数目粒子的集合体符号:n单位:摩尔(mol),简称摩国际单位制(SI)的7个基本单位第三节物质的量选多少为“一堆”?“很大很大”的数目为一堆!要可称量!0.012kg12C中所含的碳原子数1摩尔(mol)阿伏伽德罗常数1mol任何粒子数叫做阿伏伽德罗常数,1mol粒子集合体所含的粒子数约为6.02×1023 。
数值:6.02×1023(近似值)符号:NA阿伏加德罗阿伏伽德罗常数单位?mol-1【摩尔日】——在化学家之间流传的节日,通常在10月23 日的上午6:02到下午6:02之间庆祝。
《物质的量》演示课件-PPT【人教版】1

《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
[例题3] 1 摩尔水分子中有多少摩尔氢原子,多少摩 尔氧原子?
H2O
微粒个数 1 扩大 6.02 ×1023
物质的量 1 mol
2H
2 2 × 6.02 ×1023
化零散为整体
欲测定1个原子的质量,
有什么方法?
?
先测出 N个原子的总质量m总
子
1个原子的质量== m总/N
就是一个
就是一个庞
集合体
大的集合体
你一口气能喝 ?mL H20
17
?
如何简单地来描述粒子的多少呢?
20瓶就是1箱的基准
类似:2只(支)——1双 12个—— 1打
100年——1世纪
一一打双铅筷笔子
[例题1] 1.204×1024个O2中含有的氧分子 解:
mol ?
n(O2) = N(O2) / NA =(1.204 × 1024)/ (6.02 ×1023mol-1) = 2mol
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
(4)1mol H 的数目约为6.02×1023 (√ )
(5)1mol H2 的数目约为6.02×1023 ( √ ) (6)摩尔是7个基本物理量之一 ( )×
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
5、2mol CO2中含有 2 mol C和 4 mol O, 含有 1.204 1024 个CO2分子。
化学课件《物质的量》优秀ppt35 鲁科版

3.有关摩尔质量的计算
概念
理解 例1.已知一个12C原子的质量是 知识 1.99×10—23g,元素R的某种原子每个 网络 质量为2.67×10—23g,则元素R的这种
典例 原子相对原子质量为
剖析 _______1_6_______
素能
两种方法 ?
培养
课程 例2、448 mL某气体在标准状况的质量为 小结 1.28 g,求该气体的相对分子质量?
2.有关气体体积的计算
素能
培养
3.有关摩尔质量的计算
课程
小结
与我 联系
概念
理解 知识
1.有关NA的计算
网络
典例
剖析
素能 培养
课程 小结
例.1 molH2O中约含有_6_.0__2_×__1_0_2_3 个H2O、 __1_.2_0_4_×__1_0_2_4__个H、_6_._0_2_×__1_0_2_3个O、 ______2_______mol H、___1___mol O、
培养
课程 ⑵从1L1 mol/LNaCl溶液中取出10mL溶液, 小结 所取出的10mL溶液浓度为0.01mol/L?
与我 联系
概念 1.关系
理解
知识 网络
N n NA
质量
M
m
g/mol
n
典例 微粒数 物质的量 体积
剖析
素能 培养
单位:mol
Vm
V n
L/mol
物质的量浓度
课程 小结
CB
n V
87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
《物质的量》完美ppt人教1
使用物质的量注意事项:
③使用物质的量单位摩尔时必须指明 物质微粒的名称,不能笼统地称谓。 1mol氧、1mol氢就是错误的。只能说1mol 氧分子或1mol氧原子。 ④摩尔是一个巨大数量粒子的集合体,可以是整
数,也可以是小数,如可以有0.5molO2、
宏观 12 g C
32 g O2
微观 一个碳原子 一个氧分子
12 g C中含多少个碳原子?
【思考】 如何将可称量
物宏质观与肉眼看不见、难以称量的
微观 粒子
联系起来呢?
可 称
物质的量
量 物
?
肉眼看不见,
质
难以称量
怎样知道一定质量的物质里含有多少粒子?
∷∷∷∷∷∷∷∷∷∷∷∷∷∷∷∷∷∷∷∷∷∷∷∷
物质的量
伊宁市第八中学
制作:赵慧娟
阿伏加德罗常数
已知:1个12C原子的质量为1.992643×10-26千克 求:12克该碳原子所含的原子个数为多少?
解:
12×10-3千克
12克碳原子所含有的个数=
1.992643×10-26千克
阿伏加德罗常数:符号为NA ≈6.02×1023 个
此数据亦称为阿伏加德罗常数
。
4、请说出下列的含义
(1)1molH 表示1mol氢原子 (2)3molH2O 表示3mol水分子
思考:
6.02×1023个
2mol
⑴1mol O2中O2分子数约为多少个?含多少摩尔氧
原子?含多少摩尔质子? 16mol
⑵1mol NaCl含多少摩尔 氯离子?
1mol
(3) 3.01×1023.1 mol O
C.1 mol 二氧化碳
《物质的量》高中化学ppt优质课件人教版1

加 德
我们把0.012 kg C-12 中所含有的C原子个数叫做
罗 常 数
阿伏加德罗常数。用NA表示 NAN n6.02 12 03mo1 l
阿伏加德罗常数意义:单位物质的量的微粒含有的微粒个数
1 mol 有多大?
已知1粒大米的质量为2×10-5 kg,则1mol 大米的质量为?
m 6 . 0 1 2 2 个 0 3 2 1 5 k 0 / 个 g 1 . 2 1 0 1 k g 9 0 4
规定:以 0.012 kg C-12 中所含有的C原子个数作为 1mo1lmol任何物质中含有的微粒数目与0.012 kg 126C 中 所含有的C原子个数相同
1 mol 有多大?
已知1个C-12原子的质量为1.993 × 10-26
阿 伏
kg Nm m 总 C1 .90 .9 0 1 3 1 k 0 22 g k 6 g 6 .0 2 12 03
0.52_._m_含o__l6_.0,2× CO13022-3的个数Na量+ 的是N__a3_2C_.0_O1_3_×的_ 物10质23的个量是
《物质的量》高中化学ppt优质课件人 教版1
摩尔质量
微粒种类
H2SO4 Fe Na+ Si
《物质的量》高中化学ppt优质课件人 教版1
单个质量
1.628×10-25kg 9.302×10-26kg 3.821×10-26kg 4.651×10-26kg
《物质的量》高中化学ppt优质课件人 教版1
《物质的量》高中化学ppt优质课件人 教版1
物质的量
基本物理量 单位:摩尔 基准:NA
《物质的量》高中化学ppt优质课件人 教版1
本课总结
1、表示一定数目微粒的集体的物理量 2、对象为微观粒子及其特定组合
课件《物质的量》完美版_人教版1
0(33×)10单23位个:铁(m3原o)子l-11的m物质o的l 量H__2_S__O_。4中的氧原子数为_____,原子数为_____, 电子数为_____。 8g H2SO4的物质的量______ M(H2SO4)=98g·mol-1
错误,必须指明微粒的种类,是氧原子、氧分子还是氧离子
25g (3)0.25mol CaCO 的质量是_______ (2)1mol NaCl中氯离子数为_______,质子数为______。
1mol钠原子的质量为23g 正确 3mol H2O
3
M(CaCO3)=100g·mol-1
36g (4)2.0mol H O的质量_________ (4)计量对象:分子、原子、离子、中子、电子、
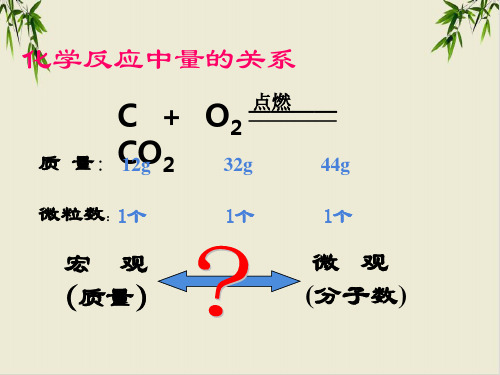
微粒数:1个 C + O2 ———— CO2
8g H2SO4的物质的量______ M(H2SO4)=98g·mol-1 204×1024个水分子的物质的量为_____,水分子个
1个
1个
数约为_____。
(2)1mol NaCl中氯离子数为_______,质子数为______。
宏 观 (3)单位:g·mol-1 或 kg·mol-1
1mol任何微粒的个数都是约为6.02×1023, 那质量呢?
质量和物质的量之间又有怎么样的联系呢?
1mol某微粒集合体中所含的微粒数与0.012kg C-12 中所含的原子数相同。
即: 1mol碳原子的质量为12g
已知:
1mol铁原子的质量为56g 1mol水分子的质量为18g 1mol硫酸分子的质量为98g 1mol钠原子的质量为23g
正确 3mol H2O
8g H2SO4的物质的量______ M(H2SO4)=98g·mol-1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4
物质
化学式:正化合价总数=|负化合价总数|
电解质溶液:所有阳离子所带正电荷总数 =所有阴离子所带负电荷总数 物料守恒
【 例2】将13.4g KBr和 KCl的混合物溶于水,配成
500mL溶液,通入过量的Cl2,反应后将溶液蒸干得到 11.18g固体,所配溶液中K+、Cl-、Br-物质的量浓度
之比为( A )
电解质溶液:所有阳离子所带负电荷总数
=所有阴离子所带负电荷总数和物料守恒
氧化
还原 反应
单一反应:氧化剂得电子总数=还原 剂失电子总数
多个连续反应:找出化合价在变化前 后真正变化的物质及所反应的量
循遵
离子反应 :等号两边离子所带电荷总数相等
电化学 阳(负)极失电子总数=阴(正)极得电子总数 反应 串联的原电池(电解池),各极上转移电子
物质的量 守恒思想
05.08.2020 1
“物质的量” 是中学化学计算的核心。而守恒法 是化学计算中应用较广的一种方法。根据守恒量的 特征, 守恒法可分为:质量守恒、原子(原子团)守 恒、电子守恒、电荷守恒等。
凡是涉及到物质的量方面的计算,一般都可找到 相应的守恒关系,在很多情况下,都可应用守恒关系 求解。
【 例5】在一定条件下,RO3x-和 F2可以发生如 下反应: RO3x- + F2+ 2OH- = RO4-+ 2F- + H2O, 从而可知在RO3x-中元素R的化合价是( B )
A. +4 B. +5 C. +6 D. +7
13
物质
化 学 变 化
化学 反应
化学式:正化合价总数=|负化合价总数|
A、3∶2∶1
B、1∶2∶3
C、1∶3∶2
D、1∶1∶1
【解析 】原混合物中,无论KBr与KCl按什么比例 混合,都有
c(K+)= c(Cl-)+ c(Br-)
即可快速得出答案为A。
物质
化 学 变 化
化学 反应
化学式:正化合价总数=|负化合价总数|
电解质溶液:所有阳离子所带正电荷总数 =所有阴离子所带负电荷总数和物料守恒
物质
化 学 变 化
化学 反应
化学式:正化合价总数=|负化合价总数|
电解质溶液:所有阳离子所带正电荷总数 =所有阴离子所带负电荷总数和物料守恒
氧化 还原
单一反应:氧化剂得电子总数=还原 剂失电子总数
反应
离子
多个连续反应:找出化合价在变化前 后真正变化的物质及所反应的量
循遵
反应 :方程式等号两边离子所带电荷总数相等
V=0.56L
故答案为B 。
物质
化学式:正化合价总数=|负化合价总数|
化 学
电解质溶液:所有阳离子所带正电荷总数 =所有阴离子所带负电荷总数和物料守恒
变 化 氧化
还原
单一反应:氧化剂得电子总数=还原 剂失电子总数
化学 反应 多个连续反应:找出化合价在变化前
反应 离子 后真正变化的物质及所反应的量
循遵
【解析】由题意知:
HNO3
NO、NO2(χ mL)
HNO3
就可发现Cu失去的电子总数等于O2得到的电子总数,
即: n(Cu)×2 = n(O2)×4 n(O2)=(1.92g/64g·mol-1)×1/2 =0.015 mol V(O2)= 0.015 mol×22.4 L·mol-1=0.336 L
x、y、z为化学计量数即系数):
4C3H5(ONO2)3→wN2+xCO2+yH2O+zO2 科学实验证明,相同条件(温度、压力)下,相同
数相等
【 例6】用石墨电解Cu(NO3)2溶液,通电一段 时间后,在阴极析出3.2g金属铜,则阳极析出气 体(B) A. 11.2L B. 0.56L C. 0.28L D. 1.12L
【 解析 】 因电解过程中阴、阳两极得失电子总数 相等,则有:
3.2g/64g·mol-1×2=V/22.4L·mol-1 ×4
物质 化学式 :正化合价总数=|负化合价总数| 电解质溶液
3
【 例1 】碘元素有多种价态,可以形成多种含氧阴离 子IxOyn—。由2个IO65—正八面体共用一个面形成的
IxOyn—的化学式为( A )
A.I2O94—
B.I2O106—
C.I2O118—
D.I2O1210—
【解析 】2个IO65—正八面体共用面为三角形, 减去三个O即为I2O94—
反应 多个连续反应:
找出化合价在反应前后真正变
循遵投入到一定量的浓硝酸中,随着 反应的进行,生成气体的颜色逐渐变浅,当铜完全溶 解后,共收集到χmL气体(标准状况)。将盛有该气 体的容器倒立于水中,欲使容器内气体恰好完全溶解 于水,试求需通入氧气的体积(标准状况)?
氧化 单一反应 :氧化剂得电子总数
还原
=还原剂失电子总数
反应 多个连续反应
【 例3 】将XmolNa2SO3和YmolNa2S溶于水中,用 硫酸酸化后:(1) 若生成S和SO2 (2)若生成S和 H2S (3 )若只生成S, 则X/Y依次为( )
A、大于1/2,等于1/2,小于1/2 B、大于1/2,小于1/2,等于1/2 C、等于1/2,大于1/2,小于1/2
当 X/Y小于1/2时,Na2S过量,则除了生成S外,Na2S 和H2SO4反应还生成H2S。因而答案为B 。
物质
化 学 变 化
化学 反应
化学式:正化合价总数=|负化合价总数|
电解质溶液:所有阳离子所带正电荷总数 =所有阴离子所带负电荷总数和物料守恒
氧化 还原
单一反应:氧化剂得电子总数 =还原剂失电子总数
表 反应 :方程式等号两边离子所带电荷总数相等
现 形 电化学 式 反应
阳(负)极失电子总数=阴(正)极得电子总数
串联的原电池(电解池),各极上转移电子 数相等
化学反应 质量守 宏观:m(反应物)=m(生成物)
方程式 恒定律 微观:元素种类不变,各元素
原子个数守恒
【 例7】三硝酸甘油酯[C3H5(ONO2)3]是一种炸药,可 因撞击而爆炸,产生高温。爆炸按下式进行(式中w、
【解析 】 首先利用电子守恒找出恰好反应的配比量, 然后判断哪种物质过量,最后判断生成什么物质。
Na2SO3 --------S∣得4e- ×1 Na2S --------S∣失2e- ×2 即可得关系式 Na2SO3------2Na2S-----3S 当 X/Y=1/2时,只生成S 。
当 X/Y大于1/2时,Na2SO3过量,则除了生成S外, Na2SO3与H2SO4反应还生成SO2 。
