原核蛋白表达与纯化
原核表达和蛋白纯化流程

原核表达和蛋白纯化流程As scientists, we often encounter the challenge of expressing and purifying proteins in prokaryotic cells. Often, the first step in this process is to select an appropriate expression system. 做为科学家,我们经常面临的挑战是在原核细胞中表达和纯化蛋白质。
在这个过程中,通常的第一步是选择一个合适的表达系统。
One commonly used expression system is E. coli, which offers the advantages of fast growth, inexpensive culture conditions, and well-established genetic manipulation techniques. 一个常用的表达系统是大肠杆菌,它具有快速生长、廉价的培养条件和良好的遗传操纵技术的优势。
After selecting an expression system, the next step is to design a suitable expression vector to insert the gene of interest. 在选择表达系统后,下一步是设计一个合适的表达载体来插入感兴趣的基因。
The choice of promoter, selection markers, and fusion tags are important considerations in the design of the expression vector. 表达载体的选择激活子、选择标记和融合标签都是在表达载体设计中的重要考虑因素。
Once the expression vector has been designed and constructed, it can be transformed into the host cells for protein expression. 在表达载体设计和构建完成后,就可以将其转化到宿主细胞中进行蛋白表达。
维真生物-原核蛋白的表达、分离和纯化

原核蛋白的表达、分离和纯化实验原理:携带有目标蛋白基因的质粒在大肠杆菌BL21中,在37℃,IPTG 诱导下,超量表达携带有6个连续组氨酸残基的重组氯霉素酰基转移酶蛋白,该蛋白可用一种通过共价偶连的次氨基三乙酸(NTA)使镍离子(Ni2+)固相化的层析介质加以提纯,实为金属熬合亲和层析(MCAC)。
蛋白质的纯化程度可通过聚丙烯酰胺凝胶电泳进行分析。
实验材料:大肠杆菌BL21试剂、试剂盒:LB液体培养基、氨苄青霉素、Washing Buffer、Elution Buffer、IPTG、蒸馏水、胰蛋白胨、酵母粉、氯化钠仪器、耗材:摇床、离心机、层析柱、离心管、移液枪、枪头盒、烧杯、玻璃棒实验步骤:一、试剂准备1. LB液体培养基:Trytone 10 g,yeast extract 5 g,NaCl 10 g,用蒸馏水配至1000 mL。
2. 氨苄青霉素:100 mg/mL。
3. 上样缓冲液:100 mM NaH2PO4,10 mM Tris,8M Urea,10 mM2-ME,pH8.0。
4. Washing Buffer:100 mM NaH2PO4,10 mM Tris,8 M Urea,pH6.3。
5. Elution Buffer:100 mM NaH2PO4,10 mMTris,8M Urea,500 mM Imidazole,pH8.0。
6. IPTG:100mM IPTG(异丙基硫代-β-D-半乳糖苷):2.38g IPTG溶于100ml ddH2O中,0.22μm滤膜抽滤,-20℃保存。
二、获得目的基因1. 通过PCR方法:以含目的基因的克隆质粒为模板,按基因序列设计一对引物(在上游和下游引物分别引入不同的酶切位点),PCR循环获得所需基因片段。
2. 通过RT-PCR方法:用TRIzol法从细胞或组织中提取总RNA,以mRNA为模板,逆转录形成cDNA第一链,以逆转录产物为模板进行PCR循环获得产物。
人乳酸脱氢酶a基因的原核表达及其蛋白的纯化

人乳酸脱氢酶a基因的原核表达及其蛋白的纯化人乳酸脱氢酶a基因的原核表达及其蛋白的纯化人乳酸脱氢酶a基因在细胞过程中起着至关重要的作用。
对于这个主题,我们将从原核表达开始深入探讨,并结合蛋白的纯化过程,逐步展开全面评估和详细讨论。
1. 人乳酸脱氢酶a基因的重要性人乳酸脱氢酶a基因是一种编码人体内催化丙酮酸还原为乳酸的酶的基因。
该基因的表达与细胞内能量代谢息息相关,对于维持细胞内稳态至关重要。
深入了解这一基因在细胞中的表达和功能具有重要意义。
2. 原核表达的意义和挑战在研究人乳酸脱氢酶a基因时,选择合适的表达系统是至关重要的。
原核表达系统由于其高效、简便以及成本低廉而备受青睐。
然而,在原核表达过程中仍然存在着诸多挑战,例如蛋白的溶解和折叠问题,对于这些问题的解决将直接影响目标蛋白的纯化。
3. 蛋白的纯化过程蛋白的纯化过程对于后续实验的结果和分析至关重要。
在纯化过程中,采用合适的方法和技术能够有效地去除杂质,确保目标蛋白的纯度满足后续实验的需求。
4. 个人观点和理解在进行人乳酸脱氢酶a基因的原核表达及其蛋白的纯化过程中,科学家们需要克服不少困难,但一旦成功将获得来自对基因和蛋白的深入理解。
对于这一主题,我认为深入挖掘其相关的细胞机制,有利于我们更好地理解细胞内的代谢过程,从而为细胞生物学和分子生物学领域的研究提供重要参考。
总结回顾在本文中,我们深入探讨了人乳酸脱氢酶a基因的原核表达及其蛋白的纯化过程。
通过从原核表达的意义和挑战开始,逐步对蛋白的纯化过程展开论述,希望能够给读者带来全面、深刻和灵活的理解。
在探讨的过程中,我们也共享了个人的观点和理解,期望能够引发更多学术讨论和思考。
以上是一篇有关人乳酸脱氢酶a基因的原核表达及其蛋白的纯化的文章,希望对你有所帮助。
人乳酸脱氢酶a基因的原核表达及其蛋白的纯化是生物技术领域中一个极其重要的课题。
通过对这一过程的研究,人们可以更深入地了解基因的表达调控机制,以及蛋白质的结构和功能特点。
原核表达步骤总结
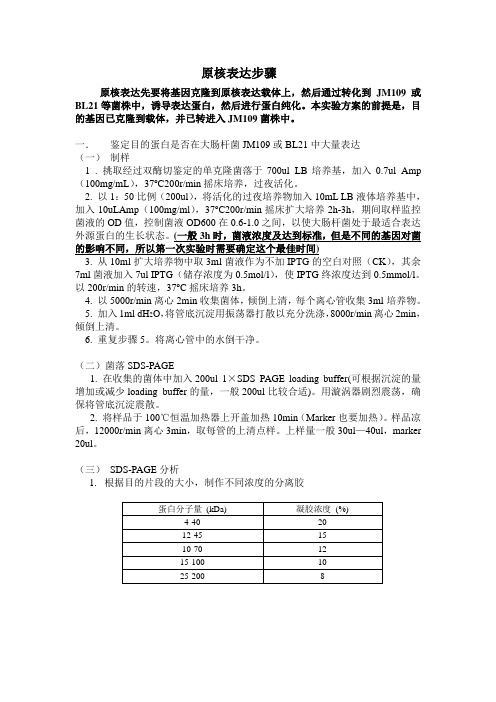
原核表达步骤原核表达先要将基因克隆到原核表达载体上,然后通过转化到JM109或BL21等菌株中,诱导表达蛋白,然后进行蛋白纯化。
本实验方案的前提是,目的基因已克隆到载体,并已转进入JM109菌株中。
一.鉴定目的蛋白是否在大肠杆菌JM109或BL21中大量表达(一)制样1 . 挑取经过双酶切鉴定的单克隆菌落于700ul LB培养基,加入0.7ul Amp (100mg/mL),37o C200r/min摇床培养,过夜活化。
2. 以1:50比例(200ul),将活化的过夜培养物加入10mL LB液体培养基中,加入10uLAmp(100mg/ml),37o C200r/min摇床扩大培养2h-3h,期间取样监控菌液的OD值,控制菌液OD600在0.6-1.0之间,以使大肠杆菌处于最适合表达外源蛋白的生长状态。
(一般3h时,菌液浓度及达到标准,但是不同的基因对菌的影响不同,所以第一次实验时需要确定这个最佳时间)3. 从10ml扩大培养物中取3ml菌液作为不加IPTG的空白对照(CK),其余7ml菌液加入7ul IPTG(储存浓度为0.5mol/l),使IPTG终浓度达到0.5mmol/l。
以200r/min的转速,37o C摇床培养3h。
4. 以5000r/min离心2min收集菌体,倾倒上清,每个离心管收集3ml培养物。
5. 加入1ml dH2O,将管底沉淀用振荡器打散以充分洗涤,8000r/min离心2min,倾倒上清。
6. 重复步骤5。
将离心管中的水倒干净。
(二)菌落SDS-PAGE1. 在收集的菌体中加入200ul 1×SDS PAGE loading buffer(可根据沉淀的量增加或减少loading buffer的量,一般200ul比较合适)。
用漩涡器剧烈震荡,确保将管底沉淀震散。
2. 将样品于100℃恒温加热器上开盖加热10min(Marker也要加热)。
样品凉后,12000r/min离心3min,取每管的上清点样。
原核蛋白纯化步骤

摇菌:3-1(12/9)6-4小批量表达过程:取100μl菌液至20ml Amp+LB培养基,摇菌至OD(600nm)值到0.6,IPTG(1:1000稀释)诱导,取0h 2h 4h 6h 8h样品各1ml,离心(6000rpm,5min)加60μl 1×PBS悬浮沉淀。
蛋白大小检测:caspase 3 846bp,约33kd;caspase 6 912bp,约38kd加20μl 4×loading buffer(含2-ME)至60μl菌液中,煮沸10min。
配胶,根据蛋白大小,选12% SDS-PAGE胶,跑胶检测。
70V 30min,120V 60min。
大批量表达过程:1)取20μl菌液至1ml Amp+ LB培养基,十管,摇菌过夜;2)将菌液转移至装有200ml Amp+ LB培养基的锥形瓶中,摇菌2.5h,测OD(600nm),0.6左右较好;3)加IPTG(1:1000)诱导5h;4)转移至灭菌了的50ml离心管中,10000rpm,20min离心收集沉淀;5)加20ml 无菌PBS悬浮菌液,加溶菌酶(1:500)室温静置1h;6)破碎菌液,温度25℃,模式06(6mm)/02(2mm)总时间20min左右,超声开约2s,超声关约5s,功率35%~40%(小于400W)7)离心(10000rpm 30min),收集上清和沉淀,上清-20℃保存,加10ml 1×结合缓冲液充分混匀溶解沉淀,4℃过夜;8)将融有沉淀的结合缓冲液分装,12000min,30min离心收集沉淀,1×PBS溶解后和上清一起跑胶检测。
试剂配置:LB培养基Tryptone 10gYeast Extract 5gNacl 10g定容至1LIPTG2.4g 至10ml无菌水中,过0.22μl 滤膜溶菌酶1g 至10ml 无菌水中,过0.22μl 滤膜Amp5g 氨苄到50ml 无菌水中,过0.22μl 滤膜8×母液(200ml)NaCl 4mol/L 4×58.44×0.2=46.75Tris 160mM 160×121.14×0.2=3.876调pH 至7.9Wash Buffer(200ml)NaCl 0.5M 0.5×58.44×0.2=5.844Tris-HCl 20mM 0.02×121.14×0.2=0.488EDTA.2Na 100mM 0.1×372.24×0.2=7.4448Binding buffer(1L)1×母液+咪唑咪唑浓度梯度:5mM 20mM 40mM 60mM 100mM 250mM8×Charge buffer(40mL)400mM NiSO4.6H2O0.4×262.86×0.04=4.20576g8M尿素100mL加48g。
蛋白表达与纯化-真核表达

蛋⽩表达与纯化-真核表达
真核表达的⽅式:包括原核蛋⽩表达与纯化、酵母蛋⽩表达与纯化、昆⾍细胞蛋⽩表达与纯化、哺乳动物细胞蛋⽩表达与纯化。
蛋⽩表达从哪⼀步开始呢?
1. 从基因合成开始,只需要提供具体的序列;
2. 提供cDNA基因模版,最后提供测序报告,以证明序列是正确的;
3. 提供质粒,如果是T载体,需要从构建载体开始,如果是PET28a和PET32a或其他可以直接⼩量诱导的质粒,可以从纯化开始;
4. 提供菌株,从纯化开始(菌株存放时间长可能活性会变差)
根据客户的需求,我们提供从基因合成,载体构建,基因表达,蛋⽩纯化、检测等⼀站式服务。
原核表达及蛋白质的纯化与浓度测定
操作步骤
• 通过PCR或RT-PCR获得目的基因 • 构建重组表达质粒 • 获得含重组表达质粒的表达菌种 • 诱导表达
诱导表达
挑取含重组质粒的菌体单克隆至5ml含相应抗生素的LB液 体培养基中37℃振荡过夜培养。(同时以空载体作为对照 ) 按1∶100比例稀释过夜菌,一般将1ml菌液接入到100ml
防止二价Ni被还原。
不能含离子型的去垢剂,比如SDS,防止Ni流失。 建议在破碎细胞的时加入蛋白酶抑制剂,如0.11mM的PMSF,防止目的蛋白被降解。
缓冲液里可以加入甘油,防止蛋白之间由于疏水
相互作用而发生聚集沉淀,甘油浓度最高可达 50%(v/v)。 缓冲液里NaCl的浓度应在300mM到2M之间。 可加入非离子型去垢剂,如Triton,Tween等,最 高2%,可以减少背景蛋白污染和去除核酸污染。
LB液体培养基中, 37℃振荡培养2-3h。
取部分液体作为未诱导的对照组,余下的加入诱导剂 IPTG至终浓度0.8mM作为实验组,37℃继续振荡培 养3h,4h,5h,6h 。
不同时间点分别取1ml菌体,12000rpm离心1min 或8000rpm离心6min收获菌体沉淀,用40ul灭菌水 重悬沉淀,加入5×蛋白上样缓冲液10ul混匀, 沸水煮5min。 剩余的样品(约95ml)然后12000rpm离心1min,用 灭菌水重悬菌体,用低温超高压细胞破碎仪或超声 破碎仪破碎重悬的菌体,4℃ 12000rpm离心10min , 上清倒入另一管中,沉淀用10ml的灭菌水重悬,然后 分别取40ul,加入5×蛋白上样缓冲液10ul混匀, 沸水煮5min,做SDS-PAGE等分析。
Tips
与超声波破碎仪相比,低温超高压连续流细胞 破碎仪的优点有: 保持细胞活性(4-6℃的环境) 省时
蛋白表达及纯化PPT课件
萃取法
液-液萃取法
利用两种不混溶的溶剂,将目标蛋白 质从一种溶剂中转移到另一种溶剂中 。
反胶团萃取法
利用反胶团形成的微环境,选择性分 离和纯化蛋白质。
色谱法
凝胶色谱法
利用凝胶介质对不同大小的蛋白质颗粒的分离作用,将目标蛋白质与其他杂质 分离开。
离子交换色谱法
利用离子交换剂对不同带电状态的蛋白质的吸附作用,将其与其他蛋白质分离 开。
亲和层析
利用基因工程改造的蛋白质分 子上的特定标签与固相载体上 的配体结合进行分离纯化。常 用的亲和层析包括His-tag亲 和层析、GST亲和层析等。
离子交换层析和凝胶过滤 层析
与抗体药物的纯化类似,离子 交换层析和凝胶过滤层析也可 用于重组蛋白药物的进一步纯 化和精制。
蛋白质相互作用研究中的纯化应用
02
蛋白纯化方法
沉淀法
盐析法
通过加入高浓度的盐溶 液,改变蛋白质的溶解
度使其沉淀下来。
有机溶剂沉淀法
利用有机溶剂降低蛋白 质溶解度的原理,使其
沉淀。
聚合物沉淀法
利用聚合物与蛋白质的 相互作用,使蛋白质沉
淀。
低温沉淀法
在低温条件下,通过改 变蛋白质的溶解度使其
沉淀。
离心法
差速离心法
通过逐渐增加离心力,将 不同大小的蛋白质颗粒分 离开。
扩展床吸附技术
将大颗粒的介质填充于柱中,使流动相能够通过吸附作用去 除杂质,提高纯化效果。
集成化与自动化技术
集成化分离系统
将多个分离步骤集成在一个系统中, 实现连续的分离纯化,提高生产效率。
自动化控制技术
通过自动化控制系统,实现分离纯化 的全流程监控和自动调节,减少人为 误差和操作时间。
xiap原核重组蛋白的表达和纯化
Caspases
• 现已确定至少存在11种caspase:
这些caspases中,caspase 1和caspase 11,以及可能还有caspase 4被认为不直接参 与凋亡信号的转导,它们主要参与白介素 前体的活化;而caspase 2,caspase 8, caspase 9和caspase 10参与细胞凋亡的起始; 参与细胞凋亡执行的则是caspase 3, caspase 6和caspase 7,其中caspase 3和7具 有相近的底物和抑制剂特异性,它们降解 PARP,DFF-45(DNA fragmentation factor-45
Ni-NTA柱改进方法洗脱后SDS-PAGE胶检测(增加了两个PH)
M:Marker A:蛋白原液 B:穿透液 W:清洗液 5.9:洗脱液ⅠpH 4.5:洗脱液ⅡpH 5.4、4.9洗脱液pH
总结:在增加两个不同pH洗脱液后,发现 在洗脱液pH为4.9、4.5时洗脱下来的目的蛋 白较标准方法多。但是纯化后的蛋白依然 有两条杂带,这有一条可能是His标签蛋白, 另外有可能是由于与目的蛋白等电点很接 近,没法用不同梯度的pH将其分离。
二、蛋白纯化条件优化
Ni-NTA柱标准方法洗脱跑胶检测 M:Marker A:蛋白原液 B:穿透液 W:清洗液 5.9:洗脱液ⅠpH 4.5:洗脱液ⅡpH
Ni-NTA柱改进方法洗脱后SDS-PAGE胶检测
M:Marker A:蛋白原液 B:穿透液 W:清洗液 5.9:洗脱液ⅠpH 4.5:洗脱液ⅡpH
• 蛋白纯化条件优化
重组蛋白的高效表达及纯化技术研究
重组蛋白的高效表达及纯化技术研究随着生物技术的发展,蛋白表达与纯化技术在医疗、工业以及科学研究等领域中扮演着越来越重要的角色。
其中,重组蛋白的高效表达及纯化技术是蛋白质学研究的关键环节之一。
本文旨在探讨目前被广泛应用的几种重组蛋白表达及纯化技术,以及它们的新进展与应用前景。
一、背景介绍重组蛋白指的是通过基因重组技术将人工合成的DNA片段引导到细胞中,使其在受到特定刺激后大量表达特定功能蛋白的一种新型蛋白质。
由于其具有高度专一性、易制备性以及更高的效力和安全性,越来越多的药物被开发为基于重组蛋白的生物制剂。
二、重组蛋白表达技术1. 原核表达系统原核表达系统是将DNA片段导入大肠杆菌等细菌中,在其形成菌落的过程中进行表达。
该系统的优点在于表达速度快、操作简便、表达产量高。
但同时,由于原核表达与真核细胞中的表达相比,它对于蛋白翻译辅助因子和蛋白修饰等生物特征的模拟程度较差,不利于蛋白的正确折叠,因此该系统表达的蛋白质通常需要经过重新折叠处理。
2. 原核表达系统与原核表达系统相比,真核表达系统更接近真实情况中的表达方式,对于全长的蛋白大多数时候能够实现正确的折叠。
在真核表达系统中,常用的系统包括昆虫细胞、哺乳动物细胞以及酵母菌表达系统等。
其中,哺乳动物细胞表达系统能够实现高产量、高质量的蛋白质表达,因此被广泛应用于蛋白质制备。
三、重组蛋白纯化技术1. 亲和层析法亲和层析法是一种将目标蛋白质从混合物中分离出来的技术。
该技术的依据是一种特定的与目标蛋白质具有相互作用的配体分离柱。
在该技术中,目标蛋白质与配体分离柱上的特定功能团结合,非特异性的蛋白质能够在洗脱过程中被去除。
2. 总体分离法总体分离法是将目标蛋白从混合物中分离出来,采用离心、可溶性和非可溶性的分离方法。
其中,在采用可溶性分离的方式时,常用的方法有两相法、分配层析等。
四、新兴技术及应用前景近年来,3D打印技术的应用逐渐渗透到生物医疗领域,并开始用于制备组织工程器官和人造蛋白质等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
严谨调控
稀有密码子
溶解性
Rosetta系列
Origami系列
稀有密码子 不同生物使用密码子存在偏爱性。某种或某几种tRNA的缺乏,会导致外源目的基 因的mRNA 无法正常在E. coli 里表达,是为“稀有”密码子。
表达条件
• 乳糖操纵子与诱导物
• 常用表达条件的优化
乳糖操纵子与诱导物
• 1980年,Guarante L等构建了以乳糖操纵子为基础的大肠杆菌表达系统
常用表达载体系统
系统名称 公司 pGEX 启动子 抗性 Amp 常用标签 GST· Tag 特点 可溶性表达,纯化难以控制,谷 胱甘肽 一步洗脱,得到的蛋白纯 度较低,通常需要去掉GST· Tag 可溶性表达,纯化难以控制,麦 芽糖一步洗脱,得到的蛋白纯度 较低,通常需要去掉MBP· Tag 种类丰富。标签小,无需切割, 一般来说,对蛋白活性无影响。 纯化及其方便。 同pET系统
The key of Prokaryotic protein expression and purification
北京全式金生物技术有限公司
☏:400-898-0321
上篇 原核表达
• 原核表达概述
• 原核表达策略选择 • 表达结果验证
• 常见问题与实验例
载体 pGEX pMal pET
pEASY
T7lac
无表达或表达量低
稀有密码子 • 影响: • 应对: 翻译终止,移码突变,氨基酸序列错误,表达量低或无表达 在宿主中补充稀有密码子的tRNA Rosetta系列菌株(Novagen公司)
目的蛋白
1:BL21(DE3); 2:Rosetta(DE3) ; 3:BL21(DE3)pLysS M 1 2 3
GE tac (Pharmacia) NEB tac
pMal
Amp
MBP· Tag
pET
Merck (Novagen) Transgen
T7 T7lac T7lac
Amp Kan Amp
His· Tag
pEASY
His· Tag
选择表达菌株
菌株
BL21 BL21(DE3) BL21(DE3)pLysS
• trc启动子:
• tac启动子:
trp+lac杂交启动子
trp+lacUV5杂交启动子; pGEX(Pharmacia)、pMal(NEB)
•T7/T7lac启动子:
pET(Novagen)、pEASY-E1/E2(Transgen)
T7启动子
T7lac启动子
融合标签
• 常用于蛋白检测与纯化。 • 有时也可增加蛋白可溶性、将蛋白运转至特定位置。
包涵体
•
• •
需要洗涤、变性、复性(如有需要)等步骤
适用于某些亲和层析方法(6×His· Tag)、离子交换层析 不适用于某些亲和层析方法(GST· Tag、 MBP· Tag )
tac启动子需要大肠杆菌自身的RNA聚合酶即可:BL21
T7启动子需要能够提供T7 RNA聚合酶的细胞:DE3溶源菌
抗性
细胞不能与载体带有相同的抗性: pET-28a + OrigamiB(DE3) No! pET-21b + OrigamiB(DE3) Yes!
BL21(DE3)pLysS / BL21(DE3)pLysE
原核表达概述 原核表达原理概述 表达载体 表达菌株 表达条件
原核表达原理概述
目的基因
构建
转化
培养,诱导
表达载体
重组载体 表达菌株
“基因——载体——菌株——培养”
表达载体
• 启动子
• 融合标签
• 常用表达载体系统
常见启动子 • λpL启动子: • trp启动子: 热诱导启动子 化学诱导启动子
Rosetta(DE3) Transetta(DE3) OrigamiB(DE3) TransB(DE3)
毒基因:基因表达产物——即目的蛋白,影响宿主生长(“毒性”) Page Down
BL21(DE3)pLysS、BL21(DE3)pLysE利用T7溶菌酶的严谨调控机制
Page Up
优化表达条件
葡萄糖: 温度: 抑制cAMP形成,进而抑制表达,严谨调控 无其他严谨调控手段(pLysS)且毒基因时,至关重要! 影响表达速率、蛋白可溶性与活性
IPTG浓度:
影响表达速率、蛋白可溶性与活性 lac透性酶(lacY1)突变使IPTG均一渗透,获得浓度依赖 的诱导:Tuner,OrigamiB,Rosetta
适合启动子
tac、trc…… (pGEX、pMal) T7/T7lac (pET,pEASY) T7/T7lac (pET,pEASY) T7/T7lac (pET,pEASY) T7/T7lac (pET,pEASY)
特性
适用于非T7启动子的表达系统 适用于T7、T7lac的表达系统,适用于非毒基因 的表达 质粒pLysS含有表达T7溶菌酶的基因,可结合 T7 RNA聚合酶,降低本底表达水平。适用于严 谨调控毒基因的表达 补充6种稀有密码子对应的tRNA,提高外源基 因,特别是真核基因在原核系统中的表达水平 具有thioredoxin reductase/glutathione reductase 双突变,有助于形成更多的二硫键,增加蛋白 的可溶性。
GE tac (Pharmacia) NEB tac
pMal
Amp
MBP· Tag
pET
Merck (Novagen) Transgen
T7 T7lac T7lac
Amp Kan Amp
His· Tag
pEASY
His· Tag
表达菌株
考虑因素 细胞特性
蛋白稳定性
启动子
蛋白酶缺陷型——B型菌株,缺失lon、ompT蛋白酶 多种常用表达菌株均为此类,如BL21、Origami、Rosetta等
N端融合:
易于构建。终止密码子来自载体/基因 表达量高 提前终止会干扰纯化 二级翻译起始不影响纯化
C端融合:
构建时注意避免移码 基因不能自带终止密码子 提前终止不影响纯化 二级翻译起始会干扰纯化
常用融合标签 • His· Tag pET系统
• GST· Tag
• MBP· Tag
pGEX系统
pMal系统
Lane 3:BL21(DE3)
1
2
3
蛋白不可溶
• 成因:蛋白质正确折叠,形成有活性、有功能的天然构象的程度。 • 定位:可溶蛋白 包涵体 • 特点:可溶蛋白 包涵体 胞质,细胞周质,胞外(培养基) 胞质,细胞周质 天然构象,正确折叠,具有生物活性 高浓度,高纯度,无活性,具免疫原性,不易水解
增加可溶表达
菌体密度 Mg2+ 培养体积与通气 ……
其他因素:
ArtMediaTM Protein Expression(AM PE)
• 葡萄糖抑制cAMP形成,无cAMP-CAP,不能正调控乳糖操纵子,因而无法利 用乳糖,使得大肠杆菌优先利用葡萄糖 • AM PE中含有特定配比的葡萄糖与乳糖,利用该机理,使得葡萄糖耗尽开始 摄入乳糖时,控制细菌恰好生长到适合诱导的阶段(对数期),利用乳糖代谢, 启动自动诱导! • 无需监控菌体生长,实现自动诱导 • 无需加入IPTG,对细菌生长无抑制 • 细胞密度高,蛋白产量高 • 应用于一切乳糖操纵子表达系统:pET、pGEX、pMal、pEASY……
pGEX pET
Lane 2:30℃ Lane 3:25℃
பைடு நூலகம்
促进包涵体形成
• 目的 高浓度,高纯度 毒基因表达
免受蛋白酶水解(小蛋白,多肽)
• 手段 胞质表达 提升表达速率(诱导温度,IPTG浓度,etc) 特定的表达载体(pET-17xb,pET-31b(+))
蛋白纯化障碍 • 表达——纯化是一个完整的、密切联系的过程,蛋 白纯化过程中,很多问题的根源来自上游表达 • 蛋白不结合,洗脱杂带多,包涵体不易溶解…… • 下篇详述
全菌 上清 沉淀
全菌
上清
沉淀
可溶表达
包涵体
常见问题与实验例 无表达或表达量低
蛋白不可溶
蛋白纯化障碍
无表达或表达量低
• 载体-菌株搭配不当
•
摸索最佳的组合
启动子 tac tac T7/T7lac 菌株 BL21 BL21 BL21(DE3) BL21(DE3)pLysS Rosetta(DE3) OrigamiB(DE3) 同上
Lane 1: LB培养基,IPTG诱导 Lane 2: AM-PE自动诱导 Lane 3: LB培养基,对照
表达结果验证
表达定位
溶解性 胞内表达 可溶/包涵体 周质表达 多为可溶 胞外分泌 完全可溶 表面展示 融合膜蛋白/ 嵌合于膜上 信号肽 活性 不需要 有/无 需要 需要 需要 有 有 免疫原性 产量 有 有 有 有 纯化难度
1
2
3
4
pET28a,30 kDa 1:ArtMedia 2:LB 3:LB+0.2% Glucose 4:SOB
1
2
3
1
2
3
载体:pEASY-E1 蛋白:70 kDa 菌株:Transetta(DE3)
载体:pGEX-5X-3蛋白:70 kDa 蛋白:30kDa 菌株:BL21
Lane 1: LB培养基,对照 Lane 2: LB培养基,IPTG诱导 Lane 3: AM-PE自动诱导
最高 蛋白种类多,需裂解 ≤50% 菌体,复杂 较少 ≤4% 变化 较大 蛋白种类少,需渗透 压休克,相对容易 纯化简单。但机理不 详,成功先例少 适用于疫苗开发、抗 体制备,前景广阔。
表达定位
