相平衡状态图(相图)1
合集下载
第二章相平衡(1)

两相的相对量可按杠杆定理计算。如果边界线是 倾斜的而不是垂直的,则表示两相的成分和相对量均 随温度变化而发生变化,即可能会发生相互溶解或析 出的变化。两个单相区只能相交于一点、而不能交了 一条线。 在二元系相图中,三相区必为一水平线,它表示 的是等温反应。三个单相区分别交于水平线上的三个 点,即水平线的两个端点相线中间的某一点。水平线 的上下方分别与三个单相区毗邻,根据与水平线相连 的三个单相区的类型相分布特点,即可确定三相平衡 的类型。
图5二元系各类恒温转变图型
4 如何分析和使用二元系相图
实际的二元系相图往往要比我们前面介绍 的相图复杂的多,有的令人看起来眼花缭乱, 似乎无从下手。其实,仔细分析就可以看出, 它多是由各类基本相图综合而成。只要我们掌 握了基本相图的特点和某些规律,就可以做到 化繁为简,易于分析和使用任何复杂的二元系 相图。则将分析二元系相田的主要方法归纳如 下。
(6)平衡状态 当一个系统的各热力学参量在不受外界 条件影响下,不再随时间而变化,我们 就称这个系统处在平衡状态下。 力学平衡条件 压强相等 热平衡条件 温度相等 相平衡条件 平衡相的化学势相等
(7)相平衡 在一多相体系中,如果它的各个相关 相之间彼此互相转化的速率部相等,也 就是各物质在每相中的化学势部相等, 我们就说这个体系处于相平衡状态。
(2)配料成分的选择 晶体生长的方法确定之后,配料就成了 生长的一个关键问题了。配料成分的选择 和相图的形态是密切相关的,必须根据系 统中诸相的关系来确定,这不仅关系到晶 体生长的成败,同时也关系到所生长晶体 的质量。
T S T m(CB CS )
a)同成分点生长, 长什么成分就配什 么成分
单相区代表一种具有独持结构和性质的相的成分和温度范围若是单相区为一根垂直线则表示该相的成分不变两相区中所包含的两个相就是该相区两边相邻的单相区中的相其边界线分别表示该两相约平衡成分即两相约成分随温度改变分别沿其边界线变化
相平衡强度状态图

3.杠杆规则
t/℃
p一定
g(A+B)
t
* A
l l(A+B)
g
k
t
* B
xBl
xB
y
g B
A
xB
B
图 3-13 杠杆规则
ng nl
lk kg
(3-5)
ng xB xBl nl yBg xB
若组成用质量分数表示
m(g) wB wBl m(l) wBg wB
(3-5)
杠杆规则推导: 根据物质守恒,
按组分数划分
单组分系统 二组分系统 三组分系统
相图的分类
按组分间相互溶解情况划分
完全互溶系统 部分互溶系统 完全不互溶系统
按性质组成划分
蒸气压 组成图 沸点 组成图 熔点 组成图 温度 溶解度图
……
I 单组分系统相图 3.1 单组分系统的 p-T 图
将相律应用单组分系统,则 f=1-φ+2=3-φ,(C=1)
4.恒沸点左侧 xB > yB, 右侧 xB < yB 。
图 3-12 CH3Cl(A) - C3H6O(B) 系统的 沸点-组成图
表3-4 H2O (A) –C2H5OH (B) 系统恒沸温度及组成随压力变化的数据
压力 p / 102kPa 恒沸温度 t /℃ 恒沸组成 xB = yB
0.127 0.173 0.265 0.539 1.013 1.434 1.935 33.35 39.20 47.63 63.04 78.15 87.12 95.35 0.986 0.972 0.930 0.909 0.897 0.888 0.887
冰点 (b)在敞口容器中 图 3-5 “水”的冰点
II 二组分系统相图
材料科学基础第四张相平衡与相图(1)

化学位: 当温度、压力不变因组元增加一个摩尔, 引起吉布斯自由能的变化,就是组元的化 学位或偏摩尔自由能。它代表了系统内物 质传递的驱动力。
组元2在β相 中化学位等于其 在α相中的化学位 推演如下:
多元系统的吉布斯自由能是温度、压力及各组元摩尔 数n1、n2…….函数,即可写成 G=f(T、P、n1、n2……….)
二元系中,三相平衡的热力学条件是每个组元在各相中的化学位相等,即 μα1=μβ1=μγ1 μα2=μβ2=μγ2 多元复相平衡的普遍条件是每个组元在各相中的化学势都必须彼此相等,即 μαi=μβi=μγ i =…=μPi
其中,α、β、γ…P表示合金中存在的相,i代表合金中的第i个组元 。 μPi则表示P相中i组元的化学位,即上标表示平衡相,下标表示组元。
温度与压力都能变动的情况
二、 SiO2系统相图 •也有晶型变化:
(<573℃)低温型α-SiO2 (α-石英) (573℃-870℃) 高温型β-SiO2 (β-石英) (870℃-1470℃) 磷石英β2-SiO2 (β2-磷石英) (1470℃-1713℃) 方石英β-方SiO2 这四种不同晶体结构的SiO2存在 的温度、压力范围不同
•确定两平衡相的相对量: •将成分坐标当作杠杆,以合金的成分点为 •支点,Wα和WL看成作用于a、b两点的力, •则与力学上的杠杆定律一样,即 • WL/Wα=0b/a0 •上式表明合金在两相区内,两平衡相的相 •对量之比与合金成分点两边的线段长度呈 •反比关系。
•合金中两平衡相的含量也可用下式表达: Wα%=(C-CL)/(Cα-CL) =a0 /abχ100% WL%=(Cα-C)/(Cα-CL) = 0b /ab χ100% 在两相区内,温度一定时,两相的质量比 是一定的。
《材料科学基础》课件——第五章相平衡与相图第一节第二节第三节第四节

相和相平衡
Байду номын сангаас四、自由度与相律
1、自由度:平衡系统中独立可变的因素
自由度数:独立可变的强度变量的最大数目
(强度变量与广度变量的区别)
2、相律:自然规律
在平衡系统中由于受平衡条件的制约,系统内
存在的相数有一定限制。 组元数 相数P≥1
吉布斯相律:不可为负数
f=c-p+n
外界影 响因素
通常外界影响因素只考虑T、P,所以f=c-p+2
• 掌握匀晶,包晶,共晶相图的特点,进而了解二元合金的一些平衡凝固,固 相转变的规律。
• 重点难点: • 二元系相图的建立,杠杆定律 • 包晶相图,共晶相图,共晶合金 • 相图分析,各种液固,固相转变的判断
材料的性能决定于内部的组织结构,而组织结构
又由基本的相所组成。
相:均匀而具有物理特性的部分,并和体系的其他 部分有明显界面。
晶型转变过程都是在恒温下进行,并伴随有体 积、密度的变化。 2、SiO2系统相图 α-石英与β-石英相变相当慢, β-石英常因冷却过快而被保留 到室温,在常压下,低于573℃
单元系相图
β-石英很稳定,所以自然界或低温时最常见的是 β-石英。晶型转变时,体积效应特别显著。 Al2O3、ZrO2也具有多晶型转变。 3、聚合物相图 (1)状态由分子间作用力决定,分子间约束力弱
共晶相图,平衡凝固,共晶合金,包晶相图,形成化合物的相图,含有双液 共存区的相图,熔晶相图等 ,二元相图的几何规律 ,单相,双相及三相共 存区,相图特征 ,二元系相图的分析,分析的方法与步骤,分析举例。
• 教学目的: • 学习相平衡与相图的基本知识,了解相图在材料科学学习中的重要性,学会
相图的使用。
物理化学--相平衡状态图

φ =1,f=3 φ =2,f=2 φ =3,f=1 φ =4,f=0
最多3个独立变量(T, p, 该相组成) 最多4个相平衡共存(无变量)
指定温度, 则有压力-组成图 ; f ′ = 3- φ
指定压力, 则有温度-组成图 . f′= 3 - φ
9
二组分系统按液态互溶情况分类:
Hale Waihona Puke g(A+B) l(A+B)
气 O
C' B
0 0.01 100
• H2O的相图
• OA线是冰的熔点随压力变化曲线, 遵守克拉贝龙方程. 注意其斜率为 负值.
• 3个面分别是气, 液, 固单相区.
• 交点O是三相平衡点, 自由度数为0, 其温度比正常熔点高0.01K.
374.2• 从相图分析恒压变温和恒温变压 t/℃ 过程的相变化(见图).
两相平衡
三相平衡
水或冰的饱和蒸汽压/Pa 平衡压力 平衡压力
/MPa
/Pa
水⇔气 冰⇔气 冰⇔水 冰⇔水⇔气
⎯
103.4
199.6
⎯
(190.5)
165.2
161.1
⎯
285.8
295.4
115.0
⎯
421.0
410.3
61.8
⎯
611.0
611.0 611.0×10-6 611.0
2337.8
⎯
⎯
相平衡状态图
表示相平衡系统的性质(如沸点、熔点、蒸汽压、溶 解度)及条件(如温度、压力、组成等) 间函数关系 的图叫相平衡状态图,简称相图
按组分数: 单组分系统,双组分系统,三组分系统 按组分间相互溶解: 完全互溶,部分互溶,完全不互溶 按性质-组成: 蒸汽压-组成图, 沸点-组成图,熔点组成图,
05 相平衡

p/kPa
T 一定
t/℃ l p* B * tA p一定
g
* pA
g
A
xB
l
B
* tB xB B
A
6.4 二组份真实液态混合物的气-液平衡相图
f 1- 2 2 1
三相点O:
f 1- 3 2 0
无变量点
6.3 二组分系统理想液态混合物的气-液平衡相图 理想液态体系 液 体 系 统 固 液 系 统 完全互溶系统 部分互溶系统 不互溶系统 不互溶系统(简单低共熔混合物系统) 生成化合物(稳定的、不稳定的)系统
真实液态体系
二 组 分 体 系
完全互溶及部分互溶(盐水体系)系统
对于二组分体系, C 2,
F 4- P
P至少为1,则 F 最多为3。这三个变量通常是 T,p 和组成 x。需空间立体图描述相变化规律。 若固定其中一个变量:
F
∴
* max
C - P 1 2 - 1 1 2
较常用
常用
可用平面坐标来描述体系的相变化过程
p* A
A
相图中表示某个平衡相组成的点,如L2点,G2点。
2. 杠杆规则 对M点,设:nG-气相量 nL-液相量 xM(nG+nL)= nGxG+nLxL nL(xM-xL)= nG(xG-xM) nLL2M= nGMG2 ——杠杆规则
p pa
L3
T 一定
l L2 L1
a M G3 b xL xM xG xB
② 空气在水中的溶解度 bB 0.00130 mol (kg水)-1
稀溶液依数性冰点下降 T2=0.00241K 两种效应的总和使冰点下降值: 0.00241K+0.00747K≈0.01K
T 一定
t/℃ l p* B * tA p一定
g
* pA
g
A
xB
l
B
* tB xB B
A
6.4 二组份真实液态混合物的气-液平衡相图
f 1- 2 2 1
三相点O:
f 1- 3 2 0
无变量点
6.3 二组分系统理想液态混合物的气-液平衡相图 理想液态体系 液 体 系 统 固 液 系 统 完全互溶系统 部分互溶系统 不互溶系统 不互溶系统(简单低共熔混合物系统) 生成化合物(稳定的、不稳定的)系统
真实液态体系
二 组 分 体 系
完全互溶及部分互溶(盐水体系)系统
对于二组分体系, C 2,
F 4- P
P至少为1,则 F 最多为3。这三个变量通常是 T,p 和组成 x。需空间立体图描述相变化规律。 若固定其中一个变量:
F
∴
* max
C - P 1 2 - 1 1 2
较常用
常用
可用平面坐标来描述体系的相变化过程
p* A
A
相图中表示某个平衡相组成的点,如L2点,G2点。
2. 杠杆规则 对M点,设:nG-气相量 nL-液相量 xM(nG+nL)= nGxG+nLxL nL(xM-xL)= nG(xG-xM) nLL2M= nGMG2 ——杠杆规则
p pa
L3
T 一定
l L2 L1
a M G3 b xL xM xG xB
② 空气在水中的溶解度 bB 0.00130 mol (kg水)-1
稀溶液依数性冰点下降 T2=0.00241K 两种效应的总和使冰点下降值: 0.00241K+0.00747K≈0.01K
相平衡状态图1
启迪与导航
自从1854年 Kelvin 提出用一个热力学温 年 自从 度值定义热力学温标后, 度值定义热力学温标后,人们几乎经过一个 世纪的不懈努力,才幸运地找到了水的三相 世纪的不懈努力, 点温度值是定义热力学温标的最理想值, 点温度值是定义热力学温标的最理想值,因 为可由热力学证明,这个温度极为稳定。然而, 为可由热力学证明,这个温度极为稳定。然而, 准确测定这个温度是极其困难的, 准确测定这个温度是极其困难的,因为 实验设计的难度是难以想象的。 实验设计的难度是难以想象的。
在气、 三个单相区 在气、液、 固三个单相区内, 固三个单相区内, f = 2 ,温度和压力独 立地有限度地变化不会 引起相的改变。 引起相的改变。 f=0 三条两相平衡线 f = 1,压力与温度只能改 变一个,指定了压力, 变一个,指定了压力,则 温度由体系自定。 温度由体系自定。
A 221 固
A C 固 液 气 0.518 B O -56.5 t/℃
CO2的相图 读图要点: 读图要点: 读懂点、 区的含义; ① 读懂点、线、区的含义; ② 注意 注意OA 线的倾斜方向; 线的倾斜方向; 数值; ③三相点的 p、T 数值; ④干冰的升华条件。 干冰的升华条件。
P/MPa
(1)CO2的相图
硫的相图
A 221 P / 10 5 Pa 固
p q
小结
C
液
trs H m dp = dT T trsVm
气
w
0.00611 C' O B 0.01
374.2 t/℃ ℃
d ln p vap H m = 2 dT RT d ln p sub H m 或 = 2 dT RT
作业
作业:教材50页思考题4
相平衡-三元相图

浓度三角形:平行线
A%=20% B B% 20% B%=20% 90 10 C%=60% 20 80 30 70 40 60 B%50 50C% 40 60 30 70 20 80 90 III 10 A 90 80 70 60 50 40 30 20 10 C ← A%
7
浓度三角形性质:平行线性质
42
析晶路程也可表示如下:
液相点 M LC f= 2 LC+A D f=1
E( (L C+A+B, f = 0) 固相点 C F M
43Leabharlann 冷却曲线44四、生成一个稳定的二元化合物的 三元相图的立体图 元相图的立体图
相图立体图的三个侧面是 由一个具有一致熔化物的 二元相图和两个形成低共 熔的简单二元相图组成。 在实际三元体系中经常出 现若干二元化合物和三元 化合物 如果这些化合物同 化合物,如果这些化合物同 组成熔化,则和二元体系一 样,可以分解成若干简单的 三元系来处理。
10
两条推论 ( 1 )给定组分体系在一定 温度下处于两相平衡时,若 其中 个相的成分给定 另 其中一个相的成分给定,另 一个相的成分点必然位于已 知成分点连线的延长线上。 知成分点连线的延长线上 ( 2 )若两个平衡相的成分 点已知,则体系的成分点必 然位于两个已知成分点的连 线上。
11
重心规则
39
要点
• M→D →E等:表示液相的组成变化 等 表示液相的组成变化 • 箭头上方表示析晶、熔化或转熔的反应式,箭头 下方表示相数和自由度; • 方括号内表示固相的变化,如[C,(C)]表示固相 总组成点在C点 (C)表示晶体c刚析出 [F, 总组成点在C点,(C)表示晶体c刚析出, [F A+C+(B)]则表示固相总组成点在F,固相中已有A 和C晶体析出 而B晶体刚要析出 和C晶体析出,而B晶体刚要析出
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
超临界CO2流体的应用---超临界流体萃取技术
利用超临界流体的萃取分离是新近发展起来的高新技术。超临界流 体由于具有较高的体积质量,故有较好的溶解性能,做萃取剂,萃 取效率高,且降压后,萃取剂气化,所剩被溶解物质即被分离出来, 而超临界CO2流体其体积质量几乎是最大的,因此最适宜作超临界 萃取剂。优点如下: (i)由于超临界CO2流体体积质量大,临界点时其体积质量为 448kg·m-3,且随压力增加其体积质量增加很快,故对许多有机物溶 解能力很强。另方面从图3-5中可以看出,在临界点附近压力和温 度微小变化可显著改变CO2的体积质量,相应影响其溶解能力。所 CO 以通过改变萃取操作参数(T、p)很容易调节其溶解性能,提高产 T p 品纯度、增大萃取效率。 (ii)CO2临界温度为31.06°C,所以CO2萃取可在接近室温下完成 整个分离工作,特别适用于热敏性和化学不稳定性天然产物的分离。 (iii)与其它有机萃取剂相比,CO2既便宜,又容易制取。 (iv)CO2无毒、惰性、易于分离。 (v)CO2临界压力适中,易于实现工业化。
OA线斜率为正值,dp/dT>0 ,而∆Hm<0,则∆Vm< 0 即Vm (金刚石)<Vm (石墨), 则 ρ (金刚石) > ρ(石墨)
作业
教材113页31、33、35。
∆ sub H m = 固-气两相平衡: 2 dT RT
d ln p ∆vapHm = 2 dT RTd ln p
dp ∆vapHm ∆vapHm = = dT TVm ( g) RT T( ) p
克—克方程的积分式
d lnp ∆Hm = 2 dT RT
若 ∆H m = 常数 不定积分: ln p ∆H m =- +B Pa RT p = A + B 经验公式 ln Pa T
2、相图坐标的确定
f = K −φ + 2
选fmax作为坐标数
3、相图重要性
1、冶金工作者的地图; 2、材料设计的指导书; 3、小型热力学数据库。
4、近代相平衡的发展
1882年,拉乌尔得出稀溶液沸点升高和凝固点降低的规律。 1887年,范特霍夫提出渗透压公式。 1891年,能斯特提出分配定律。 1887年,吕.查德里用铂铑热电偶测量粘土加热过程中的变化, 是热分析法的开始。 1919年,柯屈勒发明在上升管中达到平衡的方法,可以在气 液平衡实验中精确测定沸点。 1925年,斯韦托斯拉夫斯基在此基础上建立了沸点仪。 1928年,奥斯默建立了第一个能有效操作的的气相循环平衡 釜,开始了对混合物气液平衡的精确测定。 1876年,吉布斯导出相律,奠定了相平衡的理论基础。 1887年,罗彻博研究多相平衡及其分类,用相律说明了不少 实际问题,才使它逐步被人们所重视。 后来,施莱因梅格对相平衡原理进行了系统阐述,使之成为 物理化学的重要组成部分。
5-1-2 相图分析
Question
OA线斜率为负? OB线比OC线斜率大? 能否从理论上解释?
5-1-3
纯物质两相平衡方程
1、Clapeyron方程
推广到一般情况
得: 移项: 整理得:
对于可逆相变
代入得:
适用于任何纯物质两相平衡: l-g、s-g、l-s、s1-s2
l-g两相平衡 两相平衡: 两相平衡 l-s两相平衡 两相平衡: 两相平衡
第五章
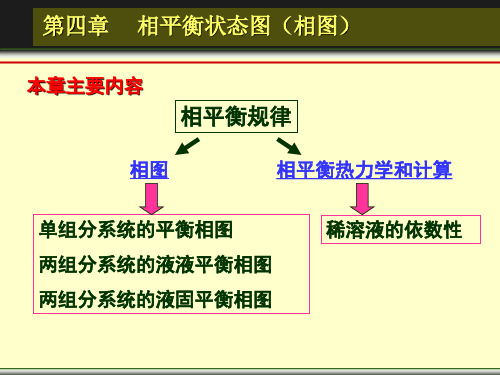
相平衡状态图(相图)
引言 §5-1 单元系相图 §5-2 相律 §5-3 二元凝聚系相图
1、研究对象、内容和方法
研究对象:多相平衡体系 研究内容:研究多相平衡体系的状态随外界 条件变化而变化的规律,即温度、压力、浓 度等与相态和相组成的关系。
研究方法:
(1)解析法:根据热力学的基本原理用热力学 解析法: 解析法 方程的形式来描述相平衡的规律性,如 Clapeyron方程。 优点:简明、定量化。 优点:简明、定量化。 缺点: 缺点:在比较复杂的情况下难以找到与实验关 系完全相当的方程式 。 *(2)几何法(图解法):用几何图形,即相图 ( )几何法(图解法) (Phase diagram)来表示平衡体系的状态及演 变的规律性,其基本理论仍是热力学基本方程、 Gibbs—Duhum方程、Gibbs相律等。 优点: 清晰、直观、形象化。 优点: 清晰、直观、形象化。
dp ∆ sub H m OB : = dT T∆ subVm dp ∆ vap H m OC : = dT T∆ vapVm ∆ sub H m > ∆ vap H m
5-1-4
H2O三相点与冰点的区别 三相点与冰点的区别
区别
水的冰点是指被101.325kPa下空气所饱和了 的水(已不是单组分系统)与冰呈平衡的温度, 即0℃; 三相点是纯水、冰及水气三相平衡的温度,即 0.01℃。 在冰点,系统所受压力为101.325kPa,它是 空气和水蒸气的总压力;而三相点时,系统的 压力是611Pa,它是与冰、水呈平衡的水蒸气 的压力,水的冰点比三相点低0.01K。
§5-1 单元系相图
教学基本要求及教学目标
1、 会读H2O,CO2,硫、碳等单组分系统的相图。 2、 会用相律分析单组分系统相图,计算各相区自 由度数。 3、理解三相点的概念,了解H2O的三相点和冰点的 区别。
5-1-1 实验作图
H2O的相平衡数据 的相平衡数据
H2O的相图 s l g
CO2相图
具体计算
解释
由于压力的增加以及水中溶有空气均使水的 冰点下降。当系统的压力由611Pa增加到 101325Pa时,可由克拉佩龙方程算得水的冰 点降低约0.0075℃;而由于水中溶有空气, 可由稀溶液的凝固点下降公式算得,水的冰 点又降低0.0023℃,合在一起为0.0098℃。
5-1-5 单元系相图举例
定积分:
p2 ∆H m 1 1 - ln = p1 R T1 T2
经验规律
总结
1、适用于任何纯物质两相平衡。 2、分子分母方向一致。 3、两边单位一致。 4、量一致。
例1
解
例2
例3
Clapeyron方程对单组分体系的应用
dp ∆ fus H m OA : = dT T∆ fusVm ∆ fus H m > 0 dp <0 ⇒ ∆ fusVm < 0 dT
dp ∆ vap H m = dT T ∆ vapVm
∆ fus H m dp = dT T ∆ fus V m
L-s平衡
积分:
2、Clausius-Clapeyron 方程
气相 凝聚相(液或固相)
以液相 气相两相平衡为例:
dp ∆ vap H m = dT T∆ vapVm
假设: ①气相为理想气体; ②液体体积与气体相比可忽略。
碳的相图
硫的相图
例4
解
(1) O点是石墨、金刚石、液相共存的三相平衡点; (2)OA为石墨、金刚石之间的相变温度随压力的变化线; OB为石墨的熔点随压力的变化线; OC为金刚石的熔点随压力的变化线; (3)常温常压下石墨是热力学的稳定相; (4)从OA线上读出2000K时约在p=65×108Pa,故转变压 力为 65×108Pa; (5)
水的相图(高压下)
O点:H2O的三相点
在20世纪30年代初这个三相点还没有公认的数据。 1934年我国物理化学家黄子卿等经反复测试,测得 水的三相点温度为0.00981℃。 1954年在巴黎召开的国际温标会议确认此数据,此 次会议上规定,水的三相点温度为273.16K。 1967年第13届CGPM(国际计量大会)决议,热力学 温度开尔文(K)是水三相点热力学温度的1/273.16。
