利用化学方程式计算的步骤
九年级化学上册 5.3利用化学方程式的简单计算教案 人教新课标

课题3 利用化学方程式的简单计算学习目标:1.在正确书写化学方程式的基础上,进行简单计算。
2.认识定量研究对于化学科学发展的重大作用。
3.正确使用量和单位。
教学重点:有关化学方程式的计算教学难点:化学方程式的计算教学过程:1.根据化学方程式计算的步骤(1)设:根据题意设未知数;(2)写:书写正确的化学方程式;(3)找:找出已知量和未知量的质量关系;(4)列:列出比例式并求解;(5)答:检查结果,简明作答。
2.根据化学方程式计算应该注意的事项(1)正确书写化学方程式,准确列出有关反应物或生成物的质量比;(2)列式时,各物质的质量单位必须统一,对应关系要正确;(3)反应物、生成物都必须是纯净物,如果是混合物,应该不纯物的质量按题意转化为纯净物的质量;(4)解题的过程要完整,规X(5)设未知数是要指明物理量,不要带单位。
例题:某实验室中需要氧气进行实验。
若用电解水的方法制取这些氧气,需要消耗水多少克?同时可生成氢气多少克?解:设消耗水的质量为x,得到氢气的质量为y2H 2O 通电===2H 2↑+O 2↑36 4 32x yg x 6.13236=,x=;gy 6.1324=,y= 答:电解消耗水,同时生成氢气。
常见题型1.利用质量守恒定律的相关信息,如何求反应物的质量及相互质量比?例1 已知在反应3A+2B=2C+D 中,反应物A 、B 的质量比为3:4。
当反应生成C 和D 的质量共140g 时,B 消耗的质量为_________g 。
分析:此题能根据质量守恒定律,由于生成物C 和D 的质量共140g ,所以A 和B 的质量之和也应为140g 。
由于反应物A 、B 的质量比为3:4,则可将物质总质量视为7份(3+4=7),A 占其中3份,B 占其中4份。
所以消耗B 的质量为140÷7×4=80g 。
例2 在化学反应3X+4Y=2Z 中,已知X 和Z 的相对分子质量分别是32和102,则Y 的相对分子质量为_____。
利用化学方程式的简单计算
根据化学方程式计算的注意事项:
( 1).化学式、方程式书写要正确。 (2). 根据物质的组成及化学方程式 求各化学式的相对分子质量(或相对 原子质量)与化学式前边计量数的乘 积,计算时必须准确无误。
(3). 解题格式的书写要规范化。
(4). 注意单位的书写要求。
练习一:15.5克红磷在氧气中充分燃烧,可 生成五氧化二磷多少克?
说明:在化学反应中,反应 物与生成物之间的质量比是 成正比例关系。因此,利用 正比例关系根据化学方程式 和已知的一种反应物(或生 成物)的质量,可求生成物 (或反应物)的质量。
[例题]:3克镁在氧气中充分燃烧,可以生成多少克氧化镁? 解:设可生成氧化镁的质量为X 点燃 2 Mg + O 2 ====== 2 Mg O 48 80 3克 X 48 ------ = 3克 -----80 X (1)设未知数 ….... …….….设
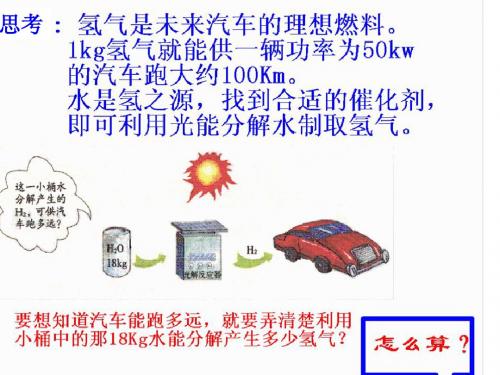
思考
一种思路:可根据化学式的计算求解 理由:水中的氢元素全部转化为氢气 解:18kg水中氢元素的质量 = 18kg × 2H × 100% H2O 2×1 × 100% = 18kg × 2×1+16 =2kg
产生氢气的质量为2kg。
若某种元素没有全部转化到某种物质(生成物) 中去,求该物质的质量该怎么办? 如用6g H2O2制O2,可得到多少克O2? 可见根据化学式计算有它的局限性 思路二:利用化学方程式来计算
×
练习二、过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小。小 军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质 质量分数。他们取出该溶液51g,加入适量二氧化锰,生成气的质量与 反应时间的关系如图所示。 (1)完全反应后生成氧气的质量为 。
(2)计算该溶液中溶质的质量分数。 解(1)由题意可知生成氧气的质量为: 0.48克。 (2)设H2O2的溶质质量分数为X 2H2O2 MnO 2 2H2O+O2↑ 68 32 51g ×X 0.48g
初中利用化学方程式的简单计算(共31张PPT)

56
2
65
2
m
x
m
y
7、加热15.8g高锰酸钾,当产生1.6g氧气时,固体剩余物的成分是( )
A
A.K2MnO4和MnO2
B.KMnO4、K2MnO4和MnO2
C.KMnO4和MnO2
D.KMnO4和K2MnO4
思路:根据氧气的质量来求生成这么多氧气需要分解多少克高锰酸钾。要注意到15.8克
高锰酸钾有可能没有全部分解。所以15.8克这个数据在此不能直接用于计算。
316 ∶
197 ∶ 87 ∶ 32
65 2 14、有X、Y两种元素,12gX2与XY3反应生成24gC,若反应的化学方程式为X2 + XY3 === 3C,则X、Y两元素的相对原子质量之比为(
= )
13g 2KClO3 ==== 2KCl + 3O2↑
X
(2)气体、液体的体积,要换算成气体、液体的质量。
65
2
5g-3.7g
X
65
2
1.3g = X
X = 0.04g
答:生成氢气的质量为0.04克
4、把23克乙醇(俗称酒精)在空气中充分燃烧后,只生成27克水和44克二 氧化碳,由此推断乙醇由几种元素组成?
思路:乙醇中肯定有什么元素? 为什么有? 乙醇中的C元素、H元素的质量是多少? 怎么计算?
C:44克× H 27克×
65
1
2CX.铁+ 生Y2锈=以=后= 2总Z2质K量M 比原n来O铁的4=加质==量热=大 K2MnO﹢4 MnO2﹢ O2
该 A.物煤质燃中烧碳后、剩氢余元2煤素×渣的的1质质5量8量比小为于3煤︰的1 质量
32
6g A.CH4 B.C2H2 C.CH3OH D.C2H5OH
如何进行化学方程式的计算

如何进行化学方程式的计算化学方程式是描述化学反应的一种方式,通过化学方程式可以知道反应物之间的摩尔比例关系以及生成物的数量。
在进行化学方程式的计算时,可以按照以下几个步骤进行:
1. 确定已知条件:在进行化学方程式的计算前,首先需要明确已知的条件。
这可以是给定的物质的摩尔数、质量或体积,或者是反应物或生成物的化学计量比等。
2. 列出化学方程式:根据反应物和生成物之间的化学计量关系,自己或者从题目中给定的条件中,可以列出化学方程式。
确保方程式中的反应物和生成物都是经过平衡的。
3. 计算物质的摩尔数:根据已知条件,计算所有涉及到的物质的摩尔数。
摩尔数可以通过质量和摩尔质量之间的关系进行计算,或者通过体积和浓度之间的关系进行计算。
4. 根据化学计量比计算其他物质的摩尔数:根据化学方程式中反应物和生成物之间的化学计量关系,可以利用已知的摩尔数计算其他物质的摩尔数。
通常情况下,摩尔比就是化学方程式中的系数比。
5. 计算所需物质的质量或体积:根据已知的摩尔数和物质的摩尔质量或摩尔体积,可以计算出所需物质的质量或体积。
这个步骤可以根据题目中的具体要求进行计算。
6. 检查计算结果:在完成计算后,要对结果进行检查,确保计算正确无误。
可以验证各个物质的摩尔数是否符合化学方程式中的化学计量关系,以及物质的质量或体积是否满足题目给定的条件。
通过以上的步骤,可以较为准确地进行化学方程式的计算。
在实际操作中,还要注意保留有效数字,并进行适当的单位换算,同时注意反应的温度、压力等条件对结果的影响。
利用化学方程式计算的一般步骤

利用化学方程式计算的一般步骤
利用化学方程式计算的一般步骤
利用化学方程式计算的一般步骤:
(1)根据化学方程式计算的依据:
利用化学方程式计算的理论基础是质量守恒定律, 计算时依据化学方程式中反应物、生成物各物质之间的质量比
(2)利用化学方程式计算的一般步骤:
②写出化学方程式
③写出有关物质的式量、已知量和未知量
④列比例式, 求解
⑤简明地写出答案
(3)根据化学方程式计算应该注意的事项
①正确书写化学方程式, 准确列出有关反应物或生成物的质量比;
②列式时, 各物质的质量单位必须统一, 对应关系要正确;
③反应物、生成物都必须是纯净物, 如果是混合物, 应该将不纯物的质量按题意转化为纯净物的质量;
④解题的过程要完整, 规范
⑤设未知数是要指明物理量, 不要带单位.。
化学方程式计算的步骤

实际产量与理论产量的比值乘以 100,得到百分比产率。
THANKS FOR WATCHING
感谢您的观看
化学方程式到古代的炼金术和冶金学,但直到19世纪中叶,随着化学工业的快速发展,化学 方程式计算才逐渐形成完整的体系。
发展
随着计算机技术的进步,化学方程式计算逐渐向自动化、智能化方向发展,出现了许多计算化学软件和应用,大 大提高了计算效率和精度。同时,化学方程式计算也在不断拓展其应用领域,从传统的化工生产向新能源、新材 料、生物医药等领域延伸。
确定质量关系
根据反应系数和质量守恒定律,计算出反应物和生成物的质 量关系。
根据质量关系计算反应物和生成物的质量
计算反应物的质量
根据反应物在化学方程式中的质量关系,计算出反应物的质量。
计算生成物的质量
根据生成物在化学方程式中的质量关系,计算出生成物的质量。
计算反应的百分比
计算百分比
根据反应物和生成物的质量,计算出反应的百分比。
实例
如反应 A + B → C + D + BaSO₄ 中,如果知道反应物的 物质的量或质量,以及沉淀的系数和摩尔质量,就可以计 算出沉淀的质量或物质的量。
04 化学方程式计算的应用实 例
计算反应物的质量比
确定化学反应方程式
01
首先需要知道化学反应的具体方程式,包括反应物的分子式和
系数。
计算各反应物的质量
考虑反应物的质量和消耗量
在计算生成物质量时,需要考虑参与反应的反应物的质量和实际消 耗量。
计算反应的百分比产率
确定化学反应方程式
需要知道化学反应的具体方程 式,包括产物的分子式和系数
。
计算理论产量
利用化学方程式的计算步骤

利用化学方程式的计算步骤化学方程式是描述化学反应的符号表示法,可以用来表示反应物与生成物之间的化学变化关系。
通过化学方程式,可以对化学反应进行定量计算和分析,包括反应物的摩尔比例、生成物的摩尔比例、反应的产物量和反应的热效应等。
化学方程式的计算步骤可以分为以下几个部分:1. 确定反应物和生成物:首先根据实验条件或已知信息确定反应物和生成物的种类和物质量。
例如,对于氧化铁的制备反应Fe + O2 -> Fe2O3,反应物是铁和氧气,生成物是氧化铁。
2. 平衡化学方程式:化学方程式中的反应物和生成物要满足质量守恒和电荷守恒定律。
根据元素的原子数目和化合价,可以将方程式中的反应物和生成物的系数进行调整,使得反应物和生成物的原子数目平衡。
例如,对于以下不平衡方程式:C2H2 + O2 -> CO2 + H2O可以通过调整系数,使得方程式平衡,变为:2C2H2 + 5O2 -> 4CO2 + 2H2O3. 计算摩尔比例:根据平衡化学方程式中的系数,可以计算出反应物和生成物之间的摩尔比例关系。
摩尔比例可以用来计算反应物的摩尔量或生成物的摩尔量。
例如,在上述平衡方程式中,可以得到以下摩尔比例:2 mol C2H2 : 5 mol O2 : 4 mol CO2 : 2 mol H2O4. 计算反应的产物量:根据已知的反应物的质量或摩尔量,可以通过摩尔比例计算出生成物的摩尔量或质量。
例如,如果已知反应物C2H2的质量为10 g,可以通过摩尔比例计算出生成物CO2的质量: 10 g C2H2 * (4 mol CO2 / 2 mol C2H2) * (44 g CO2 / 1 mol CO2) = 88 g CO25. 计算反应的热效应:化学方程式中的系数还可以表示反应的热效应,即反应的放热或吸热情况。
正系数表示反应放热,负系数表示反应吸热。
通过已知的反应物和生成物的热效应,可以计算出反应的热效应。
利用化学方程式的简单计算1

36
32
18g
x
—33—62 =1—8xg— 解得 x=16g
强化练习
3、在2A+3B=2C+4D中,3.2g A与9.6g B恰好完全反应生成5.6g C,已知D的相对分子质
量为18,则C的相对分子质量为( B )
A.6 B.28 C.44 D.64
【方法点拨】根据质量守恒定律可求D的质量,进而根据D的相对分子质量,C、D的质量
48 32 80 故镁、氧气、氧化镁的质量比是48:32:80。
强化练习
2、完全电解18g水产生氧气的质量是( C )
A.2 g B.4 g C.16 g D.32 g
【方法点拨】根据分解的水的质量,由反应的化学方程式计算出产生氧气的质量即可。
【解析】解:设产生氧气的质量是x。 2H2O通==电=2H2↑+O2↑
解:反应后剩余3g氢气,说明氧气和氢气反应了9g,
设参加反应的氢气质量是x,则氧气就是(9g-x),
点燃
2H2+O2===2H2O 4 32
x 9g-x —342—=9—gx-—x 解得 x=1g
所以混合气体中氢气的质量是1g+3g=4g
方法二:根据质量守恒定律,生成水的质
量为12g-3g=9g
点燃
设B的相对分子质量为x。
A + 3B = 2C + 2D
28 3x
14g 48g
28 3x
=
14g 48g
解得 x=32
化学方程式质量比的表示方法: (1)实际质量之比(g) (2)相对分子质量×化学计量数之 比
新课讲解
【例题4】氢气和氧气的混合气体12g,点燃充分反应后,还剩余了3g氢气,则混合气体 中含有氢气多少克?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
245 ——
X
=
—96— 1.92g
X= 4.9g
(3) KClO3 和MnO2 KCl 和MnO2
6克
4.08克
6g - 4.9g = 1.1g 4.08g - 1.1g = 2.98g
挑战题: 1、高炉炼铁的主要反应是:
高温
Fe2O3+3 CO
2 Fe + 3 CO2
计算20吨含氧化铁80%的铁矿石,可以炼出多 少吨铁? 2、含杂质15%的石灰石(主要含碳酸钙)200 克,应含有碳酸钙的质量的计算过程是 ________。充分分解后所得CaO的质量是多少 ?
深化练习
1. 氢气在氯气中燃烧生成氯化氢气体,燃烧100g 氢气需要氯气多少克?Cl—35.5 H—1
解:设燃烧100g氢气需要氯气的质量为X
H2 + Cl2 点燃 2HCl
2
35.5×2
100 g
X
2×36.5
2
=
35.5×2
100 g X
X=
35.5×2 ×100g 2
= 3550g
答:需要氯气3550g。
四.有关不纯反应物或生成物的计算。
1.化学反应方程式中不管是反应物还是生成 物,代入的都是纯物质的质量.如果遇到不纯 反应物或生成物,应将不纯物质换算成纯物质 的质量. 2.不纯物质和纯物质质量间的换算.
纯物质的质量 = 不纯物质的质量 ×纯度(质量分数)
2.将氯酸钾和二氧化锰的混合物6g放在试管 中,加热不再产生气体为止,剩余固体的质量 为4.08g问:
3.氢气在氯气中燃烧生成氯化氢气体,燃烧100g氢
气需要氯气多少克?生成氯化氢气体多少克? Cl— 35.5 H—1
解:设燃烧100g氢气需要氯气的质量为X,生成氯化氢气
体的质量为Y
H2 +
Cl2 点燃 2HCl
2
100 g
2
=
35.5×2
35.5×2 X 100 g X
2×36.5 Y
2 =
2×36.5
解:设所需液氧的质量为X
2H2 + O2 点 燃 2H2O
4
32
275Kg X
4
32
=
275Kg
x
X=2200Kg
答:所需液氧的质量为2200Kg。
本课小结
利用化学方程式计算的步骤: (1)设未知数 (2)写出化学方程式并配平
上标质量比
(3) 写出有关物质的量
下标已知质量和未知量
(4) 列比例式,求解 (5) 简明地写出答案
借你一双慧眼
1、加热分解10g高锰酸钾,可以得到多少克氧气? 解:设加热分解10g高锰酸钾,可以得到氧气的质量为Xg
KMnO4===K2MnO4+MnO2+O2↑
158
32
10g
X
158 ----------
=
--1-0--g-
32
X
X = -3-2--×---1-0--g-158
= 2g
答:加热分解10克高锰酸钾,可以得到氧气2克。
(1)反应中制得了多少克氧气?
(2)原混合物中有多少克氯酸钾?
(3)剩余固体中含有哪些物质?各是多少克?
解:(1)根据质量守恒定律,O2的质量为 6g - 4.08g = 1.92g
(2)设原混合物中氯酸钾的质量为x。
2 KClO3
MnO2 △
2 KCl + 3O2↑
245
149 96
X
1.92g
100 g Y
X=
35.5×2 ×100g 2
= 3550g
Y = 36.5×2 ×100g 2
答:需要氯气3550g,生成氯化氢3650g
= 3650g
三.关于质量和体积间的换算 气体的质量=气体的体积×气体的密度
1.实验室用13g锌粒与足量的稀硫酸反应制取氢气。
(已知:Zn+H2SO4===ZnSO4+H2↑) 计算:(1)生成氢气的质量为多少克?
2. 氢气在氯气中燃烧生成氯化氢气体,燃烧100g
氢气生成氯化氢气体多少克? Cl—35.5 H—1
解:设生成氯化氢气体的质量为X
H2 + Cl2 点燃 2HCl
2
35.5×2
100 g
2×36.5 X
2 =
2×36.5
100 g X
X = 36.5×2 ×100g = 3650g 2
答:生成氯化氢3650g。
(2)这些氢气在标准状况下的体积是多少升?
(标准状况下,氢气密度为0.0899g/L)
解: 设生成氢气的质量为X
Zn+H2SO4===ZnSO4+H2↑
65
2
13g
X
65
2
=
13g
X
X = 0.4g
V氢气=
m氢气
0.4g
=
≈4.4L
ρ 0.0899g/L
氢气
答:生成氢气的质量为0.4克,这些氢气在标准状况下的体积是4.4L。
课题3 利用化学方程式的 简单计算
2H2 + O2
4 : 32
点燃
2 H2O
: 36
4g ( 32g)
( 36g)
1g ( 8g )
( 9g)
0.567g ?
?
H2、O2、H2O之
间在的化质学量比反是 应中多少,?反
应物与生
成物之间
的质量比
成正比例 关系
例1、加热分解6.3克高锰酸钾,生成氧气多少克? K——39 Mn——55 O——16
利用化学:
1.正确写出化学方程式 2.已知量和未知量写在相应物质的下方
3.单位不一致时,必须进行单位换算 4. 计算结果按题中要求保留小数,若题中没有要求,又得 不到整数时,一般保留一位小数.
动动手
已知,火箭升空至少要携带275kg的液氢,充分燃烧才能获 得足够的能量。你会在火箭助燃仓中填充多少千克的液氧 来满足这些液氢的完全燃烧?
解:设可生成氧化镁的质量为X
m(mO2(O) ) 1.43g / L 11.2L 16g
点燃
2 Mg + O 2 ====== 2 Mg O
32
80
1161g.2L
X
32 16g
------ = ------
80
X
X = -8-0--×---1-6--g--
32
= 40 g
答:充分燃烧后可生成氧化镁 40 g。
例4:6克镁粉与8克氧气充分反应后能生成氧化镁多 少克?
>
∴
3.根据化学方程式计算的注意事项:
(1)所有代入化学方程计算的量必须是纯净物的质量,如果 是不纯物,则需要转换。
纯物质的质量=不纯物质质量×纯度=不纯物质质量×(1-杂 质的质量分数)
2、电解9g水,能得到氢气的质量为多少? 解:设能得到氢气的质量为X
通电
2H2O
2H2 + O2
36
4 32
9g
X
注 未 应
36 32
=
9g X
X =16g
答:能得到氢气16g。
3、足量的镁带在标准状况下与11.2升的氧气(密度为 1.43g/L) 充分燃烧,可以生成多少克氧化镁?(Mg—24 O—16)
