强电解质的活度及活度系数.
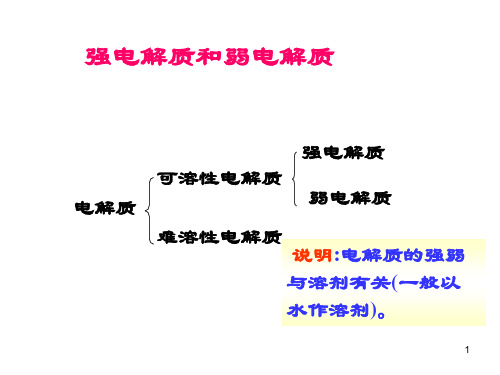
强电解质和弱电解质
(4)液态或固态的纯物质,以及稀溶液中的 溶剂(如水),其活度均规定为aBonic strength)
(3.3)
式中, bi和 zi分别为溶液中第i 种离子的质 量摩尔浓度和该离子的电荷数,近似计算时, 也可以用ci代替bi 。
已解离的分子数 原有分子总数
(3.1)
在相同浓度下,不同电解质的电离度大小 反映了电解质的相对强弱,解离度就愈小,电 解质愈弱
4
表3-1 强电解质的表观电离度 (298K,0.10mol·L-1)
通常按解离度的大小,把浓度为 0.1mol·kg-1的电解质溶液中解离度大于30%的 称为强电解质,解离度小于5%的称为弱电解 质,而解离度介于5%~30%的称为中强度电解 质。
例如:醋酸的解离平衡如下式所示:
HAc + H2O
H3O + + Ac-
在平衡状态下,弱电解质在水溶液中的解离
程度的大小可以定量地用解离度ɑ来表示:
3
解离度(degree of ionization):符号为α 是指在一定温度下当解离达到平衡时,已解 离的弱电解质分子数与解离前分子总数的比率。
α=
离子氛是一个平均统计模型,虽然一个离 子周围的电荷相反的离子并不均匀,但统计结 果作为球形对称分布处理。
6
三、离子的活度和活度系数
离子的活度aB(activity):它是电解质溶液 中实际上能起作用的离子浓度。
aB = γ·cB/ cθ (3.2)
式中 γ称为溶质B的活度系数(activity coefficient)
例如:
NaCl HCl
Na+ + Cl- (离子型化合物) H+ + Cl- (强极性分子)
强电解质的活度及活度系数解读课件

模型计算法
定义
模型计算法是一种利用经验或 半经验模型计算活度和活度系
数的方法。
方法
根据已知的实验数据或经验公 式,建立模型,通过输入参数 得到活度和活度系数的估计值 。
优点
操作简和可靠性取决于 模型的可靠性和适用范围,可
能存在较大的误差。
03
强电解质活度系数的 影响因素
活度及活度系数的概念
• 活度是指电解质在溶液中的实际有效浓度,它包括了离子间的相互作用。活度系数则是用来衡量活度的一个指标,它描述 了实际溶液与理想溶液之间的偏差程度。
活度系数的重要性
• 活度系数对于理解溶液的物理化学性质以及反应机理至关重 要。它不仅可以帮助我们了解离子在溶液中的实际浓度和行 为,还可以帮助我们预测溶液的某些性质,如电导率、离子 迁移率等。此外,在化学反应中,活度系数还可以帮助我们 理解反应如何进行,以及反应速率如何受到离子强度、温度 等因素的影响。
要点二
详细描述
在电解过程中,电解质的活度和活度系数是重要的物理量 ,它们的大小直接决定了电流效率、电极反应等关键参数 。通过调整电解质的活度和活度系数,可以优化电解过程 ,提高电流效率,减少副反应,提高产品的质量和产量。
电池设计优化
总结词
强电解质的活度及活度系数对电池设计具有指导意义。
详细描述
电池设计过程中,电解质的活度和活度系数是重要的设 计参数。通过研究和掌握这些参数,可以优化电池设计 ,提高电池的能量密度、功率密度、循环寿命等关键性 能指标,同时也可以提高电池的安全性。
温度的影响
温度对强电解质活度系数的影响
随着温度的升高,强电解质的活度系数通常会增大,因为高温可以促进离子的 运动和溶剂的蒸发,从而增加离子的有效碰撞和溶解。
水质分析化学 第三章 酸碱滴定法

共轭酸碱对HA和 共轭酸碱对HA和A- 有如下关系 HA
2. 活度系数的计算
γi的大小不仅与溶液中各种离子的总浓度有关,也与离子
的电荷有关, Debye- ckel极限公式近似求解 Debye-Hückel极限公式近似求解: 极限公式近似求解:
lg γ i = −0.5Z
式中:Zi-i离子的电荷
I-溶液中的离子强度
2 i
I (Ci 〈0.1mol / L)
一、酸碱质子理论( 1923年,丹麦Bronsted和英国Lowry提出 1923年 丹麦Bronsted和英国Lowry Bronsted和英国Lowry提出
)
酸——溶液中凡能给出质子的物质 溶液中凡能给出质子的物质 碱——溶液中凡能接受质子的物质 溶液中凡能接受质子的物质
酸碱半反应: HA 酸 A- + H+ 碱 质子
第三章 酸碱滴定法
活度和活度系数 酸碱质子理论 酸碱平衡中有关浓度的计算 酸碱指示剂 酸碱滴定和指示剂的选择 水中的碱度和酸度 滴定误差
§3-1
活度和活度系数
1. 离子活度和活度系数
活度:离子在化学反应中起作用的有效浓度。 活度系数:活度与浓度的比值,代表了离子间力的大小。
a= γiC 其中a表示离子的活度; γi表示离子的活度系数 对于无限稀的强电解质: γi =1; 对于较稀的弱电解质: γi 1,a≈C 对于较稀的强电解质: γi < 1,a<C 中性分子: γ=1
强电解质溶液理论简介

当溶液很稀,可看作是理想溶液,B,m1,则:
aB,m
mB mo
强电解质溶液的活度和活度系数
对强电解质:
(1)强电解质几乎完全电离成离子,整体电解质 不复存在,其浓度与活度的简单关系不再适用;
(2)与极稀的非电解质溶液可视作理想(稀)溶液, 活度系数近似等于1不同,对极稀的强电解质溶液, 由于离子间的相互作用,使它比非电解质溶液的 情况复杂得多,此时的活度与理想(稀)溶液的活度 仍有一定的偏差。
• 离子氛:每一离子周围被相反电荷离子包围,由于 离子间的相互作用,使得离子在溶液中不是均匀分 布,而是形成了球形对称的离子氛。
离 子 氛 示 意 图
负离子
正离子
中心正离子 中心负离子
Debye-Hückel 离子互吸理论要点:
ⅰ.离子氛的离子分布遵守Boltzmann分布律,电荷密 度与电位的关系遵守Poisson公式。
8kTa
kT 2e2Lsln
1
I
化简得:
ln j
Azj2 1 Ba
I I
其中:
B
2e2 Ls ln
e2 A
2e2Lsln
kT
8kT kT
采用平均活度系数时
ln
Az z 1 Ba
I I
对于水溶液: A0.509 mol1kg1/2 B0.3291010 mol1kg1/2m1
当溶液极稀时,Ba I 1 可得Debye-Hückel极限公式
B (o RTlna)(o RTlna) (o RTlna)(o RTlna)
类似的,定义
离子平均活度系数(mean activity coefficient of ions)
def
医用化学 第五章 电解质溶液

酸和碱的离解常数具体反映了酸碱的强度,酸的 Ka越大,酸就越强;若碱Kb的越大,碱就越强, 在共轭酸碱对中,酸Ka的越大,则碱的Kb越小
第三节 溶液的酸碱性及PH值计算
一、水的质子自递平衡 水的离子积常数 Kw [H+][OH-]
25oC时,Kw = 1.00 × 10-14 [H+] = [OH-] = 1.00 ×10-7 (mol· L-1)
第二节 缓冲溶液 (buffer solution)
一、缓冲溶液的组成及缓冲原理
( 一) 缓冲作用与缓冲溶液:
能对抗外来少量强酸、强碱或稍加稀释而 保持溶液pH值基本不变的作用叫做缓冲作用; 具有缓冲作用的溶液,叫做缓冲溶液。
(二)缓冲溶液的组成
缓冲溶液由较高浓度的共轭酸和它的 共轭碱组成
1.弱酸及其对应的盐
一、强电解质溶液
(一)离子相互作用理论
强电解质的解离度都小于100%
(二)活度和活度系数
活度—有效浓度
公式5.1,5.2
二.弱电解质溶液 (一) 解离平衡和解离常数
HAc
+
H2O
H+
H3O+
+
Ac-
简写为: HAc
Ka
+ H
Ac
HAc
Ac
注意:1. ka是弱酸解离常数,反映解离能力 的相对强弱 2. ka只随温度改变,不随浓度改变
二、溶液的酸碱性表示
PH定义 PH = -lg[H+] PH越小,溶液酸性越强; PH越大,溶液碱性越强
PH = 7 溶液显中性 PH > 7 溶液显碱性 PH < 7 溶液显酸性
三、 酸、碱溶液pH值的计算
强电解质溶液的活度与活度系数

5.3 强电解质溶液的活度和活度系数5.3.1 电解质溶液的活度和活度系数对于非理想溶液,其溶质的化学位可表示为:m a RT ln +=*μμ,m a m γ=m a — 活度(有效浓度) *μ—标准状态时的化学位,即1a m =时的化学位。
m — 溶质的质量摩尔浓度 γ — 活度系数对于强电解质溶液,由于电解质在溶剂中解离为离子,故m a m γ=关系不适用于溶质的整体,但对离子本身仍然适用,即:+++γ=m a ,---γ=m a 设某电解质 -+ννA M 在溶液中电离:--++ννν+ν→-+z z A M A M这时:+*+++=a RT ln μμ, -*--+=a RT ln μμ 而:--++*+=+=μνμνμμa RT ln又: *--*++*μν+μν=μ 故: -+ν-ν+⋅=a a a因为溶液是电中性的,各种离子的γ、m 无法通过实验测定,而引出“平均离子活度”的概念。
令: -+ν+ν=ν定义:平均离子活度 ()νν-ν+±-+⋅=1a a a 平均离子活度系数 ()νν-ν+±-+γ⋅γ=γ1平均离子浓度 ()νν-ν+±-+⋅=1mm m又: m m ++ν=,m m --ν= 得: ① ±±±γ=m a② ()νν-ν+ν±-+ν⋅νγ=ma表格1 298K 时一些1-1价型电解质溶液中TlCl 饱和溶液的±γ5.3.2 离子强度由下表可知,当21m m +<0.021kgmol -⋅时,TlCl 的±γ只与(21m m +)有关而与外加电解质的种类无关。
1921年,路易斯(Lewis )等人在研究了大量不同离子价型电解质对活度系数的影响之后,总结出一个经验规律:在稀溶液中,电解质离子的平均活度系数±γ与溶液中总的离子浓度和电荷有关,而与离子的种类无关。
总的离子浓度和电荷对±γ的影响可用公式描述:I z z A -+±-=γlg ——德拜-休克尔(Debye-H ückel )极限公式A 是一个只与温度和溶剂性质有关的常数,对于25℃的水溶液,A=0.509kg/mol ;+z 和-z 分别为正负离子的价数;I 为离子强度,它被定义为∑=ii i z m I 221i m 和i z 分别为离子i 的质量摩尔浓度和价数。
第三章电解质溶液

(c )2 c c
c 2 1
加水稀释, 平衡右移,
增大
∵ HA是弱电解质, < 5 %,1- 1,
∴ K a c 2
Ka
c
(无外加酸或碱)
一定温度下,与HA初始浓度的平方根成反比
24
(2)同离子效应:在已经建立平衡的弱电解质 溶液中,加入与其含有相同离子的强电解质, 而使平衡向降低弱电解质解离度方向移动的作 用称为同离子效应。
如:在1L0.10 molL-1HAc溶液中加入0.10mol NaCl
HAc + H2O NaCl
H3O+ + AcNa+ + Cl-
Ka
a a H3O Ac aHAc
H3O [H3O ] Ac [ Ac ]
[HAc]
H3O Ac (0.10 )2 0.10(1 )
H3O
Ac 0.10 2
1、活度:在单位体积的电解质溶液中,表现出的 能起作用的离子浓度。
aB= B(cB /c )
( B < 1 )
2、活度系数:反映了电解质溶液中离子相互牵制
作用的大小。
4
a、溶液浓度越大;离子电荷越高,离子间的牵制
作用越大,B越小,aB和cB差距越大。
b、溶液极稀时,离子间相互作用极微小,B 1, aB cB 。
a. 从化学组成上揭示了酸碱的本质; b. 成功解释了中和热的实验事实; c. 不能解释非水溶剂体系的酸碱性; d. 不能解释Na2CO3, Na3PO4, NH3呈碱性的事实
9
二、酸碱质子理论
1、酸碱的定义:
酸(acid): 给出质子(H+) 碱(base):接受质子(H+)
电解质溶液的活度和活度系数

•
G T,P = Wf, max
33
G T,P = Wf, max
•
若非膨胀功 Wf 仅电功一种,即对于可
逆电池反应:
G T,P = W电,max = -nEF
即: m a m
mi ai i m
对于强电解质:m+= + m,m= m
13
例:
(1)HCl 溶液,浓度 m,则:
m = (m++ m ) 1/
=(mm)1/2 = m = (+ )1/2
a = (m / m )· =(m /m)
对1-1型电解质: ai= a+ · a
9
2. 平均活度 a、平均活度系数
电解质溶液中正、负离子总是同时存在; 热力学方法只能得到电解质的化学势和活度; 得不到单种离子的化学势和活度。 所以我们采用正、负离子的平均活度 a 来表 示电解质溶液中离子的活度。
10
定义离子平均活度:
的“离子氛”,而该离子
同时又为别的中心离子的
“离子氛”的一员。
“离子氛”模型可以把溶液中非常复杂的大量离子之 间的相互库仑作用能等效地归结为中心离子与“离 子氛”之间的作用 大大简化了所研究体系。
28
三、电解质溶液的活度系数
1. 离子 j 的活度系数 j
2 log j A Z j I
或表达成:
i = i (T ) + RT ln ai
比较上两式: i (T) =+ + (T) + (T) —— 假想标准态化学势 ai= a+ + a —— 离子活度之幂乘积
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
这个公式只适用于强电解质的稀溶液、离
子可以作为点电荷处理的体系。式中 为离子
平均活度系数,从这个公式得到的
为理论计
算值。用电动势法可以测定 的实验值,用来
检验理论计算值的适用范围。
本节告一段落.
van’t Hoff因子
实验中发现电解质溶液的依数性比同浓度非电解
质的数值大得多,van’t Hoff用一个因子表示两者的
m
(m
m
)1
[(
mB
)
(
mB
)
]1
( _
)1
mB
对1-1价电解质
m mB
另外,以Na2SO4为例
从大量实验事实看出,影响离子平均活 度系数的主要因素是离子的浓度和价数,而 且价数的影响更显著。1921年,Lewis提出 了离子强度(ionic strength)的概念。当浓 度用质量I摩尔浓度表示时,离子强度 I 等 于:
1
aB 1(molkg-1)12
则
lg
A| 1
zz | I / m
I
弛豫效应(relaxation effect)
由于每个离子周围都有一个 离子氛,在外电场作用下,正负 离子作逆向迁移,原来的离子氛 要拆散,新离子氛需建立,这里 有一个时间差,称为弛豫时间。
在弛豫时间里,离子氛会变 得不对称,对中心离子的移动产 生阻力,称为弛豫力。这力使离 子迁移速率下降,从而使摩尔电 导率降低。
def ( )1
离子平均质量摩尔浓度(mean molality of ions)b±,或m±
m def (m m )1
a
m m
aB a a a
(
m m
)
从电解质的 mB求 m
m mB m mB
考虑弛豫和电泳两种效应,推算出某一浓度时电解 质的摩尔电导率与无限稀释时的摩尔电导率之间差值的 定量计算公式,称为 Debye Huckel's Onsager 电导公式:
L
m
L
m
(
p
qL
m
)
c
式中 p 和 q 分别是电泳效应和弛豫效应引起的使L m的 降低值。这个理论很好地解释了克尔劳乌施的经验式:
电泳效应(electrophoretic effect)
在溶液中,离子总是溶剂化的。在外加电场作用 下,溶剂化的中心离子与溶剂化的离子氛中的离子向 相反方向移动,增加了粘滞力,阻碍了离子的运动, 从而使离子的迁移速率和摩尔电导率下降,这种称为 电泳效应。
Debye Huckel's Onsager 电导公式
这是德拜-休克尔理论 中的一个重要概念。他们认 为在溶液中,每一个离子都 被反号离子所包围,由于正、 负离子相互作用,使离子的 分布不均匀。
若中心离子取正离子,周围有较多的负离子,部分电
荷相互抵消,但余下的电荷在距中心离子 r 处形成一
个球形的负离子氛;反之亦然。一个离子既可为中心 离子,又是另一离子氛中的一员。
偏差,这因子称为van’t Hoff因子或van’t Hoff系数,
用 i 表示。 非电解质
电解质
pA pA* xB
pA i pA* xB
Tb kb mB
Tf kf mB
P B cB RT
Tb i kb mB Tf i kf mB
P B i cB RT
离子氛(ionic atmosphere)
强电解质溶解后 HCl(aHCl ) H+ (aH+ ) Cl (aCl )
全部变成离子。为简
HCl
HCl
(T
)
RT
ln
aHCl
单起见,先考虑1-1价
H
H
(T
)
RT
ln
a
H
电解质,如HCl,
Cl
Cl
(T
)
RT
ln
a Cl
HCl H Cl
对于离子半径较大,不能作为点电荷处理的体系, 德拜-休克尔极限定律公式修正为:
lg
A | z z | 1 aB I
I
式中 a 为离子的平均有效直径,约为 3.51010 m ,B
是与温度、溶剂有关的常数,在298 K的水溶液中,
B
0.331010
(mol1
kg)
m 1 2
§6.4 强电解质的活度及活度系数
平均活度和平均活度系数 离子强度
非电解质化学势表示式
B
B
(T
)
RT ln B,m
mB m
B
(T
)
RT
ln
aB,m
aB,m
B,m
mB m
当溶液很稀,可看作是理想溶液, B,m 1 ,则:
aB,m
mB m
电解质化学势的表达式
RT
ln(a
a
)
B
RT
ln(
a
a
)
aB a a 以Na2SO4为例
定义: 离子平均活度(mean activity of ions)
a def (a a )1
=+
离子平均活度系数(mean activity coefficient of ions)
H Cl RT ln(aH aCl )
aHCl aH+ aCl
对任意价型电解质
M+ A +Mz+ Az
B
B
(T
)
RT
ln
aBຫໍສະໝຸດ (T)
RT ln a
(T
)
RT ln
a
B
lg i Azi2 I
式中 zi 是 i 离子的电荷,I 是离子强度,A 是与温度、
溶剂有关的常数,水溶液的AA 值有表可查。
298K,A=0.509(mol/kg)-1/2
由于单个离子的活度系数无法用实验测定来加以 验证,这个公式用处不大。
德拜-休克尔极限定律的常用表示式:
lg A | z z | I
I
1 2
mB zB2
B
式中mB是离子的真实浓度,若是弱电解质,应 乘上电离度。I 的单位与 m 的单位相同。
0.01mNa2SO4+0.2mCH3CH2OH的水溶液的I=?
德拜-休克尔根据离子氛的概念,并引入若干假
定,推导出强电解质稀溶液中离子活度系数 i 的计
算公式,称为德拜-休克尔极限定律。
