林可霉素工艺控制参数
盐酸林可霉素、硫酸大观霉素可溶性粉生产工艺规程

盐酸林可霉素、硫酸大观霉素可溶性粉生产工艺规程目录1 产品概述2 处方和依据3 工艺流程图4 制剂工艺过程及工艺条件5 原辅材料的预处理6 原辅材料质量标准和检查方法7 中间产品质量标准和检查方法8 成品质量标准和检查方法9 包装规格、包装材料质量标准10 说明书、产品文字说明和标志11 工艺要求12 设备一览表和主要设备生产能力13 技术安全与劳动保护14 劳动组织15 原辅料消耗定额16 包装材料消耗定额17 动力消耗定额18 综合利用与环境保护目的:制定本标准的目的是规范盐酸林可霉素、硫酸大观霉素可溶性粉生产过程,对一定数量的成品所需的起始原辅料和包装材料,以及工艺、加工说明、技术参数、注意事项等进一步标准化。
适用范围:适用于盐酸林可霉素、硫酸大观霉素可溶性粉生产全过程。
责任人:质量部部长、生产部部长、车间主任。
内容:1 产品概述:本品为盐酸林可霉素、硫酸大观霉素可溶性粉。
1.1 产品特点:1.1.1性状:本品为白色或类白色粉末。
1.1.6 贮藏:密闭,在干燥处保存。
1.1.7有效期:二年1.1.8批准文号:2.处方和依据2.1处方:30g盐酸林可霉素: 6.7g (林可霉素)硫酸大观霉素: 13.3g(大观霉素)无水葡萄糖:加至30g2.2处方依据:3生产工艺流程图及环境区域划分示意图4 制剂工艺过程及工艺条件4.1总述:按生产指令领取盐酸林可霉素原料药、硫酸大观霉素原料药和预处理过的无水葡萄糖,将盐酸林可霉素原料药、硫酸大观霉素原料药和预处理过的无水葡萄糖用等量递增法混合均匀,定量分装即可。
4.2分述:4.2.1投料量:为处方量的整数倍。
5 原辅材料的预处理5.1 按生产指令单领取无水葡萄糖粉的预处理按粉碎机操作规程操作,粉碎,使完全通过80目筛。
过筛结束后,检查合格将粉碎好的药粉装入洁净容器,称量、记录,挂上标签,注明品名、批号、数量、日期等,填写中间产品交接单,转入下工序。
进行物料平衡计算,收率97.0%~99.9%。
盐酸林可霉素注射液生产工艺

8
GMS-1A远红外隧道烘箱(PM1-05)
用途 本机广泛用于各种安瓿瓶、易拉瓶、西林瓶 及其它玻璃容器的干燥灭菌,也可供化工、 电子、食品等行业烘烤之用。
9
300L保温加热配液罐(PM1-10)
采用电热管水平插入夹套下部,夹套 内注入加热介质(导热油或水)用电
热管对导热油或水进行加热,产生热
能对罐内物料进行间接加热,配液罐 可用于中药、食品、化工等行业的液
6
主要生产设备:
QCA型超声波洗瓶机(PM1-02)
用途:本机用于水针安瓿瓶、口服液易拉瓶、片剂用黄元瓶的清
洗,也可供其他行业中的玻璃器具,机械零件的清洗。
7
安瓿甩水机
主要用途:该机采用高速旋转离心力来实现 甩干功能供制药厂清洗后的安瓿瓶、易拉瓶 脱水之用,将机注满的玻璃容器甩干,以便 进行烘干灭菌,是口服液,西林瓶安瓿瓶生 产的必备设备。
4
配制罐内,并用少量注射用水洗涤不锈钢桶,洗涤 液一并倒入罐内,搅拌均匀,测pH值后加入配制用 量的活性碳搅拌脱色5分钟,准备过滤。 2、粗滤:钛棒过滤器的滤芯孔径为1.0μm,检查 过滤器的完好性。将配制好的溶液经过过滤器进行 粗滤。过滤时应注意过滤器压力变化,过滤前后注 意滤芯的完整性,滤液泵入500L储液罐内。接到浓 配岗位过滤完成的通知后,加入注射用水至200L用 盐酸或氢氧化钠调PH应在5.0~5.5之间。继续在配 液罐内搅拌30分钟。
5
3、中间品检验:由QA取样送化验室进行中间产品 的检查。操作人员挂上黄色的待检标志,经质量部 出示中间产品合格报告单后,配液罐挂放绿色的合 格标志。 4、精滤:接到灌装通知后,将药液用过滤器进行 精滤,滤芯孔径为0.45μm、0.22μm。精滤好的药 液泵入高位罐,经高位罐输送至灌装间。盐酸林可 霉素注射液的配制、过滤时间应在4小时内完成。
A 盐酸林可霉素工艺规程

盐酸林可霉素(无菌粉)工艺规程起草人:日期:年月日审核人:日期:年月日批准人:日期:年月日有效日期:药业有限公司盐酸林可霉素(无菌粉)工艺规程目录1.主题内容 (3)2.适用范围 (3)3.职责 (3)4.产品概述 (4)5.工艺流程图 (4)6.依据 (5)7.操作过程及工艺条件 (5)8.工艺卫生................................................................................................... 错误!未定义书签。
10.原辅料、中间体、包装材料、成品以及工艺用水的质量标准和检验操作规程编码。
(10)11.物料平衡 (10)12.技术经济指标的计算及原料、辅料、包装材料消耗定额 (11)13.技术安全及劳动保护 (11)14.劳动组织与单位劳动定额、产品生产周期 (12)15.设备 (13)16.综合利用和环境保护 (13)17.附录 (14)1.主题内容本标准规定了原料药××××生产全过程的工艺技术、质量、物耗、安全、工艺卫生等内容,符合GMP规范要求。
本工艺规程具有技术法规作用。
2.适用范围本标准适用于原料药××××生产全过程,是各部门共同遵循的技术准则。
3.职责起草:原料车间主任审核:生产工程部经理、质量部经理批准:质量副总执行批准:QA主任执行:各级生产质量管理人员及操作人员监督管理:生产质量管理人员4.产品概述4.1.产品名称4.1.1.通用名:××××4.1.2.汉语拼音名:Yansuan Linkemeisu英文名:Lincomycin Hydrochloride4.1.3.产品概述4.1.4.主要成份:本品为****。
分子式:C18H34N2O6S2·HCl·H2O,分子量:461.02;分子结构式:按干燥品计算,含×××不得少于98.5%。
009.盐酸林可霉素片工艺规程
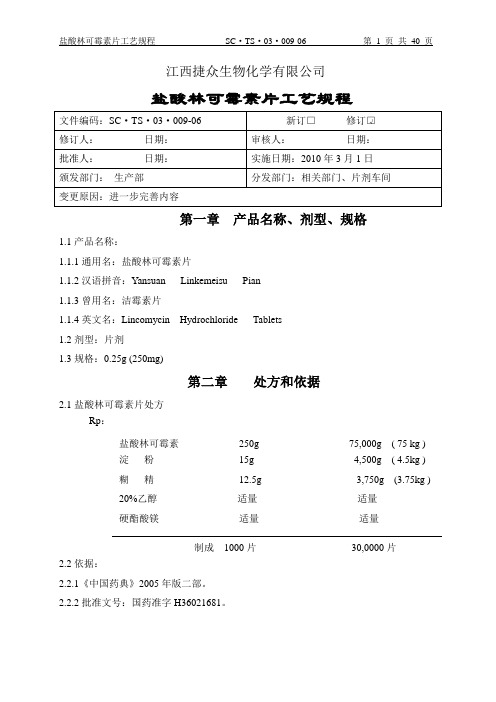
江西捷众生物化学有限公司盐酸林可霉素片工艺规程第一章产品名称、剂型、规格1.1产品名称:1.1.1通用名:盐酸林可霉素片1.1.2汉语拼音:Yansuan Linkemeisu Pian1.1.3曾用名:洁霉素片1.1.4英文名:Lincomycin Hydrochloride Tablets1.2剂型:片剂1.3规格:0.25g (250mg)第二章处方和依据2.1盐酸林可霉素片处方Rp:盐酸林可霉素250g 75,000g ( 75 kg )淀粉15g 4,500g ( 4.5kg )糊精12.5g 3,750g (3.75kg )20%乙醇适量适量硬酯酸镁适量适量制成1000片30,0000片2.2依据:2.2.1《中国药典》2005年版二部。
2.2.2批准文号:国药准字H36021681。
第三章工艺流程3.1片剂车间工艺流程图及区域图第四章操作过程与工艺条件4.1原辅料处理4.1.1操作过程4.1.1.1物料脱外包装经缓冲间,发现内包装有污物时用75%乙醇擦试,并贴上物料状态标示卡,方能进原辅料物暂存间。
4.1.1.2需粉碎的原辅料应进行粉碎、过筛。
4.1.1.3不需粉碎的原辅料用100~120目过筛。
4.1.2工艺条件4.1.2.1粉碎和过筛前核对品名、物料编号、批号、规格、重量、日期和操作者。
4.1.2.2粉碎和过筛应先开启除尘装置。
4.1.2.3料袋、筛网在每次使用前后,检查磨损和破裂情况,发现问题查明原因并及时更换。
4.1.2.4粉碎和过筛后原辅料细粉应在100~120目。
4.2称量4.2.1操作过程4.2.1.1按生产指令和要求分别核对原辅料品名、物料编号、规格、批号、生产厂家。
4.2.1.2按生产指令(配制指令)分别称取原辅料。
4.2.2工艺条件4.2.2.1处方(投料)量计算,称量及投料必须双人复核,操作者及复核者均应在记录上签名。
4.2.2.2称好的物料及时送配制间进行配制。
GMP质量体系林可霉素利多卡因凝胶生产工艺规程

目的:建立林可霉素利多卡因凝胶的生产工艺规程。
范围:林可霉素利多卡因凝胶的生产。
职责:生产管理部、质量管理部、车间主任、班长、工艺员、操作工、QA。
规程:1.品名、剂型与处方依据1.1通用名称:林可霉素利多卡因凝胶汉语拼音:Linkemeisu Liduokayin Ningjiao英文名: Lincomycin Hydrochloride and Lidocaine Hydrochloride Gel 1.2 剂型:凝胶剂1.3 处方与处方依据项的说明1.3.1处方:(制成10000瓶量)盐酸林可霉素 5亿单位盐酸利多卡因 404g雷弗奴尔 20g羟苯乙酯 100g卡波姆 850g三乙醇胺 850g甘油 7500g乙醇 1000ml亮蓝 3 g柠檬黄 1.94 g香草香精 300ml纯化水加至 100kg1.3.2 处方依据项说明:药品的生产批文:国药准字H44025261批准时间:2003年7月28日质量标准编号:S-QS/C-054-002.工艺流程示意图:检验→↓→↓←中间产品检验→↓↓↓←成品检验3.生产工艺操作要求、工艺技术参数:3.1配制:3.1.1配料操作工按照“软膏剂、凝胶剂配制岗位标准操作规程”SOP-MN/Z-(R)-001-00规定,在油相缸中加入甘油和处方量1/10量的纯化水,搅拌溶解均匀,抽入到真空乳化机内,与已用纯化水搅拌后浸透24小时的卡波姆混匀。
3.1.2在水相缸中将纯化水加热(85℃以上)溶解处方量的盐酸林可霉素、盐酸利多卡因、雷弗奴尔,在搅拌条件下,加入用乙醇溶解的处方量的羟苯乙酯。
3.1.3将以上物料抽入到真空乳化机内混和,保持搅拌,另加纯化水至足量,开真空机抽真空,20分钟后,加入亮蓝和柠檬黄、香草香精,再过5分钟后加三乙醇胺,再开真空机抽真空,搅拌大约5分钟即得。
3.2 中间品检验:检验室按“中间产品取样操作规程”规定,抽取配制好的胶体进行中间产品的检验。
盐酸林可霉素注射液生产工艺

体物料贮存,配液罐节能、浓缩、生
产能力强、清洗方便、结构简单等优 点。储罐可作储料罐、混料罐、暂存
罐、调配罐。
300L保温加热配液罐(PM1-10)
10
AY系列安瓿印字机
该机是药厂水针包装流水线用于印字 的主要设备,并带调速.本机主要用于 制剂厂针剂安培管形瓶的印字、包装。
11
AAG6/1-2型安瓿拉丝灌封机(PM1-07)
8
GMS-1A远红外隧道烘箱(PM1-05)
用途 本机广泛用于各种安瓿瓶、易拉瓶、西林瓶 及其它玻璃容器的干燥灭菌,也可供化工、 电子、食品等行业烘烤之用。
9
300L保温加热配液罐(PM1-10)
采用电热管水平插入夹套下部,夹套 内注入加热介质(导热油或水)用电
热管对导热油或水进行加热,产生热
能对罐内物料进行间接加热,配液罐 可用于中药、食品、化工等行业的液
6
主要生产设备:
QCA型超声波洗瓶机(PM1-02)
用途:本机用于水针安瓿瓶、口服液易拉瓶、片剂用黄元瓶的清
洗,也可供其他行业中的玻璃器具,机械零件的清洗。
7
安瓿甩水机
主要用途:该机采用高速旋转离心力来实现 甩干功能供制药厂清洗后的安瓿瓶、易拉瓶 脱水之用,将机注满的玻璃容器甩干,以便 进行烘干灭菌,是口服液,西林瓶安瓿瓶生 产的必备设备。
4
配制罐内,并用少量注射用水洗涤不锈钢桶,洗涤 液一并倒入罐内,搅拌均匀,测pH值后加入配制用 量的活性碳搅拌脱色5分钟,准备过滤。 2、粗滤:钛棒Байду номын сангаас滤器的滤芯孔径为1.0μm,检查 过滤器的完好性。将配制好的溶液经过过滤器进行 粗滤。过滤时应注意过滤器压力变化,过滤前后注 意滤芯的完整性,滤液泵入500L储液罐内。接到浓 配岗位过滤完成的通知后,加入注射用水至200L用 盐酸或氢氧化钠调PH应在5.0~5.5之间。继续在配 液罐内搅拌30分钟。
盐酸林可霉素工艺规程

盐酸林克霉素(无菌粉)原料药生产工艺规程目录1、适用范围 (2)2、引用标准 (2)3、职责 (2)4、产品名称及剂型 (2)5、产品概述 (2)6、生产工艺流程图 (3)7、工艺过程 (4)8、物料规格、质量标准 (4)9、生产工艺和质量控制检查成品质量标准 (4)10、技术安全与防火 (7)11、综合利用与“三废”治理 (8)12、操作工时与生产周期 (8)13、劳动组织与岗位定员 (8)14、设备一览表及主要设备生产能力 (9)15、原材料、动力消耗定额和技术经济指标 (9)16、物料平衡 (9)1、适用范围本规程规定了流感XXXXXXXXX生产全过程的工艺技术、质量、物耗、安全、工艺卫生、环境保护等内容,经验证合格,符合GMP规范要求。
本工艺规程具有技术法规作用。
本工艺规程适用于流感XXXXXXXXX的生产全过程,是各部门共同遵循的技术准则。
2、引用标准《中华人民共和国药典》2005年版(第三部)《中国生物制品主要原辅材料质控标准》(2000年版)《药品生产质量管理规范》(1998年修订)《XXXXXXXXXX制造和检定规程》批准件3、职责起草:生技部组织相关专业技术人员负责起草。
审批:技术总监和质量总监审核,总经理批准。
执行:各级生产质量管理人员及操作人员。
4、产品名称及剂型4.1产品通用名称:注射用盐酸林克霉素汉语拼音:Yansuan Linkemeisu商品名:XXXXXXXXX英文名称:Lincomycin Hydrochloride4.2剂型:注射用无菌粉5、产品概述5.1定义、组成与用途本品为链菌属链丝菌菌群生长时的产物,即一种林可胺类碱性抗生素。
主要通过抵制细菌的蛋白质合成而起作用。
本品适用于链球菌、肺炎球菌和金黄色葡萄球菌等敏感菌所引起的严重感染性疾病的治疗,也可用于青霉素过敏的或临床医师判定为青霉素药物不适用的感染性疾病的治疗。
本品可能导致抗生素所致的伪膜性肠炎的危险,医师在选择本药时就当考虑感染的情况是否有较低毒性药物适用的可能(如红霉素)。
04盐酸林可霉素注射液工艺规程分则

主要内容与适用范围1. 本标准在小容量注射剂工艺规程通则的基础上,规定了盐酸林可霉素注射液的处方依据、原辅料质量标准,包装材料质量标准,半成品的检验方法和控制,成品质量标准等内容。
2. 本标准适用于盐酸林可霉素注射液的生产质量控制及检验。
产品名称、剂型、规格1. 产品名称:1.1. 通用名称:盐酸林可霉素注射液1.2. 汉语拼音:yansuan Linkemeisu Zhusheye1.3. 英文名:Lincomycin Hydrochloride Injection2. 剂型:注射剂3. 规格:2ml:0.2g 2ml:0.6g4. 性状:本品为无色的澄明液体。
产品处方和依据1. 处方:1.1. 2ml:0.6g盐酸林可霉素300g(活性)苯甲醇8ml亚硫酸氢钠3g活性炭0.1~0.5%注射用水加至1000ml1.2.2ml:0.2g盐酸林可霉素100g(活性)苯甲醇4ml亚硫酸氢钠 1.5g活性炭0.1~0.5%注射用水加至1000ml2. 依据: 中国药典2005年版二部3. 批准文号:(1)2ml :0.6g 国药准字H37021474 (2)2ml :0.2g 国药准字H370214754. 安瓶质量要求:玻璃瓶应为中性安瓶外观,尺寸,折断力应符合小容量注射剂工艺规程通则.5. 安瓶精洗:注射用水终端经0.22μm 微孔滤器滤过。
6. 滤器要求:除炭过滤(5μm 钛棒),粗滤(5μm 钛棒),保证过滤(0.45μm 聚砜),精滤(0.22μm 聚砜).7. 药液配制7.1. 根据配制量,向浓配罐内注入配制总量1/2的注射用水,温度控制在90℃,打开进料口盖向上反放稳妥.7.2. 向盛有亚硫酸氢钠的桶内注入适量注射用水,以溶解亚硫酸氢钠。
7.3. 启动搅拌电源开关进行搅拌,边搅拌边将称好的苯甲醇加入浓配罐中溶解.待苯甲醇溶解后,加入溶解好的亚硫酸氢钠,再加入林可霉素,加入溶解的活性炭.注意不要把原料撒在加料口. 7.4. 投完料关闭机械搅拌,用洁净工具在投料罐之处,手工搅拌5分钟(防止浓配罐底原料堆积结块)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0.02~0.2kg/十亿
温度
一次
60±5℃
脱炭过滤
酸水透光度
一次
≥95%
结晶
共沸温度
一次
60±5℃
降温温度
一次
5±5℃
离心甩滤
湿粉干燥失重
一次
≤20%
母液效价
一次
≤20000u/ml
烘干、混合
烘干温度
一次/小时
50±20℃
双锥内真空度
一次
≤-0.09Mpa
装料系数
一次/批
0.2~0.5
振筛
粒度
林可霉素工艺流程
关键步骤
控制项目
控制频率
控制范围
菌种
斜面
温度
湿度
培养时间
外观
无菌检查
1次/小时
1次/小时
一次
一次
一次
30±2℃
30~45%
6~8天
亮白色或稍灰白色,中突丰满
无菌
摇瓶
温度
湿度
培养时间
外观
无菌检查
1次/小时
1次/小时
一次
一次
一次
30±2℃
25~60%
40~55h
淡黄绿色或棕褐色,挂壁
无菌
萃取
温度
次/小时
60±10℃
碱化液Ph
一次
10.5±1.0
萃取液效价
一次
11000±3000u/ml
重液效价
一次
≤200u/ml
反萃取
温度
次/小时
55±10℃
pH
次/小时
4.0±1.5
酸水效价
一次
280000±40000u/ml
反萃余液效价
一次
≤200u/ml
萃取、反萃取
收率
一次
80~95%
脱色
活性炭加量
反萃余液效价
一次
≤200u/ml
萃取、反萃取
收率
一次
80~95%
脱色
活性炭加量
一次
0.02~0.2kg/十亿
温度
一次
60±5℃
脱炭过滤
酸水透光度
一次
≥95%
结晶
共沸温度
一次
60±5℃
降温温度
一次
5±5℃
离心甩滤
湿粉干燥失重
一次
≤20%
母液效价
一次
≤20000u/ml
烘干、混合
烘干温度
一次/小时
50±20℃
一次
30目以上
双锥内真空度
一次
≤-0.09Mpa
装料系数
一次/批
0.2~0.5
振筛
粒度Leabharlann 一次30目以上关键步骤
控制项目
控制频率
控制范围
预处理
发酵液酸化PH
一次
3.0±1.0
尾线效价
一次
≤300μ/ml
碱化pH
一次
10.5±1.0
碱化液温度
一次
60±10℃
碱化液效价
一次
4000±500μ/ml
预处理收率
一次
85~125%
一次
60±10℃
碱化液效价
一次
4000±500μ/ml
预处理收率
一次
85~125%
萃取
温度
次/小时
60±10℃
碱化液Ph
一次
10.5±1.0
萃取液效价
一次
11000±3000u/ml
重液效价
一次
≤200u/ml
反萃取
温度
次/小时
55±10℃
pH
次/小时
4.0±1.5
酸水效价
一次
280000±40000u/ml
≥40%
菌丝网状、粗状、着色深
无菌
发酵放罐
指标
还原糖(g/100ml)
氨基氮(mg/100ml)
发酵单位(u/ml)
放罐前
放罐前
放罐前
1.0以下
100以下
≥5000
关键步骤
控制项目
控制频率
控制范围
预处理
发酵液酸化PH
一次
3.0±1.0
尾线效价
一次
≤300μ/ml
碱化pH
一次
10.5±1.0
碱化液温度
一级种子
移种指标
pH
菌浓
菌丝形态
无菌检查
移种前
移种前
移种前
移种前
6.5~7.5
≥20%
菌丝网状、粗状、着色深
无菌
二级种子
移种指标
pH
菌浓
菌丝形态
无菌检查
移种前
移种前
移种前
移种前
6.3~7.5
≥40%
菌丝网状、粗状、着色深
无菌
三级种子
移种指标
pH
菌浓
菌丝形态
无菌检查
移种前
移种前
移种前
移种前
6.3~7.5
