高效液相色谱法
高效液相色谱法

2.高效液相色谱法与气相色谱法的比较
(l)气相色谱法:分析对象仅占有机物总数的20%。 高效液相色谱法:分离和分析占有机物总数近80%的那些 高沸点、热稳定性差、离子型化合物及摩尔质量大的物质。
(2)气相色谱:流动相与组分不产生相互作用力,仅起运 载作用。 高效液相色谱法:流动相对组分可产生一定亲和力,并参与 固定相对组分作用的剧烈竞争,流动相对分离起很大作用, 相当于增加了一个控制和改进分离条件的参数;
高压输液泵应符合下列要求:密封性好,输出 流量恒定,压力平稳,可调范围宽,便于迅速 更换溶剂及耐腐蚀。
高压输液泵
常用的输液泵分为恒流泵和恒压泵两种。 恒流泵特点是在一定操作条件下,输出流量保持恒定而与色谱 柱引起阻力变化无关; 恒压泵是指能保持输出压力恒定,但其流量则随色谱系统阻力 而变化,故保留时间的重视性差。 目前主要使用恒流泵,又称机械泵,它又分机械注射泵和机械 往复泵两种,应用最多的是机械往复泵。
(四)检测系统
两种基本类型的检测器: 溶质型检测器:它仅对被分离组分的物理或化学特性有响应, 属于这类检测器的有紫外、荧光、安培检测器等。 总体检测器:它对试样和洗脱液总的物理或化学性质有响应, 属于这类检测器的有示差折光,电导检测器等。 (l)紫外检测器 (2)荧光检测器 (3)示差折光率检测器 (4)电化学检测器
高效液相色谱法
High Performance Liquid Chromatography,HPLC
§1
概 述
Introduction
一、高效液相色谱法概述
高效液相色谱法(HPLC)吸取了气相色谱与经典液相色谱优 点,并用现代化手段加以改进。
引入了气相色谱的理论;
在技术上采用了高压泵、高效固定相和高灵敏度检测器; 具备速度快、效率高、灵敏度高、操作自动化的特点;
hplc高效液相色谱法

HPLC高效液相色谱法简介高效液相色谱法(HPLC)是一种利用液体作为流动相,通过高压输液系统,将样品中的各组分在固定相和流动相之间进行分配或吸附等作用而实现分离和检测的色谱技术。
HPLC具有分离效率高、灵敏度高、选择性强、分析速度快、样品适用范围广等优点,已成为化学、生物、医药、环境等领域中最重要的分析方法之一。
本文将简要介绍HPLC的基本原理、仪器组成、常用的色谱模式和应用领域,以期对HPLC感兴趣的读者有所帮助。
一、HPLC的基本原理HPLC的基本原理是利用样品中的各组分在固定相和流动相之间的不同亲和力,使其在色谱柱内以不同的速度移动,从而达到分离的目的。
固定相是填充在色谱柱内的颗粒状物质,可以是固体或涂于固体载体上的液体。
流动相是通过高压泵送入色谱柱的溶剂或溶剂混合物,可以是极性或非极性的。
样品是通过进样器注入流动相中,并随流动相进入色谱柱。
当样品中的各组分经过固定相时,会发生吸附、分配、离子交换、排阻等作用,导致它们在固定相中停留不同的时间。
这个时间称为保留时间(retention time),通常用tR表示。
保留时间是反映样品组分在色谱柱内分离程度的重要参数,不同的组分有不同的保留时间。
当样品组分从色谱柱出口流出时,会被检测器检测到,并产生一个信号。
这个信号随时间变化而变化,形成一个色谱峰(chromatographic peak)。
色谱峰的位置反映了样品组分的保留时间,色谱峰的面积或高度反映了样品组分的含量或浓度。
将检测器信号随时间变化而绘制出来,就得到了一条色谱图(chromatogram)。
色谱图上可以看到不同的色谱峰,每个峰对应一个样品组分。
通过比较保留时间和色谱峰面积或高度,就可以对样品进行定性和定量分析。
二、HPLC仪器组成HPLC仪器主要由以下几个部分组成:溶剂供给系统(solvent delivery system):负责提供恒定压力和流速的流动相,并将溶剂混合成所需比例。
高效液相色谱法

第八章高效液相色谱法(High Performance Liquid Chromatograph)第一节概述(Generalization)以高压液体为流动相的液相色谱分析法称高效液相色谱法(HPLC)。
HPLC是20世纪70年代初发展起来的一种新的色谱分离分析技术。
具有分离效能高、选择性好、灵敏度高、分析速度快、适用范围广(样品不需气化,只需制成溶液即可)的特点,适用于高沸点、热不稳定有机及生化试样的分离分析。
HPLC基本方法是用高压泵将具有一定极性的单一溶剂或不同比例的混合溶剂泵入装有填充剂的色谱柱,经进样阀注入的样品被流动相带入色谱柱内进行分离后依次进入检测器,由记录仪、或数据处理系统记录色谱信号再进行数据处理而得到分析结果。
高效液相色谱法按固定相不同可分为液-液色谱法和液-固色谱法;按色谱原理不同可分为分配色谱法(液-液色谱)和吸附色谱法(液-固色谱)等。
目前,化学键合相色谱应用最为广泛,它是在液-液色谱法的基础上发展起来的。
将固定液的官能团键合在载体上,形成的固定相称为化学键合相,具有固定液不易流失的特点,一般认为有分配与吸附两种功能,常以分配作用为主。
C18(ODS)是最常使用的化学键合相。
根据固定相与流动相极性的不同,液-液色谱法又可分为正相色谱法和反相色谱法,当流动相的极性小于固定相的极性时称正相色谱法,主要用于极性物质的分离分析;当流动相的极性大于固定相的极性时称反相色谱法,主要用于非极性物质或中等极性物质的分离分析。
《中国药典》中有50种中成药的定量分析采用HPLC法,在中药制剂分析中,大多采用反相键合相色谱法。
一、高效液相色谱法的特点目前经典LC主要用于制备,若用于分析则采用脱机或非连续检测。
经典LC填料缺陷,通常是填料粒度大、范围宽、不规则,不易填充均匀,扩散和传质阻力大,谱带展宽加大。
它存在致命弱点:速度慢、效率低和灵敏度低。
HPLC填料(高效固定相)颗粒细、直径范围窄、能承受高压。
高效液相色谱法教学【全】精选全文

例: 流动相极性变化对组分k’的影响
②更换色谱柱(改变N)
措施: a.选择长柱子(N=L/H) b.填料颗粒尽量小 c.低流速(溶质传质阻力小,峰扩展小) d.低的溶剂粘度(提高柱效)
高效液相色谱法
High Performance Liquid
Chromatography (HPLC)
前言:
HPLC是70年代以后发展最 快的一个分析化学分支,现 已成为生化、医学、药物、 化学化工、食品卫生、环保 检测等领域最常用的分离分 析手段。
我国:
开始仅为少数研究实验室拥有, 现很多的生产、研究、质检部门都拥有。 广泛应用于: 质量控制、分析化验、制备分离。 讲课目的:入门 教材:《实用色谱法》(詹益兴 编著) 学习要求:记好笔记,
ⅰ大分子,扩散系数小 ⅱ小分子,扩散系数大
5. 影响分离的因素与提高柱效的途径
• 液体的扩散系数仅为气体的万分之一,在高效液
相色谱中,速率方程中的分子扩散项B/u较小,可忽略 不计,即 H = A + C u
• 降低传质阻力是提高 柱效主要途径。 •气相和液相H-u区别
§1-4 分离度 (Rs)
于世林编著)
第一章 高效液相色谱法基本原理 §1-1 概述 一、色谱法
混合物最有效的分离、分析方法。 是一种分离技术。 混合物分离过程:试样中各组分在 固液两相间不断进行着的分配。 一相固定不动,称为固定相。 另一相是携带试样混合物流过固定 相的液体,称为流动相。
液相色谱仪
高效液相色谱仪流程图
(1) 存在着浓度差,产生纵向扩散;
(2) 扩散导致色谱峰变宽,H↑(N↓),分离变差; (3) B/u与流速有关:流速↓→ 滞留时间↑→ 扩散↑
高效液相色谱法

(2)化学键合固定相 ) B. 极性键合相 极性键合相指键合有机分子 中含某些极性基团,与空白硅胶相比, 中含某些极性基团,与空白硅胶相比,其极性 键合相表面能量分布均匀,是一种改性的硅胶, 键合相表面能量分布均匀,是一种改性的硅胶, 常用的极性键合相有氨基、氰基等。 常用的极性键合相有氨基、氰基等。氨基键合 相是分离糖类最常用的固定相,常用乙腈-水 相是分离糖类最常用的固定相,常用乙腈 水
二、液相色谱的流动相
1. 流动相特性
(mobile phases of LC) )
(2)化学键合固定相 )
化学键合固定相是应用最广的色谱法。 化学键合固定相是应用最广的色谱法。将固定液的官能团键
合在载体上形成的固定相称为化学键合相,其特点是不流失, 合在载体上形成的固定相称为化学键合相,其特点是不流失, 一般认为有分配与吸附两种功能。 一般认为有分配与吸附两种功能。 a. 硅氧碳键型: 硅氧碳键型: ≡Si—O—C b. 硅氧硅碳键型:≡Si—O—Si — C 硅氧硅碳键型: 稳定,耐水、耐光、耐有机溶剂,应用最广 稳定,耐水、耐光、耐有机溶剂, c. 硅碳键型: 硅碳键型: d. 硅氮键型: 硅氮键型: ≡Si—C ≡Si—N
4.6
高效液相色谱法
高效液相色谱法(high pressure Liquid 高效液相色谱法 chromatography,HPLC)是利用物质在两 , 是利用物质在两 相之间吸附或分配的微小差异达到分离的目的。 相之间吸附或分配的微小差异达到分离的目的。 当两相作相对移动时, 当两相作相对移动时,被测物质在两相之间做 反复多次的分配, 反复多次的分配,这样使原来微小的差异产生 了很大的分离效果,达到分离、 了很大的分离效果,达到分离、分析和测定一 些理化常数的目的。 些理化常数的目的。
高效液相色谱法

31
特点: 特点: 氰基键合相选择性与硅胶类似 键合相选择性与硅胶类似, ① 氰基键合相选择性与硅胶类似, 但极性更小。相同流动相, 但极性更小。相同流动相,组分保留 时间小于硅胶。 时间小于硅胶。 氨基键合相 主要用于糖类分析, ② 氨基键合相 主要用于糖类分析, 糖类分析专用柱 分析专用柱。 是糖类分析敏度: 紫外、荧光、电化学、 紫外、荧光、电化学、质谱等高灵敏 度检测器使用。 度检测器使用。 最小检测量: 最小检测量: 10-9 ~10-11 g 4. 高度自动化: 高度自动化: 采用色谱专家系统为核心的色谱智 能化和仿真优化技术, 能化和仿真优化技术,使 HPLC不仅能 不仅能 自动处理数据,绘图和打印分析结果, 自动处理数据,绘图和打印分析结果, 而且还可以自动控制色谱条件。 而且还可以自动控制色谱条件。
32
2. 流动相极性与容量因子的关系 流动相极性大,洗脱能力增加, 流动相极性大,洗脱能力增加, k 减小,tR 减小;反之, k 与 tR 均 减小, 减小;反之, 增加。 增加。 极性小的组分先出柱
33
四、正、反相色谱法 正相HPLC(normal phase HPLC) ( 正相 ) 固定相: 固定相:极性 常用:改性硅胶 硅胶、 常用:改性硅胶、氰基柱 流动相: 非极性(或弱极性) 流动相 非极性(或弱极性) 常用: 正己烷 常用: 流动相极性小于固定相极性
11
第二节 分离机制 一、液-固吸附色谱法 固吸附色谱法
(Liquid-Solid Chromatography)
(一)吸附机理 根据吸附剂对样品中各组分的吸 根据吸附剂对样品中各组分的吸 附能力差异而分离 而分离。 附能力差异而分离。 吸附过程是被分离组分的分子 与流动相分子争夺吸附剂表面活性 中心(active center)的结果。 的结果。 中心 的结果
仪器分析第4讲 高效液相色谱法

经典液相色谱法 75-600 0.01-1.0 1-20 50-200 2-50 1-10
高效液相色谱法 3-50(常用5-10)
20-300 0.05-1.0
2-30 104-105 10-6-10-2
2.高效液相色谱法与气相色谱法
(l)气相色谱法分析对象只限于分析气体和 沸点较低的化合物,它们仅占有机物总数 的20%.对于占有机物总数近80%的那些高 沸点、热稳定性差、摩尔质量大的物质, 目前主要采用高效液相色谱法进行分离和 分析.
3. 柱外效应
由于色谱柱之外的因 素引起的色谱峰的展 宽,例如进样系统、 连接管路及检测器的 死体积等。
3-3 高效液相色谱的类型及其分离原理
液—液分配色谱及化学键合相色谱 液—固吸附色谱 离子交换色谱 离子色谱 空间排阻色谱
1、 液-液分配色谱
liquid- liquid partition chromatography
4、 离子色谱
ion chromatography
离子色谱法是由离子交换色谱法派生出来的一种 分离方法。由于离子交换色谱法在无机离子的分 析和应用受到限制。例如,对于那些不能采用紫 外检测器的被测离子,如采用电导检测器,由于 被测离子的电导信号被强电解质流动相的高背景 电导信号掩没而无法检测。
2、 液-固吸附色谱
liquid-solid adsorption chromatography
流动相为液体,固定相为固体吸附剂
分离原理:利用溶质分子占据固定相表面吸附 活性中心能力的差异
分离前提:K不等或k不等
液—固吸附色谱
固体吸附剂主要类型: 极性的硅胶(应用最广) 氧化铝 分子筛 非极性的活性炭
1971年科克兰等人出版了《液相色谱的现代实践》一 书,标志着高效液相色谱法(HPLC)正式建立。
高效液相色谱原理
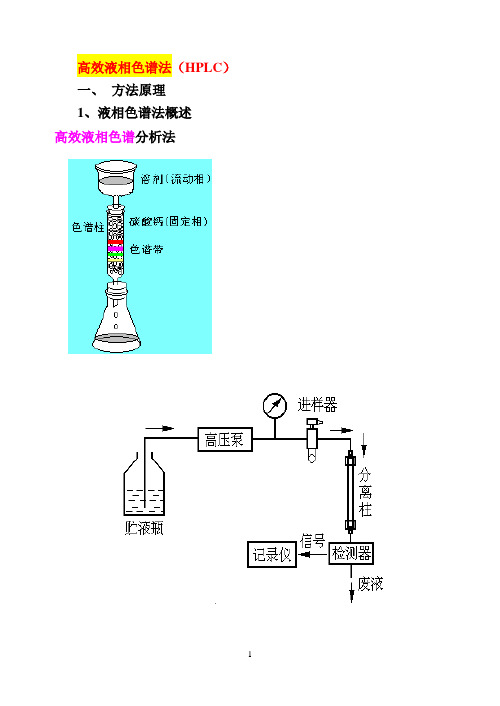
高效液相色谱法(HPLC)一、方法原理1、液相色谱法概述高效液相色谱分析法其工作流程为:高压输液泵将贮液器中的流动相以稳定的流速(或压力)输送至分析体系,在色谱柱之前通过进样器将样品导人,流动相将样品依次带入预柱、色谱柱,在色谱柱中各组分被分离,并依次随流动相流至检测器,检测到的信号送至数据处理系统记录、处理和保存。
HPLC仪器的基本结构2、高效液相色谱法的特点(HPLC)与经典柱色谱原理相同,是由液体流动相将被分离混合物带入色谱柱中,根据各组分在固定相及流动相中吸附能力、分配系数、离子交换作用或分子尺寸大小的差异来进行分离。
由于高压输液泵、高灵敏度检测器和高效固定相的使用,提高了柱效率,降低了检出限,缩短了分析时间。
特点是选择性高、分离效能高、分析速度快的特点。
高沸点有机物的分析、离子型化合物、高分子化合物、热稳定性差的化合物以及具有生物活性的物质,弥补了气相色谱法的不足。
高效液相色谱法与气相色谱法相比,各有所长,互相补充。
如果能用气相色谱法分析的样品,一般不用液相色谱法,因为气相色谱法分析速度更快、更方便、成本更低。
3、高效液相色谱法的固定相和流动相(1)固定相表面多孔型和全多孔型两大类。
(2)流动相(淋洗液)流动相的选择对改善分离效果产生重要的辅助效应。
从实用,选用的流动相具有廉价、易购的特点外,还应满足下列要求:①与固定相互不相溶,并能保持色谱柱的稳定性。
②高纯度,以防所含微量杂质在柱中积累,引起柱性能的改变。
③与所用的检测器相匹配。
④应对样品有足够的溶解能力,以提高测定的灵敏度。
⑤具有低的黏度(可减少溶质的传质阻力,提高柱效)和适当低的沸点。
⑥应避免使用具有显著毒性的溶剂,以保证工作人员的安全。
液相色谱法中常用的流动相有正己烷、正庚烷、甲醇、乙腈等。
4、高效液相色谱法的主要类型(1)液—固吸附色谱法①分离原理:基于各组分吸附能力的差异来进行混合物分离的。
②固定相:极性和非极性两种。
极性固定相:硅胶、氧化镁。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高效液相色谱法高效液相色谱法(《中国药典》2010年版二部附录V D)系采用高压输液泵将规定的流动相泵入装有填充剂的色谱柱,对供试品进行分离测定的色谱方法。
注入的供试品,由流动相带人柱内,各组分在柱内被分离,并依次进入检测器,由积分仪或数据处理系统记录和处理色谱信号。
1 对仪器的一般要求所用的仪器为高效液相色谱仪,由输液泵、进样器、色谱柱、检测器和色谱数据处理系统组成,仪器应按现行国家技术监督局"液相色谱仪检定规程"定期检定并符合有关规定。
1.1 色谱柱最常用的色谱柱填充剂为化学键合硅胶。
反相色谱系统使用非极性填充剂,以十八烷基硅烷键合硅胶最为常用,辛基硅烷键合硅胶和其他类型的硅烷键合硅胶(如氰基键合硅烷和氨基键合硅烷等〉也有使用。
正相色谱系统使用极性填充剂,常用的填充剂有硅胶等。
离子交换色谱系统使用离子交换填充剂;分子排阻色谱系统使用凝胶或高分子多孔微球等填充剂;对映异构体的分离通常使用手性填充剂。
填充剂的性能(如载体的形状、粒径、孔径、表面积、键合基团的表面覆盖度、含碳量和键合类型等)以及色谱柱的填充,直接影响供试品的保留行为和分离效果。
孔径在15nm(lnm= lOA)以下的填料适于分析分子量小于2000的化合物,分子量大于2000的化合物则应选择孔径在30nm以上的填料。
除另有规定外,分析柱的填充剂粒径一般在3~10µm之间。
粒径更小(约2µm)的填充剂常用于填装微径柱(内径约2mm)。
使用微径柱时,输液泵的性能、进样体积、检测池体积和系统的死体积等必须与之匹配;如有必要,色谱条件也需作适当的调整。
当对其测定结果产生争议时,应以品种正文规定的色谱条件的测定结果为准。
以硅胶为载体的键合固定相的使用温度通常不超过40°C,为改善分离效果可适当提高色谱柱的使用温度,但不宜超过60°C。
流动相的pH值应控制在2~8之间。
当pH值大于8时,可使载体硅胶溶解;当pH值小于2时,与硅胶相连的化学键合相易水解脱落。
当色谱系统中需使用pH值大于8的流动相时,应选用耐碱的填充剂,如采用高纯硅胶为载体并具有高表面覆盖度的键合硅胶填充剂、包覆聚合物填充剂、有机-无机杂化填充剂或非硅胶填充剂等;当需使用pH值小于2的流动相时,应选用耐酸的填充剂,如具有大体积侧链能产生空间位阻保护作用的二异丙基或二异丁基取代十八烧基硅烧键合硅胶填充剂,或有机-无机杂化填充剂等。
1.2 检测器最常用的检测器为紫外检测器,包括二极管阵列检测器,其他常见的检测器有荧光检测器、蒸发光散射检测器、示差折光检测器、电化学检测器和质谱检测器等。
紫外、荧光、电化学检测器为选择性检测器,其响应值不仅与待测溶液的浓度有关,还与化合物的结构有关;蒸发光散射检测器和示差折光检测器为通用型检测器,对所有的化合物均有响应;蒸发光散射检测器对结构类似的化合物,其响应值几乎仅与待测物的质量有关;二极管阵列检测器可以同时记录待测物的吸收光谱,故可用于待测物的光谱鉴定和色谱峰的纯度检查。
紫外、荧光、电化学和示差折光检测器的响应值与待测溶液的浓度在一定范围内呈线性关系,但蒸发光散射检测器的响应值与待测溶液的浓度通常呈指数关系,故进行计算时,一般需经对数转换。
不同的检测器,对流动相的要求不同。
如采用紫外检测器,所用流动相应符合紫外-可见分光光度法(《中国药典》)2010年版二部附录Ⅳ A)项下对溶剂的要求;采用低波长检测时,还应考虑有机相中有机溶剂的截止使用波长,并选用色谱级有机溶剂。
蒸发光散射检测器和质谱检测器通常不允许使用含不挥发性盐组分的流动相。
1.3 流动相反相色谱系统的流动相首选甲醇-水系统(采用紫外末端波长检测时,首选乙腈一水系统) ,如经试用不适合时,再选用其他溶剂系统。
应尽可能少用含有缓冲液的流动相,必须使用时,应尽可能选用含较低浓度缓冲液的流动相。
由于C18链在水相环境中不易保持伸展状态,故对于十八烷基硅烷键合硅胶为固定相的反相色谱系统,流动相中有机溶剂的比例通常应不低于5%,否则C18链的随机卷曲将导致组分保留值变化,造成色谱系统不稳定。
各品种项下规定的条件除固定相种类、流动相组分、检测器类型不得改变外,其余如色谱柱内径、长度、载体粒度、流动相流速、混合流动相各组分的比例、柱温、进样量、检测器的灵敏度等,均可适当改变,以适应供试品并达到系统适用性试验的要求。
其中,调整流动相组分比例时,以组分比例较低者(小于或等于50%)相对改变量不超过±30%且绝对改变量不超过土10%为限,如30%相对改变量的数值超过10%时,则改变量以士10%为限。
对于必须使用特定牌号的填充剂方能满足分离要求的品种,可在该品种项下注明。
2 系统适用性试验色谱系统的适用性试验通常包括理论板数、分离度、重复性和拖尾因子等四个参数。
其中,分离度和重复性尤为重要。
按各品种项下要求对色谱系统进行适用性试验,即用规定的对照品溶液或系统适用性试验溶液在规定的色谱系统进行试验,必要时,可对色谱系统进行适当调整,应符合要求。
2.1 色谱柱的理论板数(n) 用于评价色谱柱的效能。
由于不同物质在同一色谱柱上的色谱行为不同,采用理论板数作为衡量柱效能的指标时,应指明测定物质,一般为待测组分或内标物质的理论板数。
在规定的色谱条件下,注入供试品溶液或各品种项下规定的内标物质溶液,记录色谱图,量出供试品主成分峰或内标物质峰的保留时间tR (以分钟或长度计,下同,但应取相同单位)和峰宽(W)或半高峰宽(W A/2) ,按n=16(t R/W)2或n=5.54(t ) 2 计算色谱柱的理论板数h。
R/W A/22. 2 分离度(R) 用于评价待测组分与相邻共存物或难分离物质之间的分离程度,是衡量色谱系统效能的关键指标。
可以通过测定待测物质与已知杂质的分离度,也可以通过测定待测组分与某一添加的指标性成分(内标物质或其他难分离物质)的分离度,或将供试品或对照品用适当的方法降解,通过测定待测组分与某一降解产物的分离度,对色谱系统进行评价与控制。
无论是定性鉴别还是定量分析,均要求待测峰与其他峰、内标峰或特定的杂质对照峰之间有较好的分离度。
除另有规定外,待测组分与相邻共存物之间的分离度应大于1.5。
分离度的计算公式为R=2(t R2–t R1)/(W1十W2)或R=2(t R2–t R1)/1. 70(W1.h/2十W2.h/2)式中,t R2为相邻两峰中后一峰的保留时间;t R1 为相邻两峰中前一峰的保留时间;W1、W2及W1.h/2、W2.h/2分别为此相邻两峰的峰宽及半高峰宽。
2. 3 重复性用于评价连续进样后,色谱系统响应值的重复性能。
采用外标法时,通常取各品种项下的对照品溶液,连续进样5次,除另有规定外,其峰面积测量值的相对标准偏差应不大于2.0% ;采用内标法时,通常配制相当于80%、100%和120%的对照品溶液,加入规定量的内标溶液,配成3种不同浓度的溶液,分别至少进样2次,计算平均校正因子。
其相对标准偏差应不大于2.0%。
2.4 拖尾因子(T) 用于评价色谱峰的对称性。
为保证分离效果和测量精度,应检查待测峰的拖尾因子是否符合各品种项下的规定。
拖尾因子计算公式为T=W O.O5A/2d1式中,W O.O5A为 5% 峰高处的峰宽;d1 为 5% 峰高出峰顶点至峰前沿之间的距离。
除另有规定外,峰高法定量时T应在0.95~1. 05之间。
峰面积法测定时,若拖尾严重,将影响峰面积的准确测量。
必要时,应在各品种项下对拖尾因子作出规定。
3 测定法3. 1 内标法按各品种项下的规定,精密称(量〉取对照品和内标物质,分别配成溶液,精密量取各适量,混合配成校正因子测定用的对照溶液。
取一定量注入仪器,记录色谱图。
测量对照品和内标物质的峰面积或峰高,按下式计算校正因子校正因子(f) = ( As/ Cs ) / ( A R /C R)式中As为内标物质的峰面积或峰高;A R 为对照品的峰面积或峰高; Cs为内标物质的浓度;C R为对照品的浓度。
再取各品种项下含有内标物质的供试品溶液,注入仪器,记录色谱图,测量供试品中待测成分和内标物质的峰面积或峰高,按下式计算含量含量(Cx)= f²Ax/(A's/c's)式中,Ax为供试品峰面积或峰高;cx为供试品的浓度;A's为内标物质的峰面积或峰高;c's为内标物质的浓度;f为校正因子。
采用内标法,可避免因样品前处理或进样体积误差对测定结果的影响。
3.2 外标法按各品种项下的规定,精密称(量)取对照品和供试品,配制成溶液,分别精密取一定量,注入仪器,记录色谱图,测量对照品溶液和供试品溶液中待测成分的峰面积(或峰高) ,按下式计算含量含量(Cx)= C R(A x/ A R)式中各符号意义同上。
由于微量注射器不易精确控制进样量,当采用外标法测定供试品中成分或杂质含量时,以定量环或自动进样器进样为好。
3.3 加校正因子的主成分自身对照法测定杂质含量时,可采用加校正因子的主成分自身对照法。
在建立方法时,按各品种项下的规定,精密称(量)取杂质对照品和待测成分对照品各适量,配制测定杂质校正因子的溶液,进样,记录色谱图,按上述3. 1法计算杂质的校正因子。
此校正因子可直接载入各品种项下,用于校正杂质的实测峰面积。
这些需作校正计算的杂质,通常以主成分为参照,采用相对保留时间定位。
其数值一并载入各品种项下。
测定杂质含量时,按各品种项下规定的杂质限度,将供试品溶液稀释成与杂质限度相当的溶液作为对照溶液,进样,调节检测灵敏度(以噪声水平可接受为限)或进样量(以柱子不过载为限) ,使对照溶液的主成分色谱峰的峰高约达满量程的10%,~25%或其峰面积能准确积分[通常含量低于0.5%的杂质,峰面积的相对标准偏差(RSD)应小于10% ;含量在0.5%~2% 的杂质,峰面积的RSD 应小于5%;含量大于2%的杂质,峰面积的RSD 应小于2%]。
然后,取供试品溶液和对照品溶液适量,分别进样,供试品溶液的记录时间,除另有规定外,应为主成分色谱峰保留时间的2倍,测量供试品溶液色谱图上各杂质的峰面积,分别乘以相应的校正因子后与对照溶液主成分的峰面积比较,依法计算各杂质含量。
3.4 不加校正因子的主成分自身对照法测定杂质含量时,若没有杂质对照品,也可采用不加校正因子的主成分自身对照法。
同上述3.3法配制对照溶液并调节检测灵敏度后,取供试品溶液和对照溶液适量,分别进样,前者的记录时间,除另有规定外,应为主成分色谱峰保留时间的2倍,测量供试品溶液色谱图上各杂质的峰面积并与对照溶液主成分的峰面积比较,计算杂质含量。
若供试品所含的部分杂质未与溶剂峰完全分离,则按规定先记录供试品溶液的色谱图Ⅰ,再记录等体积纯溶剂的色谱图Ⅱ。
