常见的市售酸碱的浓度
常见的无机酸性清洗剂介绍

常见的无机酸性清洗剂介绍酸是处理金属表面污垢最常用的药剂。
酸是一种电解质,它在水中电离时产生的阳离子都是氢离子。
但各种酸在水中电离出的氢离子浓度不同。
常用溶液的pH值来表示溶液的酸碱性。
在相同浓度下,酸溶液的pH值越小,它的酸性越强。
1、硫酸硫酸是三氧化硫的水合物,是一种无色黏稠的液体,含量可达100%。
把三氧化硫溶于100%的硫酸中可得到棕色油状液体,叫发烟硫酸。
通常在清洗中应用的是98%及以下含量的硫酸溶液。
稀硫酸容易与钢铁反应并产生氢气,常温下,60%及以上的硫酸会在钢铁表面形成钝化膜而使钢铁对它有耐蚀性;93%以上时,即使加热到煮沸条件也几乎不腐蚀钢铁。
而铅与钢铁正相反,可溶于浓硫酸中,但对稀硫酸有良好耐蚀性。
其他金属与硫酸的反应情况如下。
铝:易溶于10%的硫酸中,但对80%以上的硫酸有耐蚀性。
锌、镁:易溶于各种浓度的硫酸中。
锡:对稀硫酸才有耐蚀性。
镍:常温下对80%以下的硫酸有耐蚀性。
铬:可被浓硫酸氧化生成钝化膜,所以它不被浓硫酸腐蚀。
含铬的18-8铬镍钢,常温下与硫酸接触也会生成耐蚀的氧化膜而钝化,但在加热情况下会被腐蚀。
铜:由于金属活动性差,不能从酸中置换出氢离子,所以一般情况下不会被硫酸溶解,只有在浓硫酸加热条件下,铜被氧化才能被硫酸溶解厂。
2、盐酸盐酸是氯化氢气体的水溶液,15℃时氯化氢在水中溶解度最大,可生成42.7%的盐酸。
市场上出售的浓盐酸为37.2%。
盐酸与硫酸一样,是一种价格便宜的强酸,在清洗金属中应用很广泛。
它与硫酸的不同是具有易挥发性,在40℃以上使用时,氯化氢气体会从盐酸溶液中挥发出来,使用时产生困难。
盐酸与金属反应生成的氯化物水溶性大都很好,但盐酸与卤化物对金属都有腐蚀作用,在使用时要注意。
盐酸对各种金属的腐蚀作用如下。
镁、锌、铬、铁:易被盐酸腐蚀。
铅:对20%以下浓度的盐酸有一定的耐腐蚀性。
锡、镍:在常温下对稀盐酸有一定耐腐蚀性,在氧化气氛中会慢慢被腐蚀。
18-8铬镍不锈钢:对许多化学药品有良好的耐腐蚀性,但会被盐酸腐蚀。
常见酸碱的性质及使用中应注意的事项

吸收空气中的水份,而使浓度降低。
• 3.浓硫酸具有脱水性,能将有机物中的H和O以2:1的形式脱去,从而使有机物 炭化。
• 4.浓硫酸具有强烈的腐蚀性,如果皮肤沾到浓硫酸会使皮肤严重灼伤。若皮
肤不慎沾上浓硫酸时,应立即用大量的水冲洗。 保存:密闭、干燥的玻璃容器中。
3.氧化性:浓硝酸和稀硝酸都有强氧化性
• 它能与几乎所有的金属(金、铂)除外和非金属发生氧化 还原反应。 • 应当注意:铁和铝能溶于稀硝酸,但遇冷浓硝酸发生钝化 现象,所以可以用铁或铝制容器盛装浓硝酸。 • 浓硝酸 :浓盐酸 = 1 : 3 (体积比)叫做王水。其 氧化能力比硝酸强,能溶解金、铂等贵重金属。 • 三、使用时注意事项 • 1.稀、浓硝酸都有腐蚀性,若不慎沾到皮肤上,立即用大 时的水冲洗。
盐 酸
HCL
• 一、物理性质: • 工业三大强酸之一, 纯的盐酸是无色有刺激气味的 液体,通常市售浓盐酸的密度为1.19g/cm3,质量分数为 0.37。工业用的盐酸由于含有FeCL3 略带黄色。 • 盐酸是一种低沸点、易挥发的酸。 • 化学性质: • 二、化学性质 • 1.具有酸的通性,能使指示剂变色。 • 2.能和多数属反应。 • 三、保存 • 密闭容器中(挥发性)。
2.三大特性: 具有强酸性,氧化性和吸水性。:
•
•ቤተ መጻሕፍቲ ባይዱ
常温时,浓硫酸能使铁、铝表面产生致密的氧化物薄膜,阻止
内部金属继续与硫酸反应。受热后,浓硫酸可与铁、铝等大多数金属反 应。所以,冷的浓硫酸可用铁或铝制容器储存或运输。
• 三、使用时应注意事项
• 1.配制溶液时要将硫酸沿玻璃棒注入水中,切不可将水注入硫酸中,且不断
试剂的配制和取用
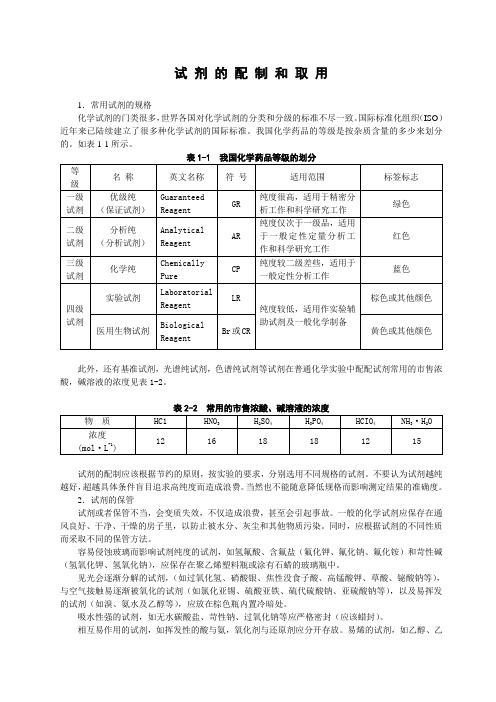
试剂的配制和取用1.常用试剂的规格化学试剂的门类很多,世界各国对化学试剂的分类和分级的标准不尽一致。
国际标准化组织(ISO)近年来已陆续建立了很多种化学试剂的国际标准。
我国化学药品的等级是按杂质含量的多少来划分的。
如表1-1所示。
此外,还有基准试剂,光谱纯试剂,色谱纯试剂等试剂在普通化学实验中配配试剂常用的市售浓酸,碱溶液的浓度见表1-2。
试剂的配制应该根据节约的原则,按实验的要求,分别选用不同规格的试剂。
不要认为试剂越纯越好,超越具体条件盲目追求高纯度而造成浪费。
当然也不能随意降低规格而影响测定结果的准确度。
2.试剂的保管试剂或者保管不当,会变质失效,不仅造成浪费,甚至会引起事故。
一般的化学试剂应保存在通风良好、干净、干燥的房子里,以防止被水分、灰尘和其他物质污染。
同时,应根据试剂的不同性质而采取不同的保管方法。
容易侵蚀玻璃而影响试剂纯度的试剂,如氢氟酸、含氟盐(氟化钾、氟化钠、氟化铵)和苛性碱(氢氧化钾、氢氧化钠),应保存在聚乙烯塑料瓶或涂有石蜡的玻璃瓶中。
见光会逐渐分解的试剂,(如过氧化氢、硝酸银、焦性没食子酸、高锰酸钾、草酸、铋酸钠等),与空气接触易逐渐被氧化的试剂(如氯化亚锡、硫酸亚铁、硫代硫酸钠、亚硫酸钠等),以及易挥发的试剂(如溴、氨水及乙醇等),应放在棕色瓶内置冷暗处。
吸水性强的试剂,如无水碳酸盐、苛性钠、过氧化钠等应严格密封(应该蜡封)。
相互易作用的试剂,如挥发性的酸与氨,氧化剂与还原剂应分开存放。
易烯的试剂,如乙醇、乙醚、苯、丙酮与易爆炸的试剂,如高氯酸、过氧化氢、硝基化合物,应分开贮存在阴凉通风、不受阳光直射的地方。
剧毒试剂,如氰化钾、氰化钠、氢氟酸、二氯化汞、三氧化二砷(砒霜)等,应特别注意由专人妥善保管,严格做好记录,经一定手续取用,以免发生事故。
极易挥发并有毒的试剂可放在通风橱内,当室内温度较高时,可放在冷藏室内保存。
3.试剂滴液的配制配制试剂溶液时,首先根据所配制试剂纯度的要求,选用不同等级试剂,再根据配制溶液的浓度和数量,计算出试剂的用量。
实验室安全操作规程

实验室安全操作规程一、实验室安全守则(一)分析人员必须认真学习分析规程和有关的安全技术规程,了解设备性能及操作中可能发生事故原因,掌握预防和处理事故的方法。
(二)玻璃管与胶管、胶塞等拆装时,应先用水润湿,手上垫棉布,以免玻璃管折断扎伤. (三)稀释浓硫酸的容器要放在塑料盆中,只能将浓硫酸慢慢到入水中,不能相反!必要时用水冷却。
(四)蒸馏和提纯时不能离人,以防温度过高或冷却水突然中断。
(五)化验室每瓶试剂必须贴有明显的与内容物相符的标签。
严禁将用完的原装试剂空瓶不更换标签而装入别种试剂。
发现试剂瓶上标签掉落或将要模糊时应立即贴好标签.(六)不准使用绝缘损坏或老化的线路及电器设备。
保持电器及电线的干燥.(七)正确操作闸刀开关,应使闸刀处于安全合上或完全拉断的位置,不能若即若离,以防接触不良打火花.(八)使用酒精灯时,注意酒精切勿装满,应不超过容量的2/3,灯内酒精不足1/4容量时,应灭火后添加酒精。
燃着的灯焰应用灯冒盖灭,不可用嘴吹灭,以防引起灯内酒精起燃。
酒精灯应用火柴点燃,不应用另一正燃的酒精灯来点,以防失火。
(九)若局部起火,应立即切断电源,用湿抹布或石棉布覆盖熄灭。
若火势较猛,应立即与有关部门联系,请求救援.(十)打开浓盐酸、浓硝酸、浓氨水试剂瓶塞时应戴防护用具。
(十一)打开高温烘箱前,须确认箱内温度小于100℃后方可打开。
(十二)若遇酸碱液灼烧时,速用大量自来水冲洗患处。
属酸液烧伤,用2%碳酸氢钠冲洗;属碱液烧伤,用2%硼酸冲洗,再用清水冲洗。
二、化学试剂的分类和规格(一)化学试剂按其用途分为一般试剂、基准试剂、无机离子分析用有机试剂、色谱试剂与制剂、指示剂与试纸等。
(二)实验室最常见试剂的规格1.基准试剂是一类用于标定滴定分析标准溶液的标准参考物质,可作为滴定分析中的基准物用,也可精确称量后直接配制标准溶液.主成分含量一般在99.95%—100.05%,杂质含量略低于优级纯或与优级纯相当.标签颜色为浅蓝色.2.优级纯试剂,也称为保证试剂,其成分高,杂质含量低,主要用于精密的科学研究和测定工作,简称GR级。
化学清洗剂中无机酸的种类及原理详解

化学清洗剂中无机酸的种类及原理详解酸是处理金属表面污垢最常用的化学药剂。
清洗中常用的酸包括无机酸和有机酸两类。
无机酸是无机化合物中酸类的总称,也称为矿酸,如硫酸、盐酸、硝酸、磷酸等。
无机酸通常是由氢和非金属元素组成的。
酸是一种电解质,它在水中电离时产生的阳离子都是氢离子。
但是各种酸在水中电离出的氢离子浓度不同。
常用溶液的pH值来表示溶液的酸碱性。
pH 值是溶液中氢离子浓度负对数,pH=-lgcH+。
中性水溶液在常温下,氢离子浓度为10-7mol/L,所以水的pH=-lg10-7=7。
在酸的水溶液中氢离子浓度大于10-7mol/L,所以酸的pH<7。
在相同浓度情况,酸溶解的pH值越小说明此酸电离出的氢离子越多,它的酸性越强。
酸对各种金属的溶解能力与金属的活泼性有关,越活泼的金属越易与酸电离出的氢离子反应而转变成金属离子。
金属变成金属离子的难易顺序为:Li>K>N9>Ca>Mg>Zn>Cr>Fe2>Cd>Co>Ni>Pb>Sn>Fe3>[H]>Cu>Ag>Hg>Au 这种顺序又称为金属活动顺序,其中氢以前的金属易于在酸中转变成金属离子,它们在酸中与氢离子反应时被溶解,同时有氢气发生。
在上面的顺序中Fe出现两次,Fe2表示铁转变成二价铁离子(Fe2+),Fe3表示转变成三价铁离子(Fe3+),在前一转变过程中金属铁更为活泼。
已知,假如在金属表面由于发生了氧化作用产生了耐腐蚀的氧化覆盖膜时,酸对金属时的溶解作用会明显地受到抑制,这种现象叫金属的钝化。
在用各种酸清除污垢的过程中,H+离子起着主要作用,但酸根离子对污垢的溶解也有一定作用,有时还是很重要的,比如F-离子可使水垢中的SiO2发生化学反应而溶解,而别的酸根(阴离子)是不行的。
因此在用酸作化学清洗剂时不仅要考虑到酸的强度,也要考虑不同酸的特性。
4食品分析的基础知识和数据处理

滴定度: 滴定度:指1ml的标准溶液相当于被测物的 的标准溶液相当于被测物的 表示, 代表标准 质量,可用符号“ 质量,可用符号“ TS/X ”表示,S代表标准 表示 溶液(滴定剂)的化学式。 溶液(滴定剂)的化学式。
如: THCl/Na2CO3=0.05316g/mL,表示 ,表示1mL盐酸标准 盐酸标准 溶液相当于0.05316gNa2CO3。 溶液相当于
d = xi − x
平均绝对偏差 d
d = ( d1 + d2 + d3 +... + dn ) / n
相对偏差——绝对偏差占测定平均值的 (2)相对偏差 绝对偏差占测定平均值的 百分比。 百分比。 ①相对算术平均偏差= d / x×100% 相对算术平均偏差= ②标准偏差 S 2 2 2 d1 + d2 +... + dn S= = n −1 相对标准偏差——变异系数 ③ 相对标准偏差 变异系数
2 4
c(1/2H SO ) = 2mol/L
2 4
c(2H SO ) = 0.5mol/L
2 4
比例浓度:指溶液中各组分的体积比, 比例浓度:指溶液中各组分的体积比, 记为A+B+C。 记为 。
正丁醇-氨水 无水乙醇( 氨水-无水乙醇 如:①正丁醇 氨水 无水乙醇(7+1+2),表示正 ) 表示正 丁醇、氨水和无水乙醇按体积比7:1:2混合 丁醇、氨水和无水乙醇按体积比 混合; 混合 有时试剂名称后注明( ②有时试剂名称后注明(3+4)等,但未指 ) 明与何种试剂混合时, 明与何种试剂混合时,则第一个数字表示试剂 的体积, 个数字表示水的体积。 的体积,第2个数字表示水的体积。 个数字表示水的体积
4食品分析的基础知识和数据处理

Q 值表(狄克逊检验法临界值) n 3 4 5 6 7 8 9 显著性水平 α 0.05 0.01 0.970 0.994 0.829 0.926 0.710 0.821 0.628 0.740 0.569 0.680 0.608 0.717 0.564 0.672 n 10 11 12 13 14 15 … 显著性水平 α 0.05 0.01 0.530 0.635 0.502 0.605 0.479 0.579 0.611 0.697 0.586 0.670 0.565 0.647
2 4
c(2H SO ) = 0.5mol/L
2 4
比例浓度:指溶液中各组分的体积比, 记为A+B+C。
如:①正丁醇-氨水-无水乙醇(7+1+2),表示正 丁醇、氨水和无水乙醇按体积比7:1:2混合; ②有时试剂名称后注明(3+4)等,但未指 明与何种试剂混合时,则第一个数字表示试剂 的体积,第2个数字表示水的体积。
食品分析
龙岩学院生命科学学院
主讲教师:
陈雪梅
食品分析的基础知识 和数据处理
一、分析方法的选择
(一)选择分析方法应考虑的因素 1.分析要求的准确度和精密度 2.分析方法的繁简和速度 3.样品的特性 4.现有条件
(二)分析方法的评价
1、精密度
精密度——指多次平行测定结果相互接 近的程度。 反应测定方法的稳定性和重现性。
按Grubbs法,先求全组数据的平均值和标准 偏差:
4
x
1 . 25 1 . 27 1 . 31 1 . 40 4
1 . 31 , S
i 1
(x x) n 1
2
0 066
分析化学实验讲义╱附录

附录附录1洗涤液的配制及使用1. 铬酸洗液主要用于去除少量油污,是无机及分析化学实验室中最常用的洗涤液。
使用时应先将待洗仪器用自来水冲洗一遍,尽量将附着在仪器上的水控净,然后用适量的洗液浸泡。
配制方法:称取25g化学纯K2Cr2O7置于烧杯中,加50 mL水溶解,然后一边搅拌一边慢慢沿着烧杯壁加入450 mL工业浓H2SO4,冷却后转移到有玻璃塞的细口瓶中保存。
2. 酸性洗液工业盐酸(1:1),用于去除碱性物质和无机物残渣,使用方法与铬酸洗液相同。
3. 碱性洗液1%的NaOH水溶液,可用于去除油污,加热时效果较好,但长时间加热会腐蚀玻璃。
使用方法与铬酸洗液相同。
4. 草酸洗液用于除去Mn,Fe等氧化物。
加热时洗涤效果更好。
配制方法:5~10g草酸溶于100 mL水中,再加入少量浓盐酸。
5. 盐酸-乙醇洗液用于洗涤被染色的比色皿、比色管和吸量管等。
配制方法:将化学纯的盐酸与乙醇以1:2的体积比混合。
6. 酒精与浓硝酸的混合液此溶液适合于洗涤滴定管。
使用时,先在滴定管中加入3 mL酒精,沿壁再加入4 mL 浓HNO3,盖上滴定管管口,利用反应所产生的氧化氮洗涤滴定管。
7. 含KMnO4的NaOH水溶液将10 g KMnO4溶于少量水中,向该溶液中注入100 mL 10% NaOH溶液即成。
该溶液适用于洗涤油污及有机物,洗后在玻璃器皿上留下的MnO2沉淀,可用浓HCl或Na2SO3溶液将其洗掉。
附录2市售酸碱试剂的浓度及比重附录3常用指示剂(1)酸碱指示剂(2)混合指示剂(3)配位滴定指示剂附录4不同温度下,稀溶液体积对温度的补正值附录5化学试剂纯度分级表①以20%乙醇为溶剂,配成0.1%(W / V)溶液。
除此之外,还有高纯试剂,色谱纯试剂,光谱纯试剂,生化试剂等。
高纯试剂(EP):包括超纯、特纯、高纯、光谱纯,配制标准溶液。
此类试剂质量注重的是:在特定方法分析过程中可能引起分析结果偏差,对成分分析或含量分析干扰的杂质含量,但对主含量不做很高要求。
