常用酸碱溶液的浓度及配制
常用酸碱溶液的配制

硝酸HNO3浓度:10mol/L HNO3 :取16M HNO3 625ml加入蒸馏水稀释至 1 L;8 mol/L HNO3 :取16M HNO3 500ml加入蒸馏水稀释至 1 L;6 mol/L HNO3 :取16M HNO3 375ml加入蒸馏水稀释至 1 L;2 mol/L HNO3 :取16M HNO3 125ml加入蒸馏水稀释至 1 L;1.5 mol/L HNO3 :取16M HNO3 94ml加入蒸馏水稀释至 1 L;1 mol/L HNO3 :取16M HNO3 63ml加入蒸馏水稀释至 1 L;0.1 mol/L HNO3 :取16M HNO3 6.3ml加入蒸馏水稀释至 1 L;注:65%——68%浓硝酸,密度=1.42g/ml,浓度:M=16.0 mol/L盐酸HCL浓度:6 mol/L HCL:取12M HCL 500ml加入蒸馏水稀释至 1 L;4 mol/L HCL:取12M HCL 334ml加入蒸馏水稀释至 1 L;3 mol/L HCL:取12M HCL 250ml加入蒸馏水稀释至 1 L;2 mol/L HCL:取12M HCL 167ml加入蒸馏水稀释至 1 L;1 mol/L HCL:取12M HCL 84 ml加入蒸馏水稀释至 1 L;0.1 mol/L HCL:取12M HCL 8.4ml加入蒸馏水稀释至 1 L;注:36%——38%浓硝酸,密度=1.19g/ml,浓度:M=12.0 mol/L硫酸H2SO4浓度:4.5 mol/L H2SO4:将252mL 18M H2SO4缓慢注入蒸馏水至1L;3 mol/L H2SO4:将167mL 18M H2SO4缓慢注入蒸馏水至1L;1.5 mol/L H2SO4:将84 mL 18M H2SO4缓慢注入蒸馏水至1L;1 mol/L H2SO4:将56 mL 18M H2SO4缓慢注入蒸馏水至1L;0.5 mol/L H2SO4:将28 mL 18M H2SO4缓慢注入蒸馏水至1L;注: 68%浓硫酸,密度=1.84g/ml,浓度:M=18.0 mol/L醋酸(乙酸)CH3COOH浓度:6mol/LCH3COOH:取17M CH3COOH 353ml加入蒸馏水稀释至 1 L;3mol/LCH3COOH:取17M CH3COOH 177ml加入蒸馏水稀释至 1 L;1mol/LCH3COOH:取17M CH3COOH 59ml加入蒸馏水稀释至 1 L;注: 95%冰醋酸,密度=1.84g/ml,浓度:M=17.0 mol/L草酸H2C2O4.2H2O浓度:1.5 mol/L 草酸溶液:将189g草酸溶于1L蒸馏水中;0.5 mol/L 草酸溶液:将63 g草酸溶于1L蒸馏水中;氨水NH4OH浓度:6 mol/L NH4OH:取15M 氨水400ml加入蒸馏水稀释至 1 L;4 mol/L NH4OH:取15M 氨水268ml加入蒸馏水稀释至 1 L;3 mol/L NH4OH:取15M 氨水200ml加入蒸馏水稀释至 1 L;2 mol/L NH4OH:取15M 氨水134ml加入蒸馏水稀释至 1 L;1 mol/L NH4OH:取15M 氨水77 ml加入蒸馏水稀释至 1 L;注:25%——28%浓氨水,密度=0.91g/ml,浓度:M=15.0 mol/L锶标准溶液的配制用0.1 mol/L的盐酸溶液稀释至要求浓度即可。
酸碱中和反应的溶液配制与浓度调整

酸碱中和反应的溶液配制与浓度调整酸碱中和反应是化学实验中常见且重要的反应类型。
在实验中,我们经常需要配制溶液并调整其浓度,以满足特定的需求。
本文将介绍酸碱中和反应中溶液的配制方法以及浓度的调整方法。
一、酸溶液的配制与浓度调整1. 配制酸溶液酸溶液一般通过稀释浓酸获得。
首先,将所需量的浓酸倒入容量瓶中,注意要使用滴定管或滴定瓶来准确地加入浓酸。
然后,加入适量的去离子水,并用玻璃棒搅拌均匀。
最后,用去离子水稀释到容量瓶刻度线上,摇匀即可。
2. 调整酸溶液浓度在实验中,有时需要调整酸溶液的浓度以满足特定的需求。
常见的调整方法有以下几种:(1)浓缩酸溶液:将所需量的稀酸溶液放置在热板上或加热器上,通过蒸发使其浓缩。
控制加热温度和时间,以防止过度浓缩或溶液溢出。
(2)稀释酸溶液:将所需量的浓酸溶液倒入容器中,然后逐渐加入去离子水稀释至所需浓度。
在稀释过程中,要反复搅拌以使溶液均匀。
二、碱溶液的配制与浓度调整1. 配制碱溶液碱溶液一般通过溶解固体碱或稀释浓碱获得。
固体碱的溶解通常是将一定量的固体碱加入容器中,然后加入适量的去离子水,并用玻璃棒搅拌均匀,直至固体完全溶解。
对于浓碱的稀释,可以采用与稀释酸溶液相似的方法。
2. 调整碱溶液浓度与酸溶液类似,碱溶液的浓度也需要根据实验需求进行调整。
(1)浓缩碱溶液:将所需量的稀碱溶液放置在热板上或加热器上,通过蒸发使其浓缩。
同样,要控制加热温度和时间,以避免过度浓缩或溶液溢出。
(2)稀释碱溶液:将所需量的浓碱溶液倒入容器中,然后逐渐加入去离子水稀释至所需浓度。
在稀释过程中,要反复搅拌以使溶液均匀。
三、酸碱溶液浓度的测定在实验中,我们需要准确地测定酸碱溶液的浓度,以便使用正确的量进行配制和反应。
常用的浓度测定方法有以下几种:1. 酸碱滴定法酸碱滴定法是测定溶液浓度常用的方法之一。
通过滴定管滴定标准浓度的酸溶液或碱溶液,直到达到中和终点,根据滴定液消耗量计算溶液的浓度。
常用指示剂溶液的配制
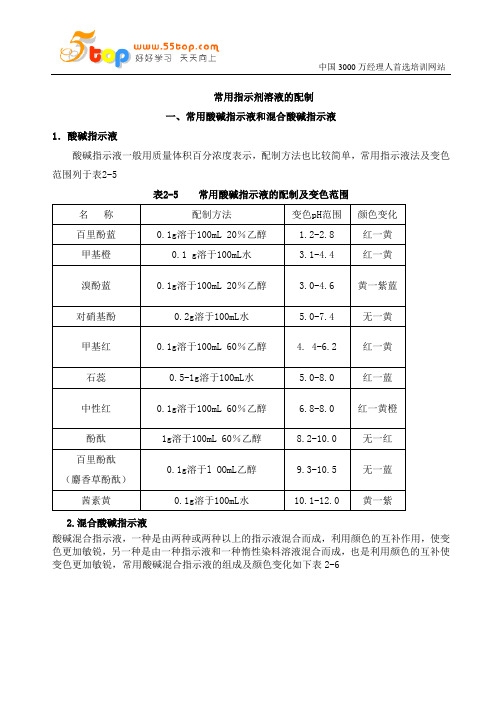
常用指示剂溶液的配制一、常用酸碱指示液和混合酸碱指示液1.酸碱指示液酸碱指示液一般用质量体积百分浓度表示,配制方法也比较简单,常用指示液法及变色范围列于表2-5表2-5 常用酸碱指示液的配制及变色范围2.混合酸碱指示液酸碱混合指示液,一种是由两种或两种以上的指示液混合而成,利用颜色的互补作用,使变色更加敏锐,另一种是由一种指示液和一种惰性染料溶液混合而成,也是利用颜色的互补使变色更加敏锐,常用酸碱混合指示液的组成及颜色变化如下表2-6德信诚精品培训课程(部分)内审员系列培训课程查看详情TS16949五大工具与QC/QA/QE品质管理类查看详情 JIT>>>德信诚深圳培训中心 E-mail:55top@ 报名表下载>>> 公开课计划表表2-6 常用酸碱混合指示液的组成及颜色变化二、氧化还原滴定指示液用于氧化还原滴定反应的指示液有以下几种。
1.氧化还原型指示液这种指示液本身就是氧化剂或还原剂,它的氧化型和还原型颜色不同,因此,在等量点附近发生氧化还原反应,从而引起颜色改变,指示终点的到达,常用以下几种:(1)二苯胺磺酸钠(5 g/L)要时过滤备用。
用时现配。
(2)邻苯氨基苯甲酸(2g/L)过滤,能保持几个月不分解。
(3)邻二氮菲亚铁(1g/L)可保存一年。
2.专属指示液专属指示剂是指在碘量法中使用的淀粉指示液。
淀粉中的直链淀粉(可溶性)可以和I 2生成蓝色配位化合物,而支链淀粉(不溶部分)与I2作用较弱,且生不易逆转的红紫色配合物。
所以,在配制指示液时,要用可溶性淀粉。
淀粉指示液的浓度为5g/L,可按下法配制:称取0.5g可溶性淀粉,于烧杯中,加10mL水调匀,徐徐倒人90mL沸水中,微沸2min,静置,取上层清液加1mlHgI2以抑制细菌作用,如果使用时现配现用,可不加HgI2三、金属指示剂溶液金属指示剂用于配位滴定中。
(1)铬黑T (5g/L) 它的水溶液不稳定,易聚合变质,常用配方有两种。
实验室常用溶液及溶剂的配制

实验室常用溶液及试剂配制表一普通酸碱溶液的配制表二常用酸碱指示剂表三混合酸碱指示剂表四容量分析基准物质的干燥表五缓冲溶液的配制实验室常用试验方法2九、柠檬酸(C6H8O7·H2O)称取试样1.5g(精确到0.0002g)于三角瓶内,加入水50ml溶解,加酚酞指示剂3滴,用1mol/L氢氧化钠标准溶液滴定至粉红色为终点,同时做空白试验。
计算:X%(一水)= (V1-V0)×C×0.06404x m×(1-0.08566)×100X%(无水)= (V1-V0)×C×0.06404x m×100V1-----消耗氢氧化钠标准溶液的体积,ml;V0-----空白所消耗氢氧化钠标准溶液的体积,ml;C------氢氧化钠标准溶液浓度,mol/L;m---样品质量。
十、钙含量测定(磷酸氢钙CaHPO4、磷酸二氢钙Ca(H2PO4)2·H2O、钙粉等)称取2g(精确到0.0002g)样品,用10ml盐酸(1+1)溶解,转移至100ml容量瓶中定溶,用移液管吸取10ml于250ml锥形瓶中,加50ml水,5ml蔗糖溶液(25g/L),2ml三乙酸胺(1+1),1ml乙二胺(1+1),1滴孔雀绿指示液(1g/L),滴加氢氧化钾溶液(200g/L)至无色,再过量10ml,加0.1g盐酸羟胺(每加一种试剂都要摇匀),加钙黄绿素少许,在黑色背景下用0.05mol/L的EDTA标准溶液滴定至绿色荧光消失呈现紫红色为滴定终点。
Ca%= C×V×0.4008x m ×100C------EDTA标准溶液的浓度,mol/L;V-----消耗EDTA标准溶液的体积,ml;m----样品质量。
(二)氟(Fˉ)含量的测定:1、标准曲线的绘制;2、试样含量的测定:称取0.5g(精确到0.0002g)置于50ml纳氏比色管中,加1mol/L盐酸10ml,密闭提取1h (不时摇动),避免粘于管壁,提取后加总离子强度缓冲液25ml,加水至刻度,以滤纸过滤。
实验室常用试剂配制

实验室常用溶液及试剂配制实验室常用溶液、试剂的配制表一普通酸碱溶液的配制表二常用酸碱指示剂表三混合酸碱指示剂表四容量分析基准物质的干燥表五缓冲溶液的配制1、氯化钾-盐酸缓冲溶液2、邻苯二甲酸氢钾—氢氧化钾缓冲溶液3、邻苯二甲酸氢钾-氢氧化钾缓冲溶液4、乙酸—乙酸钠缓冲溶液5、磷酸二氢钾—氢氧化钠缓冲溶液6、硼砂-氢氧化钠缓冲溶液7、氨水-氯化铵缓冲溶液8、常用缓冲溶液的配制实验室常用试验方法2九、柠檬酸(C6H8O7·H2O)称取试样1.5g(精确到0。
0002g)于三角瓶内,加入水50ml溶解,加酚酞指示剂3滴,用1mol/L氢氧化钠标准溶液滴定至粉红色为终点,同时做空白试验。
计算:X%(一水)= (V1-V0)×C×0.06404 m×(1-0。
08566)×100X%(无水)= (V1-V0)×C×0。
06404 m×100V1—-———消耗氢氧化钠标准溶液的体积,ml;V0———--空白所消耗氢氧化钠标准溶液的体积,ml;C———-—-氢氧化钠标准溶液浓度,mol/L;m—-—样品质量.十、钙含量测定(磷酸氢钙CaHPO4、磷酸二氢钙Ca(H2PO4)2·H2O、钙粉等)称取2g(精确到0.0002g)样品,用10ml盐酸(1+1)溶解,转移至100ml容量瓶中定溶,用移液管吸取10ml于250ml 锥形瓶中,加50ml水,5ml蔗糖溶液(25g/L),2ml三乙酸胺(1+1),1ml乙二胺(1+1),1滴孔雀绿指示液(1g/L),滴加氢氧化钾溶液(200g/L)至无色,再过量10ml,加0。
1g盐酸羟胺(每加一种试剂都要摇匀),加钙黄绿素少许,在黑色背景下用0.05mol/L的EDTA标准溶液滴定至绿色荧光消失呈现紫红色为滴定终点。
Ca%= C×V×0.4008 m ×100C———---EDTA标准溶液的浓度,mol/L;V--—-—消耗EDTA标准溶液的体积,ml;m—-——样品质量。
测定酸值用试剂配制方法

测定酸值用试剂配制方法测定酸值,一般是指对水溶液中的酸碱度进行定量测定。
常见的酸值测定方法有酸碱滴定法、pH指示剂法、电位滴定法等。
在进行酸值测定之前,试剂的配制是非常重要的。
下面将介绍一些常用试剂的配制方法。
1.盐酸(HCl)试剂的配制盐酸是酸值测定中常用的试剂,其浓度一般为0.1M。
可以按照下面的步骤进行配制:(1)称取相应质量的浓盐酸溶液(浓度为12M),如需配制1000mL 的0.1M盐酸试剂,则需称取12.1mL的浓盐酸溶液;(2)将称取的浓盐酸溶液缓慢的加入到500mL容量瓶中;(3)使用去离子水将试剂溶液稀释至刻度线。
2.NaOH(氢氧化钠)试剂的配制氢氧化钠是酸值测定中常用的碱试剂,其浓度一般为0.1M。
可以按照下面的步骤进行配制:(1)称取相应质量的氢氧化钠固体,如需配制1000mL的0.1M氢氧化钠试剂,则需称取4g的氢氧化钠;(2)将称取的氢氧化钠固体溶解在一定量的去离子水中;(3)使用去离子水将溶液稀释至1000mL体积。
3.酚酞指示剂的配制酚酞是一种常用的酸碱指示剂,其可用于酸碱滴定和pH指示。
可以按照下面的步骤进行配制:(1)称取适量的酚酞固体;(2)将酚酞固体溶解在一定量的酒精溶液中,使其浓度为0.1%;(3)将酚酞溶液保存在灰色或棕色玻璃瓶中,避免接触阳光。
需要注意的是,以上配制方法中的质量和体积均为示例值,实际配制时可根据需要进行调整。
在进行试剂配制的过程中,应注意实验室安全使用规范,戴好实验手套、护目镜等防护装备,并严格按照配制操作步骤进行操作。
总结起来,测定酸值用试剂配制方法包括盐酸试剂的配制、氢氧化钠试剂的配制以及酚酞指示剂的配制等。
正确的试剂配制是酸值测定的基础,只有确保试剂配制正确,才能获得准确的测定结果。
酸碱标准溶液的配制和标定

酸碱标准溶液的配制和标定
硼砂(Na2B4O7·10H2O)作为基准物质的优点是容易制得 纯品,不易吸收水分且比较稳定,摩尔质量(381.4 g·mol-1) 较大,可减少称量误差。但当空气中水分低于39%时,易失去 结晶水。因此应保存在相对湿度约为60%(食盐和蔗糖的饱和 水溶液)的干燥器中。硼砂水溶液实际上是同浓度的H3BO3和 H2BO3-的混合液:
分析化学
酸碱标准溶液的配制和标定
一、 盐酸标准溶液
试剂浓盐酸含HCl 37%左右,密度为1.19 g·mL-1,物 质的量浓度约为12 mol·L-1。盐酸价廉,一般不会破坏指示 剂,稀盐酸稳定性好,但浓盐酸溶液含有杂质,且易挥发, 因此只能用间接法配制。用这种试剂配制HCl标准溶液时, 先取一定体积的浓盐酸,用水稀释到所需近似浓度,再用基 准物质标定其准确浓度。
分析化学
H3BO3酸性很弱(Ka=5.8×10-10),其共轭碱H2BO3-的碱 性较强(Kb =1.75×10-5),可被HCl准确滴定。滴定反应为
此反Байду номын сангаас可选用甲基红作指示剂。
酸碱标准溶液的配制和标定
二、 氢氧化钠标准溶液
为了配制不含碳酸盐的NaOH标准溶液,可采取以下任 一方法:
(1)首先配制50%的NaOH浓溶液,在这种浓溶液中 Na2CO 3的溶解度很小,待Na2CO3沉下后,吸取上清液稀 释至所需浓度。
(2)称取比需要量稍多的固体氢氧化钠,用少量水迅速 洗涤2~3次,以除去固体表面形成的碳酸盐。然后再用水溶 解,配制溶液。
(3)预先配制较浓的NaOH溶液,往其中加入一定量的 Ba(OH)2或BaCl2,使CO32-生成BaCO3沉淀,放置后取上清 液,稀释至所需浓度。
常用酸碱浓度表

CH3COOH 质量百分数
密度 d 4 / g.cm-3
20
100mL 水溶液中 含 CH3COOH/g
CH3COOH 质量百分数
密度 d 4 / g.cm-3
20
100mL 5 20 25 30 35 40 45 50 55 60
0.9996 1.0012 1.0025 1.0040 1.0055 1.0125 1.0195 1.0263 1.0326 1.0384 1.0438 1.0488 1.0534 1.0575 1.0611 1.0642
24.38 26.85 29.35 31.90 34.48 37.10 39.75 42.44 45.16 47.92
硝酸 HNO3 质量 百分数 1 2 3 4 5 10 15 20 25 30 35 40 45 50 55 60
20 密度 d 4 / g.cm-3
100mL 水溶液 中含 HNO3/g
20 密度( d 4 / g.cm-3)
%(质量) 37 20.2 10 5 3.6 47.5 57 96 10 4.7 71 10 28.4
mol/L 12.0 6.1 2.9 1.4 1 8.8 7.6 18 1.1 0.5 16 2.8 15
100mL 水溶液 中含 NH3/g
0.9939 0.9895 0.9811 0.9730 0.9651 0.9575 0.9501 0.9430
9.94 19.79 39.24 58.38 77.21 95.75 114.0 132.0
0.9362 0.9295 0.9229 0.9164 0.9101 0.9040 0.8980 0.8920
20
100mL 水溶液 中含 H2SO4/g
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常用酸碱溶液的浓度及配制溶液密度/(g·cm-3)质量分数/%物质的量浓度/(mol·L-1) 配制浓盐酸 1.19 38 12稀盐酸 1.10 20 6 浓盐酸:水=1:1(体积比)稀盐酸 1.0 7 2 6 mol·L-1盐酸:水=1:2(体积比)浓硫酸 1.84 98 18稀硫酸 1.18 25 3 稀硫酸:水=1:5(体积比)稀硫酸 1.06 9 1 3 mol·L-1硫酸:水=1:2(体积比)浓硝酸 1.41 68 16稀硝酸 1.2 32 6 浓硝酸:水=8:9(体积比)稀硝酸 1.1 12 2 6 mol·L-1硝酸:水=3:5(体积比)冰醋酸 1.05 99.8 17.5稀乙酸 1.04 35 6 冰醋酸:水=27:50(体积比)稀乙酸 1.02 12 2 6 mol·L-1醋酸:水=1:2(体积比)浓氨水0.91 28 15稀氨水0.96 11 6 浓氨水:水=2:3(体积比)稀氨水 1.0 3.5 2 6 mol·L-1氨水:水=1:2(体积比)浓氢氧化钠 1.44 41 14.4稀氢氧化钠 1.1 8 2 氢氧化钠80g/L石灰水0.15 0.02 饱和石灰水澄清液几种常见的气体干燥剂干燥剂可干燥气体气体在水中的溶解度气体T 溶解度气体T 溶解度气体T 溶解度/o C /(mL·100mL-1H2O) /o C /(m L·100mL-1H2O) /o C /(m L·100mL-1H2O) H20 2.14 N20 2.33 O20 4.8920 0.85 40 1.42 25 3.16CO 0 3.5 NO 0 7.34 H2S 0 43720 2.32 60 2.37 40 186CO20 171.3 NH30 89.9 Cl210 31020 90.1 100 7.4 30 177SO20 22.8常用的气体净化剂气体所含杂质净化剂气体所含杂质净化剂O2Cl2NaOH溶液CO CO2石灰水H2H2S CuSO4溶液N2O2加热铜网CO2HCl 饱和NaHCO3溶液CO2CO或H2CuOCH4C2H2溴水H2S HCl 饱和NaHSCl2HCl 饱和食盐水NO NO2水常见化合物的俗名类别俗名主要化学成分硅化合物石英SiO2水晶SiO2打火石、燧石SiO2玻璃SiO2砂石SiO2橄榄石Mg SiO4硅锌石Zn SiO4硅胶SiO2钠化合物食盐NaCl硼砂Na2B4O7·10H2O 苏打、纯碱Na2CO3小苏打NaHCO3海波Na2S2O3·5H2O红矾钠Na2Cr2O7·2H2O 苛性钠、烧碱、苛性碱、火碱NaOH芒硝Na2SO4·10H2O 硫化碱Na2S水玻璃Na2SiO3·nH2O 钾盐、碱砂K2CO3黄血盐K4Fe(CN)6·2H2O钾化合物赤血盐K3Fe(CN)6苛性钾KOH灰锰氧KMnO4钾硝石、火硝KNO3吐酒石K(SbO)C4H4O6铵化合物硝铵、钠硝石NH4NO3硫铵(NH4)2SO4卤砂NH4Cl钡化合物重晶石BaSO4钡石BaSO4钡垩石BaCO3锶化合物天青石SrSO4锶垩石SrCO3铬化合物铬绿Cr2O3铬矾Cr2K2(SO4)4·24H2O铵铬矾Cr2(NH4)2(SO4)4·24H2O 红矾K2Cr2O7铬黄PbCrO4钙化合物电石CaC2白垩CaCO3石灰石CaCO3大理石CaCO3文石、霞石CaCO3方解石CaCO3萤石、氟石CaF2熟石灰、消石灰Ca(OH)2漂白粉、氯化石灰Ca(OHCl)·Cl 生石灰CaO无水石膏、硬石膏CaSO4烘石膏、熟石膏、巴黎石膏2CaSO4·H2O重石CaWO4白云石CaCO3·MgCO3锰化合物硫锰矿MnS 软锰矿MnO2黑石子MnO2铝化合物矾土Al2O3刚玉Al2O3铝胶Al2O3红宝石Al2O3明矾、铝矾K2Al2(SO4)4·2H2O高岭土Al2O3·2SiO2·2H2O铵矾(NH4)2Al2(SO4)4·24H2O明矾石K2SO4·Al2(SO4)3·2 Al2O3·6H2O群青、佛青Na2Al4Si6S4O33或Na X Al4Si6S4O23绿宝石3BeO,Al2O3,6SiO2铁化合物铁丹Fe2O3赤铁矿Fe2O3磁铁矿Fe3O4菱铁矿FeCO3滕氏盐Fe3[Fe(CN)6]2普鲁氏盐Fe4[Fe(CN)6]3绿矾FeSO4·7H2O铁矾Fe2K2(SO4)4·24H2O毒砂FeAsS磁黄铁矿FeS黄铁矿FeS2摩尔盐(NH4)2SO4·FeSO4·6H2O镁化合物白苦土、烧苦土MgO卤盐MgCl2泻利盐MgSO4·7H2O菱苦土MgCO3光卤石KCl·MgCl2·6H2O 滑石3MgO·4SiO2·H2O锌化合物锌白ZnO红锌矿ZnO闪锌矿ZnS炉甘石ZnCO3锌矾、白矾ZnSO4·7H2O 锌钡白、立德粉ZnS+BaSO4铅化合物黄丹、密陀僧PbO红铅、铅丹Pb3O4方铅矿PbS铅白2PbCO3·Pb(OH)2汞化合物甘汞Hg2Cl2升汞HgCl2三仙丹HgO辰砂米砂HgS雷汞Hg(CNO)2·1/2H2O铜化合物铜绿CuCO3·Cu(OH)2孔雀石CuCO3·Cu(OH)2胆矾、铜矾CuSO4·5H2O 赤铜矿Cu2O方黑铜矿CuO黄铜矿CuFeS2砷化合物砒霜As2O3雄黄As2S2或As4S4雌黄As2S3锑化合物锑白Sb2O3或Sb4O6辉锑矿Sb2S3闪锑矿Sb2S3有机化合物电石气C2H2蚁醇、木醇、木精CH3OH酒精、火酒CH3CH2OH福尔马林、福马林HCHO蚁酸HCOOH醋、醋精、乙酸CH3COOH石炭酸C6H5OH玫瑰油苯乙醇火棉胶硝化纤维石油醚汽油的一种(沸程30-70o C)凡士林液体和固体石蜡烃混合物常见无机离子的颜色颜色离子红[Fe(NCS)n]3-n,[Co (H2O)6]2+,[Co(NH3)5(H2O)6]2+,[Cr (NH3)3 (H2O)3]3+橙Cr2O72-,,[Co(NH3)6]3+,[Cr (NH3)4 (H2O)2]3+,[Cr (NH3)5 (H2O)]2+,[Fe(CN)6]3-肉[Mn(H2O)6]2+黄[CuCl4]2-,[Cr(NH3)6]3+,CrO42-,[Fe(CN)6]4-,[Co(NH3)6]2+、I3-绿[Cr (H2O)5Cl]2+,[Cr (H2O)4Cl2]+,CrO2-,MnO42-,[Fe(H2O)6]2+,[Ni(H2O)6]2+蓝[Cu(H2O)4]2+,[Cu(NH3)4]2+, [Cr (H2O)6]2+,[Co(SCN)4]2-,[Ni (NH3)6]2+紫[Cr (H2O)6]3+,[Cr (NH3)2 (H2O)4]3+,MnO4-,[Fe(H2O)6]3+,[CoCl(NH3)5]2+,[Co(NH3)4CO3]+,[Co(CN)6]3-常见无机化合物的颜色颜色化合物黑Ag2S,Hg2S,HgS,PbS,Cu2S,CuS,FeS,CoS,NiS,CuO,NiO,Fe3O4,FeO,MnO2,金属的沉淀,碳褐Bi2S3,SnS,Bi2O3,PbO2,Ag2O,CdO,CuBr红HgS,Sb2S3,Fe2O3,HgO,Pb3O4,HgI2,FeCl3(无水物),K3Fe(CN)6,Ag2Cr2O7,某些重铬酸盐,碘化物和钴盐粉红亚锰盐,水合钴盐黄As2S3,As2S5,SnS2,CdS,HgO,AgI,PbO,多数铬酸盐、铁盐,某些碘化物绿镍盐,水合亚铁盐,某些铜盐如CuCO3,CuCl2,某些铬盐蓝水合铜盐,无水钴盐紫高锰酸盐,一些铬盐桔红Sb2S5,Sb2S3,多数重铬酸盐几种元素的焰色反应元素火焰颜色元素火焰颜色Na 黄Ba 黄绿K 紫Cu 绿Sr 猩红 B 绿Ca 砖红Pb、Sb 淡蓝特殊化学药品的保存试剂类型常见试剂保存易挥发浓盐酸、浓氨水、丙酮、乙醇、乙醚、甲醇、甲醛、苯等严密盖紧,置阴凉处易潮解或易水解氯化钙、氯化锌、氯化亚铁、氯化铁、硝酸铵、硝酸钠、硫化钠、五氧化二磷、无水氯化铝等严密盖紧,蜡密封见光易分解浓硝酸、硝酸银、双氧水、碘化钾、溴化钾、绿化亚汞、亚铁盐、亚硝酸盐、氯水等用棕色瓶盛放,置阴凉、避光处易燃液体石油醚、氯乙烷、乙醚、乙醛、汽油、松节油、二硫化碳、甲醇、乙醇、苯、甲苯等阴凉通风处,与其它可燃物、易发生火花的器物和氧化剂(氯酸钾、高锰酸钾、过氧化钠等)隔离存放易燃易爆固体钾、钠、钙、氢化钠、磷化钙、碳化钙、硅化镁等钾、钠放在盛煤油的瓶里,其它装瓶后密封放在干燥器里硝化纤维、火药棉、苦味酸、雷汞等保存在阴凉干燥处白磷瓶装,浸没在水里红磷、硫、镁粉、锌粉、铝粉、萘、樟脑等保存在阴凉处并和氧化剂分开存放剧毒品氰化钾、氰化钠、氧化砷、白磷、氯化汞保存在阴凉干燥处,跟酸类隔离,专柜加锁、专人负责强氧化剂过氧化钠、过氧化钾、过硫酸盐、硝酸铵硝酸钠、硝酸钾、硝酸铅、高锰酸钾、重铬酸钾、氯酸钾等保存在阴凉通风处,跟酸类、木屑、硫粉、金属粉、硫化物、糖类等易燃物分开存放强腐蚀剂浓硫酸、发烟硝酸、浓盐酸、氢氟酸、氢溴酸、醋酐、液溴等液体;氢氧化钠、氢氧化钾、硫化钠、无水氯化铝、三氯化磷、苯酚等固体保存在阴凉通风处,跟其它药品隔离放置。
用抗腐蚀材料做器架,其中发烟硝酸和液溴的瓶外垫沙放置实验室常用的灭火器及其使用范围灭火器类型药液成分适用范围泡沫灭火器Al2(SO4)3和NaHCO3适用于油类起火二氧化碳灭火器液态CO2适用于扑灭电器设备、小范围油类及忌水的化学物品着火四氯化碳灭火器液态CCl4适用于扑灭电器设备、小范围的汽油、丙酮等失火。
不能用于扑灭活泼金属钾、钠的失火,因CCl4会强烈的分解,甚至爆炸。
电石、CS2的失火也不能使用它,因为会产生光气一类的毒气干粉灭火器主要成分是碳酸氢钠等盐类物质与适量的润滑剂和防潮剂扑救油类、可燃性气体,电器设备、精密仪器、图书资料和遇水易燃烧物品的初期火灾1211灭火器CF2ClBr液化气体特别适用于扑灭油类、有机溶剂、精密仪器、高压电器设备的失火常见化学毒物的急性致毒作用及救治方法分类名称主要致毒作用与症状救治方法酸硫酸、盐酸、硝酸接触:硫酸局部红肿痛,重者起水泡、呈烫伤症状;硝酸、盐酸腐蚀性小于硫酸吞服:强烈腐蚀口腔、食道、胃粘膜先用布将酸液擦净,再用大量水冲洗,然后用2%碳酸氢钠水溶液冲洗,最后清水冲洗初服可洗胃,时间长忌洗胃以防穿孔;应立即服7.5%碳酸氢镁悬液60mL,鸡蛋清调水或牛奶200mL碱氢氧化钠、氢氧化钾接触:强烈腐蚀性,化学烧伤吞服:口腔、食道、迅速用水、柠檬汁、稀乙酸或2%硼酸水溶液洗涤禁洗胃或催吐,给服稀乙酸或柠檬汁胃粘膜糜烂500mL,或0.5%盐酸100-500mL,再服蛋清水、牛奶、淀粉糊、植物油等有机化合物石油烃类吸入高浓度汽油蒸汽、出现头痛、头晕、心悸、神志不清等汽油对皮肤有脂溶性和刺激性,皮肤干燥、皲裂、个别引起红斑、水疱石油烃能引起呼吸、造血、神经系统慢性中毒症状某些润滑油和石油残渣长期刺激皮肤可能引起皮肤癌移至新鲜空气处,重症可给与吸氧温水清洗医生治疗涂5%炉甘石洗剂苯及其同系物吸入蒸汽及皮肤渗透急性:头晕、头痛、恶心,重者昏迷抽搐甚至死亡慢性中毒:肝、心、肾损害皮肤接触用清水洗涤人工呼吸、输氧、医生处置气体氮氧化物呼吸系统急性损害急性中毒:口腔、咽喉粘膜、眼结膜充血、头晕、支气管炎、肺炎、肺水肿慢性:呼吸道病变移至新鲜空气处,必要时吸氧二氧化硫、三氧化硫对上呼吸道及眼结膜有刺激作用;结膜炎、支气管炎、胸痛、胸闷移至新鲜空气处,必要时吸氧,用2%碳酸氢钠洗眼硫化氢眼结膜、呼吸及中枢神经系统损害急性:头晕、头痛甚至抽搐昏迷;久闻不觉其气味更具危险性移至新鲜空气处,必要时吸氧;生理盐水洗眼。
