(完整版)初三化学中考总复习专题一物质的共存、检验、鉴别和除杂
【中考化学】2023届第一轮复习分类专题—物质的检验、鉴别、除杂及成分确定(基础篇)含解析

【中考化学】2023届第一轮复习分类专题—物质的检验、鉴别、除杂及成分确定(基础篇)一、选择题1.化学与生活息息相关,人类的生活离不开化学。
生活中下列做法错误的是( )A .食品包装中充氮气防腐B .用过滤和蒸馏等方法净化水C .用灼烧方法区分棉纤维和合成纤维D .用硬水洗涤衣服有利于节约肥皂2.向溶液X 中加入氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝。
则溶液X 中一定含有的微粒是A. Cl - B.C. Ca 2+D.23CO -4NH +3.除去下列物质中的少量杂质,所选除杂试剂及方法不正确的是选项物质杂质除杂试剂及方法A KCl MnO 2加水溶解、过滤、蒸发B H 2HCl 先通入氢氧化钠溶液,再通入浓硫酸C Cu CuO 加入过量的稀硫酸,过滤、洗涤、干燥D CO 2CO将气体点燃A. AB. BC. CD. D4.下列实验操作能达到目的的是选项实验目的实验操作A鉴别二氧化锰和木炭粉观察颜色B鉴别尿素[CO(NH2)2]和硝酸钾加碱混合研磨闻气味C除去硝酸钠溶液中的硫酸钠加入适量的硝酸钡溶液,过滤D除去氯化钾中的氯酸钾加适量的二氧化锰,加热A. AB. BC. CD. D5.下列实验设计不能达到实验目的的是选项实验目的试剂或方法A除去粗盐中难溶性杂质溶解、过滤、蒸发B验证铜与银的金属活动性稀盐酸C鉴别合成纤维和羊毛纤维灼烧闻气味D除去硫酸亚铁溶液中混有的少量硫酸铜加过量铁粉、过滤A. AB. BC. CD. D6.下列实验方案,能达到实验目的的是实验目的实验方案A检验集气瓶中CO2是否收集满将带火星的木条伸入集气瓶内B除去KCl溶液中混有的K2SO4滴加适量Ba(OH)2溶液后过滤C鉴别CH4、H2两种无色气体点燃气体,分别在火焰上方罩一个干燥的冷烧杯D鉴别稀盐酸和蒸馏水取样,分别滴加紫色石蕊溶液A. AB. BC. CD. D7.除去下列物质中混有的少量杂质,所选试剂和操作方法均正确的是选项物质杂质所选试剂和操作方法A KCl MnO ₂加入足量的水溶解,过滤,洗涤,干燥B O 2H 2O 通过氢氧化钠溶液C Cu Fe 加入过量的稀硫酸,过滤,洗涤,干燥DNaCl 溶液BaCl 2加入适量的稀硫酸,过滤A. AB. BC. CD. D8.某兴趣小组为探究“猪肝中的铁元素”,进行了以下实验:选用新鲜猪肝,如图操作I 将猪肝中的铁转化为铁离子,再用硫氰化钾溶液检验(硫氰化钾溶液遇铁离子变红色)。
中考化学专题复习: 物质的共存、检验与鉴别、分离与除杂

知识点2 物质的检验与鉴别
3 4
③借助产物法:若用以上两种方法还不能将组内的一种或两种物质鉴别 出来,可借用相关反应产物和酸反应加以鉴别(组内物质一般含有酸)。
【实例】鉴别FeCl3、HCl、NaCl、NaOH四种溶液。 能使【沉分淀析溶】解利的用是FeHCCl3l与溶N液a,OH不反能应使的沉产淀物溶F解e(的O是H)N3来aC鉴l溶别液H。Cl和NaCl溶液,
知识点3 物质的分离与除杂
3 4
③液体的除杂步骤:
a. 对比两种物质,找出两种物质中含有的离子;
b. 根据各离子的化学性质,判断出杂质离子与非杂质离子,找出与 杂质离子不共存且不引进新杂质的离子,确定除杂试剂。如除去NaCl中 的Na2CO3。
·25 ·
例题3
3 4
除去下列物质中少量杂质,所用试剂及操作方法错误的是(A )。
·39 ·
命题点3 物质的分离与除杂
3 4
14. (黔南中考)某同学为除去食盐水中的Na2SO4杂质,进行了以下 实验:
下列有关说法错误的是( D )。
A. X为BaCl2溶液 B. Y为Na2CO3 C. Z为稀盐酸
D. 步骤②与④可交换
·40 ·
命题点3 物质的分离与除杂
3 4
15. 下列实验操作不能达到实验目的的是( B)。
答案 A 点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的 必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键。
·27 ·
·28 ·
命题点1 物质的共存
3 4
1. 在pH=3的溶液中,下列离子可以大量共存的是(A )。
2. 下列各组离子在水中能大量共存且形成无色溶液的是(B )。
九年级人教版化学复习课件 专题三 物质的检验、鉴别、除杂及共存

4.化学方法: (1)用一种试剂鉴别 ①用水鉴别:被鉴别的物质在水中溶解性差异较 大;溶于水后溶液呈现不同颜色或溶于水后溶液温 度发生明显变化,可考虑用水来鉴别。 ②用酸碱指示剂鉴别:被鉴别的物质溶液的酸碱 性不同,可考虑选用石蕊溶液、酚酞溶液来鉴别。
③用酸、碱、盐鉴别:被鉴别的物质溶液的阳 离子中有Ca2+、Mg2+、Cu2+、Fe3+等时,可考虑 选用Ba(OH)2、NaOH溶液来鉴别; ④用燃烧的木条鉴别:被鉴别的物质是气体, 根据其是否可燃或是否支持燃烧,可考虑用燃 烧的木条来鉴别。
氮肥、钾肥全部溶于水 磷肥大多不溶于水或部分溶于水 铵态氮肥(铵盐)与之混合能放出具有刺激
性气味的气体
【温馨提示】任何物质的检验或鉴别必须包 括四个步骤:(1)取样(取少量固体或液体或气 体于试管或烧杯或集气瓶中)。(2)操作(包括 所用试剂及检验或鉴别过程)。(3)现象(操作 过程中可能出现的现象)。(4)结论(根据现象 分析得出结论),即“先取样,后操作;先现 象,后结论”。
专题三 物质的检验、鉴别、
除杂及共存
望谟县第五中学 周爱军
类型一 物质的检验和鉴别
一、物质的检验 1. 原理:根据物质具有不同的特性,利用这种 特性上的差异,选择适当的、可行的方法,将物 质检验出来,要求现象要明显。 2. 检验方法 (1)物理方法:根据物质的特殊物理性质,如颜 色、气味、水溶性等,通过观察、分析、判断、 得出结论。 (2)化学方法:利用物质的特殊化学性质,反应 时产生的特征现象,对所给物质进行检验。
3. 常见气体的检验
气体名称
检验方法
实验现象
O2
用带火星的木条
带火星的木条复燃
点燃,在火焰上方罩上 产生淡蓝色火焰,烧杯内
九年级化学复习第16讲 物质的检验与鉴别、除杂、共存
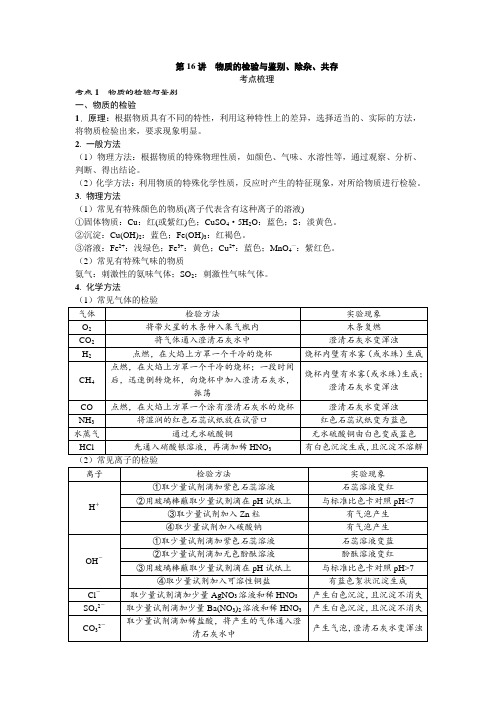
第16讲物质的检验与鉴别、除杂、共存考点梳理考点1 物质的检验与鉴别一、物质的检验1. 原理:根据物质具有不同的特性,利用这种特性上的差异,选择适当的、实际的方法,将物质检验出来,要求现象明显。
2. 一般方法(1)物理方法:根据物质的特殊物理性质,如颜色、气味、水溶性等,通过观察、分析、判断、得出结论。
(2)化学方法:利用物质的特殊化学性质,反应时产生的特征现象,对所给物质进行检验。
3. 物理方法(1)常见有特殊颜色的物质(离子代表含有这种离子的溶液)①固体物质:Cu:红(或紫红)色;CuSO4·5H2O:蓝色;S:淡黄色。
②沉淀:Cu(OH)2:蓝色;Fe(OH)3:红褐色。
③溶液:Fe2+:浅绿色;Fe3+:黄色;Cu2+:蓝色;MnO4—:紫红色。
(2)常见有特殊气味的物质氨气:刺激性的氨味气体;SO2:刺激性气味气体。
4. 化学方法(1)常见气体的检验1. 物质的鉴别原则:操作简单、试剂种类少、现象明显。
2. 物质鉴别的方法:应先简后繁,先用物理方法后用化学方法。
(1)物理方法:依据物质的特殊的物理性质(如颜色、状态、气味、溶解性、溶解时的吸放热现象)进行观察、分析、判断,得出结论。
(2)化学方法:依据物质间反应时所产生的特殊反应现象(如变色、放出气体、生成沉淀、放热等)进行鉴别。
3. 物质鉴别的形式(1)一种试剂鉴别:选择一种试剂,分别加入待测物质中,观察实验现象。
(2)多种试剂鉴别:选择多种试剂,依次加入待测物质中,会出现明显不同现象。
(3)无试剂鉴别:先利用物质物理性质不同或物质间的相互反应(包括与生成物反应)而产生不同现象把物质鉴别出来。
考点2 物质的除杂1. 除杂原则:不增、不减、易分(1)主不减:所选试剂不能与被提纯物质(主要成分)反应。
(2)杂不增:在除去杂质的同时,不能产生新的杂质。
(3)易分离:除杂后生成的产物的状态与被提纯物质的状态要不同,方便除去。
2. 除杂方法(1)气体的除杂方法一:将杂质气体通过物质吸收、反应除去,如氧气中的水蒸气可通过浓硫酸吸收除去、一氧化碳中的二氧化碳可通过氢氧化钠溶液吸收除去。
2025年中考化学复习专题二:物质的共存、检验、鉴别和除杂课件

3、常见离子的检验
离子名称
检验方法
①取少量试剂滴加紫色石蕊溶液
H+
(酸)
②用玻璃棒蘸取少量试剂滴在pH试纸上
③取少量试剂加入Zn粒
①取少量试剂滴加紫色石蕊溶液
OH- (碱)
②用玻璃棒蘸取少量试剂滴在pH试纸上 ③取少量试剂滴加无色酚酞溶液
④取少量试剂加入可溶性铜盐
实验现象
紫色石蕊溶液变红 与标准比色卡对照,pH<7 有气泡产生 紫色石蕊溶液变蓝
物质 HCl溶液 NaCl溶液 MgCl2溶液 Cu(NO3)2溶液 NaCl溶液 KNO3溶液
杂质 H2SO4溶液 Na2CO3溶液 HCl溶液 AgNO3溶液 KNO3溶液 NaCl溶液
所选试剂或方法 加入适量氯化钡溶液,过滤
加入适量的稀盐酸 加入足量镁粉,过滤 加入足量铜粉,过滤
蒸发结晶 冷却热饱和溶液
澄清石灰水变 浑浊
①视察颜色 ②取少量试剂滴加可溶性碱
溶液呈蓝色 有蓝色絮状沉淀生成
类型二 检验和鉴别
Fe3+ Fe2+
①视察颜色 ②取少量试剂滴加可溶性碱 视察颜色
溶液呈黄色 有红褐色沉淀生成 溶液呈浅绿色
NH4+
取少量试剂滴加可溶性碱,加热,把湿润的红色石蕊 产生有刺激性气味的气体,红色
试纸放在试管口
加水溶解,过滤
考B
鉴别Fe、CuO、C三种黑色固体粉末
滴加稀硫酸
C
检验碳酸钠溶液中是否含有氯化钠
加过量的稀盐酸后,再滴加硝酸
银溶液
D 从含有少量氯化钠的饱和硝酸钾溶液中提纯
蒸发溶剂
硝酸钾
4、以下对不同工业废水的处理措施及对应的方法,都正确的是( D )
选项
废水中的主要污染物
中考化学专题复习物质的检验、鉴别、除杂与共存

Cu
Cu
Fe
CuO
CuO
2.初中常见物质的除杂分为三类:气体除杂、液体除
杂、固体除杂
(1)气体除杂(2017.9A;2015.10A;2011.9A)
根据物质的性质差异选用固体或液体除杂试剂。
方法一:将杂质气体通过物质吸收、反应除去,如氧气
中的水蒸气可通过浓硫酸吸收除去、一氧化碳中的二氧
化碳可通过氢氧化钠吸收除去;
方法二:将杂质气体转化为主气体,如二氧化碳中的一 氧化碳可通过灼热的氧化铜,使一氧化碳转化成二氧化 碳。
(2)固体除杂(2017.9C;2013.8D;2012.7AD;2011.9BD) 方法一:将杂质转化为气体除去,如氧化铜中的炭粉通 过在空气中灼烧除去; 方法二:将杂质转化为溶液除去,如铜中的铁可通过与 盐酸反应除去。
【常见固体除杂举例】
主物质
CuO
杂质
Cu
除杂方法
在空气(或氧气)中灼烧混合物 稀硫酸(或稀盐酸) ,过滤 加入足量的________________ 稀硫酸(或稀盐酸) ,过滤 加入足量的________________
氢气
产生淡蓝色火焰,烧 点燃,在火焰上方罩干冷烧杯 杯内壁上有水珠 产生淡蓝色火焰,干 点燃,分别用干冷的烧杯和内 冷的烧杯内壁出现水 壁涂有澄清石灰水的烧杯罩在 雾,涂有澄清石灰水 火焰上方 的烧杯内壁出现浑浊
甲烷
2. 常见离子的检验(2015.10B)
方法 离子 说明与解释 蓝 色;含Fe2+的溶 观察 Cu2+、 Fe2+、 含Cu2+的溶液呈____ 浅绿 色;含Fe3+的溶液呈____ 黄 色 Fe3+ 液呈_____ 法 红 色;OH-能 H+能使紫色石蕊试液变___ 变色 蓝 色,能使无色酚 H+、OH- 使紫色石蕊试液变___ 法 红色 酞试液变___
2020年中考化学复习物质的检验,除杂,共存常考知识点总结(共21张PPT)

黄金、假黄金 盐酸 (铜锌合金) 灼烧
现象 泡沫 较多的是软水, 泡沫 较少的是硬水 灰白色或难溶于水或部分溶于水的是磷肥 有 刺激性气味气体 产生的是铵态氮肥 有 气泡 产生的是假黄金,反之是黄金 有 黑色物质 生成的是假黄金,反之是黄金
鉴别方法:
(1)鉴别硬水和软水用肥皂水。 (2)鉴别天然纤维和合成纤维用燃烧法。 (3)鉴别合金和纯金属用相互刻画法。 (4)鉴别热塑性塑料和热固性塑料用加热法。
方法
适用范围或原理
举例
物理
过滤法
①固体与液体混合物的分离 粗盐的提纯,步骤为
②可溶性固体与不溶性固体 过滤 、 蒸发 混合物的分离
溶解 、
方法
①分离溶质与溶剂
从含有HCl的NaCl溶液中
蒸发
②除去易挥发的杂质
分离出固体NaCl
结晶法
可溶性固体溶质溶解度受
降低温度 温度影响变化大小不同
提纯混有少量NaCl的KNO3
(2)化学方法 ①沉淀法:在混合物中加入某种试剂,使其中一种以沉淀形式分离出去的方法。使用该法一定 要注意不能引入新的杂质。如 NaCl 中混入少量的 Na2CO3 溶液,可用适量的 CaCl2 溶液,Na2CO3 跟 CaCl2 反应生成沉淀物 CaCO3,从而把 CO32 除去。 ②气化法:采用加热或加入某种试剂,使杂质转化为气体(试剂通常为稀盐酸或稀硫酸)。如除 去氯化钠溶液中混有的少量碳酸钠,可用稀盐酸,盐酸跟碳酸钠反应生成气体二氧化碳、氯化 钠和水,从而把碳酸钠除去。 ③吸收法:将杂质转入溶剂或溶液中,常用来除气体中的杂质,如气体通过盛有浓硫酸的洗气 瓶,水蒸气被吸收;再如 CO 中混有少量 CO2,可将混合气体通入氢氧化钠溶液来吸收 CO2。 ④转化法:通过反应将杂质转化为被提纯的物质。如 KCl 混有 K2CO3,可加入适量盐酸将 K2CO3 转化为 KCl;CO2 中混有少量 CO,可通过灼热的 CuO 粉末将 CO 转化为 CO2。 ⑤加热法:杂质受热易分解,通过加热或高温将杂质除去。如除去 CaO 中混有的 CaCO3、KCl 中 混有的 KClO3 等。 ⑥溶解法:用酸或碱溶液将杂质转化成液体而除去。如铜粉中混有少量铁粉,向混合物中滴加 足量的稀硫酸除去铁粉。
中考化学专题突破- 物质的检验、鉴别、共存和除杂

1.(2015河北中考)下列实验方案不能达到目的的是( C ) A.用Na2SO4除去NaCl中的BaCl2 B.用点燃的方法鉴别涤纶和羊毛线 C.用点燃的方法除去CO2中的CO D.用水鉴别NH4NO3和NaOH固体
2.(2014河北中考)如图所示实验设计不能达到目的的是( A )
3.(2014河北中考)除去下列各组物质中的少量杂质,所用方法错误的是( C ) 4.(2017河北中考)下列实验操作能够达到目的的是( C )
相互刻画
灼烧(或加入 稀盐酸)
加入二氧化 锰
有___划__痕___的是纯铜 ___变__黑___(或___有__气__泡__产__生___)的是黄铜,无明显现象的 是黄金
有__气__体__产__生___的是过氧化氢溶液,无明显现象的是水
其他物质的鉴别:
①热塑性塑料和热固性塑料的鉴别:加热。能熔化的是__热__塑__性__塑__料___ ,
的溶液、使紫色石蕊溶液变红的溶液等。
(2)“碱性”(或pH>7)条件型:溶液中一定存在OH-,该溶液中没有能
和OH-反应的物质(或离子)。常见的叙述为:碱性溶液、pH=11
(pH>7)的溶液、使紫色石蕊溶液变蓝的溶液或使无色酚酞溶液变
红的溶液等。
(3)“无色”条件型:则溶液中不含以下物质或离子:
①蓝色溶液:含Cu2+的溶液,如CuSO4、CuCl2、Cu(NO3)2溶液。
中的NaHCO3,可加热混合物将NaHCO3转化为Na2CO3。反应原理 为2NaHCO3==Δ=Na2CO3+CO2↑+H2O。 ⑥置换法:将杂质通过置换反应除去。如除去FeSO4溶液中的CuSO4, 可加过量的铁粉再过滤。反应原理为CuSO4+Fe===Cu+FeSO4。 ⑦吸收法:将气体中的杂质用固体或液体吸收除去。如除去CO中混 有的少量CO2,可以用NaOH溶液。反应原理为CO2+2NaOH=== Na2CO3+ H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题一物质的共存、检验、鉴别和除杂Ⅰ. 物质的共存(8年3考)针对训练1. (2013长沙)下列各组物质分别加入到足量的水中,能得到无色透明溶液的是()A. KNO3、NaCl、HClB. FeCl3、Na2SO4、KClC. CuSO4、H2SO4、NaClD. FeCl2、KCl、NaOH2. (2016赤峰)某溶液中大量存在的离子仅有NH+4、Ba2+和X离子,则X是()A. OH-B. Cl-C. K+D. SO2-43. (2016重庆A)某植物培养液中含有NH4Cl和CuSO4,下列物质在该培养液中能大量存在的是()A. NaOHB. BaCl2C. KNO3D. AgNO34. (2017衡阳)下列离子在pH=1的溶液中能大量共存,且为无色溶液的是()A. NH+4Ca2+Cl-NO-3B. K+Na+Cl-CO2-3C. Fe3+Mg2+NO-3Cl-D. Na+Ba2+NO-3OH-5. (2017荆州)某溶液能使紫色石蕊溶液变蓝,下列各组离子在该溶液中能大量共存的是()A. SO2-4、NO-3、Ba2+、Cl-B. Cu2+、Na+、NO-3、K+C. K+、CO2-3、NO-3、Cl-D. H+、Ba2+、K+、NO-36. (2017南京)下列各组离子在水中能大量共存的是()A. Cu2+、Na+、Cl-、OH-B. H+、K+、NO-3、SO2-4C. Na+、NH+4、NO-3、OH-D. Ag+、Ba2+、NO-3、Cl-7. (2017滨州)小滨对某无色溶液所含溶质的记录,合理的是()A. HCl、NaOH、Na2SO4B. KNO3、ZnCl2、FeCl3C. AgNO3、H2SO4、NaClD. NaOH、Na2CO3、NaCl8. (2016巴中)下列各组离子在指定的溶液中能大量共存的一组是()A.在硝酸铵溶液中:Na+、Cu2+、OH-B.在稀盐酸中:Ba2+、CO2-3、Zn2+C.在氯化钠溶液中:K+、Ca2+、NO-3D.在氢氧化钠溶液中:H+、Mg2+、Cl-Ⅱ.物质的检验、鉴别(8年4考)针对训练【长沙真题精选】1. (2011长沙)“家庭小实验”是利用家庭生活中常用的物质,进行化学实验探究的活动。
下列实验不能..用“家庭小实验”完成的是()A. 检验自来水是否含有氯离子B. 用闻气味的方法鉴别酒精和水C. 检验自来水是否为硬水D. 探究铁在潮湿的空气中是否生锈2. (2014长沙)鉴别下列物质使用的方法或试剂,正确的是()A. 氧气与氢气——闻气味B. 硫酸铜粉末与氯化钠固体——加水C. 稀硫酸与稀盐酸——滴加紫色石蕊溶液D. 二氧化碳气体与氯气——用燃着的木条3. (2017长沙)下列各组物质的溶液,不另加试剂就不能..鉴别出来的一组是()A. CuSO4NaOH KNO3B. FeCl3AgNO3NaNO3C. Na2CO3HCl BaCl2D. CaCl2K2CO3NaCl【好题精练】4. (2017北京)下列方法能区分氧气和二氧化碳两瓶气体的是()A. 闻气味B. 观察颜色C. 倒入适量氢氧化钠溶液D. 将燃着的木条伸入集气瓶中5. (2017成都)能用于鉴别氢氧化钠溶液和氢氧化钙溶液的物质是()A. HClB. KNO3C. K2CO3D. FeCl36. (2017株洲)只用一种试剂可以区分(NH4)2SO4、NH4Cl、K2SO4三种无色溶液,这种试剂是()A. AgNO3溶液B. Ba(OH)2溶液C. NaOH溶液D. 盐酸7. (2017南雅下学期一模改编)下列鉴别物质的方法中,切实可行的是()A. 用酚酞溶液鉴别NaCl溶液和盐酸B. 用水鉴别Na2CO3和CaCO3固体C. 用碳酸钠鉴别稀盐酸和稀硫酸D. 用酚酞溶液鉴别烧碱与纯碱8. (2017麓山一模)用括号内试剂不能一次性将组内物质鉴别出来的是()A. 固体:NaOH、NH4NO3、NaCl(水)B. 液体:稀盐酸、H2O、Ca(OH)2溶液(石蕊溶液)C. 固体:NaCl、CaCO3、KCl(水)D. 液体:Ba(NO3)2溶液、MgCl2溶液、K2CO3溶液(稀硫酸)9. (2017烟台改编)下列各组物质的溶液,不用其他试剂,只用观察和组内物质的溶液相互混合的方法,就能将它们一一鉴别出来的是()A. NaCl、BaCl2、CuSO4、KNO3B. Ba(NO3)2、NaCl、Na2SO4、HClC. NaOH、CuCl2、NaCl、KClD. HCl、Na2CO3、KCl、CaCl210. (2017哈尔滨)区分下列各组物质的两种方法都正确的是()12. (2017德州)下列四个实验方案设计不合理的是()鉴别的是()A. Na2SO4、BaCl2、KNO3、NaClB. NaOH、Na2SO4、FeCl3、BaCl2C. Na2SO4、Na2CO3、BaCl2、HClD. NaCl、AgNO3、NaNO3、HClⅢ. 物质的除杂(近8年仅2011年未考)针对训练【长沙真题精选】2. (2014长沙)除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是()A. CO(CO2)——通过灼热的氧化铜B. NaCl(Na2SO4)——加入硝酸银溶液C. CaCO3固体(CaO固体)——高温煅烧D. FeSO4溶液(H2SO4)——加入铁粉【好题精练】3. (2017株洲)除去氯化钾溶液中混有的少量碳酸钾,最合理的方法是()A. 加入足量的氯化钡溶液,过滤B. 加入足量的稀盐酸,加热C. 加入足量的硝酸钡溶液,过滤D. 加入足量的稀硫酸,加热4. 下列各组括号内除杂质的试剂或方法错误的一组是()A. O2中混有少量的水蒸气(浓硫酸)B. CaO中混有CaCO3(高温煅烧)C. 铜粉中混有少量铁粉(稀硫酸,过滤)D. KCl溶液中混有少量MgCl2(适量NaOH溶液,过滤)5. (2017湘潭)要除去下列物质中的少量杂质(括号内物质为杂质),所选试剂不正确的是()A. NaOH(Na2CO3):盐酸B. CO2(O2):灼热的铜粉C. CO(CO2):氢氧化钠溶液D. O2(H2O):浓硫酸6. (2017广州改编)下列除杂所选用试剂与操作方法均正确的是()7. ),所用试剂及主要操作均合理的是()确的是()9. (2017麓山一模)下列关于物质的除杂所选用的试剂或方法错误的是()11. (2017南京改编)除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是()A. FeCl2溶液(CuCl2)——加入过量的铁粉,过滤B. KCl固体(KClO3)——加入少量的二氧化锰,并加热C. CuSO4溶液(H2SO4)——加入足量的氧化铜粉末,过滤D. NaCl溶液(MgCl2)——加入过量的氢氧化钠溶液,过滤,滤液中加稀盐酸至中性12. (2017遵义改编)除去下列物质中少量杂质(括号内为杂质)的方法,叙述正确的是()A. 一氧化碳(二氧化碳)——通过灼热的氧化铜B. 水(植物油)——加洗洁精,搅拌振荡C. Na2CO3(NaHCO3)固体——充分加热至固体质量不变D. NaCl溶液(CaCl2)——滴加适量K2CO3溶液、过滤参考答案及解析Ⅰ.物质的共存针对训练1. A【解析】A中的三种物质溶于水都能形成无色透明的溶液,相互之间不发生化学反应;B中FeCl3的水溶液呈黄色;C中CuSO4的水溶液呈蓝色;D中FeCl2的水溶液呈浅绿色,且FeCl2与NaOH不能共存。
2. B【解析】铵根离子和钡离子均属于阳离子,三种离子可大量共存,所以X离子一定是阴离子,C错误;铵根离子与氢氧根离子结合生成氨水,不能大量共存,A错误;氯离子与铵根离子、钡离子均不会结合生成沉淀、气体或水,可以大量共存,B正确;钡离子与硫酸根离子结合生成硫酸钡沉淀,不能大量共存,D错误。
3. C【解析】氯化铵、硫酸铜溶液均能与氢氧化钠反应,氢氧化钠不能在该培养液中能大量存在,A错误;硫酸铜溶液能与氯化钡反应产生BaSO4白色沉淀,氯化钡不能在该培养液中大量存在,B错误;氯化铵、硫酸铜溶液均不与硝酸钾反应,硝酸钾能在该培养液中大量存在,C正确;氯化铵溶液能与硝酸银反应产生AgCl白色沉淀,硝酸银不能在该培养液中大量存在,D错误。
4. A【解析】pH=1的溶液显酸性。
铵根离子、钙离子、氯离子、硝酸根离子、氢离子相互间不反应,可在酸性溶液中共存,且溶液为无色,A正确;酸性溶液中含有氢离子,碳酸根离子与氢离子不能共存,B错误;铁离子的溶液显黄色,C错误;氢氧根离子与氢离子结合生成水,二者不能共存,D错误。
5. C【解析】由题中信息溶液能使紫色石蕊变蓝,可知溶液显碱性,溶液中含有大量的OH-。
A组中硫酸根离子能与钡离子反应生成硫酸钡沉淀,所以这组离子在该溶液中不能大量共存,A错误;B中铜离子能与氢氧根离子反应生成氢氧化铜沉淀,所以B组离子不能在该溶液中大量共存,B错误;C组中各组离子间不会反应生成沉淀、水或气体,且不与OH-反应,所以C组离子可在该溶液中大量共存,C正确;D组中氢离子能与氢氧根离子反应生成水,所以D组离子不能在该溶液中大量共存,D错误。
6. B【解析】因为Cu2+与OH-能反应生成Cu(OH)2沉淀,所以Cu2+和OH-在水中不能大量共存,A错误;因为H+、K+、NO-3、SO2-4相互间都不能反应生成水、沉淀或,所以H+、K+、NO-3、SO2-4在水中能大量共存,B正确;因为NH+4与OH-能反应生成NH3·H2O,NH3·H2O不稳定,会进一步分解生成H2O和NH3气体,所以NH+4和OH-在水中不能大量共存,C错误;因为Ag+与Cl-能反应生成AgCl沉淀,所以Ag+和Cl-在水中不能大量共存,D错误。
故选B。
7. D【解析】HCl和NaOH反应生成H2O,不能共存,A错误;FeCl3呈黄色,B错误;AgNO3和NaCl能反应生成AgCl沉淀,不能共存,C错误。
故选D。
8. C【解析】针对训练【长沙真题精选】1. A【解析】检验Cl-要用到硝酸银溶液,但家里没有硝酸银溶液,A无法完成;酒精有特殊气味,水无气味,B可实现;区分自来水为硬水还是软水可用肥皂水,C可实现;要探究铁在潮湿的空气中是否生锈,可通过观察铁钉表面颜色的变化,D可实现。
2. B【解析】氧气和氢气都是无味的气体,不能通过闻气味的方法鉴别,A错误;硫酸铜粉末溶于水形成蓝色溶液,氯化钠固体溶于水形成无色溶液,B正确;稀硫酸和稀盐酸都是酸,都显酸性,因此滴加紫色石蕊溶液后,溶液都变为红色,C错误;二氧化碳气体和氯气都不支持燃烧,都会使燃着的木条熄灭,D错误。
