适用医疗器械法律法规清单
医疗器械法律法规目录

医疗器械法律法规目录一、引言医疗器械是保障人们健康和生命安全的重要设备。
为了规范医疗器械的研发、生产、销售和使用,各国均制定了相关的法律法规。
本文将介绍医疗器械的法律法规目录,以便读者了解和遵守相关规定。
二、国际法律法规1. 世界卫生组织(WHO)相关文件-《医疗器械再利用的指南》-《医疗器械质量管理与监督的指南》-《医疗器械注册、申报、管理的指南》2. 欧盟相关法规-《医疗器械法规》-《医疗设备使用前评估指南》-《医疗器械标志指导》3. 美国相关法规-《美国食品药品监督管理局(FDA)相关法规》-《医疗器械风险分级指南》-《美国医疗设备报告指南》三、中国法律法规1. 医疗器械管理法律法规-《中华人民共和国医疗器械管理法》-《医疗器械生产许可证办法》-《医疗器械经营许可证办法》2. 医疗器械注册与申报法律法规-《医疗器械注册管理办法》-《医疗器械注销管理办法》-《医疗器械变更注册管理办法》3. 医疗器械监督与检查法律法规-《医疗器械不良事件报告与处理办法》-《医疗器械监督与抽查办法》-《医疗器械监管执法办法》四、地方性法规不同地区可针对性地制定医疗器械法规,以满足当地医疗器械管理的需求。
例如:- 上海市医疗器械分类目录- 北京市医疗器械行政许可及备案管理办法五、其他法规除了上述的国家和地方性法律法规外,还有以下补充法规可供参考:- 《医疗器械产品标准》- 《医疗器械召回管理办法》- 《医疗器械质量管理规范》六、总结医疗器械的法律法规目录包括国际、国家、地方以及其他相关法规。
医疗器械生产、销售和使用的各个环节都需要严格遵守相应法规以确保人们的健康和生命安全。
希望本文所列出的法律法规目录能够帮助读者更好地了解和遵守相关规定,并为医疗器械行业的发展提供指导。
医疗器械法律法规清单

医疗器械法律法规清单1. 《医疗器械监督管理条例》该法规于2000年7月1日实施,旨在规范和加强医疗器械的监督管理。
该法规详细说明了医疗器械分类、注册、生产、销售、使用和检验等方面的要求,以确保医疗器械的安全有效和合理使用。
2. 《医疗器械生产企业许可管理办法》根据《医疗器械监督管理条例》的要求,该办法于2004年9月1日实施,明确了医疗器械生产企业的许可管理要求。
该办法规定了医疗器械生产企业的许可申请程序、许可条件和监督检查等内容。
3. 《医疗器械经营企业许可管理办法》根据《医疗器械监督管理条例》的要求,该办法于2005年12月25日实施,明确了医疗器械经营企业的许可管理要求。
该办法规定了医疗器械经营企业的许可申请程序、许可条件和监督检查等内容。
4. 《医疗器械注册管理办法》根据《医疗器械监督管理条例》的要求,该办法于2004年6月1日实施,明确了医疗器械注册管理的要求。
该办法规定了医疗器械注册申请的程序、要求、审批和监督检查等内容。
5. 《医疗器械广告管理办法》该办法于2005年5月1日实施,旨在规范医疗器械广告,防止虚假宣传,保护消费者权益。
该办法规定了医疗器械广告的内容、形式、发布媒体的要求,以及广告审查和监督检查的程序和要求。
6. 《医疗器械不良事件报告与处理办法》该办法于2006年7月1日实施,规定了医疗器械不良事件的报告和处理要求。
根据该办法,医疗机构和医疗器械生产企业应及时报告和处理医疗器械不良事件,以保障患者和使用者的安全。
7. 《医疗器械注册人备案管理办法》该办法于2004年7月1日实施,明确了医疗器械注册人备案管理的要求。
根据该办法,医疗器械注册人应按照规定申请备案,备案成功后方可从事医疗器械的注册、生产和销售等活动。
8. 《医疗器械经营备案管理办法》该办法于2005年6月1日实施,明确了医疗器械经营备案管理的要求。
根据该办法,医疗器械经营者应按照规定申请备案,备案成功后方可从事医疗器械的经营活动。
医疗器械法规文件大全

医疗器械法规文件大全
一、国内法规
1.《医疗器械监督管理条例》:是我国医疗器械监管的基础性法规,对医疗器械的生产、流通、使用、监督管理等方面进行了规定。
2.《医疗器械注册管理办法》:规定了医疗器械的注册申报、审核、审批等管理要求,确保医疗器械的安全有效性。
3.《医疗器械分类目录》:精确划分了医疗器械的分类,对不同类别的器械管理要求不同。
4.《医疗器械生产许可证管理办法》:规定了医疗器械生产企业的许可证申请、审核、核发等程序和要求。
5.《医疗器械经营许可证管理办法》:规定了医疗器械经营企业的许可证申请、审核、核发等程序和要求。
6.《医疗器械广告管理办法》:对医疗器械广告的发布、宣传、内容等进行了规范,保证广告真实合法。
7.《医疗器械使用管理办法》:明确了医疗器械的使用要求和管理制度,保障医疗机构和患者的安全。
8.《医疗器械召回管理办法》:规定了医疗器械的召回程序和要求,确保召回工作的有效进行。
9.《医疗器械不良事件报告与处理办法》:规定了医疗器械不良事件的报告和处理程序,加强对医疗器械安全性的监管。
二、国际标准与指南
三、国内行业标准
1.《医用一次性注射器、针头、输液器标准》:规定了医用一次性注射器、针头、输液器等产品的设计、生产和使用要求。
2.《医疗器械可燃性和不可燃性材料标准》:对医疗器械的可燃性和不可燃性材料进行了分类和规范。
3.《医用电子设备电磁兼容性标准》:规定了医用电子设备的电磁兼容性要求,确保设备在电磁环境中的正常工作。
四、国际行业标准。
医疗器械法规及标准清单2023.11.29
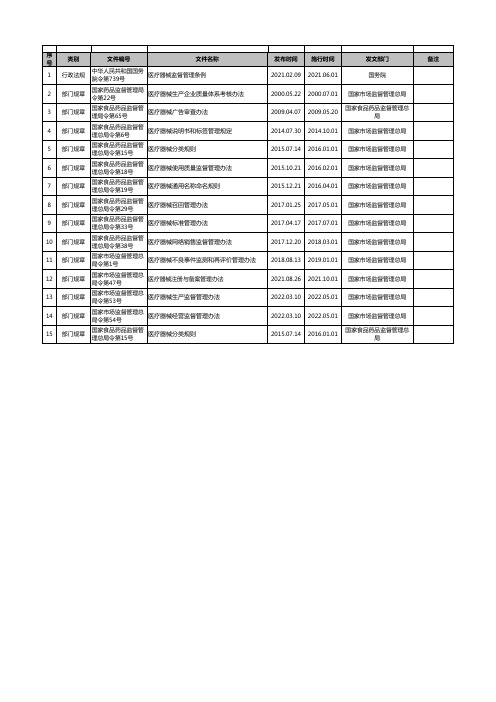
14
部门规章
国家市场监督管理总 局令第54号
医疗器械经营监督管理办法
15
部门规章
国家食品药品监督管 理总局令第15号
医疗器械分类规则
发布时间 施行时间 2021.02.09 2021.06.01
发文部门 国务院
2000.05.22 2000.07.01 国家市场监督管理总局
2009.04.07
2009.05.20
2022.03.10 2022.05.01 国家市场监督管理总局
2015.07.14
2016.01.01
国家食品药品监督管理总 局
备注
医疗器械标准管理办法
10
部门规章
国家食品药品监督管 理总局令第38号
医疗器械网络销售监督管理办法
11
部门规章
国家市场监督管理总 局令第1号
医疗器械不良事件监测和再评价管理办法
12
部门规章
国家市场监督管理总 局令第47号
医疗器械注册与备案管理办法
13
部门规章
国家市场监督管理总 局令第53号
医疗器械生产监督管理办法
序 号
类别
文件编号
文件名称
1
行政法规
中华人民共和国国务 院令第739号
医疗器械监督管理条例
2
部门规章
国家药品监督管理局 令第22号
医疗器械生产企业质量体系考核办法
3
部门规章
国家食品药品监督管 理局令第65号
医疗器械广告审查办法
4
部门规章
国家食品药品监督管 理总局令第6号
医疗器械说明书和标签管理规定
5
国家食品药品监督管理总 局
2014.07.30 2014.10.01 国家市场监督管理总局
医疗器械质量体系法律法规清单

医疗器械质量体系法律法规清单1.《医疗器械监督管理条例》:该条例是我国医疗器械行业的主要法规,主要规定了医疗器械的生产、流通、监管等方面的内容,包括医疗器械注册、备案、监督检查等。
2.《医疗器械监督管理办法》:该法规是对《医疗器械监督管理条例》的具体实施细则,包括了医疗器械生产、流通、销售、使用等方面的具体规定。
3.《医疗器械生产许可管理规定》:该规定详细规定了医疗器械生产许可的条件和程序,要求医疗器械企业必须具备一定的生产能力和质量控制能力,并且通过相关的审核才能获得生产许可证。
4.《医疗器械产品注册管理办法》:该办法规定了医疗器械产品注册的要求和程序,包括申请材料、试验验证、技术评审等方面的内容,确保医疗器械产品的安全有效性。
5.《医疗器械产品备案管理办法》:该办法规定了医疗器械产品备案的要求和程序,备案是针对低风险和无风险医疗器械的管理方式,要求企业向监管部门备案并进行清单管理。
6.《医疗器械生产质量管理规范》:该规范是医疗器械行业的质量管理标准,包括医疗器械设计、验证、生产、监测等方面的内容,规范了医疗器械生产过程中的质量要求和操作规程。
7.《医疗器械生产质量管理规范》:该规范是医疗器械行业的质量管理标准,要求医疗器械生产企业建立完善的质量管理体系,包括质量手册、程序文件、记录等。
8.《医疗器械质量管理体系要求》:该要求是国家食品药品监督管理总局部颁布的,规定了医疗器械质量管理体系的基本要求和核心指标,要求企业建立和实施符合国家标准要求的质量管理体系。
9.《医疗器械不良事件监测与处理管理规定》:该规定要求医疗器械生产企业建立和实施医疗器械不良事件的监测与处理制度,规定了不良事件的报告、调查、处理等程序,保障医疗器械的安全使用。
10.《医疗器械召回管理办法》:该办法规定了医疗器械召回的程序和要求,要求医疗器械生产企业在发现产品存在严重缺陷或有可能危及人体健康时,必须及时召回相关产品并采取相应的措施。
医疗器械质量体系医疗器械法律法规清单模板

医疗器械质量体系医疗器械法律法规清单模板以下是医疗器械质量体系中所涉及的一些法律法规清单模板,供参考使用。
1.医疗器械相关法律法规-《医疗器械注册管理办法》:该办法规定了医疗器械的注册管理流程及要求。
-《医疗器械不良事件监测与处理办法》:该办法规定了医疗器械不良事件的监测与处理要求。
-《全国医疗器械经营许可证管理办法》:该办法规定了医疗器械经营许可证的申请、审批等管理要求。
2.医疗器械质量管理相关法规-《医疗器械监督管理条例》:该条例规定了医疗器械质量管理的一些基本要求。
-《医疗器械质量管理规范》:该规范是为了指导医疗器械质量管理活动而制定的,包括质量管理体系的建立、质量控制和质量保证等内容。
-《医疗器械不合格产品召回管理办法》:该办法规定了医疗器械不合格产品召回的管理要求。
-《医疗器械质量不良事件报告与处理管理办法》:该办法规定了医疗器械质量不良事件报告与处理的管理要求。
-《医疗器械生产质量管理规范》:该规范是为了指导医疗器械生产企业质量管理活动而制定的,包括生产过程控制、产品质量控制等内容。
3.医疗器械安全相关法规-《医疗器械安全监督管理规定》:该规定规定了医疗器械安全监督管理的一些基本要求。
-《医疗器械安全管理办法》:该办法规定了医疗器械安全管理的具体要求,包括医疗器械安全检测、医疗器械召回等。
-《医疗器械不良事件报告与处理管理办法》:该办法规定了医疗器械不良事件报告与处理的管理要求,其中包括医疗器械安全风险评估和分级管理等。
以上仅为医疗器械质量体系中涉及的一部分法律法规清单模板,具体的法规清单需根据企业自身情况进行补充和调整。
不同地区、不同类型的医疗器械可能还会有其他相关法规适用。
企业应该密切关注医疗器械领域的法律法规动态,确保符合相关法律法规要求,并不断完善自身的医疗器械质量管理体系。
医疗器械法律法规清单

医疗器械法律法规清单中国的医疗器械行业具有重要的地位和作用。
为了规范医疗器械的生产、销售和使用,保障人民群众的生命健康安全,中国政府制定了一系列相关的法律法规。
本文将为您介绍一些重要的医疗器械法律法规。
一、医疗器械监督管理法医疗器械监督管理法是中国医疗器械行业的基础法律法规,于2014年6月1日正式实施。
该法明确了医疗器械监督管理的原则、目标和责任分工,规定了医疗器械的分类、注册备案、生产许可、经营许可等管理措施。
通过该法的实施,加强了医疗器械的监督管理,提高了医疗器械的质量和安全水平。
二、医疗器械生产质量管理规范医疗器械生产质量管理规范是由国家食品药品监督管理总局制定的,用于规范医疗器械生产过程中的质量管理。
该规范包括了医疗器械的质量管理体系、设备管理、原辅材料管理、生产过程控制、产品检验等内容。
企业在生产医疗器械时必须按照该规范的要求进行操作,确保医疗器械的质量安全。
三、医疗器械注册管理办法医疗器械注册管理办法是用于对医疗器械进行注册管理的法规,由国家食品药品监督管理总局制定。
该办法规定了医疗器械注册的程序、材料要求、审批标准等内容。
企业想要生产和销售医疗器械,必须先按照该办法进行注册,取得相应的注册证书。
四、医疗器械经营许可管理办法医疗器械经营许可管理办法是用于对医疗器械经营行为进行许可管理的法规,由国家食品药品监督管理总局制定。
该办法规定了医疗器械经营许可的条件、程序、材料要求等内容。
企业想要从事医疗器械的经营活动,必须先按照该办法进行许可申请,取得相应的经营许可证书。
五、医疗器械不良事件报告与召回管理办法医疗器械不良事件报告与召回管理办法是用于企业对医疗器械不良事件进行报告和实施召回的管理规定,由国家食品药品监督管理总局制定。
该办法规定了医疗器械不良事件的定义、报告程序、召回程序等内容。
企业在发现医疗器械存在安全隐患或不良事件发生时,必须按照该办法要求及时报告,并采取相应的召回措施。
六、医疗器械广告管理办法医疗器械广告管理办法是用于规范医疗器械广告行为的管理规定,由国家食品药品监督管理总局制定。
中国医疗器械法规清单

中国医疗器械法规清单一、国家法规1.医疗器械监督管理条例(国务院令第650号)该法规是我国医疗器械监管的基本法律,对医疗器械的生产、流通、使用、监督等方面进行了全面规定,明确了各相关方的责任和义务。
2.医疗器械生产许可管理办法(卫生部令第43号)该法规规定了医疗器械生产企业的许可申请、审查、发放及管理等事项,保证医疗器械生产的质量和安全。
3.医疗器械经营许可管理办法(卫生部令第45号)该法规规定了医疗器械经营企业的许可申请、审查、发放及管理等事项,保证医疗器械经营的质量和安全。
4.医疗器械广告管理办法(卫生部令第32号)该法规对医疗器械广告的内容、形式、发布渠道等进行了详细规范,保证广告信息真实、准确、合法。
5.医疗器械标准化法(国务院令第693号)该法规规定了医疗器械标准化的基本原则和管理制度,保证医疗器械标准的科学性和规范性。
二、地方法规1.地方卫生行政部门制定的医疗器械管理办法各地方卫生行政部门根据国家法规的要求,制定了一系列与本地区医疗器械管理相关的法规,具体规定了医疗器械经营、使用等方面的要求。
2.地方卫生行政部门制定的医疗器械生产许可办法各地方卫生行政部门根据国家法规的要求,制定了与本地区医疗器械生产许可相关的法规,具体规定了医疗器械生产的要求和管理制度。
三、行业标准1.医疗器械注册管理办法(国家食品药品监督管理总局令第28号)该标准规定了医疗器械注册的程序和要求,包括申请、审查、审批等流程,保证医疗器械注册的科学性和可靠性。
2.医疗器械召回管理规定(国家食品药品监督管理总局令第87号)该标准规定了医疗器械召回的程序和要求,包括召回通知、召回的实施等方面,保证医疗器械召回的及时性和有效性。
3.医疗器械不良事件管理办法(国家食品药品监督管理总局令第37号)该标准规定了医疗器械不良事件的报告、调查、处理等程序和要求,保证医疗器械不良事件的及时处理和防范。
四、国际规范该国际标准规定了医疗器械质量管理体系的要求,包括管理责任、设计开发、供应商评估等方面,旨在提高医疗器械的质量和安全。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
备注
YYT 0466.1-2009 医疗器械 用于医疗器械标签、标记和提供信息的符号 第1 部分:通用要求 93-42-EEC(中文) 98-79-EC体外诊断医疗器械指令(中文版) IEC60601-1第三版(中文版) GB 9706.6-1992 医用电气设备 微波治疗设备专用安全要求 GB 9706.7-1994 医用电气设备 超声治疗设备专用安全要求 TR14969应用指南 ISO_14971-2007-风险管理对医疗器械的应用 ISO_14971-2012-风险管理对医疗器械的应用 YY-T_0316-2008_医疗器械_风险管理对医疗器械的应用 关于印发B型超声诊断设备(第二类)和多参数患者监护设备(第二类)医疗 器械产品注册技术审查指导原则的通知 GB 9706.1-2007医用电气设备 第1部分:安全通用要求 GB4793.1-2007_测量、控制和实验室用电气设备安全通用要求 GB 9706.15-2008 医用电气设备 第1-1部分:安全通用要求 并列标准:医用 电气系统安全要求 GB/T 14710-2009 《医用电气设备环境要求及试验方法》 GB 10152-2009 《B型超声诊断设备》 YYT 1084-2007 医用超声诊断设备输出功率的测量方法 yy 0287-2003 医疗器械 质量管理体系 用于法规的要求 YY 0449-2009 超声多普勒胎儿监护仪 yy 0467-2003 医疗器械 保障医疗器械安全和性能公认基本原则的标准选用指 南 yyt 0162.1-1994 医用超声设备档次系列 第一部分-B型超声诊断设备 YYT 0749-2009超声手持探头式多普勒胎儿心率检测仪性能要求及测量和报 告方法 GB9706.15-2008第1-1部分:安全通用要求并列标准:医用电气系统安全要 求 GBT 16846-2008 医用超声诊断设备声输出公布要求 医疗器械经营监督管理办法 国家食品药品监督管理总局关于医疗器械重新注册有关事项的通告(第9号) 医疗器械使用质量监督管理办法 核准: 审核:
本次登 录日期:2016-4-11
法律法规名称
登 录部门:品保部 实施日期
1989/4/1 2000/9/1 2015/4/24 2003/11/1 2008年5月 2009年2月 1989/7/1 1986/7/1 2001/12/1 2004/7/1 2014/6/1 2014/10/1 2014/10/1 2014/10/1 2002/5/1 2008/9/16 2014/10/1 2004/7/8 2000/7/1 2013/1/1 2016/1/1 2005/7/5 2003/8/13 1985/11/29 2006/1/19 1985/11/29 1985/11/29 2004/4/1 2009/3/18 2005/3/22 2007/9/17 2007/1 2010/2/1
备注
适用医疗器械法规法规清单 上次登录日期: 2015-4-13
序号 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64
本次登 录日期:2016-4-11
法律法规名称
登 录部门:品保部 实施日期
版本:1.2
发文单位/发文字号
国家技术监督局 国家质量技术监督局 全国人民代表大会常务委员会 全国人民代表大会常务委员会 BS EN980:2008 BS EN1041:2008 国家医药管理局 国家医药管理局 国家食药监局 全国人民代表大会常务委员会 国务院 国家食药监局 国家食药监局 国家食药监局 国家食药监局 国家食药监局 国家食药监局 国家食药监局 国家食药监局 国家食品药品监督管理局 国家食药监局 国家食药监局 国家食药监局 国家食药监局 国家食药监局 国家食药监局 国家食药监局 国家食药监局 国家食药监局 国家食药监局 国家食药监局 国家食药监局 江苏省食品药品监督管理局 国家食品药品监督管理局 90-385-EEC 国家质量技术监督局 国家质量监督检验检疫总局
适用医疗器械法规法规清单 上次登录日期: 2015-4-13
序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 中华人民共和国标准化法 中华人民共和国产品质量法 中华人民共和国计量法 中华人民共和国认证认可条例 医疗器械标签用图形符号 制造商需随医疗器械提供的信息 医用X射线设备高压电缆插头、插座技术条件GB 10151-1988 医用X射线设备高压电缆插头、插座连接GB5579-85 中华人民共和国药品管理法 中华人民共和国行政许可法 医疗器械监督管理条例 医疗器械经营企业许可证管理办法 医疗器械生产监督管理办法 医疗器械注册管理办法 医疗器械标准管理办法 关于清理医疗器械注册管理文件有关问题的通知 医疗器械说明书和标签管理规定 医疗器械说明书、标签和包装标识编写要求示范文本 医疗器械生产企业质量体系考核办法 国家食品药品监督管理局关于印发药品和医疗器械行政处罚裁量适用规则的 通知 国食药监法[2012]306号 医疗器械分类规则 国家食品药品监督管理局医疗器械司关于向生产企业提供境内第三类、境外 医疗器械注册产品标准副本有关操作程序的通知 国家食品药品监督管理局关于启用新的医疗器械注册申请表的通告 医疗器械产品质量管理办法 医疗器械生产日常监督管理规定 医疗器械产品质量考核办法 医疗器械产品质量分等办法 医疗器械临床试验规定 国家食品药品监督管理局医疗器械监管司关于印发X射线诊断设备等6个医疗 器械产品注册技术审查指导原则的通知 国家食品药品监督管理局关于发布《境内第三类、境外医疗器械注册申报资 料受理标准》的通告 国家食品药品监督管理局行政受理服务中心关于规定医疗器械境内第三类医 疗器械注册申请材料受理要求的公告 国家食品药品监督管理局关于执行GB9706.1-1995标准相关产品医疗器械注 册证延期的公告(四) 江苏省食品药品监督管理局转发国家食品药品监督管理局关于印发《医疗器 械生产日常监督管理规定》的通知 医疗器械召回管理办法(试行)》(卫生部令第82号) 90-385-EEC有源植入医疗器械(中文) GB 9706.4-1999 医用电气设备 第二部分:高频手术设备安全专用要求 GB 9706.5-2008 医用电气设备第2部分:能量为1mev至50mev电子加速器 安全专用要求 第 1 页,共 2 页
作成:
第 2 页,共 2 页
2010/12/1 1993/7/12 1998/10/27 2005第三版 1993/5/1 1995/3/1 2007/5/1 2007/3/1 2012/7/1 2009/6/1 2009/6/18 2008/7/1 2007/9/1 2010/2/1 2010/5/1 2010/12/1 2008/1/1 2004/4/1 2010/12/1 2004/1/1 1994/7/1 2010/12/1 2010/2/1 2009/1/1 2014/10/1 2013/12/9 2016/2/1
版本:1.2
发文单位/发文字号
国家食品药品监督管理局 欧共体理事会 欧洲议会和欧盟理事会 IEC国际电工委员会 国家技术监督局 国家技术监督局 国家食品药品监督管理局 ISO 14971:2007 ISO 14971:2012 国家食品药品监督管理局 国家食品药品监督管理局 国家食品药品监督管理局 国家质量监督检验检疫总局 国家质量监督检验检疫总局 国家质量监督检验检疫总局 国家质量监督检验检疫总局 国家食品药品监督管理局 国家食品药品监督管理局 国家食品药品监督管理局 国家食品药品监督管理局 国家医药管理局 国家食品药品监督管理局 国家质量监督检验检疫总局 中国国家标准化管理委员会 国家质量监督检验检疫总局 中国国家标准化管理委员会 国家食品药品监督管理总局 国家食品药品监督管理总局 国家食品药品监督管理总局
