高一化学寒假作业(十)
高一化学寒假作业题及答案

高一化学寒假作业题及答案高一化学寒假作业题及答案本文是为高一年级同学整理的高一化学寒假作业题及答案一文,希望能够切实帮助到您!1.HBr分子的电子式为:A. B.H+Br- C. D.H-Br2.下列叙述中正确的是A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数B.除短周期外,其他周期均有18个元素C.副族元素中没有非金属元素D.碱金属元素是指ⅠA族的所有元素3. 在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:A.甲的分子数比乙的分子数多B.甲的物质的量比乙的物质的量少C.甲的摩尔体积比乙的摩尔体积小D.甲的相对分子质量比乙的相对分子质量小4. 在溶液中加入足量Na2O2后仍能大量共存的离子组是( )A.NH4+、Ba2+、Cl-、NO3-B.K+、AlO2-、Cl-、SO42-C.Ca2+、Mg2+、NO3-、HCO3-D.Na+、Cl-、CO32-、SO32-5. 下列各组给定原子序数的元素,不能形成原子数之比为A.SiH4比CH4稳定B.O2―半径比F―的小C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱11. 下列物质在氯气中燃烧时,能产生白色烟雾的是A. 红磷B. 铜丝C. 氢气D. 金属钠12. 实验室制取下列气体,可用同一气体发生装置,并用相同收集方法的一组是A.SO2和O2B.H2和HClC.H2S和HClD.Cl2和HCl13. 有颜色又有毒的气体是A.COB.Cl2C.HClD.H2S14. 通常用来区别SO2和CO2的试剂是A.烧碱溶液B.品红试液C.石蕊试液D.澄清石灰水15.绿色化学的着眼点是使污染消灭在生产的源头,从根本上消除污染。
美国斯坦福大学Barry Trost教授提出了绿色化学下的原子经济的概念。
(word完整版)高一化学必修一上学期寒假作业及答案
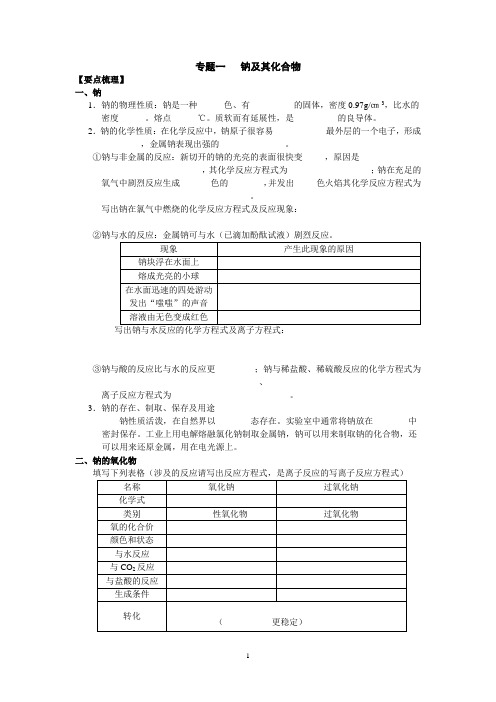
专题一钠及其化合物【要点梳理】一、钠1.钠的物理性质:钠是一种______色、有__________的固体,密度0.97g/㎝3,比水的密度______。
熔点______℃。
质软而有延展性,是__________的良导体。
2.钠的化学性质:在化学反应中,钠原子很容易____________最外层的一个电子,形成_________,金属钠表现出强的_______________。
①钠与非金属的反应:新切开的钠的光亮的表面很快变_____,原因是____________________________________,其化学反应方程式为___________________;钠在充足的氧气中剧烈反应生成_______色的________,并发出____ 色火焰其化学反应方程式为__________________________________。
写出钠在氯气中燃烧的化学反应方程式及反应现象:___________________________ ________________________________②钠与水的反应:金属钠可与水(已滴加酚酞试液)剧烈反应。
写出钠与水反应的化学方程式及离子方程式:③钠与酸的反应比与水的反应更_________;钠与稀盐酸、稀硫酸反应的化学方程式为____________________________________、____________________________________离子反应方程式为___________________________。
3.钠的存在、制取、保存及用途钠性质活泼,在自然界以________态存在。
实验室中通常将钠放在________中密封保存。
工业上用电解熔融氯化钠制取金属钠,钠可以用来制取钠的化合物,还可以用来还原金属,用在电光源上。
二、钠的氧化物填写下列表格(涉及的反应请写出反应方程式,是离子反应的写离子反应方程式)1、物理性质:氢氧化钠俗名________、_________、________,是一种_____色固体,易吸收空气中的水分而________,___溶于水并放热,水溶液有涩味,有强________性。
鲁科版高中化学必修一高一化学寒假作业10.docx

高中化学学习材料唐玲出品鲁版高一寒假作业十一、选择题1.下列各组分散系,需用丁达尔效应鉴别的是()A.溶液与浊液 B.胶体与胶体 C.溶液与胶体 D.溶液与溶液2.在体积为V L的密闭容器中通入a mol NO和b mol O2,发生反应:2NO+O2=2NO2,反应后容器内氮原子和氧原子数之比是A.a:b B.a:2b C.a: (a+2b) D.a: (2a+2b)3.右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
据此下列说法正确的是 ( )A.该硫酸的物质的量浓度为9.2mol/LB.取该硫酸与等体积水混合所得溶液质量分数为49%C.配制200mL4.6mol/L的稀硫酸需取该硫酸50 mLD.取该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol/L硫酸化学纯(CP)(500mL)品名:硫酸化学式:H2SO4相对分子质量:98密度:1.84g/cm3质量分数:98%4、向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。
充分反应后,被还原的H2SO4的物质的量A、小于0.45 molB、等于0.45 molC、在0.45~0.90 mol之间D、大于0.45 mol 5.由Na2S、Na2SO3和Na2SO4三种物质组成的混合物,测得其中钠元素的质量分数为36.8%,则混合物中氧元素的质量分数是()A. 63.2%B. 44.8%C. 25.6%D. 37.6%6.被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)()A.NaBH4既是氧化剂又是还原剂B.NaBH4是氧化剂,H2O是还原剂C.硼元素被氧化,氢元素被还原 D.被氧化的元素与被还原的元素质量比为17.有一种消字灵,是由甲、乙两瓶溶液组成的,甲瓶是高锰酸钾溶液(内加少量稀硫酸),呈紫红色;乙瓶是将无水亚硫酸钠溶于水(内加少量稀硫酸)配制而成,呈无色,此瓶实际上是亚硫酸溶液,反应的化学方程式是Na2SO3+H2SO4==Na2SO4+H2SO3。
2020-2021学年高一化学上学期寒假作业十

2020-2021学年高一化学上学期寒假作业十复习:完成下列反应的化学方程式或离子方程式研细的硅在氧气中燃烧:硅与HF溶液反应:硅与烧碱溶液反应离子方程式:二氧化硅与NaOH反应:二氧化硅高温下被C还原:二氧化硅高温下和Na2CO3\ CaCO3反应:、二氧化硅与氢氟酸反应:向水玻璃中滴加HCl,现象是:离子方程式:向Na2SiO3中通入足量的CO2气体,现象:离子方程式:练习:()1.下列说法:①硅的化学性质很稳定,因此硅在自然界中以游离态形式存在;②二氧化硅和二氧化碳在物理性质上有很大差异;③二氧化硅是一种酸性氧化物,它不可与任何酸发生反应。
其中正确的是A.①②③ B.①② C.①③ D.②()2.下列有关硅及其化合物用途的说法中,不正确的是A.硅单质是制造光电池的主要原料 B.二氧化硅是制造光导纤维的材料C.可用石英坩埚加热氢氧化钠固体 D.玻璃、水泥、陶瓷都是硅酸盐产品()3.下列试剂中,必须用橡胶塞的细口瓶贮存的是A.氢氟酸B.氢氧化钠溶液C.盐酸D.氯化钠溶液()4.以下物质间的每步转化通过一步反应能实现的是A.Al → Al2O3→ Al(OH)3→ NaAlO2 B.N2→ NO→ NO2→ HNO3C.Si → SiO2→ H2SiO3→ Na2SiO3D.S → SO3→ H2SO4→ MgSO45.已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:①按图组装仪器,并检查装置的气密性②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液③称量盛有碱石灰的U型管的质量,得到b g④从分液漏斗滴入6 mo1·L-1的硫酸,直到不再产生气体时为止⑤从导管A处缓缓鼓入一定量的空气⑥再次称量盛有碱石灰的U型管的质量,得到c g⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g请填空和回答问题:(1)装置中NaOH溶液的作用是;(2)装置中干燥管B的作用是;(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果;(填偏高、偏低或不变)(4)步骤⑤鼓入空气的目的是;(5)步骤⑦的目的是;(6)该试样中纯碱的质量分数的计算式为。
【高中化学】新课标高一化学寒假作业(含解析)

【高中化学】新课标高一化学寒假作业(含解析)从开始用火的原始社会,到使用各种人造物质的现代社会,人类都在享用化学成果。
化学网为大家推荐了新课标高一化学寒假作业,请大家仔细阅读,希望你喜欢。
一、选择题(本题共7道小题1.我国西气东输工程输送的化石燃料主要是()A. 水煤气B. 天然气C. 焦炉气D. 石油气2.北京奥运会火炬使用的燃料是一种常用燃料,其分子式为C3H8,它属于( )A.烷烃B.烯烃C.炔烃D.芳香烃3.下列有关表述正确的是A.与组成元素相同,含有的电子数也相同B.丙烷的分子的球棍模型为:C.次氯酸的电子式为D.熔化时的电离方程式为4.如右图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是①CO、O2 ②C12、CH4 ③NO2、O2 ④N2、H2A.①②B.②④C.②③D.③④5.由于发生化学反应而使溴水褪色的物质是()A.乙酸B.苯C.甲烷D.乙烯6.下列过程中所发生的化学反应不属于取代反应的是()A.光照射甲烷与氯气的混合气体B.在镍作催化剂的条件下,苯与氢气反应C.乙醇与乙酸在浓硫酸作用下加热D.苯与液溴混合后撒入铁粉7.制取较纯净的一氯乙烷最好采用的方法是( )A.乙烷和氯气反应B.乙烯和氯气反应C.乙烯和氯化氢反应D.乙烷通入浓盐酸二、填空题(本题共3道小题8.(5分)下列各组物质(用序号填空):① 红磷和白磷; ② 1H、2H、3H; ③ CH4和C10H22; ④乙烷和(CH3)2CHCH2CH3;⑤ 和;⑥ 和⑦ CH3 (CH2) 3 CH3和(1)互为同位素的是 (2)互为同素异形体的是 ;(3)互为同系物的是(4)互为同分异构体的是 ;(5)属于同一物质的是。
9.将装有甲烷和氯气混合气体的三个集气瓶,用玻璃片盖好瓶口后,分别作如下处理,各有怎样的现象发生。
(1)①置于黑暗中:________________________________________________________________________;②将点燃的镁条靠近集气瓶外壁:________________________________________________________________________;③放在有光线的房子里:________________________________________________________________________。
高一化学寒假作业10含答案

高一年级化学学科寒假作业1.在空气中,有下列反应发生:①N2+O2═2NO;②2NO+O2═2NO2;③3NO2+H2O═2HNO3+NO;④2SO2+O2═2SO3;⑤SO3+H2O═H2SO4;⑥SO2+H2O═H2SO3;⑦3O2═2O3.其中属于氧化还原反应的是()A.①②③④ B.①②③④⑦C.①②④⑦ D.①②③④⑤⑥⑦2.氰化钠(Na N)是工业上冶炼黄金的重要原料,工业上生产氰化钠的化学方程式为2Na+2C+2NH3=2NaCN+3H2↑该反应中的还原剂为()A.NH3 B.C和Na C.Na和NH3 D.C和NH33.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是() A.2F2+2H2O═4HF+O2B.AgNO3+NaCl═AgCl↓+NaNO3C.3CO+Fe2O32Fe+3CO2D.MgCl2(熔融)Mg+Cl24.下列说法中正确的是()A.在Fe+Cu2+=Fe2++Cu的反应中Fe作还原剂,在Fe于其他物质反应中Fe一定也作还原剂B.在上述反应中,氧化性:Fe2+>Cu2+C.金属活动性顺序表中,排在前面的金属阳离子氧化性强于排在后面的金属阳离子D.SO2+4中的硫原子化合价是+6价,处于硫的最高价,因此SO2+4氧化性一定很强5.已知反应:①Cl2+2KBr=2KCl+Br2 ②KClO3+ 6HCl =3Cl2↑+KCl+3H2O③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是()A.上述三个反应都是置换反应B.反应②中还原剂与氧化剂的物质的量之比为6:1 ①中KCl是氧化产物,KBr发生还原反应C.氧化性由强到弱的顺序为:KBrO3>KClO3>Cl2>Br2D.反应③中1molKBrO3反应,则还原剂得电子的物质的量为5 mol6.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱.下列反应在水溶液中不可能发生的是()A.3Cl2+6FeI2═2FeCl3+4FeI3 B.Cl2+FeI2═FeCl2+I2C.Co2O3+6HCl═2CoCl2+Cl2↑+3H2O D.2Fe3++2I﹣═2Fe2++I27.镁粉加入到很稀的硝酸中发生反应:4Mg+10HNO3═4Mg(NO3)2+NH4NO3+3H2O在该反应中被还原的硝酸和未被还原的硝酸的物质的量比为()A.4:10 B.1:9 C.1:5 D.1:78.三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF 3+5H2O2NO+HNO3+9HF。
高一化学寒假作业试题及答案参考

高一化学寒假作业试题及答案参考高一化学寒假作业试题及答案参考高一化学习题,其实就只是重在培养学生审题习惯和表达能力,突出抓好题意分析,规范解题步骤。
下面小编给大家整理了关于高一化学寒假作业试题及答案的内容,欢迎阅读,内容仅供参考!高一化学寒假作业试题及答案可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27S:32 Cl:35.5 Fe:56 Cu:64 Zn:65第I卷(共54分)一、选择题(本题包括12小题,每题只有一个选项符合题意,每小题2分,共24分)1.容量瓶上需标有:①温度②浓度③容量④压强⑤刻度线⑥酸式或碱式;六项中的 ( )A.①③⑤B.③⑤⑥C.①②④D.②④⑥2.下列说法中正确的是 ( )A.纯净物一定由分子构成B.由同种分子构成的物质一定是纯净物C.混合物肯定是由两种以上的元素组成的D.含有氧元素的化合物就是氧化物3.下列物质在水溶液中的电离方程式正确的是 ( )A.NaHSO4===Na++ HSO4-B.Al2(SO4)3===2Al3++3SO42-C.NH4Cl===NH3 + H++Cl-D.H2CO3===2H++CO32-4.下列图示不正确的是 ( )5.在下列溶液中Cl- 的物质的量浓度的是 ( )A.0.5L 0.1mol/L的NaCl溶液B.100mL 0.2mol/L的MgCl2溶液C.1L 0.2mol/L的AlCl3溶液D.1L 0.3mol/L盐酸溶液6.下列有关实验操作正确的是 ( )A.蒸馏实验中温度计的水银球应插入液态混合物中B.用酒精萃取碘水中的碘C.分液时,打开旋塞,使下层液体从下口流出,上层液体从上口倒出D.开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯7.离子方程式H++OH-===H2O所表示的反应是 ( )A.所有酸和碱之间的中和反应B.所有强酸和强碱之间的中和反应C.所有可溶性酸和可溶性碱的反应D.强酸与强碱生成可溶性盐和水的反应8.完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是 ( )A.用CCl4提取溴水中的Br2B.从KI和I2的固体混合物中回收I2C.稀释浓硫酸D.工业酒精制备无水酒精9.实验室制取氧气的反应为2KClO3=====MnO2△2KCl+3O2↑,反应后从剩余物中回收纯净的二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体) ( )A.溶解、过滤、蒸发、洗涤B.溶解、过滤、洗涤、干燥C.溶解、蒸发、洗涤、过滤D.溶解、洗涤、过滤、加热10 .下列反应完成后有沉淀生成的是 ( )A.BaCl2溶液与Na2CO3溶液加足量CH3COOH溶液B.Ba(OH)2溶液与KNO3溶液加足量稀硫酸C.AgNO3溶液与Na2CO3溶液加足量稀硝酸D.Ca(OH)2溶液与FeCl3溶液加足量稀硝酸11.相等物质的量的H2O和H2O2相比较,下列有关叙述中正确的是 ( )①它们所含的分子数目之比为1∶1 ②它们所含的原子总数目之比为3∶4 ③它们所含的O原子数目之比为1∶2 ④它们所含的H原子数目之比为1∶1⑤它们所含的质子数目之比为5∶9A、①②③B、③④⑤C、①②④D、①②③④⑤12.下列常见现象与胶体无关的是 ( )A.清晨在密林中看到一缕缕的光束B.向豆浆中加入硫酸钙使蛋白质等聚沉,制成可口的豆腐C.FeCl3溶液加入NaOH溶液产生红褐色沉淀D.利用电泳将油漆、乳胶、橡胶等微粒均匀地沉积在镀件上二、选择题(本题包括10小题,每题只有一个选项符合题意,每小题3分,共30分)13.下列离子方程式中,只能表示一个化学反应的是 ( )①CO2-3+2H+===CO2↑+H2O②Ba2++2OH-+2H++SO2-4===BaSO4↓+2H2O③Ag++Cl-===AgCl↓④Fe+Cu2+===Fe2++Cu⑤Cl2+H2O===H++Cl-+HClOA.①③B.②④C.②⑤D.只有⑤14.实验室需配置一种仅含四种离子(不考虑水电离出来的离子)的无色混合溶液,且在混合物溶液中四种离子的浓度均为1mol/L。
高一化学寒假快乐寒假作业

高一化学寒假快乐寒假作业(1)固体B所含物质的化学式为____________________________________________。
(2)固体E所含物质的化学式为_____________________________________________。
(3)反应①的离子方程式为________________________________________________。
10.A为两种金属组成的合金,发生如下图所示的变化:试填写以下空白:(1)合金A由________和________组成。
(2)写出下列变化的离子方程式。
CE_________________________________________________ _______________________;DF_________________________________________________ _______________________。
11.金属钠与水的反应是中学化学中的一个重要反应。
教材中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示:(1)现按图甲所示的方法,在室温时,向盛有饱和Ca(OH)2溶液的水槽中,加入一小块金属钠。
下列现象描述正确的是________(填字母)。
A.钠浮在液面上,并四处游动,最后消失B.钠熔化成一个光亮的小球C.溶液底部有银白色物质生成D.恢复到室温时,水槽底部有固体物质析出(2)请补充并完成甲实验中从试剂瓶中取出钠到向水槽中投入钠的有关操作:用镊子从试剂瓶中取出一小块钠________________________________用镊子夹取切好的金属钠投入到盛有Ca(OH)2溶液的水槽中。
(3)某同学用镊子夹住一块钠,按图乙所示方法来收集产生的气体,但钠很快脱落,实验没有成功。
正确的操作应为________________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学寒假作业(十)
一.选择题(共7小题,每个小题只有一个正确选项)
2.现有三组实验:①除去混在植物油中的水②回收碘的CCl4溶液中的CCl4 ③用食用酒精
Al2
3.今有0.1mol•L﹣1Na2SO4溶液300mL,0.1mol•L﹣1MgSO4溶液200mL和0.1mol•L﹣1
二.填空题(共3小题)
8.已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.(1)A中装有Ca(OH)2和NH4Cl混合粉末,该反应的化学方程式是:_________.(2)B中加入的是碱石灰,其作用是_________.
(3)实验时在C中观察到的现象是_________,发生反应的化学方程式是:
_________.
(4)D中收集到的物质是_________,检验该物质的方法和现象是_________.
9.某小组准备在实验室中制取干燥、纯净的氯气并验证氯气的性质,设计了如下的实验装置图:
(一)制取纯净的氯气
(1)写出A中反应的化学方程式:_________.
(2)B中加入的物质是:_________作用是:_________.
(3)C中加入的物质是:_________作用是:_________.
(4)E中反应方程式为:_________.
(二)验证氯气的性质:
(1)B中发生反应的方程式为:_________.
(2)C中发生反应的方程式为:_________.
(3)D中的反应方程式为:_________.
10.某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.
请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是_________、_________;(2)反应后,装置B中发生的现象是_________,反应的离子方程式为_________;装置C中的现象是_________,表现了SO2的_________;装置D中现象是
_________,发生反应的化学方程式为_________;
(3)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________.(4)F装置的作用是_________,漏斗的作用是_________.
参考答案
一选择题
2
N
(浓)。
