第十七章杂环化合物(Heterocyclic Compounds).
杂环化合物的合成与应用

杂环化合物的合成与应用杂环化合物(heterocyclic compounds)是由不同原子构成的环状有机化合物,其中至少有一个原子是碳以外的其他原子,常见的异原子有氮、氧和硫等。
这类化合物具有广泛的应用领域,例如医药、农药和材料科学等。
本文将介绍杂环化合物的合成方法以及其在不同领域中的应用。
一、杂环化合物的合成方法杂环化合物的合成方法多种多样,常用的方法包括以下几种:1. 环形反应(circular reactions):杂环形成的一种重要方法是环形反应。
这类反应包括环加成、环缩合和环开链等,通过将碳链或碳环上的特定位置反应生成杂环。
其中一种常见的环形反应是Diels-Alder 反应,在该反应中,二烯和二烯酮之间的[4+2]环加成反应可以有效地合成具有杂环结构的化合物。
2. 催化合成(catalytic synthesis):催化合成是合成杂环化合物的常用方法之一。
通过引入合适的催化剂,催化合成可以在较温和的条件下进行,提高反应的选择性和产率。
例如,过渡金属催化的C-H官能团化反应可以有效地合成杂环化合物。
3. 原子经济合成(atom-economic synthesis):原子经济合成是一种绿色合成策略,旨在最大限度地利用反应中的原子。
该方法通过选择具有高原子利用率的起始物质和催化剂,以及最小化副产物的生成,实现杂环化合物的高效合成。
以上仅为杂环化合物合成的几种常用方法,实际上还有其他多种合成途径,如环状代谢(cyclic metabolism)和串联反应(tandem reactions)等。
合成方法的选择取决于目标化合物的具体结构和功能需求。
二、杂环化合物的应用领域杂环化合物由于其多样的结构和丰富的性质,在各个领域具有广泛的应用。
以下是几个常见的应用领域:1. 药物合成:杂环化合物被广泛应用于药物合成领域。
许多常见的药物和天然产物中都含有杂环结构,如噻唑啉(thiazolidine)、吡咯(pyrrole)和噻吩(thiophene)等。
有机化学精品课件——杂环化合物

+
OH CO2H
Kolbe-Schmitt反应
OH OH CHO
OH CHCl3 OH
+
CHO OH
Reimer-Tiemann反应
O O C
R
O AlCl3 R C
OH + C O R
Fries重排
39
5. 呋喃、吡咯和噻吩环的制法
AcONO2 S Ac2O-AcOH, 0oC S 60%
14
NO2
• 呋喃发生加成反应(特殊,共轭烯烃性质)
AcONO2 O 5 ~ 30 C
o
碱 或 AcO O NO2 HOAc O NO2
加成
消除
机理:
B NO2 O AcO O NO2 AcO H O H NO2
O
NO2
+
HOAc
15
性质与相应的开链化合物极相似,则不看作是杂环化合物。如环状内酯, 环状酸酐、环状酰胺、环醚、环状酰亚胺等。
2
常见杂环化合物的分类、名称
含一个杂原子 五元杂环
O S N H
呋喃
N
噻吩
N N H
吡咯
N S O N
含二个杂原子
单 杂 环 六元杂环
N H
咪唑 含一个杂原子
N
吡唑
噻唑
噁唑
O
吡啶
γ-吡喃 α-吡喃
6 1 N
稠合体系
2 N4 3
嘌呤
4
命名
1、音译法(带“口”旁的同音汉字) 2、当环上连有烷基、硝基、卤素、羟基、氨基等取代基时, 以杂环为母体; 当环上连有醛基、羧基、磺酸基等时,将杂 环作为取代基。 3、编号从杂原子算起依次用1,2,3,4,5…编号。(用α,β ,γ…则从杂原子相邻的碳原子依次编号),如有不同种类 杂原子,则按O,S,N的顺序由小到大编号,使杂原子尽可 能具有较低的编号。
Heterocyclic Compounds(杂环化合物)
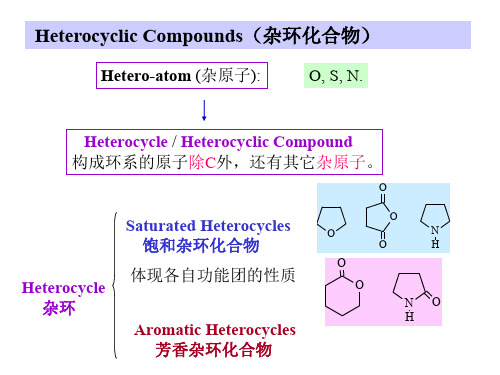
Aromatic Heterocycles 芳香杂环化合物
O
O
N
O
H
O
O
NO H
一 .Classification & Nomenclature:
按环的大小
Five-membered ring Six-membered ring
按杂原子的数目
一个杂原子杂环 两个杂原子杂环 多个杂原子杂环
2. Physical properties
(1) (偶极矩) Dipole moment
= 7.4110-38 c.m
3.90 10-38 c.m
I
方向一致
C
(2) Solubility: 吡啶可以与水以任意比例互溶
Six-membered Heterocyclic compounds
Classification & Nomenclature
取代杂环的命名: 编号原则:单杂环、稠杂环;最小编号和优先顺序法则
5 6
7 8
4 3
N2
1
iso-quinoline* 异 喹啉
6
7
1N
5N
8
2
N
3
4
N H
9
PurinLeabharlann * 嘌呤Classification & Nomenclature
非特定稠环
基本环
附加环
稠合边的表示
b d
a 1
SO 5 2
呋喃并[2, 3-b] 噻吩
3
4
c
a
4
S
5 3
HN
1
2
c
17杂环化合物

+
NH2 OH
CH CH2 OH
N 8- 基 啉 羟 喹
H
O C CH CH2
CH3
+
H3 C NH2
+
H3 C ( ) 主 N N 5- 基 啉 甲 喹 7- 基 啉 甲 喹
上页 下页 返回 退出
(2)化学性质
弱 碱 性
氧
化
取代反应
还
原
上页 下页 返回 退出
弱碱性
喹啉与吡啶很相似,也具有弱碱性(pKb=9.1)。 喹啉与酸作用生成盐,例如它与重铬酸形成难溶于水 的复盐。
上页 下页 返回 退出
(1)制 取
斯克洛浦法
CH2OH CHOH CH2OH H HO C CH2 N H CH2
H2SO4 - H2O [O] C6H5NO2 浓 H2SO4 - H2O
H CHO CH CH2
C6H5NH2
O
C CH2 N H CH2
N H
N
上页 下页 返回 退出
若其他芳胺或不饱和醛代替苯胺或丙烯醛,便可 制得各种喹啉的衍生物。
N N H 吡 咯 吡 啶 噻 吩 呋 喃 Furan thiophene pyrrole pyridine
上页 下页 返回 退出
O
S
N N 喹 啉 puinoline S 噻 唑 thiazole
N N H 咪 唑 imidazole N 吲 哚 indole
上页 下页 返回 退出
环上有取代基的杂环化合物,命名时以杂环为母体, 从杂原子开始将环上的原子编号。当环上含有两个或两 个以上相同杂原子时,应使杂原子所在位次的数字最小。 当环上的杂原子不同时,按O、S、N的次序编号。
第十七章 杂环化合物

NH
N
N
HN
例如:叶绿素(1818年,由植物叶中分离出)
(3)噻唑的重要衍生物
一些重要的天然产物及合成药物含有噻唑结构, 如青霉素、维生素B1等。
噻唑环
维生素B1(VB1)
NH3Cl N CH3 N Cl CH3 S CH2CH2OH
CH2 N
噻唑环
5. 杂环化合物的检验方法
呋喃: 盐酸浸渍的松木片 → 绿色 吡咯: 盐酸浸渍的松木片 → 红色 噻吩: 浓硫酸-靛红 → 蓝色 糠醛: 乙酸-苯胺→红色 吲哚: 盐酸浸渍的松木片 → 红色
O
1 4
N1 H
4 3 5 6 7 3
N
1 4
5 6 7
5 6 7
3
O
1
2
S
1
2
N1 H
2
例如:
O CHO O2N O CHO
2-呋喃甲醛(糠醛)
CH3
5-硝基-2-呋喃甲醛
CH2COOH
N
COOH
N H
4-甲基-2-吡啶甲酸
3-吲哚乙酸
(2)含有两个或两个以上相同杂原子
从连有氢或取代基的杂原子开始编号,并且使 杂原子位次之和最小。
(CH3)3C N
CH2CH3 KMnO4 (CH3)3C N
COOH
CH3 N
? N
NH2
还原反应
吡啶因环上电子云密度较低,比苯易还原, 用钠加乙醇、催化加氢等均使吡啶还原。
H2,Pt
N
CH 3COOH
N H
六氢吡啶(哌啶)
六氢吡啶(哌啶),沸点106℃,能溶于水、 乙醇、乙醚等溶剂,它的性质与一般仲胺相似。 是常用的有机碱。
17第十七章 杂环化合物

N H
2、亲核取代反应:主要发生在α位 、亲核取代反应:主要发生在 位
KOH
NaNH2
齐齐巴宾反应
3、氧化反应(对氧化剂稳定) 、氧化反应(对氧化剂稳定)
CH3 │ COOH │
V2O5 [O] NH2NH2
CONHNH2 │
N
N
N
异烟肼
4—吡啶甲酸(异烟酸) 吡啶甲酸(异烟酸) 吡啶甲酸
雷米封( 雷米封(Rimifon)可治结核病 )
二 杂环化合物的命名
1、命名:英文音译再加“口”字旁,表示是杂环化合 命名:英文音译再加“ 字旁, 物 3β 3β 4 4 3β 4 五元杂环
5
O 1
2α
5
S 1
2α
5 1N H
2α
呋喃(furan) 呋喃
γ 4 5 6 N 1 3β 2α
噻吩(thiophene) 噻吩
吡咯(pyrrole) 吡咯
O
S
N H
茂(环戊二烯) 氧(杂)茂 环戊二烯)
硫(杂)茂
氮(杂)茂
N
N
苯
氮(杂)苯
萘
1─氮杂萘 氮杂萘
第二节 含有一个杂原子的五元杂环体系
吡 咯 的 结 构
N H
sp2杂 环 有一个
N
呋喃、噻吩、吡咯的结构P 一 呋喃、噻吩、吡咯的结构 412
子的 子的 子 子 环 p
吡咯N 结构 吡咯
二、五元环的化学性质
六元杂环
吡啶(pyridine) 吡啶
2、有取代基的杂环化合物的命名: 、有取代基的杂环化合物的命名: 以杂环为母体,从杂原子开始,顺着环编号。 以杂环为母体,从杂原子开始,顺着环编号。
4 5 3 O2 1
第十七章杂环化合物

O
O
S
S
N H
HN
为
Π
6 5
共轭体系
π 电子 = 6
符 合 4n + 2
具有芳性
富电子芳环
吡啶的结构
NH
N上的孤电子对在 P轨道上,参与 环内共轭,为富 电子芳环。
N
N
N上的孤电子对在 sp2 轨道上,在环外 未参与环内共轭。
C_ sp2
N_ sp2
6
Π6
体系
成环原子
共平面
由于吡啶环的N上在环外有一孤对电子,故吡啶环上的电荷分 布不均。
叶绿素 α 的结构
叶绿素与蛋白质结合存在于植物的叶和绿色的茎中。植 物光合作用时,叶绿素吸收太阳能转变为化学能,是植 物进行光合作用时必需的催化剂。自然界的叶绿素不是 一个单纯的化合物,而是由两种叶绿素组合而成,即蓝 绿色的叶绿素a(熔点:117~120 ℃)和黄绿色的叶绿 素b(熔点:120~130 ℃) ,两者的比例为:3:1。
4 3
7 8
2
O
1
苯并吡喃
5 6
4
5
36
4
4
3 3N
5
N
6
7 8
27
N
1
8
N2 2
N
1
1
7
N
8
喹啉
异喹啉
喋啶
二.几种重要环系的结构与性质
1.呋喃、噻吩、吡咯、吡啶的结构
呋喃、噻吩、吡咯在结构上具有共同点,即构成环的五个 原子都为sp2杂化,故成环的五个原子处在同一平面,杂原 子上的孤对电子参与共轭形成共轭体系,其π电子数符合 休克尔规则(π电子数 = 4n+2),所以,它们都具有芳香性。
杂环化合物

O2N
O
CHO
5-硝基-2-呋喃甲醛
S
SO3H
2-噻吩磺酸
(2) 含两个杂原子的五元环
4 5 3 N2 O1
4 5
3 N2 S1
4 5 N1 H
3 N2
异噁唑(isoxazole) 异噻唑(isothiazole)
吡唑(pyrazole)
编号从杂原子开始,选择杂原子的顺序为:
-O- > -S- > -NH- > -N=
PhN 2+ClEtOH, H 2O
N H
N N C 6H 5
(1)卤代反应 (2)硝化反应 (3)磺化反应 (4)傅克酰基化反应 (5)呋喃的特殊反应
呋喃的离域能较小,环的稳定性较低,其 芳香性是几个芳杂环中最差的,所以呋喃 具有明显的共轭二烯性质,可以发生双烯 加成类型的反应(Diels-Alder反应)。吡 咯也能发生类似的反应
芳香及饱和五元杂环的偶极矩方向及数值如下
O 2.33x 10-3 0 C.m O
N H -30 C .m 6.03x10 -3 0 C .m 1.70 x10 S
5.76 x10 -30 C.m
N H -30 . 6.33 x10 C m 5.25x10-30 C.m
S
三个五元杂环都能溶于有机溶剂,水溶解度 都小于六元杂环吡啶,这是由于杂原子与水 分子缔合的倾向减弱所致,它们的水溶解度 顺序为:
7 5 N 8
α 2
O
苯并--吡喃酮
7
吲哚 (indole)
N 4 N9 H 3 嘌呤(purine)
(benzo--pyrone)
SO3H
CH2COOH N H
I OH
N
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O
N H
S
五元杂环化合物的结构
杂化轨道理论认为:环上的五个原子都是SP2杂化,彼此成键, 形成一个平面形分子,四个C原子还各有一个单电子P轨道,杂 原子还有一个孤对电子P轨道,它们彼此侧面重叠,形成一个 6 环状的离域大键, 因此,它们都具有芳香性。 5
π
O
S
N
H
五元杂环的结构与芳香性
1N 3N
H3COOC Br
N
N
O 2-呋喃甲醛 (糠醛)
H3C
S
CH2COOH N H 3-吲哚乙酸 β -吲哚乙酸
N7 N9 H
5-甲基噻唑 O6 H3C N O
1 3N
OH 8-羟基喹啉 N CH3 N9
7
N
嘌呤
CH3 1,3,7-三甲基-2,6-二氧嘌呤 (咖啡因)
二、系统命名法
第十七章 杂环化合物 (Heterocyclic Compounds)
17.1 17.2 17.3 17.4 17.5 17.6 杂环化合物的分类与命名 五元杂环化合物的结构与芳香性 五元杂环化合物的化学性质 六元杂环化合物的结构与芳香性 吡啶的化学性质 其它杂环化合物
引言
一般地讲,凡分子中具有环状结构,且构成环的原子除C原子 外,还包括有O、S、N、P、Si等杂原子的化合物,统称为杂 环化合物。因此,严格地讲,前面学的一些化合物也应属于杂 环化合物。 O O
O O O O O O H3C O O O O O O NH O N H O
但是,这些化合物的性质与相应的开链化合物接近,它们容易 由开链的化合物闭环制得,也容易开环变成开链的化合物,因 此,通常不把这些化合物归属于杂环化合物,而是和相应的开 链化合物放在一起学习。 本章要学习的主要是那些环系比较稳定的,都具有不同程度芳 香性的杂环化合物,简称为芳杂环化合物。
五元杂环的化学性质
五元杂环的亲电取代反应主要发生在-位上,而且,由于反应 活性较高,不能用一般的方法进行亲电反应,而要用较温的的试 剂和较温和的反应条件。 1、呋喃--遇浸有盐酸的松木片显绿色,这叫松木片反应。
Br2 0℃ 二噁烷 Br2 室温 O CH3COONO2 -5--30℃ N SO 3 ClCH2CH2Cl Br O O O O Br Br NO2 SO 3 N H HCl O SO 3H
系统命名法:是把杂环化合物看作相应的环状烃中碳原子被杂 原子取代而形成的化合物。命名时,在相应的环状烃前面加上 杂原子的名称。如:
O 茂 氧(杂)茂
N 苯 氮(杂)苯
萘
N 1-氮(杂)萘
17.2 五元杂环的结构与芳香性
典型的五元杂环化合物有三个,即呋喃、噻吩、吡咯。它们的结 构相似,有许多共性。 从结构式上看,都具有共轭二烯烃结构,但它们的化学性质却不 象共轭二烯烃,而是类似于苯,具有芳香性,易发生亲电取代反 应。
O Furan 呋喃
N Pyridine 吡啶
N H Indole 吲哚
常见的杂环化合物及其命名见表17-1。
杂环化合物的命名
当杂环上有取代基时,编号应杂原子开始;如果含有多个杂原子, 应使杂原子位次代数和最小;如果杂原子不同时,按O、S、N 的顺序编号。
CHO N H 5-溴-4-咪唑甲酸甲酯
由上述结构可以看出: (1)由于杂原子是提供一对电子参与共轭,形成56共轭体系,是 一个富电子共轭体系,即电子云密度高于苯环,故它们的亲电取 代活性比苯高。 (2)由于杂原子电负性较大,杂环上的电子云分布不像苯那样均 匀。因此,虽然都具有芳香性,但却没有苯高。
> S 离域能: 152 117 > N H 88 > O 67 KJ/mol
呋喃的化学性质
由于在呋喃中,氧的电负性较大,共轭效果不好,使其还具有 环状二烯烃的性质,如能发生双烯合成。
(CH3CO)2O O CH C O CH C O O H2 Ni O BF3 O O COCH3
C O C O O (THF,bp 65℃)
O
HCl 2 NaCN Cl(CH2)4Cl NC(CH3)4CN ZnCl2 醇
H3O
己二酸
H2 Ni 己二胺
2、吡咯的化学性质
吡咯--遇浸有盐酸的松木片显红色。 吡咯的亲电活性最高,甚至比苯胺和苯酚还高,也需要较温和的 试剂和较温和的条件,遇强酸聚合成红色树脂。
17.1 杂环化合物的分类与命名
五元杂环化合物 按环的大小分,最常见的有 六元杂环化合物 单杂原子的杂环 按杂环中杂原子的数目分 单杂环 稠杂环 多个杂原子的杂环 N N N H N N O N
按环的形式分
杂环化合物的命名
杂环化合物的命名有音译法和系统命名法两种,比较常用的是 音译法。 一、音译法 音译法就是杂环化合物英文名称的音译,并在同音汉字的左边 加一口字旁,表示为杂环化合物。如:
简介
杂环化合物数目众多(约占有机化合物的三分之一),广泛存在 于自然界中,许多都有重要的生理功能。如:植物中的叶绿素, 动物中的血红素,细胞中具有遗传作用的RNA、DNA中的生物 碱,以及某些蛋白质、维生素等都含有杂环化合物。 另外,许多合成药物、染料、香料、工程塑料等也是由杂环化 合物组成的。可见,杂环化合物无论在实际应用上,还是理论 研究上,尤其是与生命现象有关的科学领域里,都非常重要。 虽然这一章学时少,只能做简单地介绍,但其存在量和重要性 却远远高于其它类的化合物。
上述顺序与杂原子的电负性有关,电负性越大,共轭效果越差, 环上的电子云平均化程度就越差,芳香性就越小。
17.3 五元杂环的化学性质
五元杂环化合物存在一个 56,是一个富电子共轭体系,因此, 比苯更容易进行亲电取代反应,实验发现,它们的活性顺序为:
> N H O > S >
上述顺序大致与芳香性顺序相反,因为芳香性越大,体系越稳定, 就越不易发生亲电取代反应。但是,吡咯的活性稍高于呋喃,与 上述规律有出入。这是因为,在呋喃环上,O的电负性较大,使 共轭体系中的电子云主要集中在氧上,这不但使其芳香性降低, 而且由于在环中其它C上电子云密度相对降低,因此C上的亲电 活性稍小于吡咯。 实验和量子化学计算发现,在五元杂环上,-位的电子云密度 最高,因此,五元杂环的亲电取代反应主要发生的-位上。
