脂质体的制备
脂质体的制备方法

脂质体的制备方法脂质体是一种在生物医学领域中具有广泛应用前景的载体,它可以用于药物传递、基因治疗等方面。
脂质体的制备方法有多种,下面将介绍其中常用的几种方法。
首先,膜溶解法是一种常见的脂质体制备方法。
在这种方法中,磷脂溶解在有机溶剂中,然后将水相缓慢注入有机相中,通过超声或搅拌等手段使两相混合,形成脂质体。
这种方法制备的脂质体粒径分布较窄,适用于一些需要较为均匀粒径的应用。
其次,薄膜水合法也是一种常用的脂质体制备方法。
在这种方法中,磷脂溶解在有机溶剂中,然后将溶液旋转蒸发,形成薄膜,最后通过加入适量的缓冲液使薄膜迅速水合膨胀,形成脂质体。
这种方法制备的脂质体结构较为稳定,适用于一些需要长期保存的应用。
另外,脂质体凝胶法也是一种常见的制备方法。
在这种方法中,磷脂和胆固醇混合后,加入溶剂并加热,形成透明的溶液,然后冷却形成凝胶,最后通过加入缓冲液使凝胶水合膨胀,形成脂质体。
这种方法制备的脂质体具有较高的稳定性和载药量,适用于一些需要长期保存和高载药量的应用。
最后,脂质体膜内溶解法也是一种常用的制备方法。
在这种方法中,磷脂和胆固醇混合后,在有机溶剂中形成薄膜,然后将药物溶解在内水相中,最后将内水相缓慢注入有机相中,通过超声或搅拌等手段使两相混合,形成脂质体。
这种方法制备的脂质体可以实现药物的高效载荷,适用于一些需要高效载药的应用。
综上所述,脂质体的制备方法有多种,每种方法都有其适用的场景和特点。
在选择制备方法时,需要根据具体的应用要求和实验条件进行综合考虑,以选择最适合的制备方法。
希望本文介绍的内容能对脂质体的制备方法有所帮助。
脂质体的制备方法

脂质体的制备方法
脂质体是一种由两层磷脂分子构成的微小囊泡,内部可以包裹
水溶性或脂溶性的药物。
由于其良好的生物相容性和药物传递性能,脂质体在药物输送领域得到了广泛的应用。
下面我们将介绍脂质体
的制备方法。
首先,脂质体的制备需要选择合适的磷脂。
常用的磷脂有卵磷脂、大豆磷脂、磷脂酰胆碱等。
在实验室条件下,我们可以根据需
要选择不同种类的磷脂来制备脂质体。
其次,将所选的磷脂溶解在有机溶剂中,得到磷脂溶液。
常用
的有机溶剂有氯仿、甲醇、乙醇等。
在此过程中需要注意控制温度
和溶剂的选择,以确保磷脂能够完全溶解。
接下来,将药物溶解在水相中。
需要注意的是,药物的选择应
当考虑其溶解度和药效学特性。
将药物溶液缓慢滴加到磷脂溶液中,并利用超声波或机械搅拌等方法使两相充分混合。
然后,利用旋转蒸发、薄膜超滤、凝胶层析等方法去除有机溶剂,得到脂质体悬浮液。
在此步骤中需要注意控制温度和压力,以
避免对脂质体结构的破坏。
最后,通过超声处理、高压均质等方法对脂质体悬浮液进行处理,得到均匀、稳定的脂质体悬浮液。
在此过程中需要注意控制处
理时间和能量密度,以确保脂质体的质量和稳定性。
综上所述,脂质体的制备方法包括选择合适的磷脂、溶解磷脂、药物的溶解和混合、去除有机溶剂以及最后的处理步骤。
在实际操
作中,需要严格控制各个步骤的条件,以确保脂质体的质量和稳定性。
希望以上内容能够对您有所帮助。
脂质体的制备及其应用

脂质体的制备及其应用近年来,脂质体在制药领域里展现出了广阔的应用前景。
从初期的制备到现在的技术逐渐成熟,脂质体已经成为制药工业中最热门的制剂载体之一。
本文将介绍脂质体的制备及其应用。
一、脂质体的制备1. 胆固醇和磷脂共混法该制备法是最早的脂质体制备方法之一,实现较为简单。
只需将胆固醇和磷脂以特定比例共混,并使用水或其他溶剂进行溶解,即可制备出脂质体。
2. 薄膜法该制备法是制备脂质体的另一种常见方法。
将磷脂及其他组份按一定比例混合,并在热水浴中加热搅拌,并持续将其挤压,形成薄膜,薄膜会自行聚集形成脂质体。
3. 超声波法该制备法利用超声波的力量将水相和油相分散均匀,从而形成脂质体。
简单易行且可重复性良好,所以是制备脂质体最常用的方法之一。
二、脂质体的应用1. 药物传递脂质体是一种非常好的药物传递载体,由于其构成和细胞膜相似,因此可有效载药物,并快速进入人体细胞。
脂质体还可以用于治疗肿瘤和炎症。
2. 增强药物传递的稳定性很多药物容易被分解,但是通过使用脂质体,这些药物可以被稳定传递,并防止药物在消化过程中被分解。
对于某些对稳定性要求极高的药物,如RNA、DNA和酶,脂质体的应用显得尤为重要。
3. 疫苗传递最近几年,脂质体在疫苗传递方面展现出自己的优势。
将疫苗包裹在脂质体中,可呈现出更好的抗原肽处理,并取得良好的抗体反应。
这让脂质体成为了一种非常良好的疫苗传递载体。
4. 脂质体在饮食保健品中的应用还有一些饮食保健品在其制备过程中也可以使用脂质体。
例如,脂质体可用于保护鱼油或其他有益成分的品质和稳定性,并让它们更方便地传递到人体内。
总的来说,脂质体已成为制药工业中不可或缺的一部分,并在医药、食品及化妆品等领域发挥着重要作用。
脂质体的制备方法也在不断更新,未来必将有更多的应用领域,为人类健康和生活发挥更大的作用。
脂质体的制备

脂质体的制备脂质体是一种常见的生物细胞的一种重要的结构元素,它拥有独特的外型和内部结构,含有丰富的脂质和蛋白质,能够构成细胞的支架并且能赋予细胞丰富的功能。
脂质体也可以被用于制备有药效负载物质(如药物、基因治疗药物等)的药物载体,有助于药物更好地穿越血脑屏障,从而更有效地治疗神经系统疾病。
因此,脂质体制备技术受到了科学家们的关注。
1、脂质体制备技术主要有三种:溶胀法、过失法和双膜法,其中溶胀法是最常见的。
溶胀法的原理是利用热溶剂应力和化学应力使表面活性剂脂质形成脂质体。
过失法是利用热溶剂或难溶的脂质的溶解度的变化使其形成脂质体,这种方法的优点是能够大量制备单组分微粒,但缺点是生成的脂质体不稳定,多组分混合也不利于微粒的形成。
双膜法是由水溶性溶剂和水不溶的溶剂混合之后,表面活性剂脂质分相聚合形成微胶囊,该方法制备的脂质体在稳定性上有很大的提高,有利于多组分混合。
2、脂质体制备需要一系列操作步骤,包括溶剂准备放入热循环搅拌器中,调整温度和搅拌速度,根据不同的技术,使脂质体形成并分离。
其中,调节温度和搅拌速度是关键步骤,必须在合理温度范围内,以保证溶液和混合能够有效完成,同时保证搅拌速度和时间,让脂质体形成并分离。
3、在实际操作中,应考虑实验室条件、材料特性和安全性,根据实验需要确定溶剂的比例,并保证材料的完整性及包覆物的质量。
另外,脂质体的安放也需要非常严格的管理,及时进行筛选试验,以保证其品质及有效投入使用。
脂质体的制备是一种微观尺度上的操作,通过合理的物理处理,可以使脂质体具有一定的结构稳定性,可以承载药物和其它物质,发挥药物平台作用,比较安全有效地用于药物载体制备,为药物的有效穿越血脑屏障而打开新的立体思路。
脂质体制备工艺流程

脂质体制备工艺流程脂质体是一种由磷脂和胆固醇等成分组成的小型纳米载体,具有良好的生物相容性和生物可降解性。
脂质体在药物递送和基因治疗方面具有广泛的应用前景。
下面将重点介绍脂质体的制备工艺流程。
一、磷脂选择脂质体的制备以磷脂为主要原料,常用的磷脂有卵磷脂、磷脂酰胆碱、磷脂酰丝氨酸等。
选择适合的磷脂是制备高质量脂质体的重要因素。
二、制备方法1. 薄膜分散法将磷脂溶解在有机溶剂中制备成薄膜,再加入药物或基因,利用机械或超声分散制备脂质体。
该法制备的脂质体颗粒分布比较均匀,适合制备小型脂质体。
2. 溶剂挥发法将磷脂溶解在有机溶剂中,加入药物或基因,通过挥发有机溶剂制备脂质体。
该法可以制备大量的脂质体,但颗粒大小分布不如薄膜分散法。
3. 冻干法将磷脂溶解在水相中,加入药物或基因,通过冻干、再溶解、超声或机械处理制备脂质体。
该法制备的脂质体稳定性较好,适合制备高含药量的脂质体。
三、性质调节为了满足不同的应用需求,可以通过改变脂质体的表面性质、大小、药物包载量和脂质组分来调节脂质体的性质。
常用的方法有加入表面活性剂、多肽等改变脂质体表面性质,改变磷脂组分、添加胆固醇等调节脂质体结构和稳定性。
四、质量检测在脂质体制备过程中,应注意生产环境的净化和卫生,保证脂质体的质量安全。
脂质体质量的检测方法包括颗粒大小、分布、多分散性、药物包载量、稳定性等方面的指标测定。
综上所述,脂质体的制备工艺包括磷脂选择、制备方法、性质调节和质量检测。
通过合理选择磷脂和制备方法以及进行性质调节和质量检测,可以得到性质稳定、药物包载量高的高质量脂质体,为药物递送和基因治疗等领域提供了广阔的应用前景。
脂质体制备
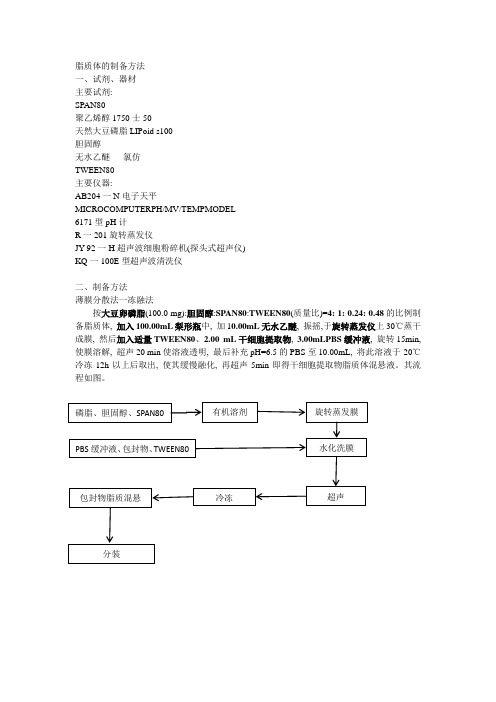
脂质体的制备方法
一、试剂、器材
主要试剂:
SPAN80
聚乙烯醇1750士50
天然大豆磷脂LIPoid s100
胆固醇
无水乙醚氯仿
TWEEN80
主要仪器:
AB204一N电子天平
MICROCOMPUTERPH/MV/TEMPMODEL
6171型pH计
R一201旋转蒸发仪
JY-92一H超声波细胞粉碎机(探头式超声仪)
KQ一100E型超声波清洗仪
二、制备方法
薄膜分散法一冻融法
按大豆卵磷脂(100.0mg):胆固醇:SPAN80:TWEEN80(质量比)=4:1:0.24:0.48的比例制备脂质体,加入100.00mL梨形瓶中,加10.00mL无水乙醚,振摇,于旋转蒸发仪上30℃蒸干成膜,然后加入适量TWEEN80、2.00mL干细胞提取物,3.00mLPBS缓冲液,旋转15min,使膜溶解,超声20min使溶液透明,最后补充pH=6.5的PBS至10.00mL,将此溶液于-20℃冷冻12h以上后取出,使其缓慢融化,再超声5min即得干细胞提取物脂质体混悬液。
其流程如图。
脂质体制备的方法

脂质体制备的方法脂质体是一种由脂质分子组成的微细粒子,主要用于制备及输送药物、基因和化妆品成分等。
脂质体具有优异的生物相容性和生物可降解性,并且可以有效稳定和保护被包封的药物或成分。
目前,常用的脂质体制备方法包括薄膜溶解法、乳化法、胶束法、膜断裂法、气相法等。
下面将详细介绍这些方法。
薄膜溶解法是一种利用脂质和溶剂溶解及薄膜形成原理制备脂质体的方法。
首先,选择适当的脂质和溶剂。
常用的脂质有磷脂类(如磷脂酰胆碱、磷脂酰丝氨酸)、脂肪醇(如固体脂肪醇)、脂肪酸等。
常用的溶剂有乙醇、二甲酚、甲醇和酯类溶剂。
然后,将脂质和溶剂溶解在一起,通过快速旋转薄膜机或制备配制机将溶液薄膜扩散到玻璃底板上,在适当的温度和时间下形成脂质质体。
最后,通过超声处理或其他方法将脂质质体分散成脂质体悬浮液。
乳化法是一种利用乳化剂和脂质相互作用生成脂质体的方法。
乳化剂常用的有表面活性剂和共乳剂。
表面活性剂包括非离子型(如Tween系列)和阴离子型(如脂肪酸钠盐)。
共乳剂包括长链脂肪醇(如固体脂肪醇)、糖(如蔗糖、葡萄糖)和胆汁酸类。
首先,将乳化剂和脂质在适当比例下溶解在无水有机溶剂中。
然后,加入水相,通过机械剪切或超声处理将脂质和乳化剂形成乳液。
最后,通过去除有机相或冷冻干燥等方法获得脂质体。
胶束法是一种利用表面活性剂和脂质相互作用形成胶束后制备脂质体的方法。
首先,选择适当的表面活性剂,如磷脂酰胆碱、磷脂酰丝氨酸等。
然后,将表面活性剂溶解在溶剂中,通过搅拌、超声处理等方法形成胶束。
最后,将胶束与药物或成分混合,通过快速稀释或其他方法获得脂质体。
膜断裂法是一种利用高压处理使脂质质体断裂形成脂质体的方法。
首先,通过之前介绍的方法制备脂质质体悬浮液。
然后,将悬浮液经过高压处理,使脂质质体断裂成小颗粒,形成脂质体。
最后,通过超声处理或其他方法除去未断裂的脂质颗粒,获得脂质体。
气相法是一种利用空气或氮气吹淋使脂质溶液蒸发形成脂质体的方法。
脂质体制备工艺流程

脂质体制备工艺流程
脂质体是一种类似于自然界中存在的脂质体的微小粒子,在药物输送中具有广泛的应用。
脂质体制备工艺流程主要包括以下几个环节: 1. 液相制备:首先需要将所需的药物、脂质体原料和乳化剂等
组分按照一定比例加入到水相中。
然后,使用机械搅拌或超声波处理等方法,使其形成一个稳定的乳液。
2. 单步法制备:将脂质体原料和药物共同混合,然后通过乳化
和超声波处理等方式制备脂质体。
3. 反向微乳化法:将脂质体原料和乳化剂,以及反相剂等组分
混合,形成一个稳定的反向微乳液,然后通过添加外相使得脂质体形成。
4. 油水两相法:将脂质体原料和药物溶于有机溶剂中,然后将
其滴加到水相中,形成一个乳液,最终通过去除有机溶剂使得脂质体形成。
脂质体制备的工艺流程具有一定的复杂性,在实际操作中需要根据具体的要求进行选择和调整。
同时,还需要注意稳定性、纯度等方面的问题,以确保制备出的脂质体具有良好的药物输送效果。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验十五
脂质体的制备
一实验目的
1.了解脂质体(liposome)在细胞
工程技术中的应用及其制备方法。
2.掌握采用超声波法、冰冻干燥法
和冻融法三种不同的方法制备脂
质体的方法并了解该技术在细胞
工程中的应用。
二实验原理
脂质体(liposome)的制备技术,一般采用超声波法、振荡法、乙醚蒸发法、去污剂透析法、冰
冻干燥法和冻融法等。
制备方法
不同,所得脂质体结构、大小不
同,性质和用途也就不同(表15-1)。
种类制备方法大小(m)特性
多层大脂质体(MLV)乙醚蒸发法、醇醚水
法、振荡法、液相快
速混合振荡法
0.1~50易制备,包被物释放
速度慢
单层小脂质体(SUV)直接超声波法、溶剂
超声波法、乙醚注射
法
0.02~0.05体积小,适合包被离
子、小分子药物等
单层大脂质体(LUV)递相蒸发法、去污剂
(胆酸纳等)透析法、
冰冻干燥法
0.05~0.5 适合包被蛋白质、
RNA、DNA片段、
大分子药物及细胞融
合
单层巨大脂质体(GUV)冻融法5~30适合包被蛋白质、
RNA、DNA片段,
除菌处理较难
本实验采用超声波法、冻融法、冰冻干燥
法三种不同类型的方法,超声波法的原理是:在超声波作用下,磷脂类双亲媒性分子被打碎为分子或分子团,并自动重新排布成类似生物膜的双分子层囊泡。
冻融法是在超声波法形成的小脂质体基础上,通过冷冻和融解过程使其破裂,重组为大体积脂质体,在通过透析时膜内外渗透压的变化而膨胀为更大体积的脂质体。
冰冻干燥法语原理与冻融法基本一致,只在处理条件上有所不同。
三实验用品
1.器材
超声波清洗机、光学显微镜、荧光显微镜、荧光分光光度计、漩涡混合器、核酸蛋白检测仪、柱层析装置、冰冻干燥机。
2.试剂
1)磷脂液:100mg经丙酮-乙醚法纯化的卵磷
脂,57.2mg胆固醇,溶于1ml氯仿。
2)荧光液:钙黄绿素(calcein)47mg溶于
100ml Tris缓冲液。
3)Tris 缓冲液:称取Tris 0.12g,EDTA
0.288mg,溶于80ml去离子水中,用0.1 mol/L
盐酸调Ph7.2,再加水至100ml。
4)2%叠氮钠液。
5)透析液:称取EDTA2.88mg,加入143ml荧光液中,再加无离子水至1000ml,同时加入10ml叠氮钠液。
6)10m mol/L氯化钴液。
四实验步骤
1.超声波法制备脂质体
取磷脂液330μl于2.0ml安瓿瓶中,真空干燥20min,再加入荧光液530μl及液530μl,充氮气、封口、漩涡混合器混匀,与超声波清洗机中处理处理10min (电流200~300mA),所得液体即为单层小体积脂质体(SUV)。
直径分配率计算:取16μl适当稀释的脂质体液(一般稀释100倍)加在载玻片上,盖上盖玻片,并用凡士林封口,用目微尺观测5个视野里的脂质体直径,记录,按下式计算直径分配率D。
D=[X1(0~0.01)+X2(0.01~0.02)×2+X3(0.02~0.03)×3+…]/N
其中X1为5个视野里0~0.01μm直径脂质体数的平均值,N为视野数5。
包被率计算:取15μl脂质体液稀释液于2985μl Tris液中,在荧光分光光度计上测量荧光强度(A);加入12μl CoCl2液,静臵5min,使脂质体外的荧光猝灭,测量膜内荧光强度值(B);加入150μl10%Triton X-100破膜液,破膜5min,再测量荧光强度(C)。
包被率=(B-C)/(A-C)
其中A为总荧光强度,B为脂质体荧光强度,C为本底荧光强度。
2.冻融法制备脂质体
取磷脂液330μl于安瓿瓶中,真空干燥20min,加入Tris液530μl,充氮气,封口,漩涡均匀,超声波处理5min(电流200~300mA),打开瓶口,加入荧光液140μl,氯化钾112mg,漩涡均匀,然后臵于干冰-丙酮浴中冷冻1min。
取出,室温融解,漩涡均匀。
冻融过程重复两次。
完成后
将脂质体装入透析袋中,在磁力搅拌下对透析
液透析2h,换透析液两次(用于与原生质体融
合实验时,透析时间与透析配方可与原生质体
培养基适当配合),即得单层巨大脂质体(GUV)。
直径分配率计算及包被率测定同超声波法。
记录测定结果。
3.冰冻干燥法制备脂质体
取磷脂液330μl于安瓿瓶中,真空干燥20min,加入Tris液530μl,充氮气,封口,涡旋均匀,超声波处理(电流200~300mA)5min,打开瓶口,加入荧光液140μl,涡旋均匀。
冰冻干燥10h,取出后加无离子水1ml,涡旋均匀,室温静臵1h,超声波处理1min,即得单层大脂质体(LUV)。
如需更大体积脂质体可重复冻干过程两次。
直径分配率及包被率测定同超声波法,记录测定结果。
4.均一脂质体的制备
冻融法和冰冻干燥法所制备的脂质体皆可作为DNA、蛋白质或其他较大分子的载体,用于药物运载及与原生质体的融合等。
一般来说,作为载体的脂质体在实用前都须经均一化处理。
将琼脂糖凝胶4B柱(1×20cm)用Tris液品平衡3倍柱体积(约47ml),流速0.5ml/min,平衡完全后,取脂质体液0.5ml常规上样,Tris液洗脱,洗脱速度0.3ml/min,用核算蛋白检测仪检测洗脱液A280,收集第一峰,即为较均一的脂质体。
以A280为纵坐标,洗脱液体积为横坐标,画出脂质体洗脱曲线。
五思考题
1.脂质体的结构及用途如何?
2.简述制备脂质体的基本步骤。
3.比较超声波法、冰冻干燥法所制备的脂质
体的体积,并解释其原因。
